Palabras clave
INTRODUCCIÓN
El aleteo auricular consiste en un circuito de macroreentrada en la aurícula derecha que implica al istmo cavotricuspídeo como zona de paso obligado1-5. La ablación con catéter mediante radiofrecuencia de esta zona resulta muy efectiva y ampliamente difundida, con una tasa de éxito superior al 85%6,7. La técnica se realiza mediante la creación de una línea de ablación que cruce en toda su longitud y grosor el istmo cavotricuspídeo8. El bloqueo bidireccional de la conducción a través del istmo representa el objetivo más efectivo para verificar el procedimiento y asegurar su éxito a largo plazo9-11.
Con el procedimiento clásico con catéteres estándar, en el 5-15% de los casos fracasa la ablación, sin llegar a lograr el bloqueo bidireccional. Además, el 10% de los pacientes presentan recurrencias después de verificar el bloqueo bidireccional del istmo12,13. Existen múltiples causas que impiden la creación de la línea de ablación con la creación de zonas de conducción (gaps) o zonas de bloqueo transitorio. La variabilidad de la anatomía del istmo, en especial su anchura y grosor, es uno de los factores más relevantes14. Esto podría explicar en parte la variabilidad en el número de aplicaciones y la duración del procedimiento, así como su tasa de recurrencias.
La limitación de los catéteres estándar es que las lesiones que crean son pequeñas (5-7 mm), insuficientes en istmos grandes15,16. Los catéteres irrigados producen lesiones más grandes y profundas (el 50% de las lesiones son transmurales frente al 15% con catéteres estándar)17. Estudios preliminares con este tipo de catéteres sugieren su beneficio con respecto a los catéteres estándar elevando la tasa de éxito de este procedimiento18-20.
El objetivo de nuestro estudio es comparar la eficacia de la ablación del istmo cavotricuspídeo mediante radiofrecuencia con catéteres irrigados en el aleteo auricular común en relación con los catéteres estándar de 4 mm en un estudio prospectivo aleatorio de pacientes referidos para ablación del istmo cavotricuspídeo por presentar aleteo auricular típico.
PACIENTES Y MÉTODO
Se estudió a un total de 37 pacientes consecutivos con aleteo auricular típico que acudieron por primera vez a la consulta de arritmias del hospital para realizar ablación del istmo cavotricuspídeo. La población consistía en 30 varones y 7 mujeres, con un intervalo de edad entre 39 y 79 años (media de 62 ± 11). El número medio de episodios de aleteo previos a la ablación fue de 2,7 ± 2,63. El 43% (17/37) de los pacientes presentaban algún tipo de cardiopatía estructural y la cardiopatía isquémica era la más frecuentemente encontrada (19%).
Habían usado 1,47 ± 0,87 fármacos antiarrítmicos. Además, 13 pacientes (35%) habían presentado previamente episodios de fibrilación auricular paroxística. Las características generales entre los dos grupos se expresan en la tabla 1.
Un total de 20 pacientes fueron asignados aleatoriamente a ablación con catéter convencional de 4 mm (Cordis Webster® o Mariner®, Medtronic) y los 17 pacientes restantes fueron asignados para realizar ablación con un catéter irrigado de sistema cerrado de 4 mm (Chilli® Cardiac Pathways). No existieron diferencias significativas en cuanto al sexo, edad, cardiopatía estructural, uso de antiarrítmicos o presencia de fibrilación auricular entre los dos grupos (tabla 1).
Protocolo de ablación con radiofrecuencia
La ablación del aleteo auricular se realizó durante dicha taquicardia o, por el contrario, si el paciente se presentaba en ritmo sinusal y se documentaba la existencia de un aleteo típico electrocardiográfico, se procedió a la ablación durante la estimulación auricular. Se demostró la activación a través del istmo cavotricuspídeo mediante técnicas de mapeo con el uso de catéter Halo y catéteres cuadripolares según la forma convencional21. Los electrogramas intracavitarios se registraron en un polígrafo multicanal Cardiolab, versión 4.1. La técnica de ablación utilizada en ambos grupos fue la aplicación punto a punto de la radiofrecuencia para crear lesiones que permitiesen lograr una línea completa que abarcase todo el istmo, comprobando a continuación la consecución del bloqueo bidireccional del istmo.
Para los catéteres estándar utilizados, la aplicación de radiofrecuencia se preprogramó a 60 s y con un control de temperatura máxima de 70 grados. Se empleó un generador Stockert®, Cordis o Ataker®, Medtronic.
Para los catéteres irrigados se utilizaron aplicaciones de 60 s con una potencia preprogramada de 25 W y, dependiendo de la dificultad para conseguir el bloqueo del istmo, se aumentó la potencia hasta 50 W. La solución salina se hizo circular a 36 ml/min mediante una bomba de infusión (modelo 8004, Cardiac Pathways) durante la aplicación de la radiofrecuencia. La temperatura se monitorizó con un sensor de termopar en la punta del electrodo y se utilizó para interrumpir la aplicación en caso de detectar un aumento superior a 50 °C. Para cada aplicación se registraron el voltaje, la corriente, la temperatura y la impedancia. Se utilizaron vainas venosas largas en aquellos pacientes en los que no se logró un contacto y una estabilidad adecuados en el istmo con cualquiera de los catéteres.
Los pacientes recibieron un protocolo con anticoagulantes orales similar al de fibrilación auricular22, 3-4 semanas antes y 4 semanas después de la ablación, manteniendo un INR entre 2 y 3. Se sustituyeron los anticoagulantes orales por heparina de bajo peso molecular 2 días antes del procedimiento, reiniciándola el día después.
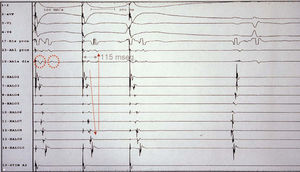
El objetivo final en el estudio electrofisiológico fue la consecución del bloqueo bidireccional del istmo, demostrado mediante el mapeo de activación durante la estimulación secuencial desde aurícula derecha lateral baja y seno coronario cercano a la línea de ablación (fig. 1)9. Además, se definió la creación de una línea completa de bloqueo mediante el registro de dobles potenciales a lo largo de la línea de ablación23. Tras la conclusión del procedimiento se esperó 30 min para verificar la estabilidad del bloqueo. El tiempo de procedimiento se define a partir de la obtención de vías para la introducción de catéteres hasta la verificación del bloqueo del istmo, sin incluir el tiempo de espera.
Fig. 1. Comprobación del bloqueo bidireccional del istmo cavotricuspídeo tras el procedimiento de ablación de éste mediante estimulación en el seno coronario y activación secuencial desde proximal a distal del catéter Halo. A su vez, en el catéter de ablación se detecta la aparición de dobles potenciales separados por 115 ms.
Cuidados postablación
La estancia hospitalaria fue entre 24 y 48 h, realizándose ECG diario y exploración física, así como telemetría continua para confirmar el ritmo sinusal y detectar recurrencias u otras arritmias (fibrilación auricular). Los pacientes fueron dados de alta sin fármacos antiarrítmicos, salvo que lo requiriesen por presentar fibrilación auricular. Al mes se realizaba un seguimiento clínico en consultas, mediante ecocardiografía y Holter de 24 h ambulatorio, con retirada de anticoagulación oral si procedía. Posteriormente, salvo nuevos acontecimientos, se revaluó a los pacientes a los 6 meses y al año mediante anamnesis, exploración física y ECG.
Estadística
Los datos se expresan como media ± desviación estándar. Para comparar las variables continuas se utilizó el test de la t de Student bilateral. Se consideraron estadísticamente significativos los valores de p < 0,05. Las variables categóricas se describen mediante frecuencia absoluta y frecuencia relativa en porcentaje y se analizaron mediante el test de la χ². En todos los casos se estableció un nivel alfa del 5% con formulación bilateral.
RESULTADOS
Eficacia
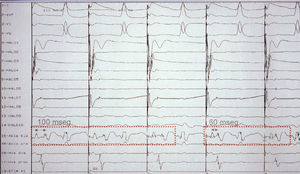
Con el uso de ambos catéteres se logró una alta tasa de éxito (tabla 2), aunque con los catéteres irrigados se consiguió demostrar el bloqueo del istmo en los 17 pacientes (100%). En los 2 pacientes en que no se consiguió establecer el bloqueo bidireccional, éste se verificó gracias al uso de catéteres irrigados. En uno de estos pacientes sólo se logró conseguir un bloqueo intermitente del istmo tras múltiples aplicaciones (30) y se decidió sustituir el catéter estándar por uno irrigado (fig. 2). Con el uso de catéteres irrigados el número de aplicaciones disminuyó significativamente desde 19 ± 5 a 8 ± 7. Aunque no se obtuvieron diferencias estadísticas entre el número de líneas realizadas durante el procedimiento (1,55 ± 0,67 frente a 1,16 ± 0,37), sí que existieron diferencias entre los catéteres irrigados y los estándar en el porcentaje de casos que presentan bloqueo del istmo al finalizar la primera línea (82 frente a 60%, respectivamente). A su vez, el tiempo de procedimiento (70 ± 35 min para los catéteres irrigados y 164 ± 56 min para los estándares) y el tiempo de radiación se acorta con el uso de catéteres irrigados (desde 40 ± 16 frente a 16 ± 8) de manera significativa. Se utilizaron vainas en 2 pacientes de cada grupo para la estabilización del catéter en el istmo cavotricuspídeo.
Fig. 2. Bloqueo transitorio del istmo cavotricuspídeo durante el procedimiento de ablación con un catéter estándar de 4 mm. Se aprecia la disminución de la diferencia entre ambos potenciales al recobrar la conducción a través del istmo cavotricuspídeo. Tras la aplicación de numerosas aplicaciones se optó por un catéter irrigado, que finalmente consiguió el bloqueo completo del istmo. DP1: primer doble potencial; DP2: segundo doble potencial.
Durante el procedimiento con los catéteres irrigados, la potencia media registrada fue menor que con los catéteres estándar (27 ± 2 frente a 43 ± 6 W, respectivamente). A su vez, la temperatura alcanzada fue mayor en los catéteres estándar (53 ± 6 °C), en comparación con los catéteres irrigados (34 ± 3 °C). Existieron diferencias significativas en cuanto a la impedancia máxima entre los catéteres, aunque no se detectaron diferencias entre las impedancias mínimas (tabla 3). Hubo menos variaciones de ésta entre aplicaciones y entre pacientes en los catéteres irrigados que con los estándar (fig. 3).
Fig. 3. Gráfico de una aplicación de radiofrecuencia con catéter irrigado sobre el istmo cavotricuspídeo de 25 W durante 60 s. Se puede observar la estabilidad de la temperatura en la punta del catéter, así como la falta de elevación de la impedancia durante la aplicación.
Seguridad
No hubo complicaciones mayores con ninguno de los dos catéteres, durante y después del procedimiento. Ningún paciente desarrolló clínica o signos electrocardiográficos de isquemia.
Seguimiento
Durante un seguimiento medio de 8 ± 3 meses no hubo recurrencias en el grupo de pacientes en los que se realizó la ablación con catéter irrigado, mientras que un enfermo del grupo con catéter estándar recurrió, objetivándose de nuevo conducción a través del istmo en el estudio electrofisiológico, por lo que se procedió con éxito a una segunda ablación con catéter irrigado.
DISCUSION
Existe un progresivo aumento del número de pacientes referidos a los laboratorios de electrofisiología para la ablación de istmo cavotricuspídeo en el aleteo auricular típico por diferentes razones: a) la ablación del aleteo auricular es un procedimiento potencialmente curativo y puede evitar el uso crónico de fármacos antiarrítmicos, con el riesgo de efectos secundarios que conllevan, por lo que algunos grupos de trabajo han pensado en la ablación como técnica de primera elección24, y b) datos recientes de la bibliografía revelan el beneficio clínico de la terapia combinada con ablación y fármacos antiarrítmicos en pacientes con fibrilación y aleteo auriculares25. La tasa de recurrencia ha disminuido durante los últimos años debido al uso de objetivos basados en la comprobación del bloqueo bidireccional creado por la línea de ablación. La recurrencia constituye probablemente la recuperación de la conducción por el istmo después de verificar el bloqueo de éste al finalizar el procedimiento, por lo que es importante verificar la estabilidad del bloqueo al terminar el estudio esperando al menos 30 min26. Con el uso de catéteres convencionales de 4 mm existe un grupo de pacientes (alrededor del 10%) en el que es difícil o imposible conseguir el bloqueo bidireccional del istmo, y alrededor del 10% de los que presentan bloqueo bidireccional tienen recurrencias del aleteo auricular. Una importante limitación del uso de catéteres estándar es el pequeño tamaño de la lesión creada, de lo que resulta la realización de una línea incompleta de bloqueo (con presencia de gaps) y la creación de lesiones agudas transitorias que recuperan la conducción una vez el proceso inflamatorio agudo desaparece. Durante la realización de la línea de ablación es importante reconocer que el mero hecho de haber liberado la energía de radiofrecuencia en el punto deseado no asegura una lesión transmural. Existen diferent es factores de los que depende: contacto del catéter con el miocardio auricular, flujo sanguíneo, energía liberada irregular por el calentamiento del catéter, grosor miocárdico y variaciones morfológicas, tanto en el tamaño como en la arquitectura del istmo (recesos largos). Es probable que esta variabilidad de la anatomía del istmo, en especial su anchura y grosor, sea uno de los factores más relevantes: la anchura media del istmo es de 3,1 ± 0,7 cm (con un intervalo que varía desde 1,8 a 5 cm)14. A su vez, la variabilidad de la anatomía del límite posterior del istmo alrededor de la cresta de Eustaquio, lo que se denomina istmo septal, afecta a la anchura funcional del istmo y probablemente a la efectividad de la ablación27. Estas diferencias anatómicas y funcionales podrían explicar en parte el distinto número de aplicaciones y la variación en la duración del procedimiento, así como su tasa de recurrencias.
La creación de lesiones de mayores dimensiones que las realizadas con los catéteres estándar ha demostrado su utilidad clínica para la ablación del aleteo auricular. Así, el catéter de 8 mm ha demostrado su eficacia y, de hecho, es utilizado rutinariamente en muchas unidades de electrofisiología, aunque precisa de un contacto óptimo electrodo-tejido, que a veces es difícil de conseguir. Una escasa estabilización sobre el tejido auricular disminuye la liberación de energía20-22, por lo que el uso de un catéter que permita el mejor contacto y que, a su vez, evite el calentamiento de la punta durante la liberación de energía, como el irrigado, puede permitir crear lesiones más grandes y profundas de forma segura y eficaz, como se ha descrito en un estudio publicado previamente18. Está demostrado que el enfriamiento de la punta del catéter conlleva la creación de lesiones más grandes, con mayor porcentaje de lesiones transmurales17. El enfriamiento del catéter con la irrigación de solución salina previene la elevación de temperatura en la superficie de contacto entre el catéter y la aurícula, que es la causa de elevaciones bruscas de la impedancia, disminuyendo la energía transmitida al tejido y, por tanto, reduciendo el tamaño de la lesión. En nuestro estudio, la impedancia es significativamente menor, lo que expresa la mayor cantidad de energía efectiva dirigida hacia el tejido auri cu lar. Cuando la punta del catéter aumenta por encima de 50 grados, la incidencia de incremento de impedancia aumenta más del 55%28.
Los resultados observados con el uso de catéteres irrigados presentan una temperatura media de 34 grados en comparación con los 53 grados observados en los catéteres estándar, lo que facilita la liberación de la energía de forma más constante, estable y efectiva, pudiendo disminuir la presencia de fenómenos como la formación de trombos y/o la carbonización. Por tanto, el mayor volumen de la lesión puede verse representado en el procedimiento en el menor número de aplicaciones y de líneas necesarias. Al ser la lesión más grande, la posibilidad de gaps entre aplicaciones será menor, con lo que, en teoría, además, la probabilidad de recurrencias podría reducirse. En nuestro estudio, la potencia media utilizada es de 27 W, lo que expresa que ésta es suficiente en la mayoría de los casos, siendo modificada en unos pocos pacientes.
A lo largo de los años, las técnicas de mapeo y ablación han ido evolucionando y definiendo unos objetivos, como el bloqueo bidireccional del istmo, que aseguran que la ablación ha sido realizada con éxito. En nuestro estudio, además de aumentar la eficacia al realizar la ablación, los tiempos de procedimiento y escopia están dentro de los reseñados en otros estudios y reflejan que el uso de catéteres irrigados conlleva una disminución de estos tiempos a la mitad.
Limitaciones
Con respecto al diseño del estudio, desde un punto de vista más estricto hubiera sido más acertado comparar el mismo catéter con y sin sistema de irrigación. Sin embargo, nuestra intención fue conocer con la máxima profundidad posible la utilidad clínica y el manejo de estos catéteres con respecto a los que se venían utilizando en la práctica diaria para realizar la ablación del aleteo auricular. Si bien actualmente los catéteres de 8 mm son ampliamente utilizados en numerosos laboratorios de electrofisiología, en el momento del diseño del estudio los catéteres de 4 mm eran los más utilizados en nuestro laboratorio. Además, los catéteres irrigados son de 4 mm, por lo que se creyó que para analizar específicamente el sistema de irrigación cerrada, éstos eran los más adecuados, al no introducir una nueva variable que pudiese dificultar la interpretación de los resultados. Un estudio más amplio entre estos catéteres sería apropiado para analizar las posibles diferencias en el procedimiento de ablación.
CONCLUSIONES
Los catéteres irrigados permiten realizar la ablación del istmo cavotricuspídeo de forma segura y efectiva. Aunque el uso de catéteres estándar de 4 mm permite efectuar el bloqueo bidireccional del istmo en un elevado porcentaje de casos, los catéteres irrigados lo realizan efectivamente con menos aplicaciones y permiten acortar el procedimiento y el tiempo de escopia. El mayor beneficio clínico podría concentrarse en pacientes con aleteo auricular resistente, o en aquellos en los que no se logra establecer un bloqueo bidireccional del istmo completo o solamente transitorio con un catéter estándar, probablemente debido a un istmo ancho y/o grueso.
Correspondencia: Dra. C. Moro.
Unidad de Arritmias. Hospital Ramón y Cajal.
Ctra. de Colmenar Viejo, km 9.100. 28003 Madrid.
Correo electrónico: cmoro@hrc.insalud.es
Recibido el 3 de abril de 2001.
Aceptado para su publicación el 25 de julio de 2001.