OBJETIVO: La ablación mediante radiofrecuencia de la taquicardia ventricular requiere buena tolerancia de la taquicardia durante el mapeo y el encarrilamiento, lo que limita su aplicación. Presentamos nuestra experiencia inicial de ablación de taquicardia ventricular durante ritmo sinusal en 7 pacientes con infarto inferior previo.
MÉTODOS: Se incluyen 7 varones de 56-70 años (media ± DE: 65 ± 4,5). Seis tenían taquicardia ventricular hemodinámicamente inestable y en 1 se inducía no sostenida. La cicatriz se localizó por registro de electrogramas fragmentados de bajo voltaje (< 2 mV). La emergencia de la taquicardia ventricular se localizó por topoestimulación en ritmo sinusal. Se trazaron líneas de radiofrecuencia radialmente, punto a punto, desde el miocardio normal al centro de cicatriz, una de las cuales cruzaba la zona de emergencia. El objetivo fue la no inducibilidad.
RESULTADOS: Se indujo taquicardia ventricular clínica sostenida en 6 casos y no sostenida en 1. Se llevaron a cabo 2-4 líneas de radiofrecuencia con 11-28 aplicaciones (21 ± 5,4) por paciente, con una duración del procedimiento de 130-280 min (230 ± 61) y fluoroscopia 49-75 min (63 ± 7,9). La taquicardia ventricular clínica se hizo no inducible en 6, aunque en 4 era inducible taquicardia ventricular no clínica, muy rápida (ciclo <= 250 ms). No hubo complicaciones. Se implantaron desfibriladores al paciente en que la taquicardia ventricular clínica siguió inducible y a otro con historia de > 60 episodios de taquicardia. Tras un seguimiento de 3-22 meses (13,8 ± 5,9), un paciente falleció por insuficiencia cardíaca a los 20 meses y otro recibió 3 descargas de desfibrilador por taquicardia ventricular a los 13 meses. En el resto no se ha producido caso de taquicardia ventricular, síncope o muerte súbita.
CONCLUSIÓN: Esta experiencia preliminar sugiere que la ablación con radiofrecuencia del sustrato de taquicardia ventricular postinfarto en ritmo sinusal es posible, lo que podría hacerla aplicable a la mayoría de los pacientes con taquicardia ventricular sostenida postinfarto.
Palabras clave
Taquicardia ventricular postinfarto
Ablación con radiofrecuencia
Mapeo de cicatriz
INTRODUCCIÓN
La técnica aceptada de ablación mediante radiofrecuencia (ARF) de la taquicardia ventricular (TV) sostenida postinfarto se basa en criterios electrofisiológicos para localizar istmos esenciales del circuito de reentrada, generalmente identificados como «zona de conducción lenta». El registro de potenciales diastólicos, encarrilamiento «oculto» de la TV (sin signos de fusión) y el ciclo de retorno local tras encarrilamiento igual que el ciclo espontáneo son criterios comúnmente aceptados para localizar estas zonas críticas 1-4. Por desgracia, este tipo de estudio no se puede llevar a cabo a menos que la TV sea bien tolerada, porque requiere mantener al paciente con este ritmo durante muchos minutos y esto limita marcadamente la aplicabilidad de la técnica 5.
Otra limitación es que con esta técnica muy selectiva se asume que el sustrato de TV sólo se utiliza en una dirección determinada, para producir un tipo concreto de TV, mientras que muchos pacientes presentan múltiples morfologías de TV inducibles y hay evidencia de que el mismo sustrato puede ser utilizado en circuitos reentrantes de diversas configuraciones 6,7, por lo que la técnica pudiera tener limitaciones inherentes a su selectividad. La cirugía de TV postinfarto basa su eficacia en la resección endocárdica de amplias superficies cicatrizales 8-11, con lo que se cubriría esta posibilidad.
Marchlinski et al han propuesto recientemente, para pacientes con TV no cartografiable, la ARF lineal amplia de la zona cicatrizal en forma de líneas entrecruzadas, realizadas durante ritmo sinusal 12,13. Esta técnica reproduciría el objetivo quirúrgico de eliminar ampliamente el sustrato potencialmente arritmogénico. A continuación presentamos nuestra experiencia inicial con esta técnica en 7 pacientes con TV postinfarto en los que la cartografía y encarrilamiento de TV no eran aplicables, bien por mala tolerancia, bien por inducirse la TV de forma no sostenida durante el estudio electrofisiológico. PACIENTES Y MÉTODOS
Se describen 5 pacientes tratados en el Hospital Universitario de Getafe y 2 pacientes tratados en el Hospital 12 de Octubre entre marzo de 1998 y febrero del 2000. Los estudios electrofisiológicos se hicieron con el paciente en ayunas, bajo sedación ligera con benzodiacepinas orales y complementado ocasionalmente con fentanilo y midazolam i.v. El paciente número 2 permaneció intubado y bajo sedación profunda, porque sólo en esta situación era posible mantenerle estable y sin TV. Se obtuvo consentimiento informado por escrito del paciente y/o sus familiares (caso 2).
Se utilizó un catéter-electrodo cuatripolar (Bard) en el ápex del ventrículo derecho (VD) y un catéter-electrodo deflector cuatripolar con electrodo distal de 8 mm (Boston Scientific), introducido por vía retrógrada arterial al ventrículo izquierdo (VI). Salvo en el caso 2, el estudio se inicia con la inducción de TV mediante estimulación programada desde el VD para reproducir la TV clínica. Se registraron, además, los ECG completos de TV no clínicas si se inducían.
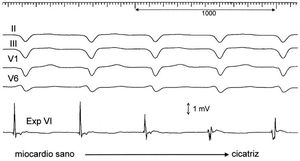
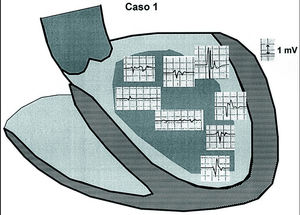
A continuación se localizó y delimitó el área de cicatriz postinfarto mediante cartografía endocárdica de VI en ritmo sinusal, observando el movimiento del catéter en 2 planos, con proyecciones oblicuas izquierda y derecha alternantes. Se consideró cicatrizal la zona con potenciales de < 2 mV de amplitud 14,15. El registro continuo durante el movimiento del catéter demostraba un cambio, rápido, de registrar electrogramas amplios y rápidos a electrogramas fragmentados y de muy bajo voltaje, con una estrecha zona límite de potenciales intermedios (fig. 1). Los límites basal, posterior y apical de la cicatriz eran relativamente sencillos de delimitar, pero el límite septal requiere maniobras más difíciles si la cicatriz se extiende ampliamente en el septo. Delimitada la cicatriz (figs. 2 y 3), se intentó localizar aproximadamente el punto de emergencia de la activación de la TV por topoestimulación, con el fin de hacer que al menos una línea de aplicaciones cruzase esta zona.
Fig. 2. Esquema de ambos ventrículos en proyección oblicua lateral izquierda. Se observa la delimitación del área de cicatriz del paciente 1 (área sombreada) y los electrogramas obtenidos mediante cartografía de voltaje en ritmo sinusal. Los electrogramas de cicatriz ponen de manifiesto potenciales fragmentados y de pequeño voltaje, a diferencia de los obtenidos sobre endocardio sano. Algunos electrogramas de voltaje «intermedio» corresponden a zonas de transición entre endocardio sano y cicatriz.
Fig. 3. El mismo esquema que en la figura 2. Se observan los electrogramas obtenidos mediante cartografía de voltaje en ritmo sinusal del paciente 6.
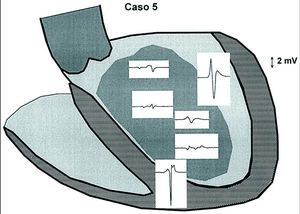
Fig. 1. Electrogramas correspondientes al registro subendocárdico de la «zona borde» entre el miocardio normal y el área de cicatriz del ventrículo izquierdo del paciente 5. Se obtiene un electrograma rápido, de voltaje > 2,5 mV, correspondiente a zona sana que, con el desplazamiento del catéter, pasa a un electrograma fragmentado, de pequeño voltaje en el área infartada. Se obtiene un electrograma de voltaje «intermedio» en el tránsito a la zona de cicatriz. Exp. VI: registro endocárdico con catéter explorador en ventrículo izquierdo.
La ARF se hizo punto a punto, usando un generador EPT-1000 XP, con temperatura límite de 70 ºC , potencia límite de 100 W y duración de 60-90 s. La primera aplicación se realizó en el borde de la cicatriz, sobre la zona de electrogramas de voltaje normal o intermedio, y las siguientes se aplicaban consecutivamente tras mover el electrodo 4-5 mm hacia el centro de la cicatriz. Se anotaron cambios en la morfología de electrogramas, pero éstos no eran objetivos finales. La aplicación de líneas no fue uniforme en todos los casos. La inducibilidad se comprobó de nuevo cuando se consideró ampliamente «cruzada» la zona cicatrizal (mínimo 2 líneas). En caso de inducir nuevas TV, de longitud de ciclo similar a la clínica, se aplicaban otras nuevas sobre la nueva zona de emergencia, localizada por topoestimulación. El objetivo final era la ausencia de inducibilidad de TV de frecuencia similar a la clínica. No se consideraron objetivo de la ARF las TV muy rápidas (LV < 240 ms) potencialmente clasificables como flúter ventricular. RESULTADOS
Caso 1
Varón de 63 años con insuficiencia renal crónica moderada por poliquistosis renal e historia de infarto inferior en 1980. Se practicó coronariografía que puso de manifiesto afección de 3 vasos no revascularizable, disfunción severa de VI e insuficiencia mitral moderada. En febrero de 1996 desarrolló TV sostenida e insuficiencia cardíaca tras recibir propafenona. Se realizó cardioversión eléctrica y se mantuvo con 200 mg diarios de amiodarona. Dos años después reingresó con TV lenta (125 lat/min) mal tolerada. En un primer procedimiento de ARF, la TV clínica se hizo no inducible, pero permanecía inducible una TV de morfología «no clínica» con longitud de ciclo similar. Un mes más tarde presentó recurrencia de la TV sostenida igual a la inducible al final de la ARF. En un nuevo intento de ARF se indujo la TV de forma reproducible, pero con mala tolerancia suspendiéndose por edema de pulmón.
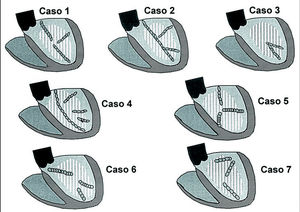
Tras estabilizar al paciente se realizó ARF en ritmo sinusal. Las líneas de ARF, con un total de 23 aplicaciones, se exponen en la figura 4. Después del procedimiento no se indujo TV sostenida ni no sostenida, con 3 extraestímulos a 3 longitudes de ciclo base. No hubo complicaciones. El paciente continuó con amiodarona, diuréticos, inhibidores de la enzima convertidora de la angiotensina (IECA) y anticoagulación oral. Su curso clínico fue de insuficiencia cardíaca progresiva y episodios de taquicardia y fibrilación auricular, sin recurrencias de TV. Falleció por insuficiencia cardíaca a los 20 meses.
Fig. 4. Representación esquemática de ambos ventrículos en una proyección oblicua lateral izquierda. Se representan las líneas de ablación con radiofrecuencia (ARF) trazadas en los pacientes descritos en el texto. Cada línea está formada por un número de puntos ovales igual al número de aplicaciones puntuales empleadas.
Caso 2
Varón de 63 años con infarto de miocardio inferoposterior en 1981. En abril de 1998 presentó TV sostenida a 250 lat/min con hipotensión y presíncope, que cedió con procainamida i.v., para recurrir múltiples veces, haciéndose resistente a amiodarona i.v. En 6 días requirió 60 cardioversiones externas y, finalmente, fue controlado con sedación profunda e intubación. La coronariografía puso de manifiesto disfunción sistólica del VI con fracción de eyección del 38% y lesiones no significativas en arteria circunfleja y la coronaria derecha.
Para la ARF se delimitó la cicatriz en la pared inferoposterior del VI por cartografía de voltaje. No se intentó la inducción por la situación del paciente y la amplia documentación clínica de la TV. El punto aproximado de emergencia de la activación estaba en el borde posterior-basal de la zona cicatrizal. Las líneas de aplicaciones se exponen en la figura 4. Tras la primera línea basal se indujo TV de ciclo 290 ms, parecida a la clínica, con eje más vertical, que fue interrumpido con estimulación. Se añaden 2 nuevas líneas de ARF guiadas por topoestimulación, con la nueva morfología de TV como referencia, tras lo cual no se indujo la TV y sí un flúter ventricular (ciclo de 210 ms) de morfología sinusoidal que requirió cardioversión. El número total de aplicaciones fue de 28. No hubo complicaciones y el paciente fue extubado posteriormente.
Dada la evolución previa se implantó desfibrilador automático. El paciente se ha mantenido sin arritmias hasta recibir 3 descargas por TV a los 13 meses de la ARF. Durante los siguientes 9 meses ha estado asintomático, tratado con sotalol, IECA, furosemida, espironolactona y omeprazol.
Caso 3
Varón de 66 años que ingresó por disnea y palpitaciones de 1 semana de duración. Al ingreso se registró TV monomorfa a 200 lat/min con morfología de bloqueo de rama derecha y eje superior, que precisó cardioversión eléctrica, recurriendo posteriormente en dos ocasiones. El ECG sugirió infarto inferior. La coronariografía puso de manifiesto lesiones en la arteria coronaria derecha y diagonal dominante, no revascularizables, aneurisma posterobasal y fracción de eyección de ventrículo izquierdo del 38%. La prueba de perfusión con talio 201 demostró isquemia reversible inferior.
Se inició el estudio con efecto residual de propranolol (hasta 12 h antes) y perfusión de lidocaína suspendida 2 h antes. Se indujeron reproduciblemente rachas de TV clínica no sostenida basalmente y bajo infusión de isoproterenol, por lo que se optó por ablación durante ritmo sinusal. Se realizaron 2 líneas de ARF en torno al punto de emergencia de la activación, determinado aproximadamente por topoestimulación, como se observa en la figura 4. El número total de aplicaciones fue de 11. Tras la ARF no se pudo inducir ninguna TV no sostenida ni sostenida. No ha presentado recurrencias de la TV en 19 meses de seguimiento. El paciente sigue tratamiento con atenolol, IECA y aspirina.
Caso 4
Varón de 68 años con historia de infarto de miocardio inferior en 1987, en tratamiento con verapamilo, nitratos y aspirina. Ingresó por cuadro de malestar y palpitaciones. El ECG puso de manifiesto TV con morfología de bloqueo de rama derecha, y eje indeterminado a 200 lat/min, que cedió con procainamida i.v. El eco-Doppler demostró discinesia inferobasal y disfunción sistólica, con fracción de eyección del 35%. La coronariografía evidenció oclusión crónica de la coronaria derecha y la circunfleja. No hubo isquemia reversible en el estudio de perfusión con talio-201.
Se indujo TV clínica, mal tolerada, con síncope, que requirió cardioversión, por lo que se decidió ARF en ritmo sinusal. Se localizó la zona de cicatriz abarcando toda la cara inferior, del ápex a la base y desde el septo inferior al VI posterior. La topoestimulación reprodujo la morfología de la TV clínica en la pared posterobasal. Se trazaron 3 líneas de ARF cruzando toda la cicatriz de ápex a la base y el borde posterior basal y medio (fig. 4). Todavía se inducía TV no clínica, con imagen de bloqueo de rama derecha y eje superior con emergencia en el borde ápico posterior de la cicatriz, por lo que se realizó una cuarta línea de ARF cruzando esta zona. Tras esta línea, aún se indujo otra TV no clínica de ciclo de 250 ms. El número total de aplicaciones fue de 23. No ha habido recurrencias de TV en 17 meses de seguimiento, bajo tratamiento con atenolol, IECA y aspirina.
Caso 5
Varón de 56 años con infarto inferoposterior en 1994 y cirugía de revascularización con fracción de eyección de ventrículo izquierdo del 25%. Presentó un cuadro sincopal en febrero de 1999 con taquicardia con morfología de bloqueo de la rama derecha y eje superior derecho, que precisó cardioversión eléctrica. El ECG puso de manifiesto un infarto inferior, un intervalo PR largo y un trastorno de la conducción intraventricular inespecífico. Se produjeron varios episodios recurrentes durante el ingreso que cedieron tras la administración de procainamida. Se realizó un estudio electrofisiológico, observándose en condiciones basales un trastorno de la conducción infrahisiano con un intervalo HV de 120 ms. Se indujo TV no clínica con morfología de bloqueo de la rama izquierda y flúter ventricular (ciclo de 235 ms) que precisó cardioversión. Finalmente, se indujo TV clínica mal tolerada por hipotensión. Se trazaron 3 líneas de ARF en ritmo sinusal, según se observa en la figura 4, con un total de 25 aplicaciones. Después se indujo flúter ventricular que degeneró en FV, precisando desfibrilación. De nuevo fue inducible la TV clínica, que finalizó con sobreestimulación. Se dio el procedimiento por fracasado y se decidió la implantación de un desfibrilador automático bicameral.
Caso 6
Varón de 70 años con historia de infarto inferior. Presentó un cuadro sincopal y registro de TV a 200 lat/min, con morfología de bloqueo de la rama izquierda y del eje superior, precisando cardioversión. Con posterioridad se produjeron 2 episodios de fibrilación ventricular que requirieron nuevos choques, para estabilizarse en ritmo sinusal. No presentó evolución enzimática típica de necrosis aguda. La coronariografía demostró oclusión en la arteria coronaria derecha media con mal vaso distal y fracción de eyección ventricular izquierda del 48%, con aneurisma posteroinferior. El estudio electrofisiológico realizado indujo TV clínica no sostenida y flúter ventricular de ciclo 230 ms, con compromiso hemodinámico, que precisó un choque para su terminación. Ante estos datos se decidió realizar ARF en líneas. Tras delimitar la cicatriz mediante cartografía de voltaje, se trazaron 3 líneas con un total de 22 puntos (fig. 4) tras lo cual no se logró inducir ninguna TV. Tras 6 meses de seguimiento bajo tratamiento con aspirina, atenolol e IECA, el paciente no ha presentado recurrencias.
Caso 7
Varón de 69 años con ECG de infarto inferior desde 3 años antes y fracción de eyección del ventrículo izquierdo del 55%. Asintomático hasta febrero de 2000, en que presentó un cuadro presincopal y dolor precordial durante un esfuerzo ligero. Se registró una TV a 180 lat/min, con hipotensión que precisó cardioversión. Bajo tratamiento con lidocaína, no presentó episodios de TV, pero reaparecieron tras suspender el fármaco. La angiografía puso de manifiesto oclusión distal de la coronaria derecha y estenosis severa de una rama obtusa marginal. En estudio electrofisiológico se indujo la TV clínica, y otra TV no clínica con mala tolerancia, que cedió con sobreestimulación. Se trazaron 3 líneas de ARF con un total de 15 de aplicaciones (fig. 4), tras lo cual sólo queda inducible un flúter ventricular de ciclo 225 ms que precisó cardioversión eléctrica. A los 3 meses de seguimiento no se han producido nuevos episodios de TV bajo tratamiento con atenolol, IECA y aspirina. DISCUSIÓN
Esta experiencia inicial demuestra que la ablación de TV postinfarto durante ritmo sinusal, siguiendo criterios anatómicos, es realizable en casos seleccionados, con buenos resultados electrofisiológicos y clínicos. El seguimiento de estos pacientes ha sido suficientemente prolongado en 6 de ellos para que la ausencia de recurrencias sea muy sugerente de una eficacia terapéutica real. El caso 1 siguió recibiendo dosis bajas de amiodarona, pero había padecido previamente recurrencias bajo la misma dosis. El caso 2, que recibió un desfibrilador automático, sólo tuvo una recurrencia tardía, con buena respuesta a los fármacos, en contraste con su situación de TV incesante inicial. El caso 5, que también recibió un desfibrilador dado el fracaso terapéutico inmediato, ha tenido recidivas de TV en los primeros meses de seguimiento.
La cirugía de TV ha sido un tratamiento con muy buenos resultados clínicos 11,14,, que se aplica rara vez sólo por su alto riesgo y la necesidad de contar con un equipo quirúrgico especialmente entrenado 15,16. En la era del desfibrilador, la ARF podría obviar la necesidad de implantarlo o podría ser necesaria en pacientes portadores de desfibrilador que padecen episodios frecuentes de TV 13. El pronóstico de pacientes bien seleccionados con TV postinfarto tratados quirúrgicamente o sometidos a ARF es satisfactorio sin desfibrilador 14,17, y en pacientes sin otros factores de riesgo de muerte arrítmica podría considerarse en principio como el tratamiento de elección, ya que elimina la raíz del problema, evitando las descargas apropiadas y no apropiadas, con sus negativas consecuencias psíquicas y los riesgos de fallos mecánicos o electrónicos del aparato 18-20. Las recientes recomendaciones de la Sociedad Española de Cardiología revisan las indicaciones de desfibrilador en pacientes con TV, considerando la falta de respuesta a la ARF o cirugía como indicación de implante 21.
Sin embargo, la gran limitación de la ARF es la necesidad de realizar maniobras de localización del objetivo durante TV sostenida, lo que limita su aplicación a los pacientes que toleran la TV. La posibilidad de realizar ARF sobre el sustrato anatómico definido en ritmo sinusal, propuesta por Marchlinski et al 12,13, puede abrir una nueva perspectiva y permitir la aplicación de la ARF a la mayoría de las TV que se presenten clínicamente fuera de un cuadro de parada cardíaca. La ARF así aplicada podría, además, ser más extensa, acercándose a la eficacia de la propia cirugía de resección endocárdica. Estudios anatomopatológicos 3,6,7,22 han demostrado que amplias zonas de las cicatrices postinfarto pueden contener fibras miocárdicas vivas, pero desacopladas por el colágeno que las separa (anisotropía no uniforme), capaces de conducir lenta y/o tortuosamente el impulso eléctrico durante los períodos más silentes de la reentrada («diástole») 23. Aunque el sustrato anatómico sea fijo, los caminos elegidos por la activación dentro del circuito pueden variar por cambios en sus características funcionales 24-26, dando lugar a múltiples morfologías de TV en el ECG. La ablación sistemática, en líneas, podría permitir eliminar los caminos potenciales de reentrada en el seno de la cicatriz en uno o varios puntos, aumentado aleatoriamente las posibilidades de eliminar el sustrato, más allá de la ARF dirigida a un punto muy limitado del circuito de una sola TV.
Siguiendo la sugerencia de Marchlinski 13, hemos procurado siempre que una de las líneas cruzase la zona de salida de la activación desde la cicatriz al miocardio sano, detectada por medio de topoestimulación 27,28. Con esta táctica se procura asegurar la ARF de al menos el punto de salida del circuito 29,30. Nuestra experiencia inicial pudiera apoyar su utilidad ya que, cuando tras las primeras líneas se inducían nuevas TV de morfología distinta a la clínica, la aplicación de nuevas líneas en torno al nuevo punto de salida fue eficaz en algunos de nuestros casos.
La forma de identificar el tejido cicatrizal en ritmo sinusal es básica para la ARF de TV con esta técnica. Estudios experimentales han demostrado cambios de voltaje y configuración de electrogramas muy significativos al entrar el tejido cicatrizal 31-33, y la cartografía endocárdica sistemática usada en nuestros casos no ofrecía dudas al respecto, con cambios bruscos de voltaje fácilmente detectables (figs. 1-3). Otro problema es la capacidad de hacer recorrer al catéter de ARF la cicatriz de forma sistemática, ya que esto requiere una fina orientación anatómica y espacial y un movimiento muy preciso del catéter. Sin duda, nuestra experiencia en mapeos sistemáticos de arritmias auriculares 34,35 ha contribuido a que esta cartografía fuese posible sin necesidad de utilizar métodos más sofisticados de localización espacial del catéter, como el sistema Carto ®. El mismo Marchlinski inició la aplicación de esta técnica sin más ayuda que la fluoroscopia multiplana 13. Por cierto que nuestros tiempos de intervención y de fluoroscopia se comparan favorablemente con los de este autor, reflejando la complejidad de aplicación de los nuevos sistemas electromagnéticos de localización en el laboratorio. En nuestra experiencia, la accesibilidad y movilidad es más fácil en las paredes inferior y posterior que en el septo, especialmente en la parte superior de este último, donde es más difícil mantener un movimiento uniforme del catéter.
Esta experiencia inicial abre también numerosas cuestiones metodológicas: ¿cuál es la localización y longitud ideal de las líneas?, ¿basta con la ARF del borde de la cicatriz, o es necesario cruzarla por entero?, ¿puede afectar a la función del VI el número elevado de aplicaciones, aunque se realicen fundamentalmente sobre tejido cicatrizal? Los estudios sobre la aplicación de radiofrecuencia en tejidos humanos previamente infartados son pocos, pero los datos disponi-bles 36 sugieren que las lesiones producen un efecto similar al realizado sobre miocardio sano. Estudios previos de ablación de TV por métodos «clásicos» ponen de manifiesto un número de aplicaciones de RDF también elevado 37, y el grupo de Marchlinski utilizó un número de aplicaciones muy superior al utilizado por nosotros, sin consecuencias negativas aparentes. Tampoco hemos observado complicaciones tromboembólicas, que se podrían quizá esperar de una ablación endocárdica más amplia.
Además, permanecen abiertas otras cuestiones metodológicas que también afectan a la ARF de TV por el método «clásico». La inducibilidad de la TV, que es la guía final en ambos métodos, no es tan reproducible como sería deseable 38,39 y esto hace a veces difícil determinar el éxito o fracaso de la intervención. La inducción de otras TV no clínicas, muy rápidas, como en alguno de nuestros casos, tiende a considerarse un artefacto, pero su significación puede ser difícil de valorar. Aunque el objetivo de la ARF sea eliminar la arritmia, frecuentemente será necesario asociar fármacos o un desfibrilador, cuando la situación clínica y la función ventricular indiquen un alto riesgo de muerte arrítmica. CONCLUSIÓN
La ARF en forma de líneas amplias que crucen la zona cicatrizal postinfarto puede ser eficaz en casos seleccionados de TV mal tolerada o no sostenida, no accesible a la ARF apoyada en la localización del punto de emergencia del circuito. Esta técnica podría abrir el campo de la ARF a un gran número de enfermos de TV y merece ser explorada con estudios amplios y prospectivos. Estos estudios deberán determinar el alcance terapéutico y las indicaciones de la técnica y, por otro lado, deberán depurar las condiciones de su aplicación, definiendo mejor el número, longitud y localización ideales de las líneas de ablación en relación al tipo de TV y el contexto clínico del enfermo.
La técnica aceptada de ablación mediante radiofrecuencia (ARF) de la taquicardia ventricular (TV) sostenida postinfarto se basa en criterios electrofisiológicos para localizar istmos esenciales del circuito de reentrada, generalmente identificados como «zona de conducción lenta». El registro de potenciales diastólicos, encarrilamiento «oculto» de la TV (sin signos de fusión) y el ciclo de retorno local tras encarrilamiento igual que el ciclo espontáneo son criterios comúnmente aceptados para localizar estas zonas críticas 1-4. Por desgracia, este tipo de estudio no se puede llevar a cabo a menos que la TV sea bien tolerada, porque requiere mantener al paciente con este ritmo durante muchos minutos y esto limita marcadamente la aplicabilidad de la técnica 5.
Otra limitación es que con esta técnica muy selectiva se asume que el sustrato de TV sólo se utiliza en una dirección determinada, para producir un tipo concreto de TV, mientras que muchos pacientes presentan múltiples morfologías de TV inducibles y hay evidencia de que el mismo sustrato puede ser utilizado en circuitos reentrantes de diversas configuraciones 6,7, por lo que la técnica pudiera tener limitaciones inherentes a su selectividad. La cirugía de TV postinfarto basa su eficacia en la resección endocárdica de amplias superficies cicatrizales 8-11, con lo que se cubriría esta posibilidad.
Marchlinski et al han propuesto recientemente, para pacientes con TV no cartografiable, la ARF lineal amplia de la zona cicatrizal en forma de líneas entrecruzadas, realizadas durante ritmo sinusal 12,13. Esta técnica reproduciría el objetivo quirúrgico de eliminar ampliamente el sustrato potencialmente arritmogénico. A continuación presentamos nuestra experiencia inicial con esta técnica en 7 pacientes con TV postinfarto en los que la cartografía y encarrilamiento de TV no eran aplicables, bien por mala tolerancia, bien por inducirse la TV de forma no sostenida durante el estudio electrofisiológico. PACIENTES Y MÉTODOS
Se describen 5 pacientes tratados en el Hospital Universitario de Getafe y 2 pacientes tratados en el Hospital 12 de Octubre entre marzo de 1998 y febrero del 2000. Los estudios electrofisiológicos se hicieron con el paciente en ayunas, bajo sedación ligera con benzodiacepinas orales y complementado ocasionalmente con fentanilo y midazolam i.v. El paciente número 2 permaneció intubado y bajo sedación profunda, porque sólo en esta situación era posible mantenerle estable y sin TV. Se obtuvo consentimiento informado por escrito del paciente y/o sus familiares (caso 2).
Se utilizó un catéter-electrodo cuatripolar (Bard) en el ápex del ventrículo derecho (VD) y un catéter-electrodo deflector cuatripolar con electrodo distal de 8 mm (Boston Scientific), introducido por vía retrógrada arterial al ventrículo izquierdo (VI). Salvo en el caso 2, el estudio se inicia con la inducción de TV mediante estimulación programada desde el VD para reproducir la TV clínica. Se registraron, además, los ECG completos de TV no clínicas si se inducían.
A continuación se localizó y delimitó el área de cicatriz postinfarto mediante cartografía endocárdica de VI en ritmo sinusal, observando el movimiento del catéter en 2 planos, con proyecciones oblicuas izquierda y derecha alternantes. Se consideró cicatrizal la zona con potenciales de < 2 mV de amplitud 14,15. El registro continuo durante el movimiento del catéter demostraba un cambio, rápido, de registrar electrogramas amplios y rápidos a electrogramas fragmentados y de muy bajo voltaje, con una estrecha zona límite de potenciales intermedios (fig. 1). Los límites basal, posterior y apical de la cicatriz eran relativamente sencillos de delimitar, pero el límite septal requiere maniobras más difíciles si la cicatriz se extiende ampliamente en el septo. Delimitada la cicatriz (figs. 2 y 3), se intentó localizar aproximadamente el punto de emergencia de la activación de la TV por topoestimulación, con el fin de hacer que al menos una línea de aplicaciones cruzase esta zona.
Fig. 2. Esquema de ambos ventrículos en proyección oblicua lateral izquierda. Se observa la delimitación del área de cicatriz del paciente 1 (área sombreada) y los electrogramas obtenidos mediante cartografía de voltaje en ritmo sinusal. Los electrogramas de cicatriz ponen de manifiesto potenciales fragmentados y de pequeño voltaje, a diferencia de los obtenidos sobre endocardio sano. Algunos electrogramas de voltaje «intermedio» corresponden a zonas de transición entre endocardio sano y cicatriz.
Fig. 3. El mismo esquema que en la figura 2. Se observan los electrogramas obtenidos mediante cartografía de voltaje en ritmo sinusal del paciente 6.
Fig. 1. Electrogramas correspondientes al registro subendocárdico de la «zona borde» entre el miocardio normal y el área de cicatriz del ventrículo izquierdo del paciente 5. Se obtiene un electrograma rápido, de voltaje > 2,5 mV, correspondiente a zona sana que, con el desplazamiento del catéter, pasa a un electrograma fragmentado, de pequeño voltaje en el área infartada. Se obtiene un electrograma de voltaje «intermedio» en el tránsito a la zona de cicatriz. Exp. VI: registro endocárdico con catéter explorador en ventrículo izquierdo.
La ARF se hizo punto a punto, usando un generador EPT-1000 XP, con temperatura límite de 70 ºC , potencia límite de 100 W y duración de 60-90 s. La primera aplicación se realizó en el borde de la cicatriz, sobre la zona de electrogramas de voltaje normal o intermedio, y las siguientes se aplicaban consecutivamente tras mover el electrodo 4-5 mm hacia el centro de la cicatriz. Se anotaron cambios en la morfología de electrogramas, pero éstos no eran objetivos finales. La aplicación de líneas no fue uniforme en todos los casos. La inducibilidad se comprobó de nuevo cuando se consideró ampliamente «cruzada» la zona cicatrizal (mínimo 2 líneas). En caso de inducir nuevas TV, de longitud de ciclo similar a la clínica, se aplicaban otras nuevas sobre la nueva zona de emergencia, localizada por topoestimulación. El objetivo final era la ausencia de inducibilidad de TV de frecuencia similar a la clínica. No se consideraron objetivo de la ARF las TV muy rápidas (LV < 240 ms) potencialmente clasificables como flúter ventricular. RESULTADOS
Caso 1
Varón de 63 años con insuficiencia renal crónica moderada por poliquistosis renal e historia de infarto inferior en 1980. Se practicó coronariografía que puso de manifiesto afección de 3 vasos no revascularizable, disfunción severa de VI e insuficiencia mitral moderada. En febrero de 1996 desarrolló TV sostenida e insuficiencia cardíaca tras recibir propafenona. Se realizó cardioversión eléctrica y se mantuvo con 200 mg diarios de amiodarona. Dos años después reingresó con TV lenta (125 lat/min) mal tolerada. En un primer procedimiento de ARF, la TV clínica se hizo no inducible, pero permanecía inducible una TV de morfología «no clínica» con longitud de ciclo similar. Un mes más tarde presentó recurrencia de la TV sostenida igual a la inducible al final de la ARF. En un nuevo intento de ARF se indujo la TV de forma reproducible, pero con mala tolerancia suspendiéndose por edema de pulmón.
Tras estabilizar al paciente se realizó ARF en ritmo sinusal. Las líneas de ARF, con un total de 23 aplicaciones, se exponen en la figura 4. Después del procedimiento no se indujo TV sostenida ni no sostenida, con 3 extraestímulos a 3 longitudes de ciclo base. No hubo complicaciones. El paciente continuó con amiodarona, diuréticos, inhibidores de la enzima convertidora de la angiotensina (IECA) y anticoagulación oral. Su curso clínico fue de insuficiencia cardíaca progresiva y episodios de taquicardia y fibrilación auricular, sin recurrencias de TV. Falleció por insuficiencia cardíaca a los 20 meses.
Fig. 4. Representación esquemática de ambos ventrículos en una proyección oblicua lateral izquierda. Se representan las líneas de ablación con radiofrecuencia (ARF) trazadas en los pacientes descritos en el texto. Cada línea está formada por un número de puntos ovales igual al número de aplicaciones puntuales empleadas.
Caso 2
Varón de 63 años con infarto de miocardio inferoposterior en 1981. En abril de 1998 presentó TV sostenida a 250 lat/min con hipotensión y presíncope, que cedió con procainamida i.v., para recurrir múltiples veces, haciéndose resistente a amiodarona i.v. En 6 días requirió 60 cardioversiones externas y, finalmente, fue controlado con sedación profunda e intubación. La coronariografía puso de manifiesto disfunción sistólica del VI con fracción de eyección del 38% y lesiones no significativas en arteria circunfleja y la coronaria derecha.
Para la ARF se delimitó la cicatriz en la pared inferoposterior del VI por cartografía de voltaje. No se intentó la inducción por la situación del paciente y la amplia documentación clínica de la TV. El punto aproximado de emergencia de la activación estaba en el borde posterior-basal de la zona cicatrizal. Las líneas de aplicaciones se exponen en la figura 4. Tras la primera línea basal se indujo TV de ciclo 290 ms, parecida a la clínica, con eje más vertical, que fue interrumpido con estimulación. Se añaden 2 nuevas líneas de ARF guiadas por topoestimulación, con la nueva morfología de TV como referencia, tras lo cual no se indujo la TV y sí un flúter ventricular (ciclo de 210 ms) de morfología sinusoidal que requirió cardioversión. El número total de aplicaciones fue de 28. No hubo complicaciones y el paciente fue extubado posteriormente.
Dada la evolución previa se implantó desfibrilador automático. El paciente se ha mantenido sin arritmias hasta recibir 3 descargas por TV a los 13 meses de la ARF. Durante los siguientes 9 meses ha estado asintomático, tratado con sotalol, IECA, furosemida, espironolactona y omeprazol.
Caso 3
Varón de 66 años que ingresó por disnea y palpitaciones de 1 semana de duración. Al ingreso se registró TV monomorfa a 200 lat/min con morfología de bloqueo de rama derecha y eje superior, que precisó cardioversión eléctrica, recurriendo posteriormente en dos ocasiones. El ECG sugirió infarto inferior. La coronariografía puso de manifiesto lesiones en la arteria coronaria derecha y diagonal dominante, no revascularizables, aneurisma posterobasal y fracción de eyección de ventrículo izquierdo del 38%. La prueba de perfusión con talio 201 demostró isquemia reversible inferior.
Se inició el estudio con efecto residual de propranolol (hasta 12 h antes) y perfusión de lidocaína suspendida 2 h antes. Se indujeron reproduciblemente rachas de TV clínica no sostenida basalmente y bajo infusión de isoproterenol, por lo que se optó por ablación durante ritmo sinusal. Se realizaron 2 líneas de ARF en torno al punto de emergencia de la activación, determinado aproximadamente por topoestimulación, como se observa en la figura 4. El número total de aplicaciones fue de 11. Tras la ARF no se pudo inducir ninguna TV no sostenida ni sostenida. No ha presentado recurrencias de la TV en 19 meses de seguimiento. El paciente sigue tratamiento con atenolol, IECA y aspirina.
Caso 4
Varón de 68 años con historia de infarto de miocardio inferior en 1987, en tratamiento con verapamilo, nitratos y aspirina. Ingresó por cuadro de malestar y palpitaciones. El ECG puso de manifiesto TV con morfología de bloqueo de rama derecha, y eje indeterminado a 200 lat/min, que cedió con procainamida i.v. El eco-Doppler demostró discinesia inferobasal y disfunción sistólica, con fracción de eyección del 35%. La coronariografía evidenció oclusión crónica de la coronaria derecha y la circunfleja. No hubo isquemia reversible en el estudio de perfusión con talio-201.
Se indujo TV clínica, mal tolerada, con síncope, que requirió cardioversión, por lo que se decidió ARF en ritmo sinusal. Se localizó la zona de cicatriz abarcando toda la cara inferior, del ápex a la base y desde el septo inferior al VI posterior. La topoestimulación reprodujo la morfología de la TV clínica en la pared posterobasal. Se trazaron 3 líneas de ARF cruzando toda la cicatriz de ápex a la base y el borde posterior basal y medio (fig. 4). Todavía se inducía TV no clínica, con imagen de bloqueo de rama derecha y eje superior con emergencia en el borde ápico posterior de la cicatriz, por lo que se realizó una cuarta línea de ARF cruzando esta zona. Tras esta línea, aún se indujo otra TV no clínica de ciclo de 250 ms. El número total de aplicaciones fue de 23. No ha habido recurrencias de TV en 17 meses de seguimiento, bajo tratamiento con atenolol, IECA y aspirina.
Caso 5
Varón de 56 años con infarto inferoposterior en 1994 y cirugía de revascularización con fracción de eyección de ventrículo izquierdo del 25%. Presentó un cuadro sincopal en febrero de 1999 con taquicardia con morfología de bloqueo de la rama derecha y eje superior derecho, que precisó cardioversión eléctrica. El ECG puso de manifiesto un infarto inferior, un intervalo PR largo y un trastorno de la conducción intraventricular inespecífico. Se produjeron varios episodios recurrentes durante el ingreso que cedieron tras la administración de procainamida. Se realizó un estudio electrofisiológico, observándose en condiciones basales un trastorno de la conducción infrahisiano con un intervalo HV de 120 ms. Se indujo TV no clínica con morfología de bloqueo de la rama izquierda y flúter ventricular (ciclo de 235 ms) que precisó cardioversión. Finalmente, se indujo TV clínica mal tolerada por hipotensión. Se trazaron 3 líneas de ARF en ritmo sinusal, según se observa en la figura 4, con un total de 25 aplicaciones. Después se indujo flúter ventricular que degeneró en FV, precisando desfibrilación. De nuevo fue inducible la TV clínica, que finalizó con sobreestimulación. Se dio el procedimiento por fracasado y se decidió la implantación de un desfibrilador automático bicameral.
Caso 6
Varón de 70 años con historia de infarto inferior. Presentó un cuadro sincopal y registro de TV a 200 lat/min, con morfología de bloqueo de la rama izquierda y del eje superior, precisando cardioversión. Con posterioridad se produjeron 2 episodios de fibrilación ventricular que requirieron nuevos choques, para estabilizarse en ritmo sinusal. No presentó evolución enzimática típica de necrosis aguda. La coronariografía demostró oclusión en la arteria coronaria derecha media con mal vaso distal y fracción de eyección ventricular izquierda del 48%, con aneurisma posteroinferior. El estudio electrofisiológico realizado indujo TV clínica no sostenida y flúter ventricular de ciclo 230 ms, con compromiso hemodinámico, que precisó un choque para su terminación. Ante estos datos se decidió realizar ARF en líneas. Tras delimitar la cicatriz mediante cartografía de voltaje, se trazaron 3 líneas con un total de 22 puntos (fig. 4) tras lo cual no se logró inducir ninguna TV. Tras 6 meses de seguimiento bajo tratamiento con aspirina, atenolol e IECA, el paciente no ha presentado recurrencias.
Caso 7
Varón de 69 años con ECG de infarto inferior desde 3 años antes y fracción de eyección del ventrículo izquierdo del 55%. Asintomático hasta febrero de 2000, en que presentó un cuadro presincopal y dolor precordial durante un esfuerzo ligero. Se registró una TV a 180 lat/min, con hipotensión que precisó cardioversión. Bajo tratamiento con lidocaína, no presentó episodios de TV, pero reaparecieron tras suspender el fármaco. La angiografía puso de manifiesto oclusión distal de la coronaria derecha y estenosis severa de una rama obtusa marginal. En estudio electrofisiológico se indujo la TV clínica, y otra TV no clínica con mala tolerancia, que cedió con sobreestimulación. Se trazaron 3 líneas de ARF con un total de 15 de aplicaciones (fig. 4), tras lo cual sólo queda inducible un flúter ventricular de ciclo 225 ms que precisó cardioversión eléctrica. A los 3 meses de seguimiento no se han producido nuevos episodios de TV bajo tratamiento con atenolol, IECA y aspirina. DISCUSIÓN
Esta experiencia inicial demuestra que la ablación de TV postinfarto durante ritmo sinusal, siguiendo criterios anatómicos, es realizable en casos seleccionados, con buenos resultados electrofisiológicos y clínicos. El seguimiento de estos pacientes ha sido suficientemente prolongado en 6 de ellos para que la ausencia de recurrencias sea muy sugerente de una eficacia terapéutica real. El caso 1 siguió recibiendo dosis bajas de amiodarona, pero había padecido previamente recurrencias bajo la misma dosis. El caso 2, que recibió un desfibrilador automático, sólo tuvo una recurrencia tardía, con buena respuesta a los fármacos, en contraste con su situación de TV incesante inicial. El caso 5, que también recibió un desfibrilador dado el fracaso terapéutico inmediato, ha tenido recidivas de TV en los primeros meses de seguimiento.
La cirugía de TV ha sido un tratamiento con muy buenos resultados clínicos 11,14,, que se aplica rara vez sólo por su alto riesgo y la necesidad de contar con un equipo quirúrgico especialmente entrenado 15,16. En la era del desfibrilador, la ARF podría obviar la necesidad de implantarlo o podría ser necesaria en pacientes portadores de desfibrilador que padecen episodios frecuentes de TV 13. El pronóstico de pacientes bien seleccionados con TV postinfarto tratados quirúrgicamente o sometidos a ARF es satisfactorio sin desfibrilador 14,17, y en pacientes sin otros factores de riesgo de muerte arrítmica podría considerarse en principio como el tratamiento de elección, ya que elimina la raíz del problema, evitando las descargas apropiadas y no apropiadas, con sus negativas consecuencias psíquicas y los riesgos de fallos mecánicos o electrónicos del aparato 18-20. Las recientes recomendaciones de la Sociedad Española de Cardiología revisan las indicaciones de desfibrilador en pacientes con TV, considerando la falta de respuesta a la ARF o cirugía como indicación de implante 21.
Sin embargo, la gran limitación de la ARF es la necesidad de realizar maniobras de localización del objetivo durante TV sostenida, lo que limita su aplicación a los pacientes que toleran la TV. La posibilidad de realizar ARF sobre el sustrato anatómico definido en ritmo sinusal, propuesta por Marchlinski et al 12,13, puede abrir una nueva perspectiva y permitir la aplicación de la ARF a la mayoría de las TV que se presenten clínicamente fuera de un cuadro de parada cardíaca. La ARF así aplicada podría, además, ser más extensa, acercándose a la eficacia de la propia cirugía de resección endocárdica. Estudios anatomopatológicos 3,6,7,22 han demostrado que amplias zonas de las cicatrices postinfarto pueden contener fibras miocárdicas vivas, pero desacopladas por el colágeno que las separa (anisotropía no uniforme), capaces de conducir lenta y/o tortuosamente el impulso eléctrico durante los períodos más silentes de la reentrada («diástole») 23. Aunque el sustrato anatómico sea fijo, los caminos elegidos por la activación dentro del circuito pueden variar por cambios en sus características funcionales 24-26, dando lugar a múltiples morfologías de TV en el ECG. La ablación sistemática, en líneas, podría permitir eliminar los caminos potenciales de reentrada en el seno de la cicatriz en uno o varios puntos, aumentado aleatoriamente las posibilidades de eliminar el sustrato, más allá de la ARF dirigida a un punto muy limitado del circuito de una sola TV.
Siguiendo la sugerencia de Marchlinski 13, hemos procurado siempre que una de las líneas cruzase la zona de salida de la activación desde la cicatriz al miocardio sano, detectada por medio de topoestimulación 27,28. Con esta táctica se procura asegurar la ARF de al menos el punto de salida del circuito 29,30. Nuestra experiencia inicial pudiera apoyar su utilidad ya que, cuando tras las primeras líneas se inducían nuevas TV de morfología distinta a la clínica, la aplicación de nuevas líneas en torno al nuevo punto de salida fue eficaz en algunos de nuestros casos.
La forma de identificar el tejido cicatrizal en ritmo sinusal es básica para la ARF de TV con esta técnica. Estudios experimentales han demostrado cambios de voltaje y configuración de electrogramas muy significativos al entrar el tejido cicatrizal 31-33, y la cartografía endocárdica sistemática usada en nuestros casos no ofrecía dudas al respecto, con cambios bruscos de voltaje fácilmente detectables (figs. 1-3). Otro problema es la capacidad de hacer recorrer al catéter de ARF la cicatriz de forma sistemática, ya que esto requiere una fina orientación anatómica y espacial y un movimiento muy preciso del catéter. Sin duda, nuestra experiencia en mapeos sistemáticos de arritmias auriculares 34,35 ha contribuido a que esta cartografía fuese posible sin necesidad de utilizar métodos más sofisticados de localización espacial del catéter, como el sistema Carto ®. El mismo Marchlinski inició la aplicación de esta técnica sin más ayuda que la fluoroscopia multiplana 13. Por cierto que nuestros tiempos de intervención y de fluoroscopia se comparan favorablemente con los de este autor, reflejando la complejidad de aplicación de los nuevos sistemas electromagnéticos de localización en el laboratorio. En nuestra experiencia, la accesibilidad y movilidad es más fácil en las paredes inferior y posterior que en el septo, especialmente en la parte superior de este último, donde es más difícil mantener un movimiento uniforme del catéter.
Esta experiencia inicial abre también numerosas cuestiones metodológicas: ¿cuál es la localización y longitud ideal de las líneas?, ¿basta con la ARF del borde de la cicatriz, o es necesario cruzarla por entero?, ¿puede afectar a la función del VI el número elevado de aplicaciones, aunque se realicen fundamentalmente sobre tejido cicatrizal? Los estudios sobre la aplicación de radiofrecuencia en tejidos humanos previamente infartados son pocos, pero los datos disponi-bles 36 sugieren que las lesiones producen un efecto similar al realizado sobre miocardio sano. Estudios previos de ablación de TV por métodos «clásicos» ponen de manifiesto un número de aplicaciones de RDF también elevado 37, y el grupo de Marchlinski utilizó un número de aplicaciones muy superior al utilizado por nosotros, sin consecuencias negativas aparentes. Tampoco hemos observado complicaciones tromboembólicas, que se podrían quizá esperar de una ablación endocárdica más amplia.
Además, permanecen abiertas otras cuestiones metodológicas que también afectan a la ARF de TV por el método «clásico». La inducibilidad de la TV, que es la guía final en ambos métodos, no es tan reproducible como sería deseable 38,39 y esto hace a veces difícil determinar el éxito o fracaso de la intervención. La inducción de otras TV no clínicas, muy rápidas, como en alguno de nuestros casos, tiende a considerarse un artefacto, pero su significación puede ser difícil de valorar. Aunque el objetivo de la ARF sea eliminar la arritmia, frecuentemente será necesario asociar fármacos o un desfibrilador, cuando la situación clínica y la función ventricular indiquen un alto riesgo de muerte arrítmica. CONCLUSIÓN
La ARF en forma de líneas amplias que crucen la zona cicatrizal postinfarto puede ser eficaz en casos seleccionados de TV mal tolerada o no sostenida, no accesible a la ARF apoyada en la localización del punto de emergencia del circuito. Esta técnica podría abrir el campo de la ARF a un gran número de enfermos de TV y merece ser explorada con estudios amplios y prospectivos. Estos estudios deberán determinar el alcance terapéutico y las indicaciones de la técnica y, por otro lado, deberán depurar las condiciones de su aplicación, definiendo mejor el número, longitud y localización ideales de las líneas de ablación en relación al tipo de TV y el contexto clínico del enfermo.
Bibliografía
[1]
Clinical cardiac electrophysiology: techniques and interpretations (2.
[2]
Slow conduction in the infarct scar: relevance to the occurrence, detection, and ablation of ventricular reentry circuits resulting from myocardial infarction. Am Heart J 1989; 117: 452-467.
[3]
Reentry as a cause of ventricular tachycardia in patients with chronic ischemic heart disease: electrophysiologic and anatomic correlation. Circulation 1988; 77: 589-606.
[4]
Recurrent sustained ventricular tachycardia: structure and ultraestructure of subendocardial regions in wich tachycardia originates. Circulation 1983; 68: 518-533.
[5]
Ventricular tachycardia in ischaemic heart disease: insights into mechanisms from mapping and implicatioms for patient management. Eur Heart J 1995; 16: 1027-1035.
[6]
Ventricular tachycardia in the infarcted Langendorff-perfused human heart: role of the arrangement of surviving cardiac fibers. J Am Coll Cardiol 1990; 15: 1594-1607.
[7]
Recurrent sustained ventricular tachycardia: structure and ultraestructure of subendocardial regions in wich tachycardia originates. Circulation 1983; 68: 518-533.
[8]
Endocardial excision guided by ventricular mapping in the surgical treatment of ventricular tachycardia. Am J Cardiol 1979; 43: 401-405.
[9]
Endocardial excision: a new surgical technique for the treatment of recurrent ventricular tachycardia. Circulation 1979; 60: 1430-1439.
[10]
Comparison of standard aneurysmectomy with directed endocardial resection for treatment of recurrent sustained ventricular tachycardia. J Thorac Cardiovasc Surg 1980; 80: 527-534.
[11]
Ventricular resection guided by epicardial and endocardial mapping for treatment of recurrent ventricular tachycardia. Am J Cardiol 1980; 302: 589-593.
[12]
Multiple linear ablation lesions to control unstable ventricular tachycardia: facilitation by nonfluoroscopic electro-anatomic mapping [resumen]. PACE 1998, 21: 843.
[13]
Linear ablation lesions for control of unmappable ventricular tachycardia in patients with ischemic and nonischemic cardiomyopathy. Circulation 2000; 101: 1288-1296.
[14]
Sustained ventricular tachyarrithmias within 2 months of acute myocardial infarction: results of medical and surgical therapy in patients resuscited from the initial episode. J Am Coll Cardiol 1985; 6: 758-768.
[15]
Tratamiento quirúrgico de las taquicardias ventriculares sostenidas. Resultados a corto y medio plazo en la «era» del desfibrilador implantable y del trasplante cardíaco. Rev Esp Cardiol 1994; 47: 227-238.
[16]
Perioperative and long-term results with mapping-guided subendocardial resection and left ventricular endoaneurysmorrhaphy. Circulation 1996; 94: 1041-1048.
[17]
Comparison of the usefluness of the implantable cardioverter-defibrillator and subendocardial resection in patients with sustained ventricular arrythmias and poor regional wall motion associated with coronary artery disease. Am J Cardiol 1993; 72: 652-657.
[18]
Anxiety and depression in patients with life-threatening ventricular arrythmias: impact of the implantable cardioverter-defibrillator. Pacing Clin Electrophysiol 1991; 14: 181-186.
[19]
Psychological reactions and family adjustement in shock versus no shock groups after implantation of internal cardioverter defibrillator. Heart Lung 1995; 24: 281-291.
[20]
The impact of the automatic implantable cardioverter/defibrillator on quality of life. Clin Prog Electrophysiol Pacing 1986; 4: 306-309.
[21]
Guías de práctica clínica de la Sociedad Española de cardiología sobre el desfibrilador automático implantable. Rev Esp Cardiol 1999; 52: 1083-1104.
[22]
Macroreentry in the infarcted human heart: the mechanism of ventricular tachycardias with a «focal» activation pattern. J Am Coll Cardiol 1991; 18: 1005-1014.
[23]
Endocardial abnormalities in left ventricular aneurysms. A clinico pathologic study. Ann Intern Med 1984; 100: 29-35.
[24]
Endocardial mapping of ventricular tachycardia in the intact human ventricle: evidence for reentrant mechanisms. J Am Coll Cardiol 1998; 11: 783-791.
[25]
Endocardial mapping of vengricular tachycardia in the intact human ventricle: evidence for multiuse reentry in a functional sheet of surviving myocardium. J Am Coll Cardiol 1992; 20: 869-878.
[26]
Endocardial mapping of ventricular tachycardia in the intact human ventricle. III. Evidence of multiuse reentry with spontaneous and induced block in portions of reentrant path complex. J Am Coll Cardiol 1995; 25: 1591-1600.
[27]
Electrogram patterns predicting succesful catheter ablation of VI. Circulation 1988; 77: 806-814.
[28]
Ventricular activation during ventricular endocardial pacing. II. Role of pace-mapping to localize origin of ventricular tachycardia. Am J Cardiol 1982; 50: 11-22.
[29]
Intraoperative electrophysiologic mapping of the ventricles during sinus rhythm in patients with a previous myocardial infarction. Identification of the electrophysiologic substrate of ventricular arrythmias. Circulation 1982; 66: 847-853.
[30]
Determinants of ventricular tachycardia in patients with ventricular aneurysms: results of introperative epicardial and endocardial mapping. Circulation 1982; 65: 856-861.
[31]
Electrophysiologic and anatomic basis for fractionated electrograms recorded from healed myocardial infarcts. Circulation 1985; 72: 596-611.
[32]
Intraoperative endocardial mapping during sinus rhythm: relationship to site of origin of ventricular tachycardia. Circulation 1984; 70: 957-965.
[33]
Electroanatomic Left Ventricular mapping in the porcine model of healed anterior myocardial infarction. Circulation 1999; 100: 1744-1750.
[34]
Endocardial catheter mapping of atrial arrhythmias. En: Shenasa M, Borggrefe M, Breithardt G, editores. Cardiac Mapping. Nueva York: Futura, 1993; 443-459.
[35]
Atrial flutter mapping and ablation. I. Studying atrial flutter mechanisms by mapping and entrainment. PACE 1996; 19: 841-853.
[36]
Histopathologic effects of radiofrequency catheter ablation in previously infarcted human myocardium. J Cardiovasc Electrophysiol 1999; 10: 336-342.
[37]
Ablación de taquicardia ventricular mediante radiofrecuencia en pacientes con cardiopatía isquémica. Rev Esp Cardiol 1999; 52: 159-168.
[38]
Reproducibility of electrophysiologic testing during antiarrhythmic therapy for ventricular arrhythmias secondary to coronary disease. Am J Cardiol 1992; 69: 1296-1299.
[39]
Reproducibility of programmed electrical stimulation responses in patients with ventricular tachycardia or fibrillation associated with coronary artery disease. Am J Cardiol 1992; 70: 758-764.