Rhythmia es un navegador capaz de crear mapas electroanatómicos de alta densidad. El objetivo del estudio es describir los resultados agudos de la ablación de la fibrilación auricular (FA) guiada por este sistema, evaluando además el volumen proporcionado por su mapa electroanatómico y su capacidad de localizar interrupciones de la conducción en las reablaciones.
MétodosEstudio observacional de 62 pacientes sometidos a ablación de FA con el sistema Rhythmia comparados con una cohorte retrospectiva de pacientes en los que se utilizó Ensite Velocity.
ResultadosEl número de electrogramas por mapa fue superior en el grupo de Rhythmia (12.125 ± 2.826 frente a 133 ± 21; p < 0,001) sin prolongar el tiempo de procedimiento. El catéter Orion se posicionó en el 99,5% de las venas pulmonares (VP), significativamente más que lo logrado con un catéter circular convencional (95,61%; p = 0,04). No hubo diferencias significativas en el porcentaje de aislamiento de VP entre ambos grupos. En reablaciones, se pudo reconocer una interrupción mediante el análisis del mapa de activación en el 67% de las VP reconectadas, más que lo observado en el grupo de control con catéter circular (40%; p = 0,042). El volumen auricular fue inferior al calculado por tomografía computarizada (109,3 ± 15,2 y 129,9 ± 13,2 ml respectivamente; p < 0,001). No hubo diferencias significativas en el número de complicaciones.
ConclusionesEl sistema Rhythmia es eficaz en la ablación de FA, con tiempos de procedimiento y perfil de seguridad similares a los conseguidos con Velocity. En procedimientos de reablación parece ser más eficaz para la identificación de las interrupciones de reconducción frente a los catéteres circulares convencionales.
Palabras clave
La ablación con catéter es un método cada vez más utilizado en la práctica clínica para la estrategia de control del ritmo en pacientes con fibrilación auricular (FA) refractaria a tratamiento farmacológico1. Los sistemas de navegación tridimensional no fluoroscópicos se utilizan habitualmente para añadir precisión a la manipulación de los catéteres, permitir la caracterización del sustrato arrítmico y facilitar el mapeo de las arritmias.
El sistema Rhythmia (Boston Scientific; Marlborough, Massachusetts, Estados Unidos) es un nuevo navegador capaz de crear rápidamente mapas de alta densidad mediante la combinación de un catéter diagnóstico multipolar (IntellaMap Orion, Boston Scientific; Marlborough, Massachusetts, Estados Unidos) con un software capaz de adquirir automáticamente la localización y la información de los electrogramas locales registrados. El catéter Orion presenta en su extremo distal una cesta desplegable (diámetro entre 3 mm cuando está cerrada y 22 mm cuando está totalmente abierta) compuesta por 8 pequeñas varillas flexibles (habitualmente denominadas splines) que contienen 8 electrodos cada una. El rastreo de los catéteres del sistema Rhythmia es doble: magnético, por lo que es capaz de detectar un sensor magnético presente dentro del catéter Orion y del catéter de ablación Intella Nav OI (Boston Scientific; Marlborough, Massachusetts, Estados Unidos) y basado en impedancias, para la detección de cualquier otro tipo de catéter una vez realizado un mapa inicial de impedancias con el catéter Orion. El sistema calcula automáticamente el volumen del mapa realizado.
Hay poca documentación en la literatura médica acerca de la precisión de este nuevo sistema para crear mapas electroanatómicos y mapas de activación, aunque los datos iniciales en modelos animales y en series cortas de humanos indican su utilidad para guiar el procedimiento de ablación de FA y comprobar el aislamiento eléctrico de las venas pulmonares (VP) tras la ablación con radiofrecuencia2–4.
Los objetivos de este estudio son describir el procedimiento y los resultados agudos de una experiencia inicial en ablación de FA guiada por sistema Rhyhtmia, comparándolos con los de una cohorte control retrospectiva de pacientes en los que se empleó un sistema de ablación convencional, así como correlacionar el volumen auricular izquierdo proporcionado por el mapa electroanatómico con el calculado mediante la tomografía computarizada (TC) cardiaca con contraste.
MÉTODOSPoblación de estudioSe trata de un estudio observacional que incluyó a los primeros 62 pacientes consecutivos con FA sintomática paroxística (n = 37) o persistente (n = 25) a los que se realizó ablación de FA con el sistema Rhythmia en nuestra institución entre julio de 2015 y julio de 2016. Los resultados se compararon con los de un grupo control formado por una cohorte retrospectiva de pacientes consecutivos a los que se había realizado ablación de FA como único procedimiento guiado por un sistema de navegación convencional (Ensite Velocity, St. Jude Medical; St. Paul, Minnesota, Estados Unidos) y realizados por el mismo operador principal entre febrero de 2015 y julio de 2016. La media de edad era 63 años, el 46% eran mujeres y 17 de los pacientes tenían como antecedente un procedimiento de ablación de FA previo con Rhythmia (2) u otro sistema de navegación (15). Todos los pacientes tomaron anticoagulantes durante al menos 21 días antes del procedimiento. Los antagonistas de la vitamina K se mantuvieron sin interrupción, mientras que los nuevos anticoagulantes se suspendieron de 12 a 24 h antes de la ablación y se reanudaron el mismo día del procedimiento sin tratamiento puente.
El comité ético de nuestro centro aprobó el estudio, que se llevó a cabo de acuerdo con los principios éticos de la Declaración de Helsinki. Todos los pacientes dieron su consentimiento informado antes del procedimiento.
Descripción del procedimiento de ablación guiado con el sistema RhythmiaValoración previa al procedimientoEl día previo a la ablación, se realizó una TC a todos los pacientes para caracterizar la anatomía de la aurícula izquierda, mediante su segmentación y reconstrucción tridimensional con el software ITK-SNAP2205. Antes del procedimiento se calculó el volumen auricular (se excluyeron las VP y la orejuela izquierda) a partir de la TC. Todos los procedimientos se realizaron con sedación consciente. Se realizó cardioversión eléctrica antes de comenzar el procedimiento si el paciente se encontraba en FA.
Estrategia para la realización del mapaSe posicionó un catéter diagnóstico decapolar convencional en el seno coronario para estimulación, como referencia eléctrica y anatómica para el rastreo por impedancia. El acceso a la aurícula izquierda se realizó mediante doble punción transeptal para el catéter Orion y el catéter de ablación, ambos a través de vainas deflectables (Agilis, St. Jude Medical; Minnesota, Estados Unidos). Se administró heparina no fraccionada tras la punción transeptal para mantener durante el procedimiento un tiempo de coagulación activado entre 300 y 350 s según un protocolo preestablecido6 e infusión de suero heparinizado (1 U/ml) a través de la luz central del catéter Orion a razón de 1 ml/min para prevenir la formación de trombos, siguiendo las recomendaciones del fabricante.
El mapa de la aurícula izquierda se realizó con el catéter Orion durante estimulación auricular desde el seno coronario proximal a una longitud de ciclo de 550 ms. El sistema seleccionó automáticamente los latidos apropiados y los electrogramas de acuerdo con criterios predefinidos. Los criterios iniciales fueron los siguientes: estabilidad en la longitud de ciclo con una tolerancia de ±10 ms; referencia de propagación con una tolerancia de ±5 ms; ciclo respiratorio aceptando solo latidos durante la fase espiratoria; Motion = 1 mm; Stability = 0,25; Tracking = 3.
Para los mapas de voltaje, se consideraron como áreas de bajo voltaje las que presentaban electrogramas < 0,3 mV y como áreas de voltaje normal, las que presentaban electrogramas > 0,5 mV.
Si bien la TC se utilizó en todos los casos como referencia, el operador era ciego a los valores del volumen auricular medidos. El sistema Rhythmia calculó automáticamente el volumen auricular, excluyendo VP y orejuela izquierda, a partir del mapa realizado.
En todos los casos se prestó especial atención a realizar un mapa de muy alta densidad de puntos a nivel de los antros venosos y la cresta izquierda, mediante el movimiento lento y la rotación del catéter Orion. La exploración de la región septal se realizó mediante una suave retirada del catéter Orion máximamente abierto hasta encontrar la resistencia ofrecida por el septo interauricular.
Estrategia de ablaciónSe utilizó un catéter Blazer OI (Boston Scientific; Marlborough, Massachusetts, Estados Unidos) o un catéter Intella Nav OI. En pacientes sin antecedentes de ablación de FA, se realizó aislamiento circunferencial de las VP construyendo, mediante técnica estándar de ablación punto a punto, una circunferencia amplia que englobaba las venas homolaterales y realizando líneas adicionales entre venas. En pacientes con antecedente de aislamiento previo de VP, tras realizar el mapa de activación de entrada y salida de las venas y de voltaje, se analizaron las interrupciones de la conducción en las venas reconectadas, definidas como el área de la VP de activación más precoz con voltaje > 0,3 mV, y se realizó ablación focal a este nivel.
Durante el aislamiento de las VP el catéter Orion se posicionó en la porción proximal de la vena correspondiente y se expandió hasta su posición nominal. En caso de interferencia mecánica o eléctrica con el catéter de ablación, se avanzó el catéter Orion hacia una posición más distal.
En todos los casos el aislamiento se confirmó mediante la introducción del catéter Orion dentro de las VP y su posterior expansión hasta alcanzar su mayor diámetro o hasta observar deformación de la cesta del catéter por contacto con las paredes venosas. En caso de confirmar bloqueo de entrada, se realizaba estimulación desde los electrodos ecuatoriales del catéter Orion para confirmar bloqueo de salida. Se realizaron maniobras de estimulación auricular izquierda, desde orejuela izquierda y desde aurícula derecha, para desenmascarar potenciales de «campo lejano» en caso necesario. En todos los casos y para cada una de las venas aisladas, se administraron bolos de adenosina con el catéter Orion dentro de la vena y se realizó ablación focal en caso de observarse reconexión. El aislamiento se confirmó en todos los casos después de al menos 20 min tras la última aplicación.
Tras su retirada, la punta del catéter Orion se revisó sistemáticamente en todos los casos en búsqueda de trombos y se realizó un ecocardiograma transtorácico tras el procedimiento a todos los pacientes.
Descripción del procedimiento de ablación guiado por Ensite VelocityEn el grupo de control, la ablación se realizó mediante nuestro protocolo habitual, siguiendo una metodología previamente publicada7,8. En resumen, se realizó doble punción transeptal, mapa electroanatómico guiado por sistema Ensite Velocity (St. Jude Medical; St. Paul, Minnesota, Estados Unidos), con un catéter de ablación irrigado TactiCath (St. Jude Medical; St. Paul, Minnesota, Estados Unidos) y un catéter diagnóstico circular de radio variable Reflexion Spiral. Asimismo, se realizó fusión con la reconstrucción tridimensional de la aurícula izquierda segmentada a partir de una TC con contraste mediante software Ensite Verismo. Los protocolos de sedación y de tratamiento anticoagulante (intraprocedimiento y periprocedimiento) y la técnica de ablación fueron los mismos en ambos grupos.
Análisis estadísticoLas variables cuantitativas se presentan como media ± desviación estándar. Las variables categóricas se presentan como número y porcentaje. Las diferencias entre los 2 grupos de pacientes se analizaron mediante prueba de la t de Student para muestras independientes. Se empleó el test de la χ2 o el test exacto de Fisher para comparar las variables cualitativas. La significación estadística se definió como un valor de p < 0,05 en pruebas bilaterales. El análisis estadístico se realizó utilizando la versión 22 de SPSS para Windows (SPSS Statistics, IBM Software Group).
RESULTADOSUn total de 124 pacientes recibieron aislamiento de VP guiado por sistema Rhythmia (n = 62; 50%) o Ensite Velocity (n = 62; 50%), que actuó como grupo de control. No se observaron diferencias estadísticamente significativas en las características basales de ambos grupos (tabla).
Características basales de los pacientes
| Características basales | Rhythmia (n = 62) | Velocity (n = 62) | p |
|---|---|---|---|
| Edad (años) | 63,84 | 64,61 | 0,694 |
| Sexo (V/M) | 34/28 | 14/21 | 0,199 |
| Tipo de fibrilación auricular (paroxística/persistente) | 37/25 | 39/23 | 0,712 |
| Reprocedimiento, n (%) | 17 (27,41) | 18 (29,03) | 0,842 |
| Puntuación CHA2DS2-VASc (mediana) | 2 | 2 | 0,783 |
| Fracción de eyección del ventrículo izquierdo (%) | 64,73 | 62,81 | 0,104 |
| Diámetro auricular izquierdo (mm) | 40,28 | 41,51 | 0,322 |
| Anatomía estándar de venas pulmonares, n (%) | 47 (75,80) | 49 (79,03) | 0,668 |
CHA2DS2-VASc: insuficiencia cardiaca congestiva, hipertensión, edad ≥ 75 años (doble), diabetes mellitus, ictus (doble), enfermedad vascular, edad 65-74 años y sexo (mujer); M: mujeres; V: varones.
En el grupo de Rhythmia, 45 eran procedimientos índice y 17, reablaciones. La TC previa al procedimiento demostró 47 casos (75,8%) con 4 VP independientes y 15 casos (24,1%) con variantes anatómicas (6 casos de colector común izquierdo, 1 caso de colector común derecho, 1 caso de colector común inferior y 7 casos en los que se observó una vena intermedia derecha), sin observarse diferencias significativas con el grupo de control, en el que se observaron 49 casos (79%) con 4 VP independientes y 13 (20,9%) con variantes anatómicas (p = 0,668).
El catéter Orion se posicionó adecuadamente en el interior de 246 de 247 (99,59%) de las VP presentes. Solo una VP inferior derecha de pequeño tamaño (5 mm de diámetro según medidas realizadas en el TC) no se pudo mapear con el catéter Orion, aunque sí con el catéter de ablación. En el grupo control el catéter circular, se pudo posicionar adecuadamente en el interior de 240 de las 251 (95,61%) VP presentes, lo cual fue significativamente menor (p = 0,04).
La media de puntos válidos por mapa fue de 12.125 ± 2.826 en el grupo de Rhythmia y 133 ± 21 en el grupo de control (p < 0,001). El tiempo medio para la realización del mapa de aurícula izquierda con el catéter Orion fue de 18 ± 5 min. El aislamiento eléctrico se consiguió en 245 de las 246 (99,5%) VP mapeadas en el grupo de Rhythmia y en las 240 VP mapeadas en el grupo de control, sin observarse diferencias estadísticamente significativas (p = 0,8).
De los pacientes con antecedente de ablación previa de FA en el grupo Rhythmia, de las 68 VP exploradas, 28 (41%) presentaron reconexión. En 19 de las 28 VP reconectadas (67%) se observó una clara interrupción de la conducción en el mapa de activación, con aislamiento de la vena o evidente retraso de los electrogramas y cambio en el patrón de entrada tras una única aplicación focal. En el resto de las venas reconectadas (9 de 28), el análisis del mapa de activación no pudo predecir un punto de ablación exitosa, bien por no observarse ninguna interrupción clara (6 de 28), bien debido a que la ablación focal en la presunta interrupción no consiguió el aislamiento de la vena (3 de 28). En el grupo control, solo en 10 de las 25 VP reconectadas (40%) el patrón inicial de activación eléctrica del catéter circular definió claramente interrupción de la conducción según los criterios anteriormente expuestos (p = 0,042).
No se observaron diferencias significativas entre ambos grupos en el tiempo medio de procedimiento (149 ± 21 min en el grupo de Rhythmia y 145 ± 30 min en el grupo de control; p = 0,412). El tiempo total de fluoroscopia fue significativamente mayor en el grupo de Rhythmia que en el de control (28 ± 9 y 24 ± 7 min respectivamente; p = 0,038). Sin embargo, al analizar los últimos 31 pacientes de cada grupo, no se observaron diferencias significativas (25 ± 9 min en el grupo de Rhythmia y 24 ± 9 min en el de control; p = 0,722), lo que indica un probable efecto de curva de aprendizaje.
El volumen auricular medio medido por el sistema Rhythmia fue significativamente menor que el medido a partir de la TC, 109,3 ± 15,2 y 129,9 ± 13,2 ml respectivamente (p < 0,001).
En el ecocardiograma, tras el procedimiento de 1 paciente del grupo de Rhythmia, se observó un derrame pericárdico sin taponamiento cardiaco que se trató mediante pericardiocentesis por progresión en su cuantía. Otro paciente presentó hematoma inguinal significativo, que se resolvió tras compresión local prolongada. En el grupo de control se observó 1 caso de taponamiento cardiaco, resuelto tras pericardiocentesis, y 1 caso de pericarditis sin derrame. No hubo complicaciones tromboembólicas ni diferencias en la incidencia total de complicaciones entre ambos grupos.
DISCUSIÓNVarios desarrollos técnicos, como los sistemas de mapeo tridimensional y su integración con otras técnicas de imagen cardiaca, se han utilizado para simplificar el procedimiento de ablación de FA. Los sistemas de mapeo de alta densidad son capaces de generar mapas electroanatómicos con un elevado número de puntos en corto tiempo mediante la anotación automática de los electrogramas registrados. Hasta la fecha, esta es la mayor serie clínica publicada sobre procedimientos guiados por el sistema Rhythmia y la primera que se realiza una comparación con un sistema de navegación no fluoroscópica convencional en procedimientos de ablación de FA. Es también el primer estudio que cuantifica la precisión del cálculo del volumen de una cámara cardiaca en un contexto clínico para validar su precisión anatómica.
Fortalezas del sistemaComo se observa en nuestra serie, se puede realizar un mapa de muy alta densidad de puntos de la aurícula izquierda y las VP sin afectar al flujo de trabajo del procedimiento de ablación de FA, lo que logra tiempos de procedimiento razonables pese a ser una serie inicial que incluye el aprendizaje del sistema. En todos los casos, la anatomía obtenida en el mapa fue comparable a la obtenida en la TC. Una ventaja del sistema, utilizado junto con el catéter multipolar Orion, es la rápida generación de un mapa completo de activación y voltaje sin necesidad de corrección manual. En modo automático, se obtuvieron mapas con una media de 12.125 electrogramas y se realizaron en una media de 18 min. En general, la corrección manual casi no es necesaria debido a que el sistema compara cada punto con los que lo rodean y corrige las potenciales discordancias de puntos aislados mal registrados. De esta manera, una pequeña cantidad de puntos erróneamente anotados son irrelevantes para la interpretación general de un mapa. En nuestra serie, la alta resolución de los mapas de activación fue particularmente útil en casos de reablación, en los que se pudo identificar con mayor exactitud las interrupciones de la conducción que con un sistema de navegación convencional (el 67 y el 40% de las VP reconectadas con Rhythmia y Velocity respectivamente; p = 0,042) (figura 1). De manera análoga, en los procedimientos índice y tras completar una aparentemente completa ablación circunferencial alrededor de una vena, se puede realizar un nuevo mapa de activación de una única vena en menos de 2 min, lo que proporciona una guía para una ablación focal. En nuestra serie hemos realizado en varias ocasiones, en VP reconectadas tras ablación previa, «mapas de salida» de la VP mediante estimulación dentro de la vena con el catéter de ablación y despliegue del catéter Orion en el ostium venoso, con posterior retirada hacia la aurícula (figura 2 y ). Esta maniobra, que no necesita más que unos minutos de mapeo, es muy útil para delimitar las interrupciones de la conducción, aunque puede estar limitada por la incapacidad para conseguir una captura estable dentro de la VP en algunos casos.
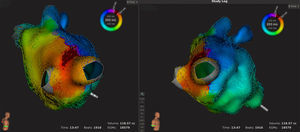
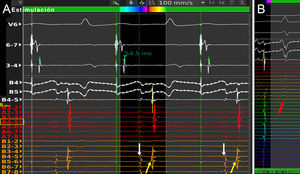
Ejemplo de caso de reablación de fibrilación auricular, en el cual se indujo mecánicamente aleteo auricular atípico. Un mapa de activación de 18.579 puntos se realizó en 13 min. Se puede observar una línea de bloqueo en el techo de la aurícula izquierda realizada en el procedimiento previo con una interrupción de la conducción en su unión con la vena pulmonar superior derecha. La arritmia terminó tras ablación focal a ese nivel. Beats: latidos aceptados para la realización del mapa; EGMs: número de electrogramas aceptados para el mapa; Time: tiempo de realización del mapa; Volume: volumen del mapa realizado. Esta figura se muestra a todo color solo en la versión electrónica del artículo.
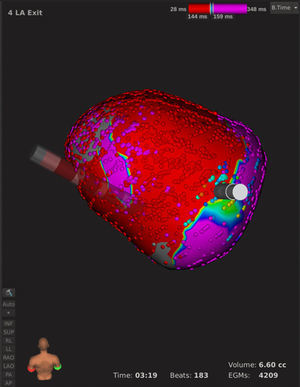
Mapa de salida de la vena pulmonar superior izquierda desde una vista posterior en un caso de reablación de fibrilación auricular. Durante estimulación dentro de la vena pulmonar con el catéter de ablación, se realizó una lenta retirada y rotación del catéter Orion desplegado al máximo. Se puede observar una clara interrupción de la conducción en el antro venoso. El aislamiento eléctrico se consiguió tras ablación focal en este punto. Beats: latidos aceptados para la realización del mapa; EGMs: número de electrogramas aceptados para el mapa; Time: tiempo de realización del mapa; Volume: volumen del mapa realizado. Esta figura se muestra a todo color solo en la versión electrónica del artículo.
En opinión de los autores, la combinación del catéter Orion con una vaina deflectable constituye una herramienta versátil para el mapeo de la aurícula izquierda y las VP, que permite una adecuada navegación incluso en casos de variables anatómicas y proporciona algunas ventajas respecto a los catéteres de mapeo circular convencionales (figura 3). En concreto, el número de VP cateterizadas selectivamente fue significativamente superior al logrado con un catéter circular convencional, y el catéter se adaptó a una amplia gama de anatomías venosas con tiempos de mapeo adecuados. Otra ventaja del catéter es la facilidad para explorar la región septal cercana a la porción inferior de la vena pulmonar inferior derecha, habitualmente una zona que ofrece dificultad tanto para el mapeo como para la ablación por el riesgo de caer a la aurícula derecha. Mediante la maniobra de retirar suavemente el catéter totalmente desplegado hasta sentir la resistencia del septo interauricular sistemáticamente, queda en el mapa una zona de aproximadamente 3 mm de diámetro sin potenciales registrados que corresponde al sitio de la punción transeptal (figura 4). La forma del catéter Orion también ayuda en la determinación de los ostium venosos mediante la simple maniobra de desplegar el catéter dentro de la vena retirándolo lentamente hasta observar un típico «salto» al pasar a la aurícula izquierda. Finalmente, la distribución espacial de los electrodos en los splines del catéter Orion, con pares de electrodos en sentido tanto longitudinal como radial, permite, sin manipular el catéter, distinguir los potenciales de la VP superior izquierda de los observados por señales de campo lejano de orejuela izquierda mediante el análisis de la propagación del impulso, que es de proximal a distal en los potenciales de VP y simultáneos en caso de señales de campo lejano (figura 5).
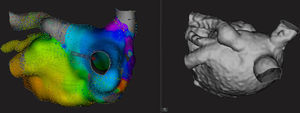
Variable anatómica de las venas pulmonares observada en el mapa electroanatómico (panel izquierdo) y en la reconstrucción tridimensional de la tomografía computarizada (panel derecho) de la aurícula izquierda desde una vista posterior. Se observa una vena pulmonar superior izquierda que desemboca en el techo auricular y presenta una dilatación y curva proximal que podrían dificultar un adecuado mapeo con un catéter multipolar. Con el catéter Orion, se pudo explorar las 4 venas observadas. Tiempo de mapa: 24 min. Esta figura se muestra a todo color solo en la versión electrónica del artículo.
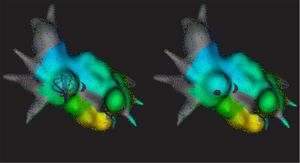
Mapa electroanatómico de la aurícula izquierda desde una vista anteroinferior derecha. Mediante suave retirada del catéter Orion desplegado al máximo hasta encontrar resistencia, se puede estudiar parte del septo interauricular y marcar el sitio de la punción transeptal. Esta figura se muestra a todo color solo en la versión electrónica del artículo.
A: ejemplo de electrogramas registrados por el catéter Orion dentro de la vena pulmonar superior izquierda; observando los registrados en un único spline, sin necesidad de manipular los catéteres ni realizar maniobras de estimulación, se puede distinguir los patrones de potenciales de vena, que presentan una propagación de proximal a distal (flechas amarillas), de los de «campo lejano» de orejuela izquierda, que son simultáneos (flechas blancas). B: en caso de campo lejano ventricular (flecha roja), también se lo distingue de los potenciales de vena porque sus electrogramas son simultáneos. Esta figura se muestra a todo color solo en la versión electrónica del artículo.
Quedan todavía muchas preguntas sin resolver. Con respecto al mapa de voltaje, no se conoce cuáles son los voltajes de corte para determinar el tejido sano o el tejido cicatricial. Si bien con los valores utilizados en esta serie en los casos de reablación se pudo observar adecuadamente las líneas realizadas en procedimientos previos, no se puede asegurar que sean los óptimos para la caracterización del tejido auricular.
El volumen medido por Rhythmia fue inferior al medido por la TC, lo que indica que no se exploró toda la aurícula izquierda. Teniendo en cuenta que los mapas se realizaron en el contexto clínico del procedimiento de ablación de FA, es posible que un mapeo más detallado de la aurícula izquierda, como el realizado en casos de aleteo auricular izquierdo, alcance áreas no exploradas sistemáticamente en esta serie y se acerque más al volumen auricular real. Aun así, el volumen auricular medio medido fue el 84,14% del medido en la TC, lo que indica una adecuada adaptación del catéter Orion a las diferentes partes de la aurícula izquierda.
Si bien se ha percibido una mejora significativa tras la introducción de un catéter de ablación con sensor magnético, la localización visual del catéter de ablación por el operador es todavía mejorable. Sería también útil disponer de un catéter magnético con sensor de fuerza de contacto. Por último, dado el sobrecoste que actualmente supone el sistema, sería conveniente disponer de estudios de coste-eficacia para poder seleccionar los subgrupos de pacientes en los que este sistema fuera más coste-eficaz.
Limitaciones del estudioLas obvias limitaciones de este estudio son la falta de aleatorización del grupo de control y la falta de seguimiento a largo plazo. De todas formas, este trabajo se propone describir la experiencia y los resultados procedimentales agudos en la ablación de FA guiada por el sistema Rhythmia, más que evaluar resultados clínicos. En el futuro, serán necesarios estudios aleatorizados con una muestra más amplia para evaluar su eficacia clínica a largo plazo.
CONCLUSIONESLos resultados de este estudio observacional indican que la ablación de FA guiada por el sistema Rhythmia es segura y, con tiempos de procedimiento similares a los observados con otros navegadores no fluoroscópicos convencionales, ofrece potenciales ventajas, especialmente en casos de reablación. El catéter Orion, en combinación con una vaina deflectable, es fácil de manipular en la aurícula izquierda, lo que permite la exploración de más VP que los catéteres circulares de mapeo convencional, incluso en casos de variables anatómicas complejas. El volumen auricular izquierdo medido por el sistema es ligeramente menor que el calculado a partir de la TC. La traducción clínica de estas ventajas potenciales se debería explorar en estudios diseñados a tal fin.
CONFLICTO DE INTERESESNinguno.
- –
Rhythmia es el primer sistema de navegación no fluoroscópica de una nueva generación que permite crear mapas de alta densidad mediante la combinación de un catéter diagnóstico multipolar con un software capaz de adquirir automáticamente la información de los electrogramas registrados.
- –
Aunque los datos de series cortas indican su utilidad para guiar el procedimiento de ablación de FA, hasta la fecha no hay estudios con grupo de comparación.
- –
Si bien se puede crear mapas de activación de alta densidad, no se ha explorado su capacidad para definir las interrupciones de la reconexión de las VP en procedimientos de reablación de FA.
- –
Constituye la serie clínica más amplia presentada hasta la fecha sobre procedimientos guiados por el sistema Rhythmia sobre cualquier sustrato y es el primer estudio que realiza una comparación con sistemas de navegación convencionales en ablación de FA.
- –
Es el primer estudio que cuantifica la precisión del cálculo del volumen de una cámara cardiaca para validar su precisión anatómica.
- –
Describe la utilidad de los mapas de activación de alta resolución para la localización de interrupciones de la reconexión en casos de reablación.
- –
Describe la técnica para realizar mapas de salida de VP reconectadas en procedimientos de reablación de FA.