La taquicardia ventricular monomórfica sostenida (TVMS) es una importante causa de morbilidad y de muerte súbita cardiaca en pacientes con cardiopatía estructural, fundamentalmente en el contexto de la cardiopatía isquémica1. El tratamiento de la TVMS y la prevención de la muerte súbita en este grupo de pacientes se sustenta en dos pilares fundamentales: el desfibrilador automático implantable (DAI) y la ablación con radiofrecuencia, cuyo desarrollo futuro se basa en un mayor conocimiento del sustrato fisiopatológico de las TVMS.
OPCIONES TERAPÉUTICAS PARA PACIENTES CON TAQUICARDIAS VENTRICULARES TRAS UN INFARTODesfibrilador automático implantableSe ha demostrado que el DAI reduce la mortalidad total y la arrítmica en comparación con los fármacos en prevención tanto secundaria como primaria2,3. Sin embargo, no se trata de una terapia inocua, ya que las descargas son dolorosas, acarrean un importante impacto psicológico que empeora significativamente la calidad de vida de los pacientes, reducen la vida útil de los dispositivos e incrementan la mortalidad4. La estimulación antitaquicárdica reduce en parte el problema, pero no lo evita completamente, ya que los pacientes que la reciben tienen riesgo de nuevos episodios que no respondan a dicha terapia y, por lo tanto, precisan descargas5. Además, los DAI tampoco eliminan el sustrato arrítmico, por lo que no previenen la aparición de taquiarritmias ventriculares6.
Ablación con radiofrecuenciaEstudios no aleatorizados realizados en la pasada década empezaron a indicar que la ablación con radiofrecuencia podría ser eficaz para tratar las TVMS, pues se conseguía reducir las recurrencias en un 38% en comparación con el tratamiento farmacológico, aunque las tasas de complicaciones eran altas7. Pero no ha sido hasta hace pocos años cuando se han realizado los primeros ensayos clínicos aleatorizados. El estudio SMASH-VT8 comparó la ablación (basada en sustrato) y el tratamiento médico estándar en pacientes con taquicardia ventricular (TV) no tolerada, con síncope y TV inducible o pacientes portadores de un DAI por prevención primaria que hubiesen recibido un choque apropiado. En el grupo de pacientes a los que se practicó ablación, se obtuvo una reducción de las intervenciones del DAI del 73% y hubo tendencia no significativa a la reducción de la mortalidad. En el estudio VTACH9, se estudió el efecto «profiláctico» de la ablación en 107 pacientes con cardiopatía isquémica crónica a los que se iba a implantar un DAI tras un episodio de TVMS tolerada hemodinámicamente. A los 2 años de seguimiento, estaban libres de recurrencias el 47% de los pacientes sometidos a ablación frente al 29% del grupo sin ablación, especialmente relevante en pacientes con fracción de eyección del ventrículo izquierdo > 30%. Así pues, estos dos trabajos demuestran la eficacia de la ablación en dos escenarios distintos pero complementarios; por un lado, los pacientes con TV mal toleradas o sincopales y, por otro, los que sufren TV toleradas aunque no tengan mucho deterioro de la función ventricular. No obstante, no hay evidencia clínica de que la ablación disminuya la mortalidad, salvo en el caso de pacientes con tormenta eléctrica10.
Estos datos justifican el uso de la ablación como tratamiento coadyuvante al DAI desde la aparición de la TVMS, sin esperar a que el paciente sufra múltiples descargas para recurrir a ella.
ABLACIÓN DE SUSTRATOEl objetivo de la cartografía convencional es la definición del istmo central de conducción lenta del circuito de las TV para su posterior ablación utilizando la cartografía de estimulación, activación y encarrilamiento. Estas maniobras deben realizarse durante la taquicardia, por lo que sus principales limitaciones son la necesidad de múltiples inducciones en algunos casos, la ausencia de inducibilidad en otros y la mala tolerancia hemodinámica de hasta el 50% de las TV inducidas11. Todo ello hace que, además, sean procedimientos muy largos en los que hay que cardiovertir reiteradamente a los pacientes, con las potenciales complicaciones asociadas ya mencionadas4.
Con intención de solventar estos problemas han surgido las técnicas de ablación de sustrato arrítmico, cuyo objetivo es definir, en ritmo sinusal, las zonas de la cicatriz relacionadas con las taquicardias.
Sustrato fisiopatológico: la cicatrizEn estudios clásicos realizados en la década de los ochenta se demostró que la gran mayoría de las TVMS tras infarto se mantienen por un mecanismo de reentrada que se localiza en la cicatriz que aparece tras un infarto agudo de miocardio12,13. La característica histológica fundamental de esta cicatriz en relación con el mecanismo de reentrada es la presencia de tejido heterogéneo (TH) en su interior, es decir, haces de miocitos viables rodeados de tejido conectivo en los que la velocidad de conducción está reducida14. Estos miocitos unidos forman canales de conducción lenta (CCL) que conectan el interior de la cicatriz con las zonas de tejido sano y constituyen los istmos críticos de los circuitos de las TVMS, mientras que las áreas de escara densa crean zonas de bloqueo anatómico alrededor de dichos CCL13. Estas estructuras favorecen la aparición de bloqueo unidireccional y la reentrada.
La relación de los CCL y el TH con el desarrollo de TVMS queda reflejada en diversos trabajos. La extensión del TH se ha relacionado con la inducibilidad de TV, con su longitud de ciclo15 y con la mortalidad16,17. Asimismo, se ha observado que los canales de TH son más frecuentes en los pacientes con TV clínicas que en quienes no las sufren18. Es decir, el TH y la presencia de CCL en la cicatriz son determinantes fundamentales para que un paciente con infarto crónico sufra TVMS en su evolución.
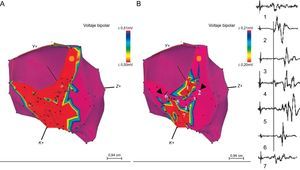
Técnica de ablación de sustratoComo se ha descrito previamente, las zonas de conducción lenta de las TVMS están relacionadas con la presencia dentro de las cicatrices de miocitos viables rodeados de tejido fibrótico y tienen pocas conexiones, lo que produce enlentecimiento de la conducción. Los electrogramas correspondientes a estas zonas tienen bajo voltaje y múltiples componentes, algunos de los cuales están aislados y retrasados; son electrogramas con componentes aislados o potenciales tardíos (ECA/PT). Los miocitos se asocian formando CCL, que se identifican dentro de la cicatriz (voltaje<1,50 mV) y, específicamente, dentro de la escara densa (voltaje<0,50 mV). Estos CCL se identifican con el ajuste de los límites de voltaje, y es importante bajar secuencialmente el límite hasta 0,10 mV (figura 1)19. Sin embargo, la mera existencia de un «canal de voltaje» no basta para definir la existencia de un CCL. Es preciso realizar un minucioso mapa de los ECA/PT y demostrar su presencia con una secuencia lógica en el interior de dichos canales, ya que se ha demostrado su importancia en la identificación de istmos de conducción lenta20,21. El mapa puede realizarse en ritmo sinusal o en estimulación desde el ápex del ventrículo derecho, que facilita la identificación de estos ECA/PT que de otro modo podrían quedar ocultos al ser activados desde varios frentes20.
Efecto del ajuste de voltaje en la definición de los canales de conducción lenta dentro de la cicatriz. A: en esta vista inferior se puede apreciar la cicatriz densa en rojo cuando el límite de voltaje se fija en 0,50 mV. B: cuando el límite de voltaje se baja hasta 0,20 mV, se objetiva la presencia de un canal que discurre por la cicatriz densa desde la zona septal a la lateral. A la derecha podemos ver la secuencia de electrogramas obtenidos dentro del canal en estimulación desde ápex de ventrículo derecho. Esta figura se muestra a todo color solo en la versión electrónica del artículo. Reproducido con permiso de Arenal et al19.
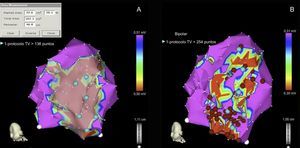
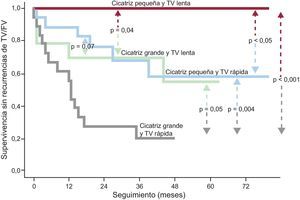
Se ha demostrado que la ablación de los CCL y ECA/PT relacionados con las TV clínicas o inducidas reduce significativamente la tasa de recurrencia de arritmias ventriculares y disminuye el riesgo de recibir descargas del DAI8,19,22. Con base en estos datos, para simplificar el procedimiento y tratar a pacientes sin registro electrocardiográfico de las TV espontáneas, han surgido técnicas cuyo objetivo es la eliminación completa del sustrato endocárdico de las TVMS, que consiste en la homogeneización total de la cicatriz mediante la ablación de todos los CCL y ECA/PT, se haya demostrado relación con la TV clínica (figura 2) o no. Empleando este abordaje en un grupo de 59 pacientes, se consiguió una tasa libre de recurrencias en el 81% de los casos en un seguimiento medio de 40 meses. El ciclo de las TV y el tamaño de la cicatriz fueron los predictores independientes relacionados con la ausencia de recurrencias (figura 3), sin que la ausencia de inducibilidad de la TV clínica influyera en la eficacia23. Esta estrategia de homogeneización de la cicatriz ha sido utilizada por otros grupos e incluso se ha extendido al epicardio22,24.
Procedimiento de ablación completa de sustrato arrítmico. A: identificación de la escara densa, definida por voltaje <0,50 mV. B: ablación completa del sustrato tras identificar los electrogramas con componentes aislados y/o potenciales tardíos y los canales de conducción lenta encontrados con el ajuste de los límites de voltaje. FV: fibrilación ventricular; TV: taquicardia ventricular. Esta figura se muestra a todo color solo en la versión electrónica del artículo. Reproducido con permiso de Arenal et al23.
Curvas de supervivencia libre de recurrencias en función del tamaño de la escara y el ciclo de las taquicardias ventriculares. La escara densa y el ciclo de la taquicardia ventricular clínica se presentan como variables dicotómicas utilizando como punto de corte el valor de la mediana: área de cicatriz grande o pequeña (> 25 o ≤ 25 cm2) según el mapa electroanatómico y el ciclo de la taquicardia ventricular clínica lenta o rápida (≤ 350 o > 350 ms). FV: fibrilación ventricular; TV: taquicardia ventricular. Reproducido con permiso de Arenal et al23.
Dos estudios recientes apuntan que los istmos de algunas TV no están relacionados con los CCL ni con ECA/PT23,25. En el primer estudio, las TV no relacionadas con CCL eran algunas de las taquicardias muy rápidas (longitud de ciclo <300 ms) que estaban en relación con electrogramas con múltiples componentes localizados en los bordes de las cicatrices23. En el segundo, las TV no relacionadas con CCL eran significativamente más lentas que las relacionadas (440 ± 40 frente a 377 ± 67 ms; p=0,016). Este estudio, sin embargo, tiene múltiples limitaciones: además de tratarse de un análisis retrospectivo, no se realizó una cartografía completa durante la taquicardia y no se localizó la salida de los circuitos, por lo que no se puede excluir que estuviera en algún canal cercano al punto de registro de los electrogramas mesodiastólicos. Aun así, al enfrentarse a TVMS muy rápidas o muy lentas, se debe tener en cuenta estas limitaciones y realizar cartografías más meticulosas tanto en ritmo sinusal como en taquicardia.
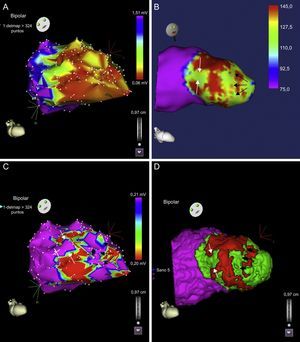
Identificación no invasiva del sustrato: papel de la resonancia magnéticaLa resonancia magnética es una técnica que proporciona una gran definición de la anatomía cardiaca, y gracias al realce tardío con gadolinio, se puede visualizar las zonas de cicatriz y de TH con una buena correlación con la cartografía de voltaje endocárdica tanto en lo que se refiere a la localización y la extensión de la cicatriz como al sustrato arrítmico, pues los puntos críticos de los circuitos se encuentran en las zonas de TH26. De hecho, la extensión de este TH se ha correlacionado con la inducibilidad de TV16 y con la mortalidad17, aunque su papel específico en la estratificación del riesgo arrítmico está aún por definir. En un intento de definir con mayor detalle el sustrato arrítmico dentro de la cicatriz, nuestro grupo ha conseguido elaborar lo que denominamos mapas de intensidad de señal, obtenidos mediante el posprocesado de las imágenes de resonancia magnética con realce tardío, para localizar la presencia de TH dentro de la cicatriz y así definir los CCL (figura 4). Estos mapas presentan buena correlación en la definición de la cicatriz y en la localización de los canales respecto a la cartografía electroanatómica endocavitaria convencional27.
Relación del mapa de voltaje endocárdico y la cartografía de intensidad de señal. A: mapa de voltaje endocárdico que muestra un infarto anterior. B: mapa de intensidad de señal subendocárdico, que concuerda con el de voltaje y muestra un canal paralelo al anillo mitral (flechas negras) y otro canal incompleto perpendicular al anterior (flechas blancas). C: mapa de voltaje con límite en 0,20 mV, en el que se aprecia una mejor definición de los canales que en A. D: integración de ambos mapas. Esta figura se muestra a todo color solo en la versión electrónica del artículo. Reproducido con permiso de Pérez-David et al27.
Los avances en las técnicas de imagen podrían ayudar en el futuro a la caracterización del sustrato no invasiva contribuyendo a una definición óptima de la cicatriz y eliminando los errores producidos en ocasiones por el mal contacto del catéter o la interposición de estructuras como la grasa epicárdica. La integración de la información aportada por la resonancia magnética con la cartografía del navegador podría llevar a la obtención de mapas más precisos, acortar los tiempos de procedimiento y mejorar los resultados a largo plazo de la ablación.
PROCEDIMIENTO IDEAL DE ABLACIÓN DE TAQUICARDIAS VENTRICULARES RELACIONADAS CON CICATRIZEn nuestra opinión, y basados en los datos presentados previamente, se deberían olvidar los términos y las diferencias de ablación convencional y ablación de sustrato y diseñar un procedimiento no invasivo estándar basado en la caracterización tridimensional meticulosa de la cicatriz, en el que se valore también la extensión epicárdica, y la realización de una cartografía tridimensional en la que se identifiquen los marcadores de sustrato. Sobre esta base se aplicarían las técnicas de identificación de zonas de conducción lenta y su relación con las taquicardias clínicas para proceder posteriormente a su eliminación completa. La inducción y la cartografía durante las taquicardias deberían ser el punto final del procedimiento con el objetivo de evitar en todo lo posible los choques durante la intervención, por su efecto deletéreo.
Así pues, los pasos a seguir en todo procedimiento de ablación serían:
- 1.
Reconstrucción y caracterización no invasivas de la cicatriz (resonancia magnética).
- 2.
Cartografía tridimensional de la cicatriz con soporte de las imágenes no invasivas y marcación de los CCL y ECA/PT.
- 3.
Identificación mediante cartografía de estimulación de las taquicardias clínicas.
- 4.
Ablación de todos estos marcadores de sustrato y zonas de conducción lenta documentadas.
- 5.
Valoración de la inducibilidad y, en caso de persistencia, repetir técnicas de cartografía endocárdica.
- 6.
Exploración del epicardio si persiste la inducibilidad o no se encuentran zonas de sustrato endocárdico.
Con base en los datos existentes, la ablación debería emplearse habitualmente en el tratamiento de los pacientes con cardiopatía isquémica que ingresen con TVMS o descargas del DAI para prevenir sus recurrencias, pero teniendo en cuenta que no es una terapia aislada y que debe acompañarse del implante de un DAI. En este ámbito, las estrategias basadas en la ablación completa del sustrato presentan ventajas notables respecto a los métodos de ablación convencional.
El empleo de la resonancia magnética podría ser de gran ayuda tanto en la evaluación del riesgo arrítmico como en la planificación y la realización del estudio electrofisiológico, por lo que habría que considerar su realización antes de implantar DAI. No obstante, todavía faltan estudios que confirmen su verdadero impacto clínico.
FINANCIACIÓNEste trabajo ha sido financiado por RECAVA (Red Temática de Investigación en Enfermedades Cardiovasculares), Instituto de Salud Carlos III, Ministerio de Sanidad y por la Fundación para la Investigación Biomédica del Hospital General Universitario Gregorio Marañón.
CONFLICTO DE INTERESESNinguno.