Palabras clave
INTRODUCCION
La introducción de técnicas como la criopreservación determinó un importante avance en el campo de la preservación tisular1. Los progresos obtenidos impulsaron la creación de bancos de homoinjertos vasculares, los cuales podían ser utilizados en la reconstrucción vascular1. Mediante el empleo de las bajas temperaturas criogénicas para mantener la integridad vascular en suspensión durante tiempos prolongados, el método permite recuperarla en el momento de la utilización del material. Sin embargo, durante la criopreservación se han descrito alteraciones en los componentes celulares y extracelulares, determinantes del comportamiento viscoelástico de la pared vascular2-6, y hay controversias acerca de si los métodos de criopreservación mantienen inalteradas las funciones hemodinámicas arteriales.
Al evaluar la metodología de criopreservación y/o la potencial utilidad clínica de un sustituto vascular deben considerarse aspectos fisiológicos y del diseño experimental. Respecto a los primeros, es imprescindible evaluar la capacidad del sustituto para desarrollar las funciones que deberá cumplir tras su implantación. Cada segmento arterial desempeña 2 funciones principales, esencialmente mecánicas: conduce sangre hacia los tejidos imponiendo baja impedancia al flujo (función conducto), y amortigua la pulsatilidad generada por la eyección ventricular (función de amortiguamiento parietal)2,3. Ambas funciones son determinadas por las características geométricas, y las respuestas elástica y viscosa de la pared vascular2,3. En nuestro conocimiento no hay trabajos que hayan evaluado la función de conducción y amortiguamiento de homoinjertos arteriales y venosos después de que hayan sido criopreservados.
Comprobar la presencia de diferencias biomecánicas, relacionadas con el procedimiento de criopreservación, permitiría validar la técnica de criopreservación y/o establecer acciones para mejorarla. Para ello, el diseño experimental debe considerar la evaluación del comportamiento viscoelástico y funcional de los segmentos, antes (vasos frescos) y después (vasos criopreservados/descongelados) de criopreservarlos. Habitualmente, los trabajos que valoran los efectos de la criopreservación sobre las propiedades biomecánicas vasculares comparan las propiedades mecánicas de anillos o tiras obtenidas de vasos frescos y criopreservados, para lo que realizan estudios estáticos5,6. Sin embargo, sólo los estudios que evalúan los homoinjertos vasculares respetando sus características geométricas y la estructura parietal que posee tras ser implantado permiten realizar análisis funcionales adecuados. Por otra parte, para la evaluación de la respuesta viscosa y las funciones hemodinámicas vasculares es necesario analizar los homoinjertos mediante estudios dinámicos y en situaciones hemodinámicas que simulen las condiciones fisiológicas in vivo.
En diversos estudios se ha propuesto que cuanto menor es la diferencia o el desacople viscoelástico entre prótesis y arteria nativa, menor es la generación de hiperplasia intimal en la zona anastomótica y, en consecuencia, menor es el fallo protésico7,8. Por tanto, se ha propuesto que el sustituto o prótesis «ideal» debe reproducir las funciones biomecánicas del vaso nativo7,8. Sólo la comparación de las propiedades biomecánicas y funcionales de homoinjertos vasculares con las de arterias de receptores (in vivo) y con las de las prótesis más utilizadas (p. ej., venas safenas [VS], politetrafluoroetileno expandido [ePTFE]) permitiría establecer si los homoinjertos reducen las diferencias viscoelásticas y funcionales que se generan con las arterias nativas. Esta comparación conlleva estudios in vivo e in vitro y la necesidad de contar con metodologías compatibles que permitan comparar los resultados obtenidos. En nuestro conocimiento, no hay trabajos en los que se haya realizado esta evaluación.
Los objetivos del presente trabajo fueron: a) evaluar la capacidad de los métodos de criopreservación empleados en nuestro banco de tejidos para mantener las propiedades viscoelásticas y funcionales de arterias musculares y venas humanas, y b) caracterizar la viscoelasticidad y la capacidad funcional de arterias musculares de pacientes (potenciales receptores), y compararlas con las de homoinjertos arteriales y venosos, frescos y criopreservados, y las de prótesis de ePTFE.
MÉTODOS
La presión, el flujo, el diámetro y el espesor parietal se midieron mediante estudios no invasivos (in vivo) y estudios realizados en un simulador circulatorio (in vitro). Todos los procedimientos contaron con el aval de los comités de ética de las instituciones participantes.
Registros no invasivos
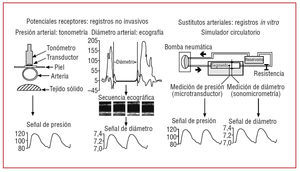
Se estudió a 15 sujetos normotensos (de 51 ± 11 años) en decúbito dorsal después de 10 min de reposo. Para evaluar el espesor arterial se utilizaron imágenes ecográficas en modo B de las arterias femorales (AF). Se examinaron las arterias con un transductor de 7,5 MHz (ATL HDI 5000, Miami Lakes, Estados Unidos) hasta visualizar 2 líneas paralelas en la pared posterior, correspondientes a las interfases lumen-íntima y media-adventicia. Una vez que las líneas paralelas fueron visibles al menos 1 cm, la imagen de fin de diástole fue congelada y transferida mediante una placa de adquisición de vídeo a un ordenador. El análisis, basado en la densidad de los niveles de gris y en algoritmos específicos de reconocimiento tisular, fue realizado de forma automática por un software que permitió obtener el espesor íntima-media9,10. Posteriormente se registró una secuencia de imágenes y, mediante un algoritmo de reconocimiento de bordes análogo al del espesor íntima-media, se calculó la curva de diámetro de un latido promedio (fig. 1)9,10. El flujo se calculó mediante ecografía. Para registrar la señal de presión se situó un tonómetro de tipo lápiz (Millar Instruments Inc.) sobre la superficie de piel adyacente a la AF (fig. 1)9,10. Para calibrar la señal, en el momento de la digitalización se registró con un esfigmomanómetro la presión arterial humeral media y diastólica9,10. Estos valores fueron asignados a los valores medio y mínimo de la señal tonométrica, respectivamente. A partir de la señal tonométrica digitalizada, se interpolaron y promediaron los valores correspondientes a cada latido, de manera que se obtenía la curva de presión de un latido promedio9,10.
Fig. 1. Metodologías utilizadas para la obtención de las señales de presión y diámetro.
Simultáneamente a los registros ecográficos y tonométricos, se registró un electrocardiograma de superficie que permitió la sincronización de las señales de presión y diámetro9,10.
Registros in vitro
De 15 donantes multiorgánicos (de 30 ± 5 años de edad), seleccionados según los criterios legales de regulación (Ley 14.005 de la República Oriental del Uruguay), se obtuvieron segmentos de AF y VS. Los criterios de exclusión de donantes estuvieron de acuerdo con los estándares de la Asociación Española de Bancos de Tejidos. Se escindieron (isquemia caliente, 53-60 min) segmentos de 5 cm de longitud de cada AF y VS (izquierda y derecha), que fueron lavados y almacenados en una solución fisiológica y antibiótica a 4 ºC durante 24-48 h (isquemia fría). De cada donante es estudiaron una AF y una VS en estado fresco, y las restantes se estudiaron después de criopreservarlas. La metodología de criopreservación empleada fue similar a la utilizada previamente (tabla 1)11.
Los segmentos vasculares y 15 segmentos de ePTFE (6 mm, Gore-Tex Vascular-graft, W.L. Gore & Associates, Inc., Flagstaff-Arizona, Estados Unidos) se estudiaron en un simulador circulatorio (fig. 1)10-12. Los segmentos fueron inmersos y perfundidos con solución Tyrode (oxigenada, 37 °C, pH = 7,4). Cada segmento se instrumentó con un transductor de presión (Konigsberg Instruments, Inc., Pasadena-CA, Estados Unidos) y con un par de cristales de ultrasonido adaptados para el registro sonomicrométrico (Triton Technology Inc., San Diego-CA, Estados Unidos)10-12. Una vez instrumentados, los segmentos se sometieron a formas de onda y niveles de frecuencia, presión y flujo similares a los registrados en los sujetos normotensos10-12. De cada segmento se digitalizaron 30 latidos (frecuencia de muestreo, 200 Hz). En trabajos previos se expone una descripción detallada del simulador y de la metodología experimental3,9,12.
Análisis de datos
Respuesta elástica y viscosa
La representación de la pared vascular mediante un modelo viscoelástico de Kelvin-Voigt (fig. 2) permitió calcular el índice presión-diámetro elástico (Epd) y viscoso (Vpd)3,9,12. El modelo considera que la presión total ejercida sobre la pared se distribuye en un elemento representante de la elasticidad (resorte) y otro de la viscosidad (amortiguador) parietal, por lo que puede separarse en un componente elástico y otro viscoso (fig. 2):
Fig. 2. Esquema del modelo de Kelvin-Voigt. Epd: índice elástico; Vpd: índice viscoso.
Reordenando la ecuación, se obtiene:
La Pviscosa es proporcional a la derivada primera del diámetro respecto del tiempo:
donde Vpd es el índice viscoso y dD/dt la derivada primera del diámetro respecto del tiempo.
A partir de las señales de presión y diámetro se construyó la relación presión-diámetro de cada latido analizado3,9,12. El área de histéresis de la relación se redujo aumentando en forma iterativa el Vpd, para lo que se utilizó un software especialmente diseñado para estos fines3,9,12. Una vez obtenida el área mínima, el incremento iterativo se detuvo y el valor de Vpd obtenido se consideró el valor del índice viscoso parietal3,9,12. Seguidamente, a la relación presión-diámetro obtenida una vez eliminada el área de histéresis, denominada elástica pura, se le ajustó la función exponencial:
El Epd se calculó como la pendiente de la función en el valor de presión media diastólica3,9,12:
Función de amortiguamiento y de conducción
En un modelo de Kelvin-Voigt, la capacidad de amortiguar un pulso de presión surge de relacionar el estímulo con la deformación resultante. Como en anteriores trabajos, la función de amortiguamiento (FAP) se cuantificó como:
Cuanto menor sea la FAP, menor es la capacidad de amortiguamiento parietal3,9,12.
La función de conducción (FC) fue calculada como 1/Zc, donde Zc es la impedancia característica del segmento, calculada como2:
donde VOP es la velocidad de la onda del pulso, Ρs la densidad del líquido de perfusión, y AST, el área de sección transversal2.
Respuesta elástica: parámetros independientes del diámetro
Con el objetivo de determinar la rigidez arterial con independencia de las dimensiones vasculares, se calcularon el módulo de Young incremental (EINC) y los indicadores clínicos, VOP y el módulo elástico presión-deformación (EP)2,3,9,12. Para el cálculo del EINC se calcularon el estrés circunferencial (σ) y la deformación (ε) vascular, de acuerdo con las ecuaciones:
donde P es presión, Ri y Re son el radio interno y externo, respectivamente, R es el radio medio [R = (Ri + Re) / 2], y R0 es el radio arterial para una presión de 0 mmHg. Seguidamente, se construyó la relación estrés-deformación de cada latido y, mediante un procedimiento similar al descrito, se eliminó el área de histéresis obteniéndose la relación estrés-deformación elástica pura. El EINC se calculó como:
donde dσ y dε son las primeras derivadas respecto del tiempo del estrés y la deformación, respectivamente2,3,9,12. El EINC se calculó para un dσ/dε correspondiente al valor de estrés medio diastólico3,9,12.
La velocidad de onda del pulso se calculó como:
donde Hm es el espesor parietal medio, y Ρs la densidad sanguínea (Ρs = 1,06 g/ml)2,3,9,12.
El EP fue calculado como2,3,9,12:
donde, PS y PD son presión sistólica y diastólica, respectivamente, y DS y DD diámetro sistólico y diastólico, respectivamente.
Desacoples viscoelásticos y funcionales
El desacople viscoelástico y funcional entre AF de potenciales receptores y los sustitutos vasculares se calculó como:
El desacople fue cuantificado para cada parámetro calculado. Para el cálculo y la comparación emparejada se asignó aleatoriamente, a cada AF de los potenciales receptores, un homoinjerto o segmento de ePTFE. Al utilizar esta ecuación, los valores de desacoples se encuentran entre -1 y 1. Valores cercanos a 0 indican bajo desacople, y valores cercanos a -1 o 1 indican máximo desacople.
Análisis estadístico
Los valores calculados para cada segmento se promediaron y expresaron como valor medio ± desviación estándar (DE). En todos los casos se realizaron comparaciones emparejadas múltiples, entre todos los grupos considerados, mediante análisis de la varianza (ANOVA) seguido del test de Bonferroni. Se consideraron estadísticamente significativos los valores de p < 0,05.
RESULTADOS
En la tabla 2 se presentan las variables hemodinámicas. Las similitudes en los valores de presión, flujo y frecuencia permitieron realizar comparaciones isobáricas, isoflujo e isofrecuencia entre los parámetros de las tablas 3, 4 y 5. Sólo las prótesis de ePTFE presentaron diferencias en el diámetro respecto a los restantes segmentos estudiados (p < 0,05).
En la tabla 3 se presentan los parámetros biomecánicos Epd y Vpd, y la FAP y FC, de cada grupo. En ambos grupos de homoinjertos --arteriales y venosos-- no hubo diferencias significativas entre los segmentos frescos y criopreservados. Todos los sustitutos presentaron diferencias en Epd, Vpd, FC y FAP respecto a las AF de potenciales receptores (p < 0,05). No hubo diferencias significativas en Epd y FC entre los homoinjertos arteriales y venosos (p > 0,05). La respuesta viscosa y FAP de los homoinjertos arteriales fue diferente respecto a las de VS y ePTFE (p < 0,05).
En la tabla 4 se muestran los valores de VOP, EINC y EP. En los homoinjertos arteriales y venosos no hubo diferencias entre los segmentos frescos y criopreservados (p > 0,05). Al considerar el EINC, EP y la VOP, las arterias de receptores fueron menos rígidas que los homoinjertos y el ePTFE. Sólo el EP mostró diferencias significativas entre los homoinjertos arteriales y los venosos (p < 0,05).
En la tabla 5 se muestran los valores de desacople entre las AF de pacientes y los sustitutos vasculares. Tanto para arterias como para las venas, el valor de desacople generado por el homoinjerto fresco y el criopreservado fue similar. El ePTFE presentó los mayores desacoples, independientemente del parámetro considerado. Al comparar el acoplamiento entre AF nativas y los homoinjertos, el acoplamiento fue mayor para los homoinjertos arteriales al considerar Vpd y EP.
DISCUSION
La siguiente discusión se centra en los 2 hallazgos principales del estudio:
1. La criopreservación preservó la respuesta elástica y viscosa, así como la función hemodinámica de los homoinjertos arteriales y venosos.
2. Los homoinjertos arteriales frescos y criopreservados fueron los que presentaron una mayor similitud viscoelástica y funcional con las AF de pacientes.
Respuesta elástica y viscosa
La respuesta elástica vascular es determinante de la función vascular. Un módulo elástico adecuado permite la distensión vascular sistólica y el retroceso elástico diastólico, lo que posibilita la continuidad del flujo sanguíneo anterógrado2,3 y la reducción de las oscilaciones generadas por el corazón, de la poscarga ventricular y de la probabilidad de rotura vascular por sobredistensión2,3.
Para evaluar la respuesta elástica se utilizaron diferentes indicadores de elasticidad que aportan información complementaria3,12. El EINC es considerado el patrón de referencia para evaluar la respuesta elástica de un material, por ser el índice que mejor define (independientemente del tamaño o la geometría) las propiedades intrínsecas del material estudiado2,3,12. Dado que su cálculo es dificultoso (requiere conocer el espesor, el diámetro y la deformación instantánea vascular), este módulo no es utilizado con frecuencia en la clínica2,3,12. Otro indicador calculado fue la VOP, que permite evaluar la capacidad vascular para propagar por sus paredes las ondas de pulso. Al igual que la VOP, los restantes indicadores utilizados, el Epd y EP, pueden ser calculados con facilidad en la clínica, ya que únicamente requieren la medición de la presión y el diámetro arterial. Las diferencias entre Epd y EP radican en que para el cálculo del Epd, al igual que para el EINC y la VOP, es necesario definir el valor de presión para el que es calculado y permite evaluar la rigidez arterial con independencia de las propiedades viscosas parietales, dado que su forma de cálculo se desarrolla a partir de la eliminación de la histéresis de la relación presión-diámetro12. Al respecto, cabe destacar que el método utilizado para el cálculo del Epd utiliza fundamentalmente la parte final de la fase diastólica de la relación presión-diámetro, donde sólo hay fenómenos elásticos debidos al estado de relajación de la pared arterial. Además, el Epd permite calcular la FAP, puesto que tiene unidades coherentes con el Vpd12. Por otra parte, el EP permite evaluar la rigidez arterial en relación con la deformación unitaria y como tal es independiente del diámetro3,12. Su utilidad en la clínica humana se sustenta en que para su cálculo sólo se requiere conocer los valores sistólicos máximos y diastólicos mínimos de las señales de presión y diámetro arterial3,12. Cabe destacar que, debido a que su cálculo implica la utilización de los valores máximos de presión y diámetro, contiene algunos elementos espurios existentes en el pico sistólico de la relación presión-diámetro. Entre estos elementos se encuentra la reflexión de la onda del pulso que afecta a la zona cercana al punto sistólico máximo, y posibles elementos determinantes del área de histéresis, entre los que se encuentra la viscosidad vascular2,12.
Nuestros resultados evidencian que, independientemente del parámetro utilizado para evaluar la respuesta elástica (EINC, VOP, Epd o EP), la criopreservación no determinó diferencias entre los homoinjertos frescos y criopreservados, arteriales o venosos.
Respecto a la similitud entre los segmentos estudiados y las AF nativas, los resultados varían según el parámetro utilizado. Cuando los parámetros analizados consideran la respuesta elástica con independencia de la respuesta viscosa (EINC, VOP y Epd), los homoinjertos arteriales y venosos presentaron diferencias con las arterias nativas, pero no entre ellos. En consecuencia, la implantación de un homoinjerto arterial o venoso, fresco o criopreservado, generaría, al menos inicialmente, similares valores de «desacople elástico» con las AF de los receptores.
La respuesta viscosa parietal determina que el sistema arterial en sístole disipe como calor parte de la energía entregada por el corazón en cada latido3,10,12. La viscosidad atenúa los componentes de mayor frecuencia de las ondas incidentes de presión y flujo y la amplitud de las ondas reflejadas, que podrían desencadenar fenómenos de resonancia en el sistema y dañar la pared arterial3,10,12.
Los resultados pusieron de manifiesto que la viscosidad (Vpd) de los homoinjertos arteriales y venosos no mostró diferencias entre segmentos frescos y criopreservados. Por lo tanto, la metodología de criopreservación permitiría no sólo conservar la respuesta elástica, sino también la respuesta viscosa. Por otra parte, los homoinjertos arteriales presentaron mayor similitud en Vpd con las AF de receptores.
Finalmente, cabe señalar que, con independencia del parámetro calculado (tablas 3 y 4), los segmentos de ePTFE presentaron las mayores diferencias con las AF de potenciales receptores.
Al considerar los resultados obtenidos observamos que los homoinjertos arteriales, frescos o criopreservados, constituirían una alternativa interesante como sustitutos de arterias musculares para minimizar las diferencias viscoelásticas con las arterias nativas.
Función vascular
El procedimiento de criopreservación no determinó variaciones en la función de amortiguamiento parietal de arterias musculares y venas. Los resultados obtenidos evidencian, además, que los homoinjertos arteriales fueron los que presentaron la mayor similitud en cuanto a la capacidad de amortiguar respecto a las AF de potenciales receptores, seguidos de los homoinjertos venosos. La menor capacidad de amortiguar la pulsatilidad y, en consecuencia, de protegerse de ella podría vincularse con las reacciones de hiperplasia parietal (respuestas adaptativas), que se evidencia en los sustitutos vasculares venosos implantados en el territorio arterial.
Considerando los resultados obtenidos, y al menos desde un punto de vista teórico, la implantación de un homoinjerto arterial fresco o criopreservado permitiría contar con un sustituto vascular que amortigua, en mayor grado que las restantes prótesis, la pulsatilidad de las ondas de presión y flujo. En consecuencia, esto determinaría en las arterias distales (anastomóticas y postanastomóticas) una menor pulsatilidad de presión y flujo y, por tanto, menores oscilaciones de estrés circunferencial y de cizallamiento. La importancia de estos factores resulta evidente sin tenemos en cuenta que elevadas oscilaciones en la presión o el estrés parietal circunferencial y de cizallamiento se han relacionado con daños parietales y la consecuente reacción hiperplásica vascular7,8.
La función de conducción se cuantificó como el inverso de la impedancincia de conocer la impedancia al flujo impuesto por las arterias nativas y los sustitutos vasculares surge de trabajos previos que demostraron que en los sitios donde hay cambios abruptos, o desacoples de impedancia, se generan trastornos hemodinámicos que resultan perjudiciales para los segmentos involucrados, así como para el resto del sistema cardiovascular7,8. Cuanto mayor desacople de impedancias o en la capacidad de conducción haya entre la arteria nativa y el sustituto implantado, menor es el restablecimiento del flujo sanguíneo, mayor la probabilidad de eventos trombóticos y/o hiperplasia, y si se coloca en grandes vasos, mayor la poscarga ventricular7,8,13.
El procedimiento de criopreservación permitió mantener la función de conducción de los homoinjertos arteriales y venosos. Respecto a las AF de pacientes, todos los sustitutos presentaron diferencias en la función de condición. Sin embargo, no hubo diferencias entre los homoinjertos arteriales y venosos. Asimismo, los segmentos de ePTFE presentaron las mayores diferencias con las arterias nativas.
De acuerdo con los resultados obtenidos podría plantearse que la interposición de un homoinjerto arterial y/o venoso en el territorio arterial generaría un grado similar de impedancia al flujo y de desacople de impedancias anastomóticas. Asimismo, el grado de desacople de impedancias sería siempre menor que el generado al interponer una prótesis de ePTFE.
Implicaciones clínicas
Se utilizan segmentos criopreservados, venosos y/o arteriales, en diversas situaciones clínicas: cirugías de revascularización, accesos vasculares para hemodiálisis, reconstrucción de cavidades cardiacas, etc.14,15. Sin embargo, hay controversia acerca de la capacidad de la criopreservación para mantener las propiedades viscoelásticas y funcionales del homoinjerto, y por tanto de la capacidad de las paredes vasculares para adaptarse a las condiciones hemodinámicas del receptor.
Los receptores de homoinjertos arteriales pueden presentar diversas situaciones hemodinámicas, así como enfermedades vasculares. En este sentido, si consideramos que las propiedades mecánicas vasculares pueden verse modificadas en diferentes situaciones, sería importante realizar una evaluación biomecánica de los vasos nativos del receptor para seleccionar el sustituto vascular más adecuado.
Los resultados del presente trabajo muestran que la metodología de criopreservación utilizada preserva la respuesta elástica y viscosa, así como las funciones hemodinámicas de homoinjertos arteriales y venosos. En consecuencia, dicha metodología permitiría almacenar, en bancos de tejidos, homoinjertos vasculares criopreservados con propiedades viscoelásticas y funcionales similares a las de los segmentos frescos.
Sin embargo, los resultados muestran que mantener inalteradas las propiedades de segmentos frescos no significa que los homoinjertos presenten propiedades similares a la de los segmentos arteriales in vivo. Al respecto, en este trabajo, los segmentos frescos presentaron mayor respuesta elástica y menor respuesta viscosa que las arterias de potenciales receptores. Esto podría estar relacionado con la pérdida de la regulación del tono muscular liso en los segmentos estudiados in vitro. En este sentido, en trabajos recientes hemos evidenciado que el tono muscular liso basal permite mantener reducida la elasticidad y elevada la viscosidad vascular, y así mantener elevada la capacidad de amortiguar10. Por tanto, minimizar las alteraciones o cambios parietales inducidos en los homoinjertos antes de su criopreservación podría ser la principal estrategia para conservar en ellos el grado de viscoelasticidad y funcionalidad vascular encontrado in vivo.
Adicionalmente, nuestro trabajo pone de manifiesto la necesidad de utilizar parámetros que consideren la respuesta vi scosa, y no sólo la respuesta elástica, al analizar el desacople entre sustitutos vasculares y arterias nativas. De lo contrario, se podría llegar a conclusiones parciales o equivocadas respecto al grado de similitud entre vasos nativos y sustitutos vasculares.
Cabe señalar que una adecuada valoración de la utilidad clínica de estos homoinjertos requiere otros estudios in vitro en los que se evalúen otras variables (p. ej., reactividad muscular, función endotelial), así como también una etapa en la que mediante estudios in vivo se evalúe el comportamiento postimplante del sustituto. De todas maneras, los estudios de evaluación preimplante como el realizado permiten analizar objetivamente el grado de acoplamiento viscoelástico y funcional «esperable» in vivo, con independencia de los factores que podrían influir en la viscoelasticidad del homoinjerto una vez implantado.
Finalmente, el presente trabajo presenta una metodología no invasiva para el registro de las señales de presión, diámetro y espesor parietal que permite realizar un detallado análisis biomecánico y funcional de las arterias humanas. Dicha metodología podría ser de gran utilidad en la evaluación biomecánica y funcional postimplante de los homoinjertos y las arterias nativas.
CONCLUSIONES
El procedimiento de criopreservación utilizado preservó el grado de respuesta elástica y viscosa, así como la capacidad de conducción y amortiguamiento de los homoinjertos arteriales y venosos.
Todos los sustitutos vasculares presentaron diferencias con las arterias de potenciales receptores. Los homoinjertos arteriales fueron los que presentaron mayor similitud viscoelástica y funcional con las arterias nativas de pacientes, seguidos por los homoinjeros venosos.
AGRADECIMIENTOS
A Elbio Agote y al personal del INDT. A Rosario García (Buquebús). A la Sociedad Española de Cardiología, por el premio otorgado al presente trabajo en el Congreso de las Enfermedades Cardiovasculares (octubre 2005, Barcelona, España).
Correspondencia: Dr. D. Bia.
Facultad de Medicina. Departamento de Fisiología.
Universidad de la República.
General Flores, 2125. 11800 Montevideo. Uruguay.
Correo electrónico: dbia@fmed.edu.uy
Recibido el 27 de diciembre de 2005.
Aceptado para su publicación el 28 de marzo de 2006.