La miocarditis se define como una enfermedad inflamatoria del músculo cardiaco y es una causa importante de insuficiencia cardiaca aguda, muerte súbita y miocardiopatía dilatada. Los virus son la causa de la mayoría de los casos de miocarditis o miocardiopatía inflamatoria y pueden inducir una respuesta inmunitaria causante de inflamación pese a haberse eliminado el patógeno. Otros agentes etiológicos causantes de miocarditis son los fármacos, las sustancias tóxicas o los trastornos autoinmunitarios. En los últimos años, los avances de técnicas no invasivas como la resonancia magnética cardiaca han sido de gran utilidad para respaldar el diagnóstico de miocarditis, pero los procesos tóxicos, infecciosos e inflamatorios, infiltrantes o autoinmunitarios se producen en las células, y solamente la biopsia endomiocárdica permite establecer la naturaleza del agente etiológico. Además, después de la generalización de las técnicas inmunohistoquímicas y de detección del genoma viral, la biopsia endomiocárdica proporciona un diagnóstico etiológico definitivo que puede conducir a tratamientos específicos como los antivirales o los inmunosupresores. No se realiza con frecuencia para el diagnóstico de miocarditis por razones de seguridad, pero la biopsia endomiocárdica, tanto derecha como izquierda, tiene una tasa de complicaciones muy baja cuando la realiza un operador experto. En este documento se presenta una revisión actualizada de la miocarditis y la miocardiopatía inflamatoria haciendo especial referencia al papel de la biopsia endomiocárdica para establecer un tratamiento específico.
Palabras clave
El término miocarditis hace referencia a una inflamación del músculo cardiaco, que puede tener su causa en infecciones, sustancias tóxicas o procesos autoinmunitarios. Durante la fase aguda, un desencadenante específico induce una respuesta inmunitaria que puede ser de diferente gravedad, desde transitoria y leve hasta fulminante. En el caso de la miocarditis viral, si el huésped no logra eliminar el virus patógeno, se produce una infección crónica, con o sin inflamación persistente. Además, la inflamación puede mantenerse aun cuando se haya eliminado el patógeno. Así, la miocardiopatía dilatada (MCD) inflamatoria es una entidad independiente, que tiene sus propios mecanismos patogénicos y es una posible causa de insuficiencia cardiaca. Con el aumento del conocimiento existente sobre la enfermedad, actualmente parece claro que la lesión miocárdica se produce en las células, por lo que el diagnóstico exacto requiere un análisis tisular mediante biopsia endomiocárdica (BEM)1. Se ha demostrado que los signos histológicos tienen implicaciones pronósticas2, y en varios casos pueden añadirse terapias específicas al tratamiento sintomático básico de la insuficiencia cardiaca3. Esta revisión tiene como objetivo proporcionar un documento práctico para el diagnóstico y el tratamiento de la miocarditis y la miocardiopatía inflamatoria, con especial énfasis en la BEM como instrumento diagnóstico, así como al posterior tratamiento individualizado basado en sus resultados.
DEFINICIONES Y ETIOLOGÍA DE LA MIOCARDITISLa miocarditis se define como una inflamación del miocardio diagnosticada mediante unos criterios histológicos, inmunológicos e inmunohistoquímicos establecidos. Tal como se indica en el documento de consenso del Grupo de Trabajo sobre Enfermedades Miocárdicas y Pericárdicas de la Sociedad Europea de Cardiología1, se define histológicamente como la presencia de infiltrados inflamatorios en el miocardio, asociados a una degeneración miocitaria y necrosis de causa no isquémica, según los criterios de Dallas4. Por lo que respecta a los criterios inmunohistoquímicos, el documento mencionado propone que el diagnóstico se establezca atendiendo a la presencia en el miocardio de al menos 14 leucocitos/mm2, entre ellos hasta 4 monocitos/mm2 y con detección de 7 o más linfocitos T CD3-positivos1. En relación con la MCD inflamatoria, la Organización Mundial de la Salud y la International Society and Federation of Cardiology la definen como una miocarditis asociada a una disfunción cardiaca1.
Infecciones, fármacos, sustancias tóxicas y enfermedades autoinmunitarias (tabla 1) pueden causar la miocarditis y las miocardiopatías inflamatorias. Los agentes infecciosos son los factores etiológicos más frecuentes, y las infecciones virales son la principal causa de miocardiopatías inflamatorias adquiridas en Europa y Norteamérica2.
Etiología de la miocardiopatía inflamatoria
| Infecciosa | No infecciosa |
|---|---|
| Virus | Autoinmunitaria |
| Adenovirus | Posinfecciosa |
| Enterovirus (Coxsackie A/B, echovirus) | Vacunación antigripal |
| Citomegalovirus | Lupus eritematoso sistémico |
| Eritrovirus | Sarcoidosis |
| Herpesvirus | Síndrome de Sjögren |
| Gripe A/B | Síndrome de Churg-Strauss |
| VIH | Granulomatosis de Wegener |
| Virus de la hepatitis C | Arteritis de Takayasu |
| Poliovirus | Trastornos intestinales inflamatorios |
| Varicela zóster | Miocarditis de células gigantes |
| Arbovirus | |
| Infecciones mixtas | |
| Bacterias | Toxinas |
| Mycobacteria | Antraciclinas |
| Chlamydia | Catecolaminas |
| Streptococci | Citocinas |
| Mycoplasma | Cocaína |
| Legionella spp. | Alcohol |
| Salmonella spp. | Fármacos de quimioterapia |
| Rickettsia spp. | |
| Corynebacteria | |
| Borrelia spp. | |
| Hongos | Alergia/hipersensibilidad |
| Aspergillus | Penicilina |
| Candida | Antidepresivos tricíclicos |
| Cryptococus | Clozapina |
| Histoplasmodium spp. | Fármacos antirreumáticos |
| Sulfamidas | |
| Cefalosporinas | |
| Parásitos y protozoos | Patógenos físicos |
| Esquistosomiasis | Arsénico |
| Larva migrans | Litio |
| Trypanosoma cruzi | Irradiación |
| Toxoplasma gondii | Hipotermia |
| Triquinosis/triquinelosis | Golpe de calor |
| Echinococci |
Otras causas muy poco frecuentes de miocarditis son las enfermedades autoinmunitarias sistémicas como la enfermedad de Loeffler o el síndrome de Churg-Strauss, que pueden asociarse a una miocarditis eosinofílica. Además, la sarcoidosis cardiaca y la miocarditis de células gigantes explican otros casos en los que el diagnóstico y el inicio del tratamiento tempranos son cruciales, puesto que determinan el pronóstico.
Miocarditis viralesComo consecuencia del uso sistemático de los métodos de biología molecular, el espectro de los virus cardiotrópicos se ha ampliado notablemente. Los genotipos aislados con más frecuencia son los de enterovirus, adenovirus, parvovirus B19 (PVB19) (que pertenece a la familia de los eritrovirus), virus del herpes humano tipo 6 (VHH-6), virus de Epstein-Barr y citomegalovirus (este sobre todo en pacientes inmunodeficientes). Alrededor del 30% de los pacientes sufren infecciones del miocardio por múltiples agentes5.
La epidemiología de las especies virales miocárdicas varía en función del lugar geográfico, pero en la última década los genomas de eritrovirus y virus del herpes se han detectado con mayor frecuencia que los de enterovirus o adenovirus6, a diferencia de lo que se había descrito anteriormente. Esta alta prevalencia de eritrovirus y virus del herpes puede deberse a una alta incidencia de la infección en la infancia y su posterior persistencia durante toda la vida7. Así pues, su detección en diferentes tejidos puede indicar una infección latente y los síntomas podrían deberse a una reactivación3. Además, no todos los virus causan miocarditis con los mismos patrones de infección. Por ejemplo, los enterovirus y los adenovirus infectan directamente los miocardiocitos de animales y seres humanos, y en los últimos años hasta un 10–15% de las miocarditis virales han sido causadas por estos agentes8.
La situación es muy diferente por lo que respecta a los eritrovirus como el PVB19. Este virus infecta principalmente las células progenitoras eritroides de la médula ósea9 y las células endoteliales, lo que da lugar a infecciones asintomáticas y latentes. Más tarde, cuando el virus se reactiva, aparecen síntomas de tipo anginoso que se han relacionado con una disfunción endotelial10.
SÍNTOMAS CLÍNICOS DE MIOCARDITIS Y DIAGNÓSTICO NO INVASIVOLa forma de presentación clínica de la miocarditis es muy diversa y va desde el dolor torácico de tipo isquémico hasta el síncope o la insuficiencia cardiaca aguda. Aunque la mayoría de los pacientes presentan síntomas leves o alteraciones electrocardiográficas transitorias, la miocarditis puede causar también insuficiencia cardiaca aguda y hasta shock cardiogénico que pone en peligro la vida del paciente1.
Con frecuencia se inicia entre 1 y 4 semanas después de una infección, habitualmente respiratoria o gastrointestinal. Sin embargo, dada la diversidad de sus síntomas, la miocarditis puede ser difícil de diagnosticar, y siempre es preciso descartar la enfermedad coronaria, dadas su alta prevalencia y su forma de presentación clínica similar. Además, la BEM es indudablemente el patrón de referencia como método diagnóstico de miocarditis y miocardiopatía inflamatoria. No hay ninguna otra prueba que pueda aportar un diagnóstico definitivo, y las técnicas no invasivas se emplean para ayudar al clínico a descartar otros diagnósticos e identificar la miocarditis de manera indirecta.
ElectrocardiogramaSe debe realizar un electrocardiograma de 12 derivaciones a todos los pacientes con sospecha de miocarditis1. Los signos electrocardiográficos de los pacientes con miocarditis incluyen alteraciones de la onda T y del segmento ST, elevación del segmento ST que semeja un infarto agudo de miocardio o anomalías de la conducción (como se observa en la enfermedad de Lyme, la sarcoidosis cardiaca o la miocarditis de células gigantes)11. Estas alteraciones son inespecíficas y pueden observarse en otros contextos clínicos, pero el electrocardiograma continúa siendo un instrumento de detección sistemática de fácil acceso. Por lo que respecta al pronóstico, el QRS alargado > 120ms es el único factor independiente relacionado con la evolución al trasplante de corazón o la muerte por causa cardiaca12.
Pruebas de imagenLa ecocardiografía continúa siendo el método clave para analizar la función ventricular ante la sospecha de miocarditis y es útil para descartar otras entidades como las valvulopatías. Así pues, se deben realizar exploraciones ecocardiográficas en el momento de la presentación inicial y durante el seguimiento a todos los pacientes con sospecha de miocarditis1. Sin embargo, los signos observados son inespecíficos, desde disfunción ventricular general o anomalías segmentarias de la contractilidad hasta disfunción diastólica. Tanto en la miocarditis aguda como en la fulminante, el grosor de la pared puede estar levemente aumentado, pero es habitual que las dimensiones diastólicas del ventrículo izquierdo (VI) sean mayores en la miocarditis aguda. Por lo que respecta a la función sistólica, normalmente se observa una mejor recuperación en los pacientes que sobreviven a la fase aguda de una miocarditis fulminante en comparación con lo que ocurre en la miocarditis aguda13. De hecho, se ha observado que la miocarditis fulminante puede tener buena evolución en un contexto clínico grave como el del dengue si se aplica un tratamiento específico14. Para los pacientes con fracción de eyección del ventrículo izquierdo (FEVI) conservada, el método de speckle tracking (rastreo de marcas) es una técnica prometedora. Así, en pacientes con inflamación miocárdica demostrada mediante biopsia, la tasa de deformación longitudinal general y el strain longitudinal general muestran un deterioro significativo en comparación con los pacientes sin inflamación, con independencia de lo que indiquen los parámetros ecocardiográficos convencionales15. Así pues, esta técnica tiene una sensibilidad superior para la detección del daño miocárdico leve en los pacientes con FEVI preservada y desempeña un papel en la predicción de la evolución clínica, puesto que los pacientes con deterioro del strain basal muestran peores resultados ecocardiográficos en el seguimiento.
La resonancia magnética cardiaca (RMC) puede ser útil para confirmar el diagnóstico de miocarditis, sobre todo en la fase aguda de la enfermedad. Se ha propuesto el uso combinado de tres técnicas de RMC diferentes, y los resultados son compatibles con la inflamación miocárdica si se cumplen al menos dos de los criterios de Lake Louise.
Estos incluyen: a) aumento de la señal focal o difusa en las secuencias potenciadas en T2; b) realce precoz con gadolinio, midiendo el realce absoluto total o el realce total relativo del miocardio, y c) al menos un foco de realce tardío focal no isquémico16.
Cuando se cumplen al menos dos criterios, se ha descrito una sensibilidad del 76% y una especificidad del 96% en pacientes con sospecha clínica de miocarditis aguda y forma de presentación como seudoinfarto17.
Además, en estudios recientes se ha observado una buena correlación entre los resultados de la RMC y la BEM en la miocarditis aguda, con una concordancia de hasta el 79% al utilizar las nuevas técnicas de RMC18. Sin embargo, no se ha demostrado que obtener la biopsia de la región con realce tardío de gadolinio en la RMC aumente el rendimiento diagnóstico19. Por otro lado, se ha observado que en la miocarditis crónica el valor diagnóstico de la RMC es inferior (sensibilidad, 63%; especificidad, 40%)16, por lo que esta técnica podría no ser apropiada para orientar el tratamiento de la miocarditis crónica.
BiomarcadoresLas troponinas cardiacas indican claramente miocarditis aguda tras haberse descartado otras posibles causas de necrosis miocárdica, como los síndromes coronarios agudos20. La elevación de troponinas cardiacas I o T es más frecuente que la de la creatincinasa MB, y unas concentraciones persistentemente altas indican necrosis persistente. Se debe determinar las concentraciones de péptido natriurético cerebral (BNP) o su prohormona aminoterminal (NT-proBNP) ante la sospecha de insuficiencia cardiaca, pero unos valores normales no descartan el diagnóstico de miocarditis21. Nuevos biomarcadores cardiacos, como la copeptina o la proadrenomedulina de región media, no aportan información diagnóstica o pronóstica adicional20.
La utilidad de las serologías virales es escasa, sobre todo en la miocarditis crónica o la miocardiopatía inflamatoria, puesto que se puede encontrar anticuerpos IgG de virus cardiotrópicos en el torrente circulatorio de población general, sin que haya una afección cardiaca asociada22. La positividad de la reacción en cadena de la polimerasa (PCR) para un virus en sangre periférica tampoco demuestra que haya una miocarditis viral. Sin embargo, cuando el genoma del virus está presente en la BEM, la PCR del virus en sangre puede descartar o confirmar una infección sistémica concomitante2. Esto ayuda a diferenciar una infección viral aguda de una reactivación viral endógena, en la que hay una mayor replicación del virus.
Por lo que respecta a los autoanticuerpos cardiacos en suero (antifibrilares, anticardiacos específicos de órgano y parcialmente específicos de órgano, antidiscos intercalados, antiinterfibrilares, etc.), pueden ser útiles cuando se observan valores elevados en ausencia de un genoma viral en la BEM, lo cual indica una miocarditis de mecanismo inmunitario o una miocardiopatía inflamatoria.
BIOPSIA ENDOMIOCÁRDICALa BEM es la técnica considerada patrón de referencia para el diagnóstico de miocarditis y miocardiopatía inflamatoria. Los procesos tóxicos, infecciosos e inflamatorios, infiltrantes o autoinmunitarios que causan la miocarditis se producen en las células, y no hay ninguna otra técnica diagnóstica que pueda establecer la naturaleza del agente etiológico. Además de la detección de la inflamación o los genomas virales en la fase aguda de la miocarditis, la BEM aporta una importante información pronóstica adicional durante el seguimiento de los pacientes, que puede influir en la toma de decisiones terapéuticas. La declaración científica sobre la BEM de 2007 de la American Heart Association, la American College of Cardiology Foundation y la Sociedad Europea de Cardiología limitó sus recomendaciones de clase I a la insuficiencia cardiaca de nueva aparición inexplicada de menos de 2 semanas de evolución asociada a deterioro hemodinámico o a la insuficiencia cardiaca de nueva aparición inexplicada de 2 semanas a 3 meses de evolución asociada a dilatación del VI y aparición de nuevas arritmias ventriculares o alteraciones de la conducción23. Sin embargo, en un reciente documento de consenso de la Sociedad Europea de Cardiología1, se ha ampliado la recomendación de uso de la BEM para incluir en ella a los pacientes con una presentación clínica tipo «seudoinfarto» tras haber descartado la enfermedad coronaria. Este cambio refleja la generalización de las técnicas de detección de genoma viral e inmunohistoquímicas, que ha permitido avanzar en el diagnóstico etiológico de la miocarditis. Con ello, hay un número creciente de pacientes que pueden beneficiarse del empleo de tratamientos específicos.
La principal razón para limitar el uso de la técnica de BEM en algunos centros es la seguridad. No obstante, cuando la realizan operadores con experiencia, la BEM tanto derecha como izquierda tienen unas tasas de complicaciones muy bajas. En un estudio de un solo centro en el que se analizaron 3.048 BEM derechas de pacientes no trasplantados, el riesgo de complicaciones mayores, como taponamiento cardiaco y bloqueo auriculoventricular con necesidad de implante de marcapasos permanente, fue del 0,12%. No se registró ninguna muerte24. Asimismo, en estudios previos se han descrito tasas de complicaciones mayores de menos del 0,5%25. En cuanto a la biopsia del VI, también se ha observado que es un procedimiento seguro26. Chimenti et al26 documentaron, en un periodo de 28 años con más de 4.000 BEM, una tasa de complicaciones de solo el 0,33% de los pacientes sometidos a BEM izquierda.
¿Cómo realizar una biopsia endomiocárdica?La BEM se realiza con el paciente en decúbito supino, con anestesia local de lidocaína al 2%. El paciente debe estar monitorizado con un electrocardiograma de tres derivaciones, monitorización no invasiva de la presión arterial y determinación de la saturación de oxígeno. Es necesario que la razón internacional normalizada (INR) sea < 1,5 antes de realizar la BEM, y se debe interrumpir el tratamiento de anticoagulación 16 h antes y hasta 12 h después de la intervención. La vía de acceso vascular para la BEM del ventrículo derecho (VD) es generalmente la vena femoral o la yugular interna derecha. Para la BEM del VI o biventricular, se prefiere la vía de acceso de la vena femoral derecha y la arteria femoral para acceder al VD y el VI27. Está justificado el empleo de bioptomos flexibles con objeto de garantizar la seguridad. Nosotros recomendamos los bioptomos Cordis modificados. Este bioptomo (B-18110; Medizintechnik Meiners, Monheim, Alemania) se ha utilizado en la práctica clínica desde 1985. Tiene un diámetro de 6 Fr y una longitud de 1.100 mm. En comparación con el bioptomo Cordis convencional, dispone de un tubo de politetrafluoroetileno (teflón) más flexible.
La BEM debe realizarse con guía de fluoroscopia con objeto de localizar el tabique intraventricular en el caso de la BEM de VD, ya que el hecho de que la pared libre sea delgada puede conllevar alto riesgo de perforación. Cuando se trata de una BEM del VI, una de las principales preocupaciones es la posible insuficiencia mitral grave debida a la rotura de cuerdas tendinosas, por lo que la fluoroscopia puede ser útil también para evitar que se dé esta situación. Además, se recomienda llevar a cabo una ecocardiografía antes y después de la intervención para descartar la presencia de un derrame pericárdico.
En un estudio reciente se ha evaluado la viabilidad y la seguridad de la BEM del VI a través de una vía de acceso transradial, y los resultados han sido prometedores28, con lo que se dispone de una alternativa menos invasiva que el abordaje femoral clásico, lo cual podría reducir la duración de la estancia hospitalaria.
Por lo que respecta al número de muestras obtenidas en la intervención, se recomienda un mínimo de 5 y un máximo de 10 para garantizar la obtención de unos resultados fiables. En la miocarditis es frecuente la afección tisular focal, por lo que se deberá tomar muestras en diferentes partes del tabique del VD o el VI. Las muestras para histología y análisis inmunohistoquímico deben ser de al menos 1-2 mm y deben fijarse de inmediato en formol al 10% o con congelación rápida en nitrógeno líquido, según el anticuerpo que se vaya a utilizar. Se debe someter las muestras para el análisis de genoma viral a una congelación rápida en nitrógeno líquido y conservarlas a un temperatura de −80°C o en tubos RNAlater® a temperatura ambiente1.
Biopsia endomiocárdica del ventrículo izquierdo frente a la del ventrículo derechoEl valor diagnóstico de la BEM de VI en comparación con la del VD se ha analizado en diversos estudios, y los resultados no son homogéneos. Mientras que algunos autores observan que el rendimiento diagnóstico de la BEM del VI es superior a la de la BEM del VD ante la sospecha de miocarditis del VI26, otros datos más recientes indican que ambas técnicas son similares cuando se evalúa la presencia de genoma viral o inflamación mediante inmunohistoquímica. No obstante, la BEM de VI parece más fiable a la hora de encontrar alteraciones morfológicas como fibrosis intersticial o expresión del colágeno29.
Interpretación de los resultados de la biopsia endomiocárdica e implicaciones pronósticasEn todos los casos de sospecha de miocarditis, se debe analizar las muestras de tejido de VI o VD mediante histología, inmunohistoquímica y evaluación de genomas virales (PCR viral en BEM y en sangre)1. Todas estas características ayudan a diagnosticar la inflamación y la presencia de genoma viral, lo cual tiene implicaciones pronósticas y hace necesario el uso de tratamientos concretos.
InflamaciónLa histología de la inflamación miocárdica se definió inicialmente con los criterios cualitativos de Dallas (presencia de infiltrados inflamatorios en el miocardio asociados a degeneración miocitaria y necrosis de causa no isquémica).
Posteriormente, la adición de criterios inmunohistoquímicos con diferentes anticuerpos monoclonales aumentó la sensibilidad de la BEM en el diagnóstico de miocarditis30 y la inflamación se estableció de manera cuantitativa tomando como umbral un valor ≥ 14 leucocitos/mm2. Durante la realización del análisis de la BEM, se puede diferenciar las células inflamatorias específicas mediante diferenciación de clusters (CD). Las células B son positivas para CD20 y todas las células T son positivas para CD3. Las subpoblaciones de células T son las CD4 (colaboradoras), CD8 (supresoras) y CD45R0 (células T activadas o de memoria) o los linfocitos citotóxicos positivos para perforina. CD68 y CD11 corresponden a macrófagos. Teniendo en cuenta estas subpoblaciones, la inflamación se puede diagnosticar31 de manera más específica por cifras > 7,0 linfocitos CD3+/mm2 y/o > 35,0 macrófagos CD11b+ o Mac-1+/mm2.
Durante el curso de una enfermedad inflamatoria aguda, las muestras de histología o inmunohistología contienen normalmente un infiltrado celular focal o difuso de linfocitos o macrófagos. La presencia de otras células como eosinófilos o células gigantes es muy poco común.
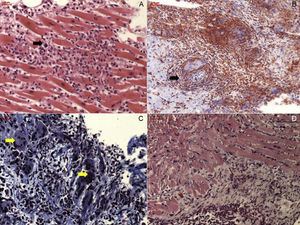
La miocarditis linfocítica activa se caracteriza por una necrosis celular aguda, además de los infiltrados antes mencionados, a diferencia de lo que ocurre en la miocarditis limítrofe (borderline), en la que no se observa necrosis (figura 1). Otras entidades, como la miocarditis eosinofílica idiopática, la miocarditis de células gigantes, los trastornos granulomatosos y los tipos de miocarditis inducidos por alergia, son muy poco frecuentes y se observan en menos del 20% de los casos8. Por lo que respecta a los factores predictivos del pronóstico en la fase aguda, se ha observado que la densidad del infiltrado de células inflamatorias determina el curso de la enfermedad a largo plazo32. Además, el pronóstico varía en función de cuáles sean las características del infiltrado celular. Así, la miocarditis focal borderline tiene un pronóstico excelente, mientras que la mortalidad temprana de la miocarditis linfocítica fulminante es del 40% en el primer mes32. El pronóstico es aún peor en la miocarditis eosinofílica o de células gigantes no tratada, en la que la supervivencia es inferior al 20% a los 4 años33,34.
Diferentes tipos de miocarditis aguda. A: miocarditis linfocítica aguda con infiltrados focales de células inflamatorias (flecha negra) y necrosis de miocardiocitos. B: sarcoidosis cardiaca, con signos de granuloma (flecha negra). C: miocarditis de células gigantes, con presencia de células gigantes multinucleadas (flechas amarillas). D: miocarditis eosinofílica. Esta figura se muestra a todo color solo en la versión electrónica del artículo.
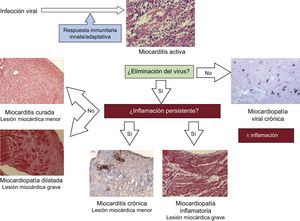
En cuanto a los pacientes con MCD e insuficiencia cardiaca crónica, se observa inflamación en hasta un 30% de las biopsias8. Sin embargo, las células tienden a distribuirse de manera más difusa que en la fase aguda, y en el examen histológico se aprecian otras características, como hipertrofia de los miocardiocitos y fibrosis intersticial (figura 2).
Recientemente, los signos inmunohistológicos de inflamación se han relacionado también con mala evolución en casos de sospecha de miocarditis. De hecho, la inmunohistoquímica positiva para células implicadas en la inflamación y la expresión de HLA-DR-α, pero no la sola presencia de criterios de Dallas, se asoció a mayor riesgo de muerte de causa cardiaca o trasplante en pacientes con miocarditis aguda y crónica35. En un estudio más reciente, del que se excluyó a los pacientes con miocarditis aguda, se observó que la perforina era un predictor de la evolución de la FEVI de pacientes con miocardiopatía inflamatoria crónica y resultados negativos para genomas de virus cardiotrópicos (enterovirus, adenovirus, virus de Epstein-Barr, VHH-6). Se observó la presencia de eritrovirus en el 54% de los pacientes, pero sin evidencia de actividad transcripcional31. A pesar de que todos los pacientes recibieron durante el seguimiento el tratamiento recomendado para la insuficiencia cardiaca, un valor de perforina > 2,95 se asoció a deterioro de la FEVI (sensibilidad, 94,2%; especificidad, 80,4%)31.
Presencia de genoma viralEn los países occidentales, la mayor parte de los agentes infecciosos que causan miocarditis son virus, y el espectro de estos difiere en función de la localización geográfica8. La PCR identifica el ADN o el ácido ribonucleico (ARN) del virus en el miocardio con una sensibilidad muy alta1. De entrada, la PCR anidada identifica el virus de manera cualitativa y, si el resultado es positivo, se determina la carga viral mediante PCR en tiempo real.
Sedebe comparar todas las muestras positivas amplificadas con controles negativos para asegurar el resultado1, y para diferenciar infecciones latentes de los casos agudos, se debe realizar un análisis paralelo con muestras de sangre.
Entre los virus que pueden causar una miocarditis, es importante diferenciar dos grupos: infecciones recién contraídas e infecciones por virus endógenos que presentan reactivaciones posteriores.
Los enterovirus y los adenovirus forman parte del primero de estos grupos. Son causas demostradas de miocarditis aguda y se puede detectarlos también en la MCD que se manifiesta en forma de insuficiencia cardiaca crónica36. Como ya se ha indicado, la lesión miocárdica se produce por la infección directa del miocardiocito o por la inmunidad antiviral. Después de la infección aguda, el 60-70% de los pacientes presentan una recuperación completa, sin que queden lesiones residuales debido a una inmunidad eficiente que es capaz de eliminar el virus. Así pues, una biopsia durante el seguimiento mostrará curación de la miocarditis. Sin embargo, si la lesión inicial es ya sustancial, con pérdida importante de tejido contráctil y remodelado, los pacientes no se recuperan por completo aunque se elimine el virus o desaparezca la inflamación.
Diversos estudios han evaluado el efecto de la persistencia de genoma enteroviral.
Si bien es cierto que el efecto de la persistencia viral en la evolución clínica no está claro con otras especies de virus (PVB19 o VHH-6), la mortalidad es mayor entre los pacientes que no han eliminado el enterovirus. Whyet al37 observaron una mortalidad del 25% a los 25 meses entre los pacientes con miocarditis/MCD e infección enteroviral persistente, a diferencia de la mortalidad del 4% observada en pacientes negativos para enterovirus. Más recientemente se han publicado datos similares, con una mortalidad de hasta un 41% de los pacientes con persistencia del genoma enteroviral después de 5 años de seguimiento38.
Por lo que respecta a las infecciones por PVB19 y VHH-6, las entidades clínicas más frecuentes son las infecciones virales latentes persistentes con episodios de reactivación22. El PVB19 es causa de una enfermedad aguda común durante la infancia y se observa con muy poca frecuencia en los adultos. Básicamente, las células infectadas se limitan a las células progenitoras eritroides de la médula ósea, pero el receptor principal del eritrovirus está presente también en las células endoteliales, incluidas las del corazón. Aunque se ha localizado excepcionalmente en vénulas o arteriolas durante la miocarditis fulminante en niños39, en la mayoría de los casos la infección es latente y asintomática. Recientemente se ha descrito que alrededor del 30% de las muestras de BEM positivas para PVB19 contienen ARN mensajero (ARNm), lo cual puede indicar una reactivación del virus10. En este contexto, se ha observado que la expresión génica cardiaca está alterada. Por ejemplo, los genes que intervienen en la respuesta inflamatoria (factor de necrosis tumoral alfa, receptor huérfano relacionado C) o en el metabolismo energético mitocondrial (ciclooxigenasa-1) presentan una desregulación en los pacientes con ARN mensajero positivo, en comparación con los que tienen tan solo ADN40. Sin embargo, el efecto que tiene la persistencia del ADN de PVB19 en la evolución clínica no está claro todavía, puesto que las series de casos en las que este virus fue el de mayor prevalencia no mostraron mayor riesgo de muerte ni mayor tasa de trasplantes35. Además, la disfunción sistólica no se ha relacionado claramente con la presencia del PVB19 pero, de un grupo de 37 pacientes con disfunción diastólica inexplicada, el 84% fue positivo para PVB19 en la BEM, lo cual indica una relación con la disfunción endotelial causada por el virus41.
El VHH-6A y el VHH-6B generalmente también causan infecciones agudas durante la infancia y, como el PVB19, persiste de forma latente en más del 70% de los adultos. Aunque el VHH-6 es principalmente un virus linfotrópico, también puede infectar tanto células endoteliales como miocardiocitos. Además, su genoma puede integrarse en los cromosomas humanos y transmitirse a través de la línea germinal42. De manera similar a lo que ocurre con el PVB19, el VHH-6 puede presentar una reactivación que cause síntomas de insuficiencia cardiaca, y un estudio reciente indica que la persistencia del VHH-6 podría conducir a un empeoramiento de la FEVI y su eliminación, a una mejoría43.
Con independencia de cuál sea la etiología viral inicial, si se lleva a cabo una biopsia cuando el paciente se encuentra ya en fase crónica, sin signos de una infección viral previa ni de inflamación persistente, el diagnóstico será MCD idiopática22. Otros escenarios clínicos son los de la infección persistente por un virus lítico sin inflamación (cardiopatía viral crónica) o los mecanismos autoinmunitarios persistentes a pesar de que el virus haya sido eliminado (miocardiopatía inflamatoria). Cuando persisten tanto la inflamación como la infección viral, el diagnóstico es de miocardiopatía viral crónica8. Todas estas entidades clínicas se resumen en la figura 2.
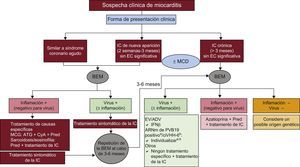
TRATAMIENTO DE LA MIOCARDITIS Y LA MIOCARDIOPATÍA INFLAMATORIAIndependientemente de cuál sea su etiología, el tratamiento básico de la miocarditis es el abordaje óptimo de la insuficiencia cardiaca y las arritmias según lo establecido en las guías basadas en la evidencia44. El uso de tratamientos específicos y no convencionales está en función de los resultados de la BEM, teniendo en cuenta los síntomas del paciente y el curso de la enfermedad33,34,45 (figura 3).
Tratamiento de la miocarditis según el contexto clínico y los resultados de la biopsia endomiocárdica. ADV: adenovirus; ARNm: ARN mensajero; ATG: antitimoglobulina; BEM: biopsia endomiocárdica; ciVHH-6: virus del herpes humano tipo 6 integrado en cromosoma; CyA: ciclosporina; EC: enfermedad coronaria; EV: enterovirus; IC: insuficiencia cardiaca; IFNβ: interferón beta; MCD: miocardiopatía dilatada; MCG: miocarditis de células gigantes; Pred: prednisona; PVB19: parvovirus B19. aPara pacientes sintomáticos, considere emplear interferón beta u otras posibles opciones en estudio, como la telbivudina (véase el texto). bPara pacientes sintomáticos pese al tratamiento óptimo de la insuficiencia cardiaca, considere emplear ganciclovir o valganciclovir (véase el texto).
Se debe tratar a los pacientes hemodinámicamente inestables en unidades de cuidados intensivos con monitorización invasiva y un equipo de profesionales bien formados en la realización de cateterismos cardiacos y BEM. Para los pacientes que presentan deterioro progresivo de la función ventricular a pesar del tratamiento convencional, la BEM es esencial para diagnosticar causas potencialmente tratables como la miocarditis de células gigantes o la miocarditis eosinofílica. Sin embargo, dado que las lesiones miocárdicas pueden progresar rápidamente y llegar a ser irreversibles, en ocasiones es necesario un dispositivo de asistencia mecánica ventricular u oxigenador de membrana extracorpóreo como puente al trasplante de corazón o la recuperación1.
Se debe tratar a los pacientes estables con disfunción ventricular sistólica con diuréticos, inhibidores del sistema renina-angiotensina-aldosterona y bloqueadores beta. El momento concreto en que se debe retirar estos fármacos tras la recuperación de la FEVI no está bien definido46. Por lo que respecta a los fármacos antiinflamatorios no esteroideos, no se recomienda su empleo debido a un aumento de la mortalidad en los modelos de miocarditis en animales de experimentación, a pesar de que se aplican ampliamente en el tratamiento de la pericarditis. El desfibrilador automático implantable se recomienda solo si los síntomas y la disfunción cardiaca sistólica persisten después de la fase aguda. Mientras tanto, cuando se dé de alta a un paciente después de una miocarditis aguda con FEVI baja, los desfibriladores portátiles (LifeVest®) pueden proporcionar una protección como puente el eventual implante de desfibrilador automático implantable.
Tratamientos específicos durante la fase agudaLa miocarditis viral aguda confirmada mediante biopsia mejora espontáneamente en más del 60% de los pacientes que reciben un tratamiento convencional para la insuficiencia cardiaca. Por lo tanto, Para estos pacientes suele bastar un seguimiento estrecho8. De hecho, la inflamación cardiaca inicial facilita la eliminación del virus lo antes posible para prevenir que se produzcan lesiones miocárdicas irreversibles, y el tratamiento antiinflamatorio o inmunosupresor puede favorecer la persistencia del virus y, consecuentemente, empeorar la situación clínica del paciente47. Sin embargo, todavía no se ha estudiado bien si la presencia de marcadores específicos como la perforina tiene influencia en el pronóstico de la miocarditis aguda. Por lo tanto, aún no se sabe si estos pacientes pueden beneficiarse de un tratamiento específico temprano.
En cambio, en otras entidades clínicas sí se obtiene un efecto beneficioso importante con los tratamientos específicos durante la fase aguda. Existen estudios que han demostrado que, en el caso de la miocarditis de células gigantes, el tratamiento combinado con antitimoglobulina, ciclosporina (concentración valle de 100-120 μg/ml) y cortisona mejora la supervivencia34 (tabla 2, pautas de tratamiento).
Opciones terapéuticas actuales para la miocarditis de células gigantes aguda y la miocardiopatía inflamatoria autoinmunitaria
| Miocarditis de células gigantes (Cooper et al33,34) |
| Antitimoglobulina |
| 275mg en 500 ml de solución salina al 0,9% durante 12/24 h |
| Días 1 a 5 |
| Con monitorización cardiaca |
| Ciclosporina |
| Dosis inicial de 200 mg/24 h (100 mg/12 h) |
| Objetivo de concentración valle: 100-120 μg/ml |
| 1 año |
| Metilprednisolona |
| Dosis inicial: 1 mg/kg |
| Después de 4 semanas: reducir la dosis 10 mg y luego otros 10 mg cada 2 semanas hasta llegar a la dosis de mantenimiento de 5-10 mg |
| 1 año |
| Sarcoidosis cardiaca |
| Metilprednisolona |
| Dosis inicial: 1 mg/kg |
| Después de 4 semanas: reducir la dosis 10 mg y luego otros 10 mg cada 2 semanas hasta llegar a la dosis de mantenimiento de 5-10 mg |
| 6 meses |
| Miocarditis crónica/autoinmunitaria (miocardiopatía inflamatoria), miocarditis eosinofílica (Frustaci et al45) |
| Azatioprina |
| 50 mg/12 h durante 6 meses |
| Control analítico semanal con hemograma/enzimas hepáticas durante el primer mes |
| Considere otras alternativas si hay < 3.000 leucocitos o < 1.000 linfocitos |
| Metilprednisolona |
| Dosis inicial: 1 mg/kg |
| Después de 4 semanas: reducir la dosis 10 mg y luego otros 10 mg cada 3 semanas hasta llegar a la dosis de mantenimiento de 5-10 mg |
| 6 meses |
| Tratamiento acompañante en todos los casos: pantoprazol/omeprazol 20 mg/24 h, calcio 1 g/24 h |
Otro ejemplo es el síndrome de hipereosinofilia, o enfermedad de Loeffler, que se desarrolla generalmente en tres fases. En la fase aguda, se produce una infiltración de eosinófilos maduros que dañan el miocardio y se evidencia hipereosinofilia en sangre periférica. Luego se observa afección valvular y obliteración apical, y la fase final consiste en fibrosis endomiocárdica48. Durante la fase aguda, en la que no hay una fibrosis irreversible amplia, se puede usar fármacos antihelmínticos o antiprotozoarios para la forma tropical de la enfermedad. En todos los demás escenarios clínicos, se recomienda el uso de inmunosupresión. La pauta de tratamiento más frecuente es la de cortisona y azatioprina, con reducción de la cortisona cada 2 semanas en 10 mg respecto a la dosis inicial de 1 mg/kg hasta llegar a una dosis de mantenimiento de 10 mg que se mantiene durante 6 meses. Otras opciones terapéuticas de las que se ha demostrado cierto efecto beneficioso en esta entidad son el interferón (IFN) o los inhibidores de la tirosincinasa (imatinib)49. Por último, a veces se observa miocarditis granulomatosa aguda en pacientes con sarcoidosis cardiaca o artritis reumatoide. La prednisona sola es una buena opción en estos casos, con una dosis inicial de 1 mg/kg, aunque se puede añadir otros fármacos inmunosupresores como la azatioprina (tabla 2). Está justificado un tratamiento prolongado, de al menos 6 meses.
Tratamientos específicos en las miocardiopatías inflamatorias crónicasAutoinmunitaria/negativa para virusEn algunos pacientes, la inflamación persiste a pesar de la eliminación del virus, según se demuestra en la BEM de seguimiento obtenida 6 meses después del inicio de la enfermedad. En estos casos, el proceso inflamatorio se debe a un estado posinfeccioso o a la autoinmunidad. Algunos ensayos aleatorizados han puesto de manifiesto que, en estos pacientes, el tratamiento inmunosupresor añadido al tratamiento convencional es superior al tratamiento convencional solo por lo que respecta a la mejora de la FEVI y la clase funcional de la New York Heart Association (NYHA)45. En el TIMIC se estudió a pacientes con miocarditis crónica negativos para virus que tenían FEVI < 45% y habían recibido un tratamiento convencional para la insuficiencia cardiaca durante un mínimo de 6 meses, y asignándolos aleatoriamente a placebo o una terapia combinada con cortisona y azatioprina45. La FEVI mejoró en el 89% de los pacientes del grupo de tratamiento y en ninguno de los del grupo de placebo. Además, en un estudio previo se había observado que solo los pacientes sin genoma viral mejoraban con la inmunosupresión47.
Dado que se han detectado autoanticuerpos circulantes en pacientes con MCD, su presencia se podría utilizar como marcador de la autoinmunidad en la miocarditis clínica y la confirmada mediante biopsia50. Basándose en ello, la inmunoadsorción podría ser una opción de tratamiento en el futuro. Un pequeño número de estudios aleatorizados han demostrado que este tratamiento mejora la FEVI51, y algunos de ellos han respaldado el papel de marcadores específicos, como los anticuerpos para el receptor adrenérgico β-1, cuya eliminación mediante inmunoadsorción conduce a una supervivencia libre de trasplante cardiaco más larga51. Sin embargo, serán necesarias investigaciones más amplias y actualmente la inmunoadsorción aún es un tratamiento experimental.
Miocardiopatía viralComo ya se ha indicado, algunos virus infectan directamente los miocardiocitos, como en el caso de los enterovirus o los adenovirus, mientras que otros, como el PVB19 o el VHH-6, dañan las células endoteliales. En consecuencia, las pautas de tratamiento y la respuesta difieren en función de la especie de que se trate.
En los pacientes con miocardiopatía crónica enteroviral o adenoviral, la eliminación del virus con un tratamiento de 6 meses con IFNβ se acompañó de una mejora de la FEVI y una disminución significativa de las dimensiones ventriculares en un ensayo no aleatorizado52. Después de un seguimiento de 5 años, el 92% de los pacientes que eliminaron el virus continuaban con vida, en comparación con tan solo el 69% de los pacientes con infección persistente38.
Además, se observó que los pacientes en que la eliminación del virus se produjo espontáneamente presentaban cifras de IFNβ endógeno superiores que los pacientes con persistencia del virus. Así pues, estos resultados respaldan la eficacia del tratamiento con IFNβ.
En los pacientes infectados por el PVB19, es muy importante diferenciar entre la infección latente (con ADN positivo solamente) y las reactivaciones virales (en las que hay también ARN mensajero positivo). De hecho, en un estudio se observó que el ARN mensajero del B19V estaba presente solo en las muestras de biopsia miocárdica de pacientes con inflamación, mientras que no lo había en los pacientes positivos para el ADN del B19V que no presentaban inflamación53. En cuanto a las pautas de tratamiento específicas, el IFNβ no es capaz de eliminar el virus en este caso. Sin embargo, un trabajo observó que la disfunción endotelial y los síntomas secundarios mejoraban con el empleo de dosis altas de IFNβ, lo cual indica que este tratamiento podría inhibir la reactivación del PVB19 y mejorar la viabilidad del endotelio54. Otras posibles opciones de tratamiento se encuentran aún en fase de estudio. Por ejemplo, la telbivudina, un análogo de la timidina, inhibe la replicación del virus in vitro y, en un ensayo piloto realizado en 8 pacientes sintomáticos y positivos para PVB19, un tratamiento de 6 meses con este fármaco silenció la actividad transcripcional en 7 de los 8 pacientes y mejoró los síntomas en las primeras semanas de administración.
El IFNβ tampoco elimina el VHH-6, pero un estudio reciente ha observado una disminución de la reactivación del VHH-6 después de un tratamiento de 6 meses con valganciclovir en pacientes sintomáticos con un VHH-6 integrado al cromosoma reactivado (positivos para ARN mensajero) con síntomas de insuficiencia cardiaca no explicada. También los síntomas mejoraron con el tratamiento55. Por el momento, parece que solo los pacientes con un VHH-6 integrado al cromosoma obtienen un efecto beneficioso del tratamiento antiviral, pero este debe usarse como opción alternativa para pacientes con síntomas persistentes a pesar del tratamiento convencional.
En la tabla 3 se resumen las dosis específicas y los tratamientos para cada uno de los virus.
Opciones actuales para el tratamiento de las miocardiopatías virales
| Miocardiopatía enteroviral/adenoviral (Kuhl et al38) |
| Interferón beta |
| 4 millones de unidades por vía subcutánea cada 48 h la primera semana |
| 8 millones de unidades por vía subcutánea cada 48 h durante 6 meses a partir de la segunda semana |
| Seguimiento con análisis de laboratorio 2 semanas después del inicio (con determinación de Cr, enzimas hepáticas, hemograma, TSH/T3/T4, cTnT/cTnI, CK/CK-MB), y luego una vez al mes |
| Se interrumpe el tratamiento si: < 100.000 plaquetas o < 2.000 leucocitos |
| Miocardiopatía por PVB19 con ARN mensajero positivo (Bock et al53, Schmidt-Lucke et al54) |
| Interferón beta |
| 4 millones de unidades por vía subcutánea cada 48 h la primera semana |
| 8 millones de unidades por vía subcutánea cada 48 h durante 6 meses a partir de la segunda semana |
| Otras posibles opciones terapéuticas en estudio: telbivudina |
| Reactivaciones de VHH-6 sintomáticas (Pellett et al42, Escher et al43) |
| Ganciclovir 1.000 mg/24 h por vía intravenosa 5 días |
| A continuación: valganciclovir 900 mg/24 h o 1.800 mg/24 h |
| • Durante 6 meses |
| • Seguimiento con análisis de laboratorio 2 semanas después del inicio (con determinación de Cr, enzimas hepáticas y hemograma) y luego una vez al mes |
| • Se interrumpe el tratamiento si: neutropenia, anemia o hepatitis |
Cr: creatinina; CK: creatincinasa; CK-MB: isoenzima MB de la creatincinasa; cTnI: troponina cardiaca I; cTnT: troponina cardiaca T; PVB19: parvovirus B19; T3: triyodotironina; T4: tiroxina; TSH: tirotropina; VHH-6: virus del herpes humano tipo 6.
Se han utilizado inmunoglobulinas intravenosas en dosis altas para la insuficiencia cardiaca sintomática crónica de diferentes etiologías, y ello se ha asociado a una mejora de la FEVI56, pero en un importante ensayo controlado no se observó efecto beneficioso en la MCD de inicio reciente57. La ausencia de mejoría probablemente se haya debido a que solo un 16% de los pacientes presentaban inflamación en la BEM y no se realizaron análisis de genomas virales. Sin embargo, actualmente no hay recomendaciones específicas para el uso de inmunoglobulinas intravenosas en la miocarditis1.
CONCLUSIONESLa miocarditis es una enfermedad inflamatoria cardiaca que se produce principalmente por infecciones virales o procesos autoinmunitarios. A pesar de los avances que se han producido en las pruebas diagnósticas no invasivas, especialmente en el campo de la RMC, la BEM continúa siendo el patrón de referencia como técnica diagnóstica estándar para la miocarditis y la miocardiopatía inflamatoria. Después de una miocarditis aguda, el proceso inflamatorio se resuelve espontáneamente en la mayoría de los pacientes después de 1-4 meses. Sin embargo, a veces la respuesta inmunitaria no logra eliminar el agente infeccioso y el proceso inflamatorio no se resuelve, con lo que se produce un daño en el miocardio. En esta situación, la BEM permite esclarecer la causa de la enfermedad y se puede iniciar tratamientos específicos, además del tratamiento estándar para la insuficiencia cardiaca, si la lesión miocárdica no es irreversible aún. En otros trastornos, como la miocarditis de células gigantes o la sarcoidosis cardiaca, se puede obtener un efecto beneficioso con el tratamiento durante la fase aguda y, por consiguiente, la BEM desempeña un papel importante tanto en el contexto agudo como en el crónico. A pesar de los resultados prometedores obtenidos con el tratamiento inmunosupresor o antiviral en situaciones clínicas específicas según los datos publicados, serán necesarios estudios aleatorizados más amplios para detectar el efecto de estos tratamientos en variables de valoración clínicas sólidas como el trasplante cardiaco o la mortalidad.
CONFLICTO DE INTERESESNinguno.