Recientemente se ha introducido un nuevo catéter-balón láser para el aislamiento eléctrico venoso pulmonar que permite la visualización del tejido auricular. El objetivo del presente trabajo es evaluar la seguridad y la eficacia a medio plazo de este catéter en el tratamiento de la fibrilación auricular.
MétodosSe realizó ablación con catéter-balón láser a 71 pacientes con fibrilación auricular paroxística (80%) y persistente (20%). Se consideró recurrencia arrítmica los episodios de duración > 30 s. Durante el seguimiento se realizaron visitas periódicas cada 3 meses con Holter 24-48 h.
ResultadosSe logró aislar 275 de 278 (99%) de las venas pulmonares. Los tiempos medios de procedimiento y de fluoroscopia fueron 154 ± 25 y 34 ± 15min respectivamente. Un 89% de las venas se aislaron en el primer intento. La complicación más frecuente fue la parálisis del nervio frénico (5,6%), que apareció solo en los primeros 18 casos. Se siguió a 59 pacientes durante una media de 420 ± 193 días, con una tasa de recurrencia arrítmica del 12 y el 30% respectivamente en fibrilación auricular paroxística y persistente (p = 0,155).
ConclusionesEl catéter-balón láser es un sistema seguro y efectivo para lograr el aislamiento eléctrico de las venas pulmonares. Entre sus ventajas destaca la capacidad de adaptarse a la anatomía venosa pulmonar con un único catéter y la eficacia con que logra el aislamiento eléctrico de las venas pulmonares, con una evolución clínica favorable a medio plazo, incluso para los pacientes con fibrilación auricular persistente.
Palabras clave
La ablación de la fibrilación auricular (FA) es el tratamiento recomendado para pacientes con FA paroxística y persistente que siguen sintomáticos pese al tratamiento farmacológico antiarrítmico1,2.
El objetivo principal en la ablación de la FA es lograr el aislamiento eléctrico completo de las venas pulmonares (VP)3. El procedimiento habitual para lograr este objetivo es la ablación punto a punto alrededor del ostium de las VP mediante radiofrecuencia, empleando catéteres de punta irrigada y con el apoyo de sistemas de navegación electroanatómica. Sin embargo, este procedimiento es complejo, consume mucho tiempo, exige una larga curva de aprendizaje y sus resultados son muy dependientes del operador. Estas limitaciones han motivado el desarrollo de catéteres especialmente diseñados para lograr el aislamiento eléctrico de las VP mediante otras fuentes de energía4,5. La crioablación con catéter-balón es la técnica alternativa a la radiofrecuencia que se emplea en más centros y sobre la que existe mayor experiencia clínica y evidencia científica. Actualmente, la ablación punto a punto con radiofrecuencia y la crioablación son los dos métodos más frecuentemente empleados para la ablación de la FA3.
En los últimos años se ha añadido al arsenal terapéutico un nuevo sistema de ablación que emplea la energía láser como fuente de ablación6–9. El catéter, que incorpora un balón adaptable, es el primer sistema que permite la visualización directa de la aurícula izquierda y de las VP para dirigir la ablación. Los primeros resultados clínicos muestran un buen perfil de seguridad y eficacia, así como una mayor durabilidad del aislamiento venoso pulmonar8,9.
El objetivo del presente trabajo es mostrar la experiencia en el centro, valorando la eficacia y la seguridad de este catéter láser en una serie de pacientes remitidos al hospital para ablación de FA paroxística y persistente, así como describir los resultados clínicos obtenidos durante un seguimiento medio de 1 año.
MÉTODOSPacientesEl sistema de ablación con catéter láser balón estuvo disponible para su utilización en el hospital en febrero de 2013. A partir de esta fecha, se seleccionó a los pacientes remitidos para ablación de FA alternativamente a tratamiento mediante ablación con radiofrecuencia o ablación con láser si cumplían alguno de los siguientes criterios: a) pacientes con FA paroxística sintomática y refractaria al menos a un fármaco antiarrítmico, y b) a partir de septiembre de 2013, pacientes con FA persistente de evolución < 1 año, sintomática y refractaria al menos a un fármaco antiarrítmico.
Se excluyó a los pacientes con alguna de las siguientes características: a) fracción de eyección del ventrículo izquierdo (FEVI) < 50%; b) edad < 18 años o > 75 años; c) cardiopatía estructural significativa concomitante, y d) diámetro de la aurícula izquierda > 50 mm. El estudio muestra los resultados obtenidos en 71 pacientes con FA tratados mediante ablación con catéter láser de un total de 137 pacientes remitidos para ablación de FA.
Descripción del catéter-balón láserEl sistema de ablación (CardioFocus, Inc.; Malborough, Maryland, Estados Unidos) incluye los siguientes componentes: vaina deflectable (diámetros interno y externo, 12 y 15 Fr), catéter-balón con diámetro adaptable, endoscopio y consola.
En el extremo distal del balón, se sitúa una punta blanda y atraumática que facilita la inserción del catéter-balón en cada VP y reducir el riesgo de lesión traumática. El diámetro del balón es adaptable y puede inflarse progresivamente hasta alcanzar un máximo de 38 mm con el objetivo de maximizar el contacto entre el balón y el antro venoso pulmonar. El eje del catéter contiene varias luces: para el D2O circulante que enfría el balón, para un endoscopio de 2 Fr que ofrece una visión en tiempo real de la superficie externa del balón y para una fibra óptica que se usa para generar un arco movible de luz que abarca 30°. La energía láser (láser diodo de 980 nm) se administra a través de la misma fibra óptica. La visión endoscópica está parcialmente obstruida en la zona situada detrás del eje central del balón. Esto obliga, una vez completada la ablación en el tejido visible alrededor de la VP, a rotar el balón para poder completar la circunferencia de ablación.
La consola controla varios parámetros, entre los que destaca la energía administrada (entre 5,5 y 12 W), el tiempo de aplicación (20 o 30 s) y el diámetro del balón. La consola presenta dos imágenes: la imagen en tiempo real y la que muestra simultáneamente la aplicación previa y la actual para asegurar la continuidad de la línea de ablación.
Procedimiento de ablaciónDos operadores (J. Osca y O. Cano) realizaron simultáneamente todos los casos. En todos los casos se canalizó el seno coronario con un catéter decapolar (referencia para la punción transeptal y estimulación diafragmática derecha) y se empleó un termómetro esofágico (SensiThermTM, St. Jude Medical; Minnesota, Estados Unidos). Se realizó doble punción transeptal mediante la técnica modificada de Brockenbrough empleando dos vainas de 8,5 Fr (SL1; St. Jude Medical). A través de una de las vainas, se insertó un catéter circular decapolar para cartografiar las VP (LassoTM, Biosense Webster; Diamond Bar, California, Estados Unidos), mientras que se intercambió la vaina SL1 libre por la vaina deflectable (CardioFocus) infundida en todo momento con suero heparinizado. Tras la punción transeptal y durante el resto del procedimiento, se administró heparina para lograr un tiempo de coagulación activado > 300 s.
A continuación, se realizó una angiografía selectiva de las VP y, tras la venografía, se introdujo el catéter láser balón por la vaina deflectable dirigiéndolo a cada ostium venoso pulmonar para iniciar la ablación. El objetivo de la ablación era dirigir el haz de láser a la zona más antral posible. Cada aplicación se solapó con la aplicación precedente en un 30-50% para lograr una línea de ablación continua. La energía administrada se ajustaba según la posición anterior o posterior de la aplicación (8,5 W en pared posterior y 10–12 W en pared anterior), según la amplitud del tejido visualizado (mayor potencia a mayor amplitud de tejido) y reduciendo la potencia ante la presencia de sangre retenida o atrapada por el balón. Tras completar la ablación alrededor de cada VP se comprobó la presencia de bloqueo bidireccional venoauricular.
Ante la persistencia de conducción entre la VP y la aurícula izquierda, se realizaron aplicaciones adicionales de láser acordes con los registros obtenidos con el catéter LassoTM.
Tras confirmar la persistencia del aislamiento eléctrico de las VP en los 20 min siguientes, se finalizó el procedimiento. En ningún caso se empleó adenosina para comprobar la reconexión venoauricular.
Seguimiento posablaciónTras la ablación, se siguió a los pacientes en la consulta de arritmias cada 3 meses. La información obtenida durante el seguimiento incluyó un electrocardiograma y un Holter de 24–48 h en cada visita. No se consideró recurrencia a las arritmias que aparecieron en los 3 meses siguientes a la ablación (periodo ciego). Tras estos 3 meses, se retiró el tratamiento antiarrítmico y se mantuvo el tratamiento anticoagulante en función de la puntuación CHA2DS2-VASc.
La variable principal de eficacia de la ablación fue la supervivencia libre de recurrencias de FA/taquicardia auricular durante el seguimiento. Se definió la recurrencia como los episodios arrítmicos con duración > 30 s detectados en la monitorización Holter y los mostrados por un electrocardiograma convencional.
Análisis estadísticoEl análisis estadístico se llevó a cabo con SPSS 15.0. Las variables categóricas se expresan como porcentaje. Las variables continuas se expresan como media ± desviación estándar.
Las comparaciones entre variables categóricas se realizaron utilizando el test de la χ2. La comparación entre variables cuantitativas se realizó mediante el test de la t de Student y ANOVA.
El análisis de la supervivencia libre de recurrencia de FA/taquicardia auricular se realizó mediante el test de Kaplan-Meier y se empleó el log rank test para comparar las curvas de supervencia para los pacientes con FA paroxística y persistente. Se consideró significativo un valor de p < 0,05.
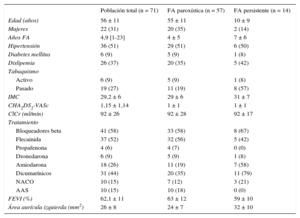
RESULTADOSCaracterísticas de los pacientesLa ablación con catéter-balón láser se realizó en 71 pacientes diagnosticados de FA paroxística (57 pacientes) o persistente (14 pacientes) y remitidos para ablación por criterio clínico entre febrero de 2013 y marzo de 2015. La media de edad de los pacientes era 56 ± 11 años (el 31% mujeres), y todos ellos habían sido tratados sin éxito con al menos un fármaco antiarrítmico. El resto de las características de la muestra se recogen en la tabla 1. Un 6% presentaba antecedentes de aleteo auricular típico (ablación previa del istmo cavotricuspídeo) y 1 paciente (1,4%) había sido sometido a un procedimiento previo de ablación de FA mediante radiofrecuencia.
Características de la población
| Población total (n = 71) | FA paroxística (n = 57) | FA persistente (n = 14) | |
|---|---|---|---|
| Edad (años) | 56 ± 11 | 55 ± 11 | 10 ± 9 |
| Mujeres | 22 (31) | 20 (35) | 2 (14) |
| Años FA | 4,9 [1-23] | 4 ± 5 | 7 ± 6 |
| Hipertensión | 36 (51) | 29 (51) | 6 (50) |
| Diabetes mellitus | 6 (9) | 5 (9) | 1 (8) |
| Dislipemia | 26 (37) | 20 (35) | 5 (42) |
| Tabaquismo | |||
| Activo | 6 (9) | 5 (9) | 1 (8) |
| Pasado | 19 (27) | 11 (19) | 8 (57) |
| IMC | 29,2 ± 6 | 29 ± 6 | 31 ± 7 |
| CHA2DS2-VASc | 1,15 ± 1,14 | 1 ± 1 | 1 ± 1 |
| ClCr (ml/min) | 92 ± 26 | 92 ± 28 | 92 ± 17 |
| Tratamiento | |||
| Bloqueadores beta | 41 (58) | 33 (58) | 8 (67) |
| Flecainida | 37 (52) | 32 (56) | 5 (42) |
| Propafenona | 4 (6) | 4 (7) | 0 (0) |
| Dronedarona | 6 (9) | 5 (9) | 1 (8) |
| Amiodarona | 18 (26) | 11 (19) | 7 (58) |
| Dicumarínicos | 31 (44) | 20 (35) | 11 (79) |
| NACO | 10 (15) | 7 (12) | 3 (21) |
| AAS | 10 (15) | 10 (18) | 0 (0) |
| FEVI (%) | 62,1 ± 11 | 63 ± 12 | 59 ± 10 |
| Área aurícula izquierda (mm2) | 26 ± 8 | 24 ± 7 | 32 ± 10 |
AAS: ácido acetilsalicílico; CHA2DS2-VASc: insuficiencia cardiaca congestiva, hipertensión, edad ≥ 75 (doble), diabetes, ictus (doble), enfermedad vascular y categoría de sexo (mujeres); ClCr: aclaramiento de creatinina; FA: fibrilación auricular; FEVI: fracción de eyección del ventrículo izquierdo; IMC: índice de masa corporal; NACO: nuevos anticoagulantes orales.
Los valores expresan n (%), media ± desviación estándar o media [intervalo].
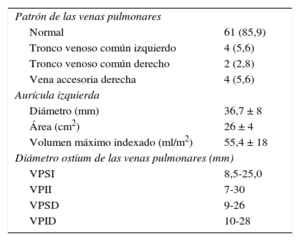
El patrón de VP se valoró mediante resonancia magnética en el 78% de los casos y en todos los pacientes mediante angiografía durante el propio procedimiento de ablación (tabla 2). Este mostró una disposición convencional en el 85,9% de los pacientes, un tronco común izquierdo en el 5,6%, un tronco común derecho en el 2,8% y otro patrón (vena accesoria derecha) en el 5,6% de los casos.
Anatomía venosa
| Patrón de las venas pulmonares | |
| Normal | 61 (85,9) |
| Tronco venoso común izquierdo | 4 (5,6) |
| Tronco venoso común derecho | 2 (2,8) |
| Vena accesoria derecha | 4 (5,6) |
| Aurícula izquierda | |
| Diámetro (mm) | 36,7 ± 8 |
| Área (cm2) | 26 ± 4 |
| Volumen máximo indexado (ml/m2) | 55,4 ± 18 |
| Diámetro ostium de las venas pulmonares (mm) | |
| VPSI | 8,5-25,0 |
| VPII | 7-30 |
| VPSD | 9-26 |
| VPID | 10-28 |
VPID: vena pulmonar inferior derecha; VPII: vena pulmonar inferior izquierda; VPSD: vena pulmonar superior derecha; VPSI: vena pulmonar superior izquierda.
Los valores expresan n (%), media ± desviación estándar o intervalos.
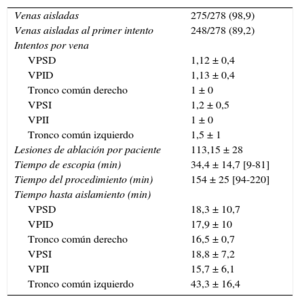
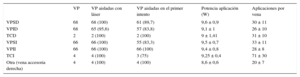
Los datos del procedimiento se recogen en las tablas 3 y 4. La duración media del procedimiento (de introducción a extracción de catéteres) fue de 154 ± 25min, con un tiempo medio de fluoroscopia de 34,4 ± 14min. Se consiguió aislar 275 de 278 VP (98,9%) y en el 96% de los pacientes se consiguió el aislamiento de todas las venas. Las venas aisladas fueron el 100% del total de venas, excepto las VP inferiores derechas, de las que se aisló el 95,6% (65 de 68). Se logró el aislamiento efectivo en todos los casos de tronco venoso común tanto derecho como izquierdo. En el 89,2% de las VP, se logró su aislamiento eléctrico tras completar la primera línea de ablación. En el 10,8% restante fueron necesarias aplicaciones adicionales. El tiempo medio empleado en el aislamiento de cada vena, considerado como el tiempo transcurrido desde la introducción del catéter-balón hasta conseguir el aislamiento de la vena en cuestión, osciló entre 16 y 19 min por vena. El tronco común izquierdo fue la estructura venosa que requirió mayor número de aplicaciones y más tiempo de ablación para lograr su aislamiento. La potencia media empleada y el número medio de lesiones necesarias para el aislamiento de cada vena se recogen en la tabla 4.
Datos de la ablación (n = 70)
| Venas aisladas | 275/278 (98,9) |
| Venas aisladas al primer intento | 248/278 (89,2) |
| Intentos por vena | |
| VPSD | 1,12 ± 0,4 |
| VPID | 1,13 ± 0,4 |
| Tronco común derecho | 1 ± 0 |
| VPSI | 1,2 ± 0,5 |
| VPII | 1 ± 0 |
| Tronco común izquierdo | 1,5 ± 1 |
| Lesiones de ablación por paciente | 113,15 ± 28 |
| Tiempo de escopia (min) | 34,4 ± 14,7 [9-81] |
| Tiempo del procedimiento (min) | 154 ± 25 [94-220] |
| Tiempo hasta aislamiento (min) | |
| VPSD | 18,3 ± 10,7 |
| VPID | 17,9 ± 10 |
| Tronco común derecho | 16,5 ± 0,7 |
| VPSI | 18,8 ± 7,2 |
| VPII | 15,7 ± 6,1 |
| Tronco común izquierdo | 43,3 ± 16,4 |
VPID: vena pulmonar inferior derecha; VPII: vena pulmonar inferior izquierda; VPSD: vena pulmonar superior derecha; VPSI: vena pulmonar superior izquierda.
Los valores expresan n/N (%) o media ± desviación estándar [intervalo].
Número y tipo de venas pulmonares aisladas (n = 278)
| VP | VP aisladas con láser | VP aisladas en el primer intento | Potencia aplicación (W) | Aplicaciones por vena | |
|---|---|---|---|---|---|
| VPSD | 68 | 68 (100) | 61 (89,7) | 9,6 ± 0,9 | 30 ± 11 |
| VPID | 68 | 65 (95,6) | 57 (83,8) | 9,1 ± 1 | 26 ± 10 |
| TCD | 2 | 2 (100) | 2 (100) | 9 ± 1,41 | 31 ± 10 |
| VPSI | 66 | 66 (100) | 55 (83,3) | 9,5 ± 0,7 | 33 ± 11 |
| VPII | 66 | 66 (100) | 66 (100) | 9,4 ± 0,8 | 28 ± 8 |
| TCI | 4 | 4 (100) | 3 (75) | 9,25 ± 0,4 | 71 ± 30 |
| Otra (vena accesoria derecha) | 4 | 4 (100) | 4 (100) | 8,6 ± 0,6 | 20 ± 7 |
TCD: tronco común derecho; TCI: tronco común izquierdo; VP: vena pulmonar; VPID: vena pulmonar inferior derecha; VPII: vena pulmonar inferior izquierda; VPSD: vena pulmonar superior derecha; VPSI: vena pulmonar superior izquierda.
Los valores expresan n (%) o media ± desviación estándar.
La curva de aprendizaje se evaluó analizando los tiempos de procedimiento cada 20 pacientes tratados (figura 1). La duración total del procedimiento y el tiempo de fluoroscopia se redujeron en torno a 10 min de media cada 20 casos realizados, diferencias que alcanzaron significación estadística en la comparación de los tiempos de fluoroscopia (p < 0,0001). La reducción de los tiempos alcanzó una fase de meseta a partir del caso 40, y permanecieron estables en torno a 145 y 25 min de tiempos de procedimiento y de fluoroscopia respectivamente.
ComplicacionesEn cuanto a las complicaciones, 3 pacientes (4,2%) presentaron hematomas femorales menores, que se resolvieron con tratamiento no invasivo, y 1 paciente (1,4%) presentó un seudoaneurisma femoral que requirió tratamiento quirúrgico; 2 pacientes (el 2,8%, casos 23 y 54) presentaron un derrame pericárdico en relación con la manipulación de la vaina de ablación: en uno, durante los intentos de ablación de la VP inferior derecha (tras completar la ablación del resto de venas), que se resolvió con pericardiocentesis, y en el otro, tras la introducción de la vaina en la aurícula izquierda y antes del inicio de la ablación. Este último requirió tratamiento quirúrgico por laceración de la base de la orejuela izquierda.
Cuatro pacientes (5,6%) presentaron una parálisis frénica derecha a la finalización del procedimiento. Estos casos aparecieron en las primeras 18 ablaciones realizadas, a partir de las cuales no se observó ninguna parálisis diafragmática adicional. Esta complicación motivó un cambio en la técnica de ablación de la VP superior derecha prestando especial atención a realizar una ablación antral y controlando la potencia a un máximo de 10 W en el segmento anterosuperior de la VP superior derecha.
No se detectó caso alguno de fístula auriculoesofágica; 6 pacientes (8,5%) presentaron elevación de la temperatura esofágica durante la aplicación del láser a la pared posterior. Este hallazgo obligó a modificar la línea de ablación (hacia el interior o el exterior de la vena) y reducir la energía de aplicación, lo cual no fue obstáculo para lograr el aislamiento de la VP en ningún caso. Finalmente, ningún paciente experimentó accidente cerebrovascular.
Resultado clínico durante el seguimientoSe siguió a los primeros 59 pacientes tratados durante una media de 420 ± 193 (intervalo, 121-753) días; en el momento del seguimiento, el 30% recibía algún tratamiento antiarrítmico. El 12% de los pacientes con FA paroxística presentaron alguna recurrencia de FA/taquicardia auricular, frente al 30% de los pacientes con FA persistente (p = 0,155). La figura 2 muestra las curvas de supervivencia libre de recurrencias de FA/taquicardia auricular para los dos grupos de pacientes (Kaplan-Meier). Los pacientes con FA paroxística mostraron mayor supervivencia libre de recurrencias arrítmicas: 21 (intervalo de confianza del 95%, 19,6-23,4) meses, frente a 12,9 (intervalo de confianza del 95%, 9,9-15,8) meses (log rank test, p = 0,20).
Curva de supervivencia libre de fibrilación auricular/taquicardia auricular (Kaplan-Meier) durante el seguimiento tras la ablación con catéter-balón láser en pacientes con fibrilación auricular paroxística y fibrilación auricular persistente (log rank test, p = 0,2). FA: fibrilación auricular; TA: taquicardia auricular.
Un paciente se trató mediante un nuevo procedimiento de ablación 4 meses tras la ablación inicial, por presentar crisis recurrentes de aleteo auricular (no evidenciadas antes de la ablación inicial). Durante el estudio se indujo un aleteo dependiente del istmo, que se ablacionó. Finalmente, se accedió a la aurícula izquierda para comprobar la reconexión eléctrica únicamente de la VP inferior izquierda. Se logró su aislamiento tras una aplicación puntual en el suelo del antro venoso. De los demás pacientes, uno estaba pendiente de repetir el procedimiento de ablación y el resto experimentó la recurrencia arrítmica sin antiarrítmicos y se encontraban estables y asintomáticos tras reintroducirlos. Siguiendo las preferencias de los pacientes, no se ha indicado un nuevo procedimiento de ablación.
Durante el seguimiento no se detectaron complicaciones adicionales a las observadas en las 24 h tras la ablación, y se constató la recuperación de la parálisis diafragmática en 3 de los 4 casos.
DISCUSIÓNEl presente trabajo muestra la experiencia en el centro con un catéter-balón diseñado para el aislamiento eléctrico de VP mediante energía láser en una serie de 71 pacientes con FA paroxística y persistente. Los principales hallazgos del estudio son: a) el catéter-balón láser muestra gran eficacia para lograr el aislamiento eléctrico de las VP; b) su diseño le permite adaptarse a la variabilidad de la anatomía venosa pulmonar con un único catéter; c) su utilización presenta una curva de aprendizaje rápida; d) la principal complicación asociada con su utilización es la parálisis frénica, con unas cifras globales de complicaciones similares a las publicadas con otros sistemas de ablación, y e) muestra buena eficacia clínica a medio plazo, con supervivencia libre de recurrencias arrítmicas > 85% en FA paroxística y > 70% en FA persistente.
Eficacia agudaEl objetivo de la ablación de la FA paroxística es el aislamiento eléctrico de las VP. En los últimos años se han publicado los resultados de diversos estudios que muestran evidencia definitiva acerca de la necesidad de lograr el bloqueo bidireccional completo de la conducción venoauricular para reducir las recurrencias de FA. Los estudios COR10 y GAP-AF11 compararon de modo similar un procedimiento de ablación con el objetivo de lograr el aislamiento completo de las VP frente a un procedimiento simplificado de ablación del que no se exigía el aislamiento completo. En ambos estudios, el más importante predictor independiente de recurrencia arrítmica fue la ausencia de aislamiento completo de todas las VP durante el procedimiento inicial de ablación.
Por otro lado, la ablación en la FA persistente está menos estandarizada y las guías recomiendan realizar una ablación de sustrato adicional al aislamiento eléctrico pulmonar3. En este contexto, el papel del catéter-balón estaría menos definido. Sin embargo, no hay evidencia clara de la superioridad de una ablación más extensa en la FA persistente. Así, los resultados del estudio STAR AF II12 cuestionan la realización de líneas de ablación o la eliminación de potenciales fragmentados y confirman que el principal objetivo de la ablación de la FA persistente, al igual que en la FA paroxística, es lograr el aislamiento eléctrico permanente de las VP. En esta línea, el catéter-balón podría tener un papel terapéutico también en la FA persistente.
El catéter de ablación láser representa una alternativa a la ablación convencional con radiofrecuencia o la crioablación. En nuestra experiencia, que incluye la curva de aprendizaje con este sistema, el catéter-balón se adaptó a la anatomía venosa de cada paciente de modo que se pudo ablacionar con éxito la gran mayoría de las venas y todos los troncos venosos. Estos resultados reflejan la capacidad del catéter-balón láser de modificar su diámetro adaptándose al calibre de cada VP, incluido los troncos venosos pulmonares y las venas de menor calibre. Estos hallazgos están en consonancia con los publicados por otros grupos. Así, en un registro multicéntrico que recoge la experiencia de los primeros 200 pacientes tratados mediante el catéter-balón láser, se logró una tasa de éxito agudo de la ablación del 98,8% de las VP9. Todos estos resultados demuestran que el catéter-balón láser es un sistema efectivo para obtener el aislamiento completo de las VP.
Tiempos de procedimientoLos tiempos medios del procedimiento de ablación y de escopia en nuestra serie fueron de 155 ± 225 y 34 ± 14 min respectivamente, valores similares a los descritos previamente para la ablación de FA mediante catéter láser7–9. Al mismo tiempo, la duración del procedimiento fue similar o incluso menor que lo publicado sobre otras técnicas de ablación de FA13,14.
Finalmente, se observa una reducción en los tiempos medios de procedimiento y de fluoroscopia en torno a 10 min cada 20 procedimientos realizados hasta alcanzar unos tiempos estables en torno a 145 y 25 min respectivamente.
SeguridadEn la presente serie, la complicación más frecuente fue la parálisis diafragmática, que afectó a 4 pacientes (5%). Sin embargo, el trastorno fue transitorio y se observó una recuperación en 3 de los 4 casos. Esta cifra es ligeramente superior a lo publicado por otros estudios que han evaluado el catéter-balón láser (incidencia entre el 2 y el 4,5%). Se observó relación con la curva de aprendizaje de la técnica, ya que todas las parálisis diafragmáticas aparecieron en los primeros 18 casos realizados.
La parálisis diafragmática es una complicación ya descrita de otros procedimientos de ablación cardiaca14,15. En el caso de la FA, es la principal complicación de la crioablación, con cifras publicadas de hasta el 10%14. Esta complicación se ha relacionado con la utilización del balón de crioablación de menor tamaño situado en el interior de la VP superior derecha, lo que se asociaría a mayor riesgo de enfriamiento de estructuras anatómicas adyacentes. Al mismo tiempo, una excesiva presión del balón contra la aurícula en la unión con la VP superior derecha podría reducir la distancia al nervio frénico16. Ambas hipótesis también pueden explicar la aparición de parálisis diafragmática durante la ablación con catéter-balón láser. Tras modificar la práctica en la ablación de la VP superior derecha, no se detectaron nuevas parálisis frénicas.
La segunda complicación en orden de frecuencia es la aparición de complicaciones vasculares, la mayoría sin consecuencias negativas. Solo 1 paciente (1,4%) requirió tratamiento quirúrgico por un seudoaneurisma femoral, con buena evolución posterior.
Como complicación más importante, 1 paciente presentó un derrame pericárdico que requirió tratamiento quirúrgico.
No se produjo ningún caso de ictus o accidente isquémico transitorio. Otros estudios con el catéter-balón láser han mostrado baja incidencia de ictus o embolia periférica. En la serie multicéntrica que incluyó a 200 pacientes, no se observó la aparición de ningún ictus, y en un estudio que comparó la crioablación con la ablación con balón láser, solo se observó un accidente isquémico transitorio con esta9,16. Estas cifras, al margen de la parálisis diafragmática, están en consonancia con lo publicado previamente, con una incidencia de complicaciones relevantes tras el procedimiento de ablación en torno al 4,0–4,5%17.
Resultados clínicos a medio plazoLa ablación con catéter láser en esta serie se asoció a una supervivencia libre de recurrencias arrítmicas durante un seguimiento medio > 1 año del 88% de los pacientes con FA paroxística y el 70% con FA persistente. En comparación con los resultados de los trabajos que evaluaron inicialmente el catéter-balón láser (alrededor del 65% de supervivencia libre de recurrencias a los 12 meses de seguimiento)8,9, se puede observar mayor eficacia a medio plazo en esta experiencia. Entre las razones que podrían justificar estos resultados tan positivos, cabría destacar la utilización sistemática de más energía en zonas con mayor riesgo de reconexión eléctrica, especialmente a nivel del ridge entre la orejuela izquierda y las VP izquierdas (aplicando entre 10 y 12 W). Además, en estudios previos con el catéter-balón láser, se identificó como una posible causa de recurrencia arrítmica la realización de una ablación excesivamente ostial. En la presente serie, y especialmente a partir de los primeros casos, se prestó especial atención a aplicar el láser en una posición proximal en el antro venoso. Tampoco se podría excluir las diferencias en las poblaciones evaluadas como causa de las diferencias encontradas. Sin embargo, los resultados generales de esta serie se obtuvieron en una población que también incluyó a pacientes con FA persistente, a los que se excluía en los estudios iniciales.
Finalmente, no se dispone de datos que indiquen la superioridad de un método de ablación sobre otro. Los resultados obtenidos con el catéter láser en esta serie son al menos tan buenos como los publicados sobre la radiofrecuencia o el balón de crioablación de segunda generación obtenidos en centros con alta experiencia. Solo existe un estudio que haya comparado la ablación con láser frente a la crioablación en pacientes con FA paroxística14. En este estudio ambas estrategias mostraron unos resultados similares con un seguimiento de 1 año. No obstante, se observó una tendencia a mayor supervivencia libre de recurrencias en el grupo tratado mediante láser, con menor incidencia de venas reconectadas cuando se realizó un segundo procedimiento de ablación.
LimitacionesEste estudio refleja la experiencia inicial obtenida con el catéter de ablación láser en un único centro, sin comparar con un grupo de control. No se realizó monitorización prolongada (Holter de 7 días o Holter insertable), por lo que no se puede descartar que se haya subestimado las recurrencias arrítmicas, especialmente por episodios asintomáticos. Por otro lado, el pequeño tamaño muestral requiere la realización de estudios de mayor tamaño, prospectivos y aleatorizados entre las diversas técnicas de ablación para poder evaluar las posibles diferencias en eficacia y los subgrupos que podrían beneficiarse de una u otra técnica.
CONCLUSIONESEl catéter-balón láser es un sistema seguro y efectivo para lograr el aislamiento eléctrico de las VP. Entre sus ventajas destacan la capacidad de adaptarse a la anatomía venosa pulmonar con un único catéter, la eficacia con que logra el aislamiento eléctrico pulmonar, el buen resultado a medio plazo en pacientes con FA paroxística, unos resultados prometedores en pacientes con FA persistente que se debe confirmar en estudios futuros y con unas cifras globales de complicaciones similares a las publicadas con otros sistemas de ablación.
CONFLICTO DE INTERESESNinguno.