Palabras clave
INTRODUCCION
El síndrome de apnea obstructiva del sueño (SAHS) se define como un cuadro de somnolencia excesiva, trastornos cognitivos-conductuales, respiratorios, cardiacos, metabólicos o inflamatorios secundarios a episodios repetidos de obstrucción de la vía aérea superior durante el sueño1. Diferentes estudios epidemiológicos llevados a cabo en Estados Unidos y Europa han puesto de manifiesto que se trata de una enfermedad con una elevada prevalencia, que afecta al 4-6% de varones y al 2-4% de las mujeres en la población adulta de edades medias2,3. Además, la prevalencia del SAHS aumenta claramente con la edad4.
Como consecuencia de las alteraciones fisiopatológicas del SAHS se originan repercusiones cardiovasculares por diversos mecanismos durante la apnea5. Además de las consecuencias de la hipoxia intermitente, la disminución de presiones intratorácicas en los intentos de inspiración fallidos durante la apnea conlleva el incremento de poscarga ventricular y, junto con ello, crisis hipertensivas debidas a la descarga catecolaminérgica6,7.
Estas alteraciones son la causa de que el SAHS se asocie no sólo con hipertensión arterial, sino con otras manifestaciones como la insuficiencia cardiaca8, los accidentes cerebrovasculares9 y la cardiopatía isquémica10, y con un incremento de las arritmias y la muerte súbita11.
Con todas estas asociaciones establecidas, parece lógico que el pronóstico del SAHS esté estrechamente relacionado con la incidencia de eventos cardiovasculares12,13. La detección de los pacientes con mal pronóstico es un problema susceptible de ser abordado precozmente.
La ecocardiografía transtorácica es una herramienta de uso cotidiano, inocua, que permite una evaluación cardiovascular tanto estructural como funcional. La mayoría de los trabajos ecocardiográficos en esta enfermedad muestra que la función cardiaca sistólica y/o diastólica del ventrículo izquierdo se recupera cuando los pacientes reciben tratamiento14.
El índice de Tei es un parámetro ecocardiográfico de fácil determinación y que permite evaluar la función ventricular, tanto sistólica como diastólica. Este índice ha demostrado su utilidad, tanto en el ventrículo izquierdo como en el derecho. No está prácticamente influido por la frecuencia cardiaca ni la precarga, por lo que no requiere normalización, y muestra una correlación con la gravedad de la clínica y la supervivencia15,16.
En este contexto nos propusimos estudiar, en una población de SAHS en el momento del diagnóstico, si hay alteraciones de parámetros ecocardiográficos, morfológicos o funcionales atribuibles al SAHS, y sus repercusiones en función de la gravedad de éste.
MÉTODOS
Pacientes
Se analizó a 110 pacientes consecutivos (edad 54 ± 13 años, varones 73,8%), remitidos entre junio de 2005 y junio de 2006 desde una consulta monográfica de neumología. Todos los pacientes fueron previamente evaluados mediante una escala que evalúa la ausencia, la presencia y la frecuencia de los síntomas fundamentales relacionados con el SAHS, aunque también se recogieron otros síntomas secundarios, como la falta de atención, la inapetencia sexual, la cefalea matutina, la enuresis, etc. Estos síntomas guía fueron: ronquidos, apneas presenciadas e hipersomnia diurna valorada mediante la escala de Epworth en su versión española validada17. También se recogieron variables antropométricas generales, como la edad, el sexo, el perímetro de cuello en centímetros y el índice de masa corporal (IMC), y comorbilidades (enfermedad cardiovascular conocida, presencia de hipertensión arterial tratada, diabetes mellitus, enfermedad cerebrovascular, tabaquismo, ingesta de alcohol y toma de sedantes). Así, consideramos que un paciente tenía una alta probabilidad de SAHS si presentaba al menos 2 de los síntomas cardinales de la enfermedad, es decir, roncopatía crónica, apneas presenciadas e hipersomnia diurna patológica (Epworth > 10 puntos).
Todos habían sido diagnosticados de SAHS mediante poligrafía respiratoria o polisomnografía convencional (realizada en 15 pacientes por poligrafía no concluyente) y eran subsidiarios de tratamiento con presión positiva continua en la vía aérea (CPAP) según las directrices vigentes1.
Inicialmente se incluyó a 110 pacientes. Fueron criterios de exclusión del estudio la falta de consentimiento por parte del paciente, recibir tratamiento con CPAP, presencia de fibrilación auricular en el estudio ecocardiográfico, bradiarritmias (< 60 lat/min) o taquiarritmias (> 100 lat/min) y la enfermedad cardiaca conocida descompensada en el momento de la inclusión. También se excluye del análisis a los pacientes con registros nocturnos considerados no válidos (menos de 5 h de registro o problemas de desconexión de los aparatos) y los casos en los que la ventana ecocardiográfica no tuvo suficiente fiabilidad. Tras aplicar estos criterios se incluyó en el estudio a 103 pacientes. Los motivos de exclusión fueron: falta de consentimiento (2 pacientes), fibrilación auricular (3 pacientes) y acceso acústico insuficiente (2 pacientes).
Se realizaron 2 grupos según el índice apnea-hipopnea (IAH); se consideró que el SAHS no era grave si el IAH < 30 (grupo 1; n = 36; 69,4% varones, 54 ± 12 años) y grave si el IAH ≥ 3018 (grupo 2; n = 67; 76,1% varones, 54 ± 13 años). A todos los pacientes se les realizó un estudio ecocardiográfico-Doppler en situación basal sin administración del tratamiento.
Equipo y método
Test de sueño
En todos los pacientes se realizó una poligrafía respiratoria con polígrafo EMBLETTA® (ResMed España), que consta de un sistema multicanal que recoge sólo variables cardiorrespiratorias, pero convenientemente validado frente a la polisomnografía convencional19. Los canales de registro utilizados fueron: flujo nasal mediante cánula con transductor de presión, saturación de O2 y frecuencia cardiaca mediante pulsioxímetro digital, ronquido, cuantificación del número de apneas según la posición del paciente mediante un sensor de posición corporal, y movimientos toracoabdominales mediante una banda toracoabdominal elástica con sensor piezoeléctrico. Todos los registros fueron revisados manualmente por el mismo neumólogo. Se consideró que había apnea obstructiva ante la ausencia o la reducción > 90% de la señal respiratoria de > 10 s de duración, en presencia de esfuerzo respiratorio detectado por las bandas toracoabdominales; apnea central ante la ausencia o la reducción > 90% de la señal respiratoria de > 10 s de duración en ausencia de esfuerzo respiratorio detectado por las bandas toracoabdominales; y apnea mixta cuando el evento respiratorio habitualmente comenzaba con un componente central y terminaba con un componente obstructivo1. Consideramos el IAH como el número de eventos respiratorios (apneas o hipopneas) acaecidos por hora de registro en cama. Se consideró que las pruebas eran válidas cuando el paciente reconocía haber dormido casi con normalidad al menos durante 3 h. Definimos la presencia de SAHS si el IAH ≥ 10 y había hipersomnia diurna patológica (Epworth > 10 puntos). Se recogieron otros parámetros del registro que evalúan la hipoxemia nocturna: SaO2 media durante la noche, SaO2 mínima alcanzada, tiempo total del registro con SaO2 < 90% (TC90) y porcentaje de apneas obstructivas. Cuando la poligrafía fue considerada negativa para el diagnóstico de SAHS pero la clínica era altamente indicativa del diagnóstico, se remitió al paciente a una unidad de sueño de referencia para la realización de una polisomnografía convencional. Para este estudio, se remitió para la realización de una ecocardiografía a los pacientes que tenían indicación de tratamiento con CPAP, establecido cuando el IAH ≥ 30, o ≥ 10 cuando hay otros condicionantes como somnolencia patológica, factores de riesgo cardiovascular o enfermedad cardiovascular conocida1.
Técnica ecocardiográfica-Doppler
El estudio se realizó con un ecocardiográfo Sonos 5500® con sonda de 2,5 MHz (Philips, Eindhoven, Holanda) y fue llevado a cabo por un único ecocardiografista. Se realizaron 3 medidas consecutivas de cada parámetro analizado y se tomó la media de las 3. Las medidas se registraron en apnea mesoespiratoria. La frecuencia cardiaca se registró durante la exploración mediante registro electrocardiográfico y se determinó una vez el paciente estaba «relajado».
Las diversas medidas de las cavidades se realizaron en modo M siguiendo las directrices establecidas20.
La función sistólica de ambos ventrículos se determinó de forma cualitativa en modo bidimensional para el derecho y mediante método de Teichholz para el izquierdo.
Los flujos transvalvulares aórtico, mitral, pulmonar y tricúspide se estudiaron mediante Doppler pulsado con el análisis de las ondas de llenado, el tiempo entre el final y el inicio de los flujos mitral y tricúspide, y el tiempo de relajación isovolumétrica del ventrículo izquierdo. El tiempo de relajación isovolumétrica del ventrículo derecho se obtuvo midiendo desde el pico de la onda R del electrocardiograma hasta el cese del flujo pulmonar, y restando este valor al tiempo entre el final y el inicio del flujo tricúspide16.
Los tiempos de contracción isovolumétrica se obtuvieron mediante sustracción de los tiempos de eyección y relajación isovolumétrica al tiempo entre el final y el inicio de flujo transvalvular auriculoventricular.
El índice de Tei se calculó mediante el cociente tiempo entre final e inicio de flujo transvalvular auriculoventricular menos el tiempo de eyección ventricular dividido por el tiempo de eyección ventricular.
Reproducibilidad
A partir de los 2 valores más extremos de las 3 medidas que se obtuvieron de cada parámetro ecocardiográfico analizado, se calculó la variabilidad intraobservador. Para las variables morfológicas fue del 1,8% (intervalo, del 1,0 [diámetro telediastólico del ventrículo izquierdo] al 4,0% [ventrículo derecho]). Para las variables Doppler del ventrículo izquierdo fue del 0,9% (intervalo, del 0,2% [velocidad máxima de la onda E] al 2,2% [tiempo de desaceleración de la onda E). Para las variables Doppler del ventrículo derecho fue del 1,2% (intervalo, del 0,68 [tiempo de eyección pulmonar] al 3,8% [tiempo de relajación isovolumétrica del ventrículo derecho]). Se obtuvo un valor de k > 0,8 en todos los casos.
Estadística
Las variables continuas se compararon mediante el test de la t de Student. Se tuvo en cuenta el test de Levene para la igualdad de varianzas. Las variables categóricas se compararon mediante el test de la χ². Se realizó un análisis de regresión logística (forward stepwise) para establecer los factores predictivos de gravedad de SAHS. Se realizó una correlación entre la gravedad del SAHS y estas variables mediante el coeficiente de correlación de Pearson. Se consideraron estadísticamente significativos los valores de p < 0,05.
RESULTADOS
Características clínicas de los pacientes
En la tabla 1 se detallan los valores absolutos y porcentuales de las variables estudiadas, tanto para la población del estudio como para cada uno de los subgrupos de SAHS establecidos en función de la gravedad.
En la comparación entre los 2 grupos encontramos una mayor presencia de tabaquismo activo, consumo de alcohol y perímetro de cuello en el grupo con SAHS grave, y las diferencias fueron estadísticamente significativas. El IMC mostró una clara tendencia a ser mayor en este grupo.
Resultados de la ecocardiografía-Doppler
Tras el análisis de todos los pacientes se obtuvieron valores normales de los diámetros ventriculares y la función sistólica de ambos ventrículos, sin diferencias estadísticamente significativas entre los grupos estudiados excepto para los parámetros funcionales, ya que los pacientes con SAHS grave presentan menores tiempos de eyección, así como índices de Tei de ambos ventrículos más elevados (tabla 2).
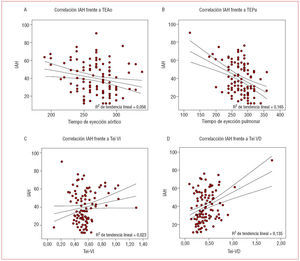
El análisis de correlación (tabla 3) mostró diferencias significativas para las variables correspondientes a los tiempos de eyección e índice de Tei del ventrículo derecho (fig. 1).
Fig. 1. Gráficas de correlación entre el índice apnea-hipopnea (IAH) (eje de ordenadas) y tiempo de eyección aórtico (TEAo) (A), tiempo de eyección pulmonar (TEPu) (B), índice de Tei del ventrículo izquierdo (Tei-VI) (C) e índice de Tei del ventrículo derecho (Tei-VD) (D).
El análisis multivariable, ajustando por hipertensión, IMC, tabaquismo y alcohol, reveló como único factor predictivo independiente de gravedad del SAHS el tiempo de eyección pulmonar (odds ratio [OR] = 0,98; intervalo de confianza [IC] del 95%, 0,97-0,99; p = 0,01).
DISCUSION
Las repercusiones cardiovasculares del SAHS son conocidas desde hace algún tiempo6-11 y parece claro que el pronóstico de la enfermedad está ligado a la incidencia de este tipo de eventos12,13. Los estudios mediante técnicas no invasivas, como la ecocardiografía-Doppler14, han permitido valorar la prevalencia de cardiopatías en estos pacientes, así como la respuesta al tratamiento con CPAP. No obstante, no se ha profundizado en el estudio de las cavidades derechas ni en el conocimiento de algún parámetro, suficientemente fiable que permita detectar precozmente las repercusiones cardiacas de estos pacientes. Éste ha sido uno de nuestros objetivos: detectar alteraciones en los parámetros ecocardiográficos, tanto morfológicos como funcionales (índice de Tei), y determinar su utilidad como indi cadores de gravedad de la repercusión cardiaca en una población de pacientes diagnosticados de SAHS que aún no han sido tratados.
Los 2 grupos analizados por gravedad de SAHS son bastante homogéneos, excepto en el consumo más elevado de tabaco y alcohol, y el mayor perímetro del cuello en el grupo más grave. Estos factores que agravan el SAHS también son factores de riesgo cardiovascular para la población general, pero en nuestra serie sólo el 2,9% de pacientes presentaba, previamente al diagnóstico de SAHS, cardiopatía isquémica, sin que hayamos encontrado una asociación de ésta con la gravedad del SAHS.
En nuestra serie, el grosor del tabique interventricular, así como de la pared posterior, estuvo en el rango de la normalidad, sin diferencias entre los 2 grupos. En algunos estudios, el grosor del tabique interventricular y de la pared posterior, así como de la masa ventricular, guardan relación con la gravedad del SAHS, sobre todo debido a la relación con el desarrollo de hipertensión arterial e hipertrofia ventricular14,21. La ausencia de diferencias en nuestra serie podría atribuirse a la distribución equitativa de la hipertensión arterial en los grupos de nuestra muestra (un 47% en cada uno), lo que no ocurre en otros estudios14,21.
No encontramos incrementos significativos del diámetro telediastólico del ventrículo derecho en la comparación intergrupos, al contrario de la serie publicada por Shivalkar et al14, con 43 pacientes con SAHS grave, en la que se objetivan diámetros significativamente mayores en ausencia de hipertensión pulmonar, correlacionándose con la gravedad del SAHS. Dado que los pacientes no presentan otra enfermedad que justifique estos hallazgos, los atribuyen tanto al aumento de retorno venoso junto con el movimiento septal hacia la izquierda22, como a la presencia transitoria de hipertensión pulmonar nocturna23. Sin embargo, estos cambios sólo se han demostrado, durante las apneas24, si hay una enfermedad pulmonar asociada25 o SAHS tan graves que presentan hipercapnia diurna26.
El estudio de la función sistólica del ventrículo izquierdo (diámetros y fracción de eyección) fue normal en los 2 grupos de pacientes. Sin embargo, al estudiar los parámetros funcionales, concretamente el índice de Tei, lo hallamos alterado en ambos grupos, tanto entre sí (con mayor afectación en el grupo de SAHS grave) como con respecto al publicado en pacientes sanos14,16. Esto podría explicarse por el menor tiempo de evolución de la enfermedad, ya que en nuestros pacientes los parámetros de llenado de ambos ventrículos tienen un predominio auricular en ambos grupos, lo que indica que hay afectación de la función diastólica, como han descrito otros autores27,28.
El índice de Tei es una medida de rendimiento miocárdico que está relacionada con la fracción de eyección, la relación de ondas E/A, el volumen sistólico, las resistencias periféricas y la masa ventricular, y es independiente de la frecuencia cardiaca y la presión arterial29. En nuestra serie, este índice está aumentado en ambos ventrículos con respecto a los valores normales publicados14,16. En el grupo de mayor gravedad de SAHS este incremento es mayor, y la diferencia con respecto al grupo menos grave es estadísticamente significativa.
Al analizar por separado los parámetros que componen este índice encontramos que su aumento se realiza a expensas de una disminución de los tiempos de eyección aórtico y pulmonar, que de nuevo muestra diferencia significativa entre ambos grupos; estos tiempos son más cortos en el grupo con mayor gravedad. A diferencia de Arias et al30, no hemos encontrado incrementos de los tiempos de relajación isovolumétrica, que también incrementaría los respectivos índices de Tei. Sin embargo, como otros autores14, en nuestro grupo de pacientes hemos encontrado una buena correlación entre estos parámetros y la gravedad del SAHS, especialmente en lo que se refiere a los del ventrículo derecho.
El análisis multivariable mostró, como única variable asociada independiente a la gravedad de SAHS, el tiempo de eyección pulmonar.
Todo esto nos hace pensar que tanto el índice de Tei derecho como el tiempo de eyección pulmonar, se podrían considerar parámetros de utilidad para valorar la función ventricular en la detección de anomalías por adaptación al estrés crónico de estos pacientes. Un ventrículo sano posee un largo período eyectivo, mientras que un ventrículo patológico se caracteriza por un acortamiento progresivo del tiempo de eyección a medida que evoluciona la enfermedad31. Esto indica que mediante estos parámetros podríamos detectar una disfunción miocárdica subclínica y distinguir entre los corazones predispuestos a desarrollar insuficiencia cardiaca y los que no32.
Este estudio tiene importantes implicaciones en la práctica clínica diaria debido a que tanto el índice de Tei como el tiempo de eyección pulmonar son parámetros de cálculo rápido y sencillo que ofrecen una orientación suficientemente fiable en la gradación de la gravedad SAHS y en el cribado de la disfunción miocárdica silente.
Nuestro estudio fue transversal, realizado en pacientes diagnosticados en una consulta monográfica de SAHS, con indicación de CPAP y remitidos de forma consecutiva para el estudio ecocardiográfico. Es una limitación no haber realizado ningún test específico para el cribado de la isquemia aunque, dada la ausencia de síntomas clínicos, la presencia de ECG no indicativos y la ausencia de alteraciones de la contractilidad segmentaria en el estudio ecocardiográfico, creemos que no es determinante. Hubiera sido deseable disponer de un grupo control, ajustado por edad, sexo e IMC, para compararlo con nuestros pacientes pero, dadas las características poblacionales que se precisarían (IMC en torno a 32 y ausencia de comorbilidad), este grupo control es difícil de obtener.
Aunque en esta serie participan más sujetos que en otras publicadas, consideramos que con un mayor número de pacientes en el grupo de menor gravedad las diferencias encontradas serían más marcadas.
CONCLUSIONES
El rendimiento miocárdico está disminuido en los pacientes afectados de SAHS. Tanto el índice de Tei (derecho e izquierdo) como los tiempos de eyección aórtico y pulmonar se encuentran alterados en esta enfermedad y se asocian con la gravedad de ésta. Un tiempo de eyección pulmonar disminuido indica una gravedad mayor de la enfermedad.
Véase editorial en págs. 569-72
Correspondencia: Dr. J.A. Moro López.
Enebro, 4, puerta 5. 46980 Paterna. Valencia. España.
Correo electrónico: moro@uv.es
Recibido el 24 de agosto de 2006.
Aceptado para su publicación el 8 de marzo de 2007.