A nivel cerebral, el amiloide-beta participa en la fisiopatología de trastornos cognitivos; en la circulación, el papel del amiloide-beta es incierto pero podría estar relacionado con procesos de inflamación estéril y senescencia. Se ha analizado la relación entre concentraciones circulantes de amiloide-beta 1-40 (Aβ40), cognición y mortalidad (global, cardiovascular y por insuficiencia cardiaca [IC]) en pacientes ambulatorios con IC.
MétodosEl Aβ40 circulante se midió en 939 pacientes consecutivos con IC. El estado cognitivo se evaluó con el cuestionario de Pfeiffer (ajustado al nivel educacional) en condiciones basales y durante el seguimiento. Se utilizaron análisis de regresión múltiple de Cox y medidas de función (discriminación, calibración y reclasificación), ajustando por riesgos competitivos para causas de muerte específicas.
ResultadosDurante 5.1 ± 2.9 años, 471 pacientes murieron: 250 de causa cardiovascular y 131 por IC. La mediana de Aβ40 circulante fue de 519,1 pg/ml [Q1-Q3: 361,8-749,9 pg/ml]. La concentración de Aβ40 correlacionó con la edad, índice de masa corporal, insuficiencia renal y clase funcional de la New York Heart Association (todas p < 0,001). No hubo diferencias en Aβ40 en pacientes con y sin trastorno cognitivo a nivel basal (p = 0,97) o durante el seguimiento (p = 0,20). En el análisis multivariado, que incluye predictores clínicos relevantes y la fracción aminoterminal del propéptido natriurético cerebral, Aβ40 permaneció asociado a mortalidad global (HR = 1,22; IC95%, 1,10-1,35; p < 0,001) y cardiovascular (HR = 1,18; IC95%, 1,03-1,36; p = 0,02), pero no con mortalidad por IC (HR = 1,13; IC95%, 0,93-1,37; p = 0,22). El Aβ40 circulante mejoró la calibración y reclasificación de los pacientes.
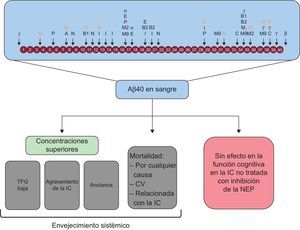
ConclusionesLas concentraciones circulantes de Aβ40 no se asocian a trastorno cognitivo en la IC. Aβ40 fue predictor de mortalidad y podría indicar envejecimiento sistémico.
Palabras clave
La insuficiencia cardiaca (IC) es una epidemia creciente que colleva una considerable carga social y económica1. En las últimas 3 décadas se han realizado avances en el tratamiento de la IC, principalmente por el mejor conocimiento de la activación neurohormonal y de su bloqueo. Actualmente, los bloqueadores beta, los inhibidores de la enzima de conversión de la angiotensina o los antagonistas del receptor de la angiotensina II y los antagonistas del receptor de mineralocorticoides son la piedra angular del tratamiento de la IC2. El tratamiento con sacubitrilo-valsartán, la incorporación más reciente al arsenal terapéutico para la IC, ha mostrado superioridad sobre el enalapril en el tratamiento de los pacientes con IC y fracción de eyección reducida3. El sacubitrilo-valsartán forma parte de una nueva clase de medicamentos de doble acción que aportan simultáneamente inhibición de la neprilisina (NEP) y bloqueo de los receptores de angiotensina.
Hay varias líneas de evidencia de que las enfermedades causadas por una inflamación «estéril» crónica asociada con la edad, como la cardiopatía y la enfermedad de Alzheimer, pueden tener vías moleculares comunes y compartir unos mismos factores de riesgo epidemiológicos, genéticos y ambientales4,5. No se ha conseguido todavía identificar de manera concluyente y hacer seguimiento de la senescencia molecular relacionada con estos procesos, pero hay diversos candidatos que podrían ser biomarcadores circulantes para este fin. Por ejemplo, la generación de amiloide beta tóxico es uno de los procesos clave en la fisiopatología de la enfermedad de Alzheimer6–8. El péptido amiloide beta 1-40 (Aβ40) se genera en el cerebro a partir de la proteína precursora de amiloide por la acción de las secretasas beta y gamma. Se ha identificado que el Aβ40 es un péptido proinflamatorio que actúa a través de varios mecanismos9. En el metabolismo normal, el Aβ40 se elimina del cerebro a través de múltiples procesos, incluida su degradación por la NEP10.
Cuando se ha relacionado las concentraciones circulantes de Aβ40 con la ateroesclerosis subclínica y la progresión de la rigidez arterial de manera independiente de otros factores de riesgo convencionales, junto con el pronóstico11, no se ha esclarecido si las concentraciones de este biomarcador proinflamatorio en el torrente circulatorio se asocian con los resultados clínicos o con el deterioro cognitivo en la IC.
En consecuencia, en este estudio se intenta evaluar el significado pronóstico del Aβ40 en una cohorte de pacientes con IC crónica ambulatorios, no tratados con inhibición de la NEP. Además, se examinan las asociaciones entre la concentración de Aβ40 en el torrente circulatorio, la función cognitiva evaluada con el cuestionario de Pfeiffer12 y los siguientes biomarcadores: NEP soluble13, supresión de la tumorigenicidad soluble 2 (ST2) y proteína C reactiva de alta sensibilidad, un biomarcador inflamatorio bien establecido.
MÉTODOSPoblación del estudioSe incluyó en el estudio a pacientes ambulatorios consecutivos tratados en una clínica de IC entre mayo de 2006 y mayo de 2013. Los criterios de inclusión para la remisión de los pacientes y la obtención de muestras de sangre se han descrito ya en otra publicación13. De forma resumida, se remitió a los pacientes a la clínica de IC desde los departamentos de cardiología o medicina interna y, en menor medida, el servicio de urgencias u otros departamentos del hospital. El criterio principal para la remisión de los pacientes fue la IC definida según la guía de la Sociedad Europea de Cardiología, con independencia de su etiología, y que hubiera habido al menos 1 hospitalización por IC. El Aβ40 y todos los demás biomarcadores se analizaron en la misma muestra de sangre, que se conservó a –80°C, sin ciclos previos de congelación-descongelación. Todas las muestras se obtuvieron entre las 9:00 y las 24:00. Todos los participantes dieron su consentimiento informado por escrito y el estudio fue aprobado por el comité de ética local. Todos los procedimientos del estudio se atuvieron a las normas éticas establecidas en la Declaración de Helsinki de 1975 y las actualizadas en 1983.
Evaluación cognitivaLa capacidad cognitiva se evaluó aplicando el cuestionario de Pfeiffer, un cuestionario breve que valora el estado mental, a 802 pacientes en la situación basal (en los 6 meses tras la toma de la muestra de sangre) y en 405 pacientes durante el seguimiento (mediana, 3,4 [2,1-6,1] años). La prueba se consideró diagnóstica de deterioro cognitivo si la puntuación era > 3. Para determinar la puntuación, se tuvo en cuenta el nivel de estudios de los pacientes (± 1 puntos en relación con el nivel de estudios) según lo descrito anteriormente14.
Seguimiento y resultados clínicosTodos los pacientes fueron objeto de un seguimiento a intervalos regulares, con visitas adicionales, según fuera necesario, en caso de descompensación13. Se contactó por teléfono con los pacientes que no acudieron a las visitas regulares. Los resultados clínicos principales fueron la mortalidad por cualquier causa, la mortalidad por causa cardiovascular (CV) y la mortalidad relacionada con la IC. La muerte se consideró de origen CV si era causada por IC (IC descompensada o IC resistente al tratamiento en ausencia de cualquier otra causa); muerte súbita (muerte inesperada, presenciada o no, de un paciente anteriormente estable, sin signos de empeoramiento de la IC ni de ninguna otra causa de muerte); infarto agudo de miocardio (muerte directamente relacionada con un infarto agudo de miocardio, como consecuencia de complicaciones mecánicas, hemodinámicas o arrítmicas); ictus (asociado a un déficit neurológico agudo reciente); intervención (muertes tras una intervención diagnóstica o terapéutica) u otras causas CV (p. ej., rotura de aneurisma, isquemia periférica o disección aórtica). Los eventos mortales se identificaron a partir de los registros clínicos de los pacientes con IC, las salas hospitalarias, el servicio de urgencias y los médicos de atención primaria o contactando con los familiares del paciente. Además, los datos se verificaron en las bases de datos del Sistema de Salud de Cataluña y de España. Dos de los autores (M. Domingo y J. Lupón) realizaron individualmente la validación (adjudicación) de los eventos13.
Análisis de biomarcadoresAmiloide beta 1-40La determinación del Aβ40 se realizó con el kit de ELISA humano del Aβ40 de DRG Instruments (Marburg, Alemania). Según el fabricante, este método de análisis no tiene reactividad cruzada con el amiloide beta 1-42 ni con el amiloide beta 12-28. La sensibilidad analítica es de 1,66 pg/ml, sin que se observe un efecto de gancho hasta valores de 96.000 pg/ml. El coeficiente de variación interanalítica fue del 9,5% a 114 pg/ml y el 7,9% a 585 pg/ml.
Fracción aminoterminal del propéptido natriurético cerebralLas concentraciones de la fracción aminoterminal del propéptido natriurético cerebral (NT–proBNP) se determinaron con un método de inmunoelectroquimioluminiscencia (Elecsys, Roche Diagnostics; Suiza; n = 903). En los estudios incluidos en este trabajo, el test tuvo un coeficiente de variación interanalítica de entre el 0,9 y el 5,5%.
Neprilisina solubleLa NEP soluble humana se determinó con un inmunoanálisis en sandwich modificado (lote número 20111893; Aviscera Biosciences; Santa Clara, California, Estados Unidos)13. Para el valor de control positivo de 1,4 ng/ml, los coeficientes de variación intraanalítica e interanalítica fueron del 3,7 y el 8,9% respectivamente.
Proteína C reactiva de alta sensibilidadLa concentración de proteína C reactiva de alta sensibilidad se determinó con una técnica de inmunoanálisis turbidimétrico con potenciación de partículas (Roche Diagnostics; Suiza; n = 649). La sensibilidad funcional fue de 0,3 mg/l, y el coeficiente de variación interanalítica fue < 8,4%.
Test de supresión de tumorigenicidad soluble 2La supresión de la tumorigenicidad soluble 2 se determinó con un inmunoanálisis monoclonal en sandwich de alta sensibilidad (Presage ST2, Critical Diagnostics; San Diego, California, Estados Unidos; n = 678). El test de ST2 soluble tuvo un coeficiente intraanalítico < 2,5%, un coeficiente de variación total del 4% y un límite de detección de 1,31 ng/ml.
Análisis estadísticoLas variable discretas se expresan en forma de porcentajes. Las variables continuas, como media ± desviación estándar o mediana [percentiles 25-75] en función de que la distribución sea normal o no normal respectivamente. La normalidad se evaluó con gráficos Q-Q normales. Para los análisis se aplicó una transformación logarítmica a los valores del Aβ40. Las diferencias de las concentraciones de Aβ40 entre ambos sexos, la función cognitiva y la etiología de la IC se evaluaron con la prueba de la U de Mann-Whitney o la prueba de Kruskal-Wallis. Las diferencias estadísticas (valor de p para la tendencia) en las concentraciones de Aβ40 en los distintos estratos de edad (≤ 50, > 50 a ≤ 60, > 60 a ≤ 70, > 70 a ≤ 80 y > 80 años), clase funcional de la New York Heart Association (NYHA I, II y III-IV), tasa de filtrado glomerular estimada (TFGe) según la fórmula de la Chronic Kidney Disease Epidemiology Collaboration (≥ 60, 30 a < 60 y < 30ml/min/1,73 m2) e índice de masa corporal (< 20,5, 20,5 a < 25,5, 25,5 a < 30 y ≥ 30) se determinaron con la prueba de Spearman. Las correlaciones con Aβ40 se evaluaron con la prueba de Pearson o la prueba de la rho de Spearman (cuestionario de Pfeiffer) según procediera. Las diferencias estadísticas entre los grupos en cuanto a las variables discretas se evaluaron con la prueba de la χ2. Se utilizó también un análisis de regresión lineal multivariable para determinar las posibles asociaciones independientes con las concentraciones de Aβ40.
Con objeto de determinar el valor predictivo independiente del Aβ40 en la IC, se realizaron análisis de regresión de Cox univariables y multivariables (método escalonado retrógrado) para los objetivos definidos. En todos los análisis relativos a la mortalidad CV y la mortalidad relacionada con la IC, se adoptó una estrategia de riesgos en competencia mediante el método de Gray, considerando la muerte no CV como evento en competencia con la muerte CV, y las demás muertes CV y la muerte no CV en el caso de la muerte relacionada con la IC. En los análisis multivariables, se elaboró un modelo con los factores predictivos clínicos relevantes (edad, sexo, etiología isquémica de la IC, fracción de eyección del ventrículo izquierdo, clase funcional de la NYHA, presencia de diabetes mellitus, hemoglobina, sodio sérico, TFGe y tratamiento con bloqueadores beta y con inhibidores de la enzima de conversión de la angiotensina o antagonistas del receptor de la angiotensina II más la NT–proBNP) y se incluyó el Aβ40 como covariable independiente. Se evaluaron los supuestos de proporcionalidad y de linealidad. Para cumplir el supuesto de linealidad, se utilizaron las funciones logarítmicas del Aβ40 y la NT-proBNP en los modelos de Cox. Se representaron gráficamente las curvas de supervivencia de Kaplan-Meier de la muerte por cualquier causa y las curvas de incidencia acumulada de la muerte CV y la muerte relacionada con la IC. Los valores de p se obtuvieron mediante test de log rank y el método de Gray respectivamente.
Se utilizaron mediciones detalladas del rendimiento (discriminación y calibración) y se exploró el valor incremental de la adición del Aβ40 al modelo mediante la reclasificación y la mejora de la discriminación.
Los análisis estadísticos se realizaron con el programa estadístico R (versión 3.2.3) (Foundation for Statistical Computing; Viena, Austria). Se consideró significativo un valor de p < 0,05 bilateral.
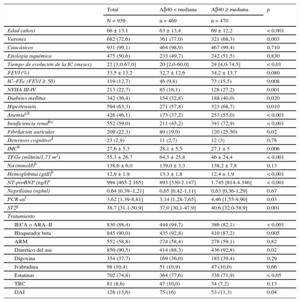
RESULTADOSSe determinaron las concentraciones de Aβ40 en sangre de 939 pacientes con IC incluidos consecutivamente entre mayo de 2006 y mayo de 2013. Las características basales de la cohorte se muestran en la tabla 1. Durante una media de seguimiento de 5,1 ± 2,9 años (6,9 ± 2,3 para los pacientes que continuaban con vida), habían fallecido 471 pacientes: 250 muertes por causas CV (53,1%), 171 por causas no CV (36,3%) y 50 por causas desconocidas (10,6%). De entre las causas de muerte CV conocidas, la IC resistente al tratamiento fue la causa en 131 pacientes (52,4%); la muerte súbita, en 55 (22%); el infarto agudo de miocardio, en 23 (9,2%), y otras causas CV, en 41 (16,4%). Se perdió el seguimiento de 5 pacientes y fueron censurados para el análisis.
Características clínicas y tratamiento en relación con la concentración sérica de péptido amiloide beta 1-40 por encima o por debajo de la mediana
| Total | Aβ40 < mediana | Aβ40 ≥ mediana | p | |
|---|---|---|---|---|
| N = 939 | n = 469 | n = 470 | ||
| Edad (años) | 66 ± 13,1 | 63 ± 13,4 | 69 ± 12,2 | < 0,001 |
| Varones | 682 (72,6) | 361 (77,0) | 321 (68,3) | 0,003 |
| Caucásicos | 931 (99,1) | 464 (98,9) | 467 (99,4) | 0,710 |
| Etiología isquémica | 475 (50,6) | 233 (49,7) | 242 (51,5) | 0,830 |
| Tiempo de evolución de la IC (meses) | 22 [3,0-67,0] | 20 [2,0-60,0] | 24 [4,0-74,5] | < 0,01 |
| FEVI (%) | 33,5 ± 13,2 | 32,7 ± 12,6 | 34,2 ± 13,7 | 0,080 |
| IC–FEc (FEVI ≥ 50) | 119 (12,7) | 46 (9,8) | 73 (15,5) | 0,008 |
| NYHA III-IV | 213 (22,7) | 85 (18,1) | 128 (27,2) | 0,001 |
| Diabetes mellitus | 342 (36,4) | 154 (32,8) | 188 (40,0) | 0,020 |
| Hipertensión | 594 (63,3) | 271 (57,8) | 323 (68,7) | 0,010 |
| Anemiaa,b | 426 (46,1) | 173 (37,2) | 253 (55,0) | < 0,001 |
| Insuficiencia renalb,c | 552 (59,0) | 211 (45,2) | 341 (72,9) | < 0,001 |
| Fibrilación auricular | 209 (22,3) | 89 (19,0) | 120 (25,50) | 0,02 |
| Deterioro cognitivod | 23 (2,9) | 11 (2,7) | 12 (3) | 0,78 |
| IMCb | 27,6 ± 5,3 | 28,1 ± 5,5 | 27,1 ± 5 | 0,006 |
| TFGe (ml/min/1,73 m2) | 55,3 ± 26,7 | 64,5 ± 25,8 | 46 ± 24,4 | < 0,001 |
| Na (mmol/l)b | 138,6 ± 6,0 | 139,0 ± 3,3 | 138,2 ± 7,8 | 0,13 |
| Hemoglobina (g/dl)b | 12,9 ± 1,9 | 13,3 ± 1,8 | 12,4 ± 1,9 | < 0,001 |
| NT-proBNP (ng/l)e | 994 [465-2.165] | 893 [330-2.147] | 1.745 [814-4.346] | < 0,001 |
| Neprilisina (ng/ml) | 0,64 [0,39–1,21] | 0,65 [0,42-1,11] | 0,63 [0,36-1,29] | 0,67 |
| PCR-asf | 3,62 [1,39-8,81] | 3,14 [1,28-7,65] | 4,46 [1,55-9,90] | 0,03 |
| ST2g | 38,7 [31,1-50,9] | 37,0 [30,1-47,9] | 40,6 [32,0-58,9] | 0,001 |
| Tratamiento | ||||
| IECA o ARA–II | 830 (88,4) | 444 (94,7) | 386 (82,1) | < 0,001 |
| Bloqueador beta | 845 (90,0) | 435 (92,8) | 410 (87,2) | 0,005 |
| ARM | 552 (58,8) | 274 (58,4) | 278 (59,1) | 0,82 |
| Diurético del asa | 850 (90,5) | 414 (88,3) | 436 (92,8) | 0,02 |
| Digoxina | 354 (37,7) | 169 (36,0) | 185 (39,4) | 0,29 |
| Ivabradina | 98 (10,4) | 51 (10,9) | 47 (10,0) | 0,66 |
| Estatinas | 702 (74,8) | 364 (77,6) | 338 (71,9) | < 0,05 |
| TRC | 81 (8,6) | 47 (10,0) | 34 (7,2) | 0,13 |
| DAI | 128 (13,6) | 75 (16) | 53 (11,3) | 0,04 |
ARA–II: antagonistas del receptor de la angiotensina II; ARM: antagonistas del receptor de mineralocorticoides; Aβ40: amiloide beta 1-40; DAI: desfibrilador automático implantable; FEVI: fracción de eyección del ventrículo izquierdo; IC: insuficiencia cardiaca; IC–FEc: insuficiencia cardiaca con fracción de eyección conservada; IECA: inhibidores de la enzima de conversión de la angiotensina; IMC: índice de masa corporal; NT–proBNP: fracción aminoterminal del propéptido natriurético cerebral; NYHA: New York Heart Association; PCR-as: proteína C reactiva de alta sensibilidad; ST2: supresión de tumorigenicidad soluble 2; TFGe: tasa de filtrado glomerular estimada (fórmula de la Chronic Kidney Disease Epidemiology Collaboration); TRC: terapia de resincronización cardiaca.
Los valores expresan n (%), media ± desviación estándar o mediana [intervalo intercuartílico].
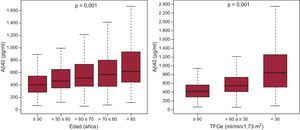
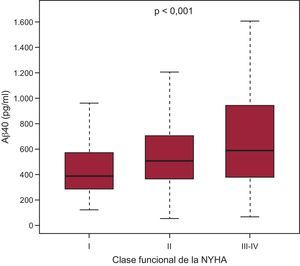
La mediana de la concentración de Aβ40 fue de 519,1 [361,8-749,9] pg/ml y mostró una correlación débil con la edad (R = 0,19; p < 0,001), la fracción de eyección del ventrículo izquierdo (R = 0,08; p = 0,01), el índice de masa corporal (R = 0,12; p < 0,001), y una correlación ligeramente superior con la función renal (TFGe, R = –0,39; p < 0,001). Los valores de Aβ40 en relación con los estratos de edad y de TFGe se muestran en la figura 1. Es de destacar que las concentraciones de Aβ40 fueron mayores en las mujeres (mediana, 562,8 [397,3-782]) que en los varones (496,4 [348,7-732,1]; p = 0,007). Las de Aβ40 tendieron a ser superiores en los pacientes con fibrilación auricular (mediana, 564,0 [384,7-796,2]) en comparación con los que estaban en ritmo sinusal (500,6 [354,2-736,3]; p = 0,056), y hubo más pacientes con fibrilación auricular que tenían concentraciones de Aβ40 superiores a la mediana (tabla 1). Se observó una asociación significativa entre la concentración de Aβ40 y la clase funcional de la NYHA (figura 2); en consecuencia, la concentración de Aβ40 tenía una correlación moderada con la NT–proBNP (R = 0,30; p < 0,001). Se observó una correlación más débil con la proteína C reactiva de alta sensibilidad (R = 0,11; p = 0,006) y la ST2 (R = 0,15; p < 0,001). Es de la máxima importancia que, dado el papel de la NEP en la biología del Aβ40, no se observara una correlación significativa entre la NEP soluble y el Aβ40 circulante (R = 0,04; p = 0,24).
En un análisis de regresión lineal multivariable, la concentración de Aβ40 se asoció de manera independiente con la TFGe (p < 0,001), la fracción de eyección ventricular izquierda (p = 0,01) y la NT-proBNP (p < 0,001), pero no con el sexo (p = 0,21), la clase funcional de la NYHA (p = 0,15), la edad (p = 0,07) o el índice de masa corporal (p = 0,06).
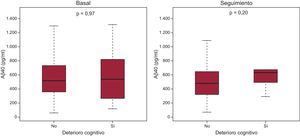
Amiloide beta 1-40 y capacidad cognitiva en la insuficiencia cardiacaLas concentraciones de Aβ40 en sangre mostraron una correlación débil con la puntuación de Pfeiffer tanto en la situación inicial (ρ = 0,10; p = 0,004) como durante el seguimiento (ρ = 0,10; p < 0,05). Con la aplicación del cuestionario de Pfeiffer, se observó un deterioro cognitivo en 23 pacientes (2,9%) en la situación inicial y en 9 (2,2%) durante el seguimiento. No se apreciaron diferencias en los valores de Aβ40 en sangre entre los pacientes con y sin deterioro cognitivo (puntuación del cuestionario de Pfeiffer ajustada según el nivel de estudios) en la situación inicial (p = 0,97) o durante el seguimiento (p = 0,20) (figura 3). Si no se tenía en cuenta el nivel de estudios del paciente para establecer la puntuación, se diagnosticaba deterioro cognitivo a 29 pacientes (3,6%) en la situación inicial y 14 (3,6%) durante el seguimiento. Nuevamente, no se apreciaron diferencias en las concentraciones de Aβ40 en sangre entre los pacientes con y sin deterioro cognitivo basal (p = 0,80) o en el seguimiento (p = 0,55).
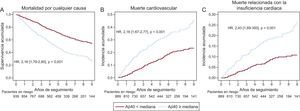
Concentraciones de péptido amiloide beta 1-40 en sangre y resultados clínicosLas concentraciones de Aβ40 eran significativamente mayores entre los pacientes fallecidos por cualquier causa (mediana, 586,2 [405-851,9] frente a 458,9 [318,1-613,2] pg/ml; p < 0,001), de causa CV (605,2 [418,3-892,7] frente a 486,9 [348-682] pg/ml; p < 0,001) y en relación con la IC (635,5 [449,1-923,8] frente a 496,7 [353,7-718] pg/ml; p < 0,001). En la figura 4 se muestran las curvas divergentes de supervivencia y de incidencia acumulada de muertes CV y relacionadas con la IC en relación con la mediana de concentración de Aβ40.
Curvas de supervivencia en relación con la mediana de concentración de Aβ40 en sangre. A: curvas de supervivencia de Kaplan-Meier para la muerte por cualquier causa. B: incidencia acumulada de muerte de causa cardiovascular, teniendo en cuenta otras causas de muerte no cardiovascular como evento de riesgo en competencia. C: incidencia acumulada de muerte relacionada con la insuficiencia cardiaca, teniendo en cuenta otras causas de muerte cardiovasculares y no cardiovasculares como eventos de riesgo en competencia. Aβ40: amiloide beta 1-40; HR: hazard ratio.
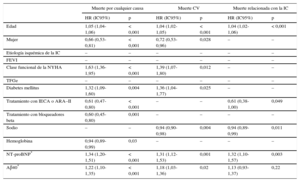
En los análisis univariables, las concentraciones de Aβ40, expresadas como variable continua, mostraron una asociación significativa con la mortalidad por cualquier causa (hazard ratio [HR] = 1,51; intervalo de confianza del 95% [IC95%], 1,37-1,66; p < 0,001), la muerte CV (HR = 1,42; IC95%, 1,25-1,62; p < 0,001) y la muerte relacionada con la IC (HR = 1,41; IC95%, 1,17-1,69; p < 0,001). En los análisis multivariables, la adición del Aβ40 a un modelo que incluía los factores predictivos clínicos relevantes junto con la NT-proBNP, mostró una asociación significativa con la mortalidad por cualquier causa (HR = 1,22; IC95%, 1,10-1,35; p < 0,001) y la mortalidad CV (HR = 1,18; IC95%, 1,03-1,36; p = 0,02), pero no con la mortalidad relacionada con la IC (HR = 1,13; IC95%, 0,93-1,37; p = 0,22) (tabla 2). Tras añadir al modelo los biomarcadores inflamatorios proteína C reactiva de alta sensibilidad y ST2, la concentración de Aβ40 siguió mostrando una asociación significativa con la mortalidad por cualquier causa (p = 0,001) y la mortalidad CV (p = 0,04), pero no con la mortalidad relacionada con la IC ().
Análisis multivariable de regresión de Cox del riesgo de mortalidad por cualquier causa, de causa cardiovascular y relacionada con la insuficiencia cardiaca. Para la muerte de causa cardiovascular y la muerte relacionada con la insuficiencia cardiaca, se utilizó el método de riesgos en competencia
| Muerte por cualquier causa | Muerte CV | Muerte relacionada con la IC | ||||
|---|---|---|---|---|---|---|
| HR (IC95%) | p | HR (IC95%) | p | HR (IC95%) | p | |
| Edad | 1,05 (1,04-1,06) | < 0,001 | 1,04 (1,02-1,05) | < 0,001 | 1,04 (1,02-1,06) | < 0,001 |
| Mujer | 0,66 (0,53-0,81) | < 0,001 | 0,72 (0,53-0,96) | 0,028 | – | – |
| Etiología isquémica de la IC | – | – | – | – | – | – |
| FEVI | – | – | – | – | – | – |
| Clase funcional de la NYHA | 1,63 (1,36-1,95) | < 0,001 | 1,39 (1,07-1,80) | 0,012 | – | – |
| TFGe | – | – | – | – | – | – |
| Diabetes mellitus | 1,32 (1,09-1,60) | 0,004 | 1,36 (1,04-1,77) | 0,025 | – | – |
| Tratamiento con IECA o ARA–II | 0,61 (0,47-0,80) | < 0,001 | – | – | 0,61 (0,38-1,00) | 0,049 |
| Tratamiento con bloqueadores beta | 0,60 (0,45-0,80) | 0,001 | – | – | – | – |
| Sodio | – | – | 0,94 (0,90-0,98) | 0,004 | 0,94 (0,89-0,99) | 0,011 |
| Hemoglobina | 0,94 (0,89-0,99) | 0,03 | – | – | – | – |
| NT-proBNP* | 1,34 (1,20-1,51) | < 0,001 | 1,31 (1,12-1,53) | 0,001 | 1,32 (1,10-1,57) | 0,003 |
| Aβ40* | 1,22 (1,10-1,35) | < 0,001 | 1,18 (1,03-1,36) | 0,02 | 1,13 (0,93-1,37) | 0,22 |
ARA–II: antagonistas del receptor de la angiotensina II; Aβ40: amiloide beta 1-40; CV: cardiovascular; FEVI: fracción de eyección del ventrículo izquierdo; HR: hazard ratio; IC: insuficiencia cardiaca; IC95%: intervalo de confianza del 95%; IECA: inhibidores de la enzima de conversión de la angiotensina; NT-proBNP: fracción aminoterminal del propéptido natriurético cerebral; NYHA: New York Heart Association; TFGe: tasa de filtrado glomerular estimada (fórmula de la Chronic Kidney Disease Epidemiology Collaboration).
El modelo que incluía la concentración de Aβ40 mostró mejor bondad de ajuste general en cuanto a la mortalidad por cualquier causa (p < 0,001) y la mortalidad CV (p = 0,02) y en cuanto a la reclasificación medida con el índice de reclasificación neto continuo en la mortalidad por cualquier causa (p < 0,001), la mortalidad CV (p < 0,001) y la mortalidad relacionada con la IC (p = 0,01) ().
En la se muestran las características clínicas y el tratamiento relativos a 2 periodos de inclusión (2006-2009 frente a 2010-2013). Aunque se observan varias diferencias entre los 2 periodos, no hubo interacción entre la concentración de Aβ40 y el periodo de inclusión, y la HR fue muy similar en los distintos análisis multivariables (HR = 1,29 [IC95%, 1,16-1,44] en el primer periodo y HR = 1,32 [IC95%, 0,99-1,75] en el segundo).
En la , se presentan análisis de supervivencia multivariables tan solo de los pacientes con fracción de eyección del ventrículo izquierdo < 50%. El Aβ40 siguió mostrando asociación independiente con la mortalidad por cualquier causa. En la se muestran las curvas de supervivencia en ese subgrupo de pacientes en relación con la mediana de Aβ40. Las concentraciones de Aβ40 en sangre por encima de la mediana mostraron asociación significativa con mayor mortalidad por cualquier causa y mayor incidencia acumulasa de muertes CV y muertes relacionadas con la IC, en comparación con lo observado en el conjunto de la cohorte.
DISCUSIÓNSe investigó la relevancia clínica de las concentraciones de Aβ40 en sangre en una cohorte de pacientes ambulatorios con IC crónica que fueron objeto de seguimiento en cuanto a la mortalidad durnate una mediana de 4 años. Las concentraciones de Aβ40 fueron detectables en todos los pacientes estudiados y, tras un ajuste respecto a los factores predictivos clínicos, el Aβ40 mostró una asociación independiente con la mortalidad por cualquier causa y con la mortalidad CV. Los resultados de este estudio indican que las concentraciones séricas de Aβ40 aumentadas pueden ser útiles para identificar a los pacientes con IC en mayor riesgo. Además, en nuestra cohorte de IC (no tratada con inhibidores de la NEP), no se observó asociación alguna entre la concentración de Aβ40 en sangre y el deterioro cognitivo, lo cual tiene una importancia considerable, dada la preocupación que se ha expresado respecto a la inhibición de la NEP con los nuevos tratamientos para la IC que están surgiendo15.
No está claro el motivo de que la concentración de Aβ40 más alta sea un factor independiente predictivo de episodios de IC; es muy probable que los mecanismos involucrados sean multifactoriales. El péptido Aβ40 podría contribuir a producir el envejecimiento vascular. La IC es el trastorno paradigmático del envejecimiento CV. Es de destacar que la rigidez arterial, que es la característica distintiva del envejecimiento, se ha asociado recientemente con la concentración de Aβ40 en una cohorte de pacientes con enfermedad coronaria11. En la IC, el aumento de la rigidez arterial da lugar a un deterioro del acoplamiento ventricular-vascular y se ha asociado con la mortalidad16. Las altas concentraciones de Aβ40 también pueden desempeñar un papel importante en la patogenia de la fibrilación auricular17, que está presente en casi un tercio de los pacientes con IC. Además, nuestros datos indican que la coexistencia de IC y fibrilación auricular aumenta en mayor medida las concentraciones de Aβ40. Por último, el Aβ40 puede actuar como estimulador inflamatorio para activar los monocitos y desencadenar un aumento notable de la producción de factor de necrosis tumoral y metaloproteinasa de matriz 9, factores ambos que intervienen en el remodelado miocárdico18. En un reciente estudio se encontró Aβ40 en el corazón de pacientes con enfermedad de Alzheimer, lo cual indica una conexión importante entre las enfermedades cerebral y cardiaca19.
Las concentraciones de Aβ40 en sangre mostraron asociación con el envejecimiento y la TFGe, lo cual es coherente con lo indicado por estudios previos20, pero el Aβ40 se correlacionaba con los eventos de manera independiente de esas covariables. Además, los valores de Aβ40 aumentaban al agravarse la IC, según la evaluación realizada con la clase funcional de la NYHA. La disminución de flujo sanguíneo cerebral y la activación neurohormonal pueden contribuir a producir la disfunción de la unidad neurovascular causando una acumulación de Aβ40 en la IC21. De hecho, las cifras de Aβ40 en sangre descritas en este estudio fueron más de 3 veces superiores a las observadas en pacientes con una enfermedad coronaria estable11.
Las consecuencias clínicas de los datos presentados son notables. La proteasa que degrada el amiloide beta —es decir, la NEP— ha emergido como una biodiana importante en la IC. En nuestro estudio, la NEP soluble no mostró asociación con la concentración de Aβ40 en suero. Por un lado, es muy probable que la NEP soluble circulante refleje tan solo una pequeña fracción del total de NEP presente en el organismo en forma de un receptor transmembranario ubicuo. Por otro lado, además de la NEP, son varias las proteasas que llevan a cabo la degradación del amiloide beta, entre ellas la enzima de conversión de la angiotensina (figura 5)22. En un estudio reciente se exploraron los efectos de la inhibición de la NEP en el Aβ40 en sangre al administrar a voluntarios sanos sacubitrilo-valsartán a lo largo de 14 días23. Entre la situación inicial y el día 14, los valores de Aβ40 en plasma aumentaron en un 50% en el grupo tratado con sacubitrilo-valsartán, alcanzando valores significativamente superiores a los del grupo de placebo. En cambio, la concentración de Aβ40 en el líquido cefalorraquídeo se mantuvo inalterada en los participantes tratados23. Hasta donde sabemos, no hay ninguna evidencia obvia o concluyente de que un aumento aislado de la concentración de Aβ40 en la sangre dé lugar o facilite la formación de placas de amiloide beta en el cerebro o un deterioro cognitivo. De hecho, en el presente estudio, las concentraciones de Aβ40 en sangre no se asociaron con el deterioro cognitivo en la situación inicial ni durante el seguimiento. No obstante, teniendo en cuenta el probablemente largo uso de la inhibición de la NEP para el tratamiento de la IC, es imprescindible esclarecer la trascendencia clínica de la NEP en la eliminación del péptido amiloide beta en la IC2,24. Podría plantearse la hipótesis de que puedan activarse vías proteolíticas alternativas con el empleo continuo de sacubitrilo-valsartán que compensen la inhibición de la NEP25,26. Se acepta que las actividades de varias enzimas que degradan el amiloide beta aumentan con la edad en la enfermedad de Alzheimer, tal vez como respuesta fisiológica para reducir al mínimo la acumulación de amiloide beta10.
El amiloide beta puede ser procesado por numerosas proteasas. La concentración de Aβ40 en sangre puede indicar el envejecimiento sistémico, pero no se asocia con el deterioro cognitivo en la IC. A: enzima de conversión de la angiotensina; Aβ40: amiloide beta 1-40; B: enzima fragmentadora de la proteína precursora de amiloide en lugar β; B1: enzima 1 fragmentadora de la proteína de amiloide beta en lugar β; B2: enzima 2 fragmentadora de la proteína de amiloide beta en lugar β; C: catepsina B; CV: cardiovascular; E: enzima de conversión de la endotelina 1 y 2; I: enzima degradadora de la insulina; IC: insuficiencia cardiaca; M2: metaloproteasa de matriz 2; M9: metaloproteasa de matriz; N: neprilisina; NEP: neprilisina; P: plasmina; TFG: tasa de filtrado glomerular; α: secretasa alfa; β: secretasa beta; λ: secretasa gamma.
Aunque el estudio se realizó en una población con IC de la práctica clínica real, con diferentes etiologías, el predominio de varones con IC y fracción de eyección reducida indica que estos resultados tendrán que validarse de manera más amplia y no deben extrapolarse a la población general con IC. En el futuro próximo, con la probable utilización generalizada de sacubitrilo-valsartán en pacientes con IC y fracción de eyección reducida, es posible que cambie el valor pronóstico del Aβ40. Existen otras pruebas de detección de deterioro cognitivo en ancianos. No obstante, el cuestionario de Pfeiffer sigue siendo útil27,28 y en este estudio sirvió de prueba de principio para explorar la ausencia de asociación entre el deterioro cognitivo y el Aβ40 en suero. Serán necesarios nuevos estudios para determinar si la adición de un biomarcador de senescencia como el Aβ40, junto con los marcadores convencionales de IC, puede aportar un nuevo aspecto al pronóstico de la IC, en especial en un contexto de práctica clínica real, de pacientes con edad en aumento y comorbilidad de IC.
CONCLUSIONESEste estudio demostró que la concentración de Aβ40 en sangre se asociaba de manera independiente con la mortalidad por cualquier causa y la mortalidad CV en una cohorte de pacientes de la práctica clínica real con IC crónica no tratados con inhibidores de la NEP. Los datos del presente estudio indican que la concentración de Aβ40 en sangre puede ser un indicador válido del envejecimiento sistémico más que del deterioro cognitivo. Dado que el Aβ40 es un sustrato de la NEP, falta determinar las repercusiones que tienen los inhibidores de la NEP en las concentraciones de Aβ40 en la IC.
CONFLICTO DE INTERESESNinguno.
- –
Las enfermedades causadas por una inflamación «estéril» crónica asociada con la edad, como la cardiopatía y la enfermedad de Alzheimer, pueden tener vías moleculares comunes. La generación de amiloide beta tóxico es un proceso clave en la fisiopatología de la enfermedad de Alzheimer. El Aβ40 se elimina del cerebro a través de múltiples procesos, incluida su degradación por la NEP. Recientemente, la NEP ha vuelto a ser el centro de interés debido a los efectos positivos observados al inhibirla con sacubitrilo-valsartán. No está claro cuál es el significado pronóstico del Aβ40 en los pacientes ambulatorios con IC crónica no tratados con inhibición de la NEP ni cuál es la asociación entre la concentración de Aβ40 en sangre y la capacidad cognitiva.
- –
Se determinaron las concentraciones de Aβ40 en sangre por primera vez en una cohorte de pacientes con IC. Es de destacar que el Aβ40 fue detectable en todos los pacientes estudiados, y tras un ajuste respecto a los factores predictivos clínicos, el Aβ40 mostró una asociación independiente con los resultados clínicos. Es posible que el Aβ40 pase a ser un biomarcador válido de la senescencia en la IC.
- –
Además, en este estudio se descartó la existencia de una asociación causal entre las concentraciones de Aβ40 en sangre y el deterioro cognitivo de los pacientes con IC no tratados con inhibidores de la NEP. Está pendiente de estudio la determinación del Aβ40 (en el torrente circulatorio y en el sistema nervioso central) en pacientes tratados con sacubitrilo-valsartán.
Damos las gracias a Beatriz González, Roser Cabanes, Margarita Rodríguez, Carmen Rivas, Nuria Benito y Alba Ros por la recogida de los datos y su inestimable trabajo en la clínica de IC. Queremos reconocer también la ayuda de Redes Temáticas de Investigación Cooperativa en Salud, Red Cardiovascular (RD12/0042/0047; beca posdoctoral RIC), Red de Terapia Celular–TerCel [RD12/0019/0029], CIBER-cardiovascular (CB16/11/00403) y Ministerio de Economía y Competitividad (Juan de la Cierva, JCI-2012-14025).