La tromboaspiración permite analizar el material intracoronario en pacientes con infarto agudo de miocardio con elevación del segmento ST. Nuestro objetivo fue caracterizar este material mediante inmunohistología y estudiar su posible relación con el pronóstico.
MétodosCohorte prospectiva de 142 pacientes sometidos a angioplastia primaria con tromboaspiración positiva. El examen histológico del material aspirado incluyó técnicas de inmunohistoquímica para detectar fragmentos de placa. Se estudiaron variables histológicas (antigüedad del trombo, grado de inflamación, presencia de placa), clínicas y angiográficas de los pacientes. Se realizaron análisis de supervivencia y regresión logística.
ResultadosDe los marcadores histológicos, solo la presencia de placa (el 63% de las muestras) se relacionó con los eventos clínicos. Los factores asociados a la supervivencia libre de eventos a los 5 años fueron: presencia de placa (el 82,2 frente al 66,0%; p = 0,033), tabaquismo (el 82,5 frente al 66,7%; p = 0,036), arteria responsable del infarto (el 83,3% en infartos de circunfleja o coronaria derecha frente al 68,5% de descendente anterior; p = 0,042); flujo angiográfico final (el 80,8% de II–III frente al 30,0% de 0–I; p < 0,001) y fracción de eyección ≥ 35% (el 83,7 frente al 26,7%; p < 0,001). En el análisis multivariable de regresión (Cox) con dichas variables, se identificaron la presencia de placa (HR = 0,37; IC95%, 0,18–0,77; p = 0,008) y la fracción de eyección (HR = 0,92; IC95%, 0,88-0,95; p < 0,001) como predictores independientes de supervivencia libre de eventos.
ConclusionesLa presencia de placa de ateroma en el aspirado coronario de los pacientes con infarto de miocardio transmural puede ser un marcador pronóstico independiente, y el análisis inmunohistoquímico con CD68 es un buen método para detectarlo.
Palabras clave
La génesis de la trombosis arterial depende de tres factores: las características de la pared arterial, las propiedades del flujo sanguíneo y ciertos factores circulantes en sangre (tríada de Virchow). En los estudios de autopsias de víctimas de muerte súbita, la trombosis asociada a la rotura de placa aparece como el mecanismo predominante que causa la aparición del síndrome coronario agudo. Este proceso patogénico puede comenzar días o semanas antes del infarto agudo de miocardio con elevación del segmento ST (IAMCEST) fatal1,2 y las hemorragias en el interior de la placa, originadas por grietas o fisuras en la superficie de la luz arterial, pueden acelerar la progresión hacia su rotura3.
Muchas placas de ateroma rotas quedan cubiertas inicialmente por trombos murales que no causan síntomas clínicos4. Este trombo mural puede organizarse con el tiempo e incorporarse a la lesión ateroesclerótica, con lo que se restaura la integridad de la pared del vaso. Este tipo de lesión «cicatricial» se observa con mucha frecuencia en las arterias coronarias en autopsias4–6, mientras que en otros pacientes, la rotura de una placa ateroesclerótica lleva a un proceso de trombosis repetida o continua, que finalmente resulta en un síndrome coronario agudo7,8.
El uso de la tromboaspiración en la intervención coronaria percutánea (ICP) primaria ofrece una oportunidad única para estudiar la composición del trombo y su formación dinámica in vivo9. Aunque las muestras así obtenidas no representan la totalidad de los componentes del trombo ni su distribución real, permiten estudiarlas sin los cambios histológicos que se desencadenan tras la muerte.
Varios investigadores han estudiado las características histológicas del material aspirado en pacientes con IAMCEST, analizando su composición y la edad del trombo coronario. En una alta proporción de los pacientes, el trombo tiene más de 24 h de evolución, lo que confirma que la oclusión coronaria súbita a menudo se precede de un periodo variable de inestabilidad de la placa y formación de trombos10,11.
Solo en 1 estudio12 se analizó la relación entre la histología del aspirado coronario y la evolución de los pacientes con IAMCEST, y la edad del trombo resultó predictor independiente de mortalidad a largo plazo.
El objetivo del presente estudio es caracterizar mediante inmunohistología el material coronario aspirado durante la ICP primaria y analizar su valor en la predicción de los eventos clínicos en pacientes con IAMCEST.
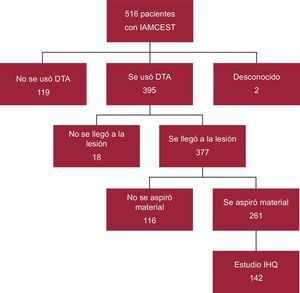
MÉTODOSSujetos de estudioLa cohorte del estudio consta de 142 pacientes con IAMCEST (figura 1) de los que se extrajo material durante la ICP primaria mediante un aspirador de trombo coronario. Las muestras se recogieron entre enero de 2005 y agosto de 2007 y durante todo el año 2009 (en 2008 se produjo el traslado del hospital a su actual ubicación y no se analizaron los trombos aspirados). La recogida de muestras se realizó consecutivamente solo en días laborables de 8.00 a 15.00 horas por razones logísticas (ausencia de personal para el envío y recogida de las muestras), por lo que, de las 261 ICP primarias en las que se aspiró material durante el periodo de estudio, se analizó un total de 142.
Diagrama de flujo de los pacientes con IAMCEST de los que se aspiró material coronario durante la ICP primaria incluidos en el estudio. DTA: dispositivo de tromboaspiración; IAMCEST: infarto agudo de miocardio con elevación del segmento ST; ICP: intervención coronaria percutánea; IHQ: inmunohistoquímico.
Las variables clínicas, angiográficas y relacionadas con el procedimiento se recogieron de forma prospectiva en una base de datos electrónica diseñada para este fin. La información recopilada incluye características epidemiológicas y antecedentes médicos de los pacientes, presencia de angina prodrómica, clase Killip, resolución del ST, parámetros analíticos, fracción de eyección del ventrículo izquierdo (FEVI) al alta, tiempos relativos al procedimiento (inicio del dolor-balón, puerta-balón, etc.), información sobre la angioplastia y evolución de los pacientes.
Se revisaron todas las angiografías y se registraron, entre otros, la presencia de circulación colateral (0 a 3, según la clasificación Rentrop13), el flujo TIMI (Thrombolisis in Myocardial Infarction) previo a la ICP y el resultado angiográfico final. Dicho resultado se evalúo mediante el flujo TIMI final, el TIMI Frame Count corregido14, y el grado de perfusión miocárdica, clasificado de 0 a 3 según la definición del TIMI Group15.
El tratamiento farmacológico antes de la ICP incluyó ácido acetilsalicílico y clopidogrel en dosis de carga de 300 y 600 mg respectivamente, y 5.000-10.000 UI de heparina no fraccionada. Los inhibidores de la glucoproteína IIb/IIIa se usaron sistemáticamente, salvo contraindicación, y la elección del dispositivo de aspiración fue decisión del operador en cada procedimiento.
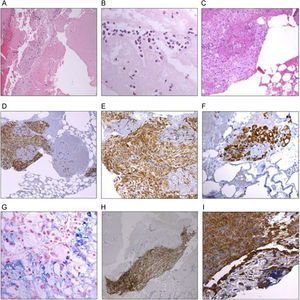
Procesamiento y análisis del material intracoronarioEl material aspirado se lavó con suero fisiológico inmediatamente tras su extracción, se fijó en formalina neutra tamponada al 10% y se envió al departamento de anatomía patología para su procesamiento. Tras la fijación, el material se embebió en parafina y se realizaron cortes de 4 μm, que se montaron en portaobjetos de vidrio. Las secciones se tiñeron con hematoxilina y eosina para microscopia de luz y con anticuerpos (Dako y Glostrup®, Denmark) contra macrófagos (CD68), moléculas de adhesión de células endoteliales y plaquetas (CD31) y filamentos de actina (HHF35). La tinción de Perls para detección de hierro pudo llevarse a cabo en 111 casos y sirvió para identificar áreas de hemorragia antigua en el interior de los fragmentos de placa (figura 2).
Imágenes microscópicas del material coronario extraído mediante tromboaspirador de pacientes con infarto agudo de miocardio con elevación del segmento ST. A: trombo heterogéneo con áreas de trombo fresco que incluyen células sanguíneas intactas (granulocitos, plaquetas y eritrocitos) y fibrina, junto a áreas líticas con desestructuración celular. B: detalle de un trombo fresco en el que se observan eosinófilos y neutrófilos con redes de fibrina. C: material coronario aspirado que incluye fragmentos de ateroma compuestos de macrófagos. D, E y F: imágenes representativas de placa de ateroma con tinciones inmunohistoquímicas: las células positivas para CD68 (macrófagos) permiten identificar fragmentos de «placa blanda». G: detalle de una tinción de Perls para hierro en la que los siderófagos permiten identificar zonas de hemorragia antigua. H: fragmentos de placa de ateroma identificados por tinción positiva para anticuerpos HF35 (actina). I: células teñidas con anticuerpos frente a moléculas de adhesión de células endoteliales y plaquetas (CD31) recubriendo el trombo organizado. Esta figura se muestra a todo color solo en la versión electrónica del artículo.
Una patóloga experimentada que no tenía acceso a la información sobre los pacientes realizó el análisis histopatológico. La edad del trombo se clasificó en 2 grupos según la definición histopatológica previamente aceptada10: el trombo fresco (< 1 día), que se compone de capas de fibrina, plaquetas, eritrocitos y granulocitos intactos, y el trombo antiguo (> 1 día), que consta de áreas líticas (1-5 días) y/u organizadas (> 5 días). Las áreas líticas se caracterizan por necrosis colicuativa y cariorrexis de granulocitos y, las organizadas, por el desarrollo de neovasos capilares y células musculares lisas, con o sin depósitos de tejido conectivo. En el presente análisis, se distingue entre trombo fresco y antiguo, en el que se identifica al menos 1 zona lítica u organizada.
Se realizó un análisis semicuantitativo de las tinciones de Perls e inmonohistoquímicas de forma que se consideró: 0 cuando la tinción era negativa; 1 cuando se observaban escasas células positivas, y 2 cuando había frecuentes células positivas. Para el análisis estadístico, se agruparon los casos 1 y 2 y se mantuvo el grupo 0 como negativo.
Los fragmentos de placa se identificaron por la presencia de algún material constituyente de «placa blanda» (lípidos extracelulares, macrófagos espumosos —CD68 positivos— y/o cristales de colesterol), fibras musculares lisas (HHF35), células endoteliales (CD31), depósitos de hierro, calcio, tejido fibroelástico o combinaciones de estos componentes. Las tinciones con CD68 y CD31 solo se consideraron positivas cuando marcaban componentes de placa: macrófagos en el caso del CD68 —presentes en la placa y no en el trombo— y células endoteliales con el CD31.
El comité de ética local aprobó la manipulación y el análisis del material aspirado y todos los pacientes aceptaron participar en el estudio. Los procedimientos utilizados se llevaron a cabo de acuerdo con los principios de la Declaración de Helsinki sobre los principios éticos para las investigaciones médicas en seres humanos.
Seguimiento clínicoEl seguimiento de los pacientes se realizó a través de la consulta externa o por contacto telefónico durante una mediana de 2,4 (1-6) años, con solo un 1% de pérdidas durante el seguimiento. Tres médicos (A. Blasco, L. Goicolea y A. Muñiz) encargados de la base de datos registraron prospectivamente los eventos adversos cardiovasculares mayores (MACE): muerte, infarto de miocardio recurrente, revascularización urgente y trombosis del stent definitiva o probable (Academic Research Consortium)16.
Análisis estadísticoLas variables categóricas se expresan como porcentajes y las continuas, como media ± desviación estándar o como medianas [intervalo intercuartílico] en el caso de los tiempos. Las asociaciones entre variables cualitativas se evaluaron mediante la prueba de la χ2 y entre variables continuas, mediante las pruebas de la t de Student o la U de Mann-Whitney. Las curvas de supervivencia para MACE se estimaron por el método de Kaplan-Meier y se compararon mediante log-rank test.
Para identificar predictores independientes de MACE en el seguimiento, se aplicó el análisis de regresión de Cox multivariable con selección hacia atrás, de modo que las variables se eliminaban si p < 0,05. El poder discriminativo del modelo se evaluó mediante el índice C de Harrell17, equivalente al área bajo la curva ROC en modelos de supervivencia; C = 0,5 indica predicciones al azar y C = 1 corresponde a una perfecta discriminación.
Todas las pruebas fueron bilaterales y los valores de p < 0,05 se consideraron estadísticamente significativos. El análisis estadístico se realizó con el programa SPSS versión 18.0.
RESULTADOSSe estudió a 142 pacientes con IAMCEST de los que se obtuvo material mediante aspiración durante la ICP primaria. En la tabla 1 se muestran las características histológicas de los aspirados coronarios.
Características histológicas e inmunohistoquímicas de los aspirados coronarios en pacientes con IAMCEST
| n (%) | |
|---|---|
| Tipo de trombo (n = 138) | |
| Fresco | 54 (39) |
| Lítico | 76 (55) |
| Organizado | 8 (6) |
| Técnicas IHQ (n = 142) | |
| CD68+ | 70 (49) |
| CD31+ | 28 (20) |
| HHF35+ | 23 (16) |
| Tinción de Perls + (n = 111) | 29 (26) |
| Presencia de placa (n = 142) | 90 (63) |
CD31: anticuerpos contra moléculas de adhesión de células endoteliales y plaquetas; CD68: anticuerpos contra macrófagos; HHF35: anticuerpos contra filamentos de actina; IAMCEST: infarto agudo de miocardio con elevación del segmento ST; IHQ: inmunohistoquímica.
En 4 de las 142 muestras estudiadas, no se identificó trombo o este era insuficiente para categorizar su antigüedad. Del resto (138 pacientes), el trombo era fresco en 54 (39%), lítico en 76 (55%) y organizado en 8 pacientes (6%). La infiltración granulocítica estaba ausente o era leve en 77 de 138 pacientes (56%) y moderada o intensa en 61 (44%).
Se identificaron componentes de placa ateroesclerótica en 90 de los 142 pacientes (63%). La tinción de anticuerpos contra macrófagos (CD68) resultó positiva en el 49% de las muestras; solo en 6 muestras negativas para CD68 alguna de las otras 2 técnicas inmunohistoquímicas resultó positiva (HHF35 en 5 casos, CD31 en 2). En 4 casos fueron los depósitos de hemosiderina (Perls+) los que permitieron identificar la placa.
La mediana del peso del material aspirado fue 0,046 [0,02-0,1] g. El análisis univariable mostró que el peso del aspirado se asoció inversamente a la presencia de placa (mediana del peso sin placa, 0,07 [0,03-0,12]; con placa, 0,04 [0,02-0,10]; p = 0,017). Es decir, los aspirados más abundantes contenían fragmentos de placa con menor frecuencia.
Las características clínicas y angiográficas de los pacientes se resumen en la tabla 2. Los eventos clínicos durante el seguimiento fueron: muerte de cualquier causa, 24 pacientes (4,4/1.000 personas-mes); muerte cardiaca, 15 (2,7/1.000 personas-mes), y reinfarto, 7 (1,3/1.000 personas-mes). La variable combinada MACE fue positiva en 32 pacientes (7/1.000 pacientes-mes).
Características clínicas y angiográficas de los pacientes y asociación de las variables previas a la aspiración coronaria con la presencia de placa en el aspirado
| Total | Sin placa | Placa | p | |
|---|---|---|---|---|
| Antes de la aspiración coronaria | ||||
| Sexo masculino | 116 (81,7) | 36 (32,4) | 75 (67,6) | 0,340 |
| Edad (años) | 60 ± 13 | 60 ± 11 | 60 ± 14 | 0,917 |
| Fumadores | 97 (68,3) | 31 (32,9) | 63 (67,0) | 0,628 |
| Hipertensión | 68 (47,9) | 26 (40,6) | 38 (59,4) | 0,145 |
| Hipercolesterolemia | 54 (38,0) | 22 (51,5) | 31 (58,5) | 0,158 |
| Diabetes mellitus | 32 (22,5) | 10 (32,3) | 21 (67,7) | 0,785 |
| Angina preinfarto | 38 (27,7) | 14 (38,9) | 22 (61,1) | 0,407 |
| Enfermedad multivaso | 43 (30,3) | 14 (33,3) | 28 (66,7) | 0,873 |
| Arteria responsable DA | 54 (39,1) | 18 (35,3) | 33 (64,7) | 0,586 |
| Flujo TIMI pre-ICP 0-1 | 118 (88,7) | 41 (35,7) | 74 (64,3) | 0,134 |
| Circulación colateral | 45 (36,6) | 14 (31,8) | 30 (68,2) | 0,859 |
| Tiempo de isquemia* (min) | 221 [170-310] | 217 [180-325] | 233 [170-310] | 0,620 |
| Inhibidores de GPIIb/IIIa | 112 (78,7) | 39 (84,8) | 68 (75,6) | 0,214 |
| Tras la aspiración coronaria | |
| Uso de stent | 134 (95,0) |
| Diámetro del stent (mm) | 3,3 ± 0,5 |
| Descenso de ST ≥ 50% tras la ICP | 87 (74,4) |
| Flujo TIMI II-III tras la ICP | 130 (92,9) |
| cTFC tras la ICP | 26 [21-41] |
| FEVI al alta (%) | 47,1 ± 11,3 |
cTFC: TIMI frame count corregido; DA: descendente anterior; FEVI: fracción de eyección del ventrículo izquierdo; GPIIb/IIIa: glucoproteína IIb/IIIa; IAMCEST: infarto agudo de miocardio con elevación del segmento ST; ICP: intervención coronaria percutánea; TIMI: Thrombolysis in Myocardial Infarction.
Las variables continuas se presentan como medias ± desviación estándar o como mediana [percentiles 25-75] y las variables categóricas, como n (%).
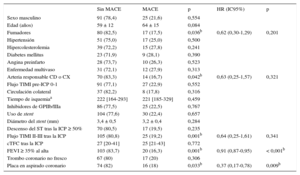
En la tabla 3 se comparan los pacientes con y sin eventos clínicos adversos a los 5 años del IAMCEST respecto a sus características clínicas y angiográficas y a la histología del aspirado coronario. La presencia de placa en el aspirado es la única variable histológica que se asoció significativamente a la aparición de MACE, y no se encontró asociación de esta con ninguna otra variable previa a la aspiración que pudiera ser indicativa de efecto confusor (tabla 2). La antigüedad del trombo no se asoció con la evolución de los pacientes en esta serie.
Comparación de las características clínicas y angiográficas de los pacientes con y sin eventos adversos a los 5 años de evolución tras el IAMCEST (HR ajustadas por la aparición de MACE en el seguimiento)
| Sin MACE | MACE | p | HR (IC95%) | p | |
|---|---|---|---|---|---|
| Sexo masculino | 91 (78,4) | 25 (21,6) | 0,554 | ||
| Edad (años) | 59 ± 12 | 64 ± 15 | 0,084 | ||
| Fumadores | 80 (82,5) | 17 (17,5) | 0,036b | 0,62 (0,30-1,29) | 0,201 |
| Hipertensión | 51 (75,0) | 17 (25,0) | 0,500 | ||
| Hipercolesterolemia | 39 (72,2) | 15 (27,8) | 0,241 | ||
| Diabetes mellitus | 23 (71,9) | 9 (28,1) | 0,390 | ||
| Angina preinfarto | 28 (73,7) | 10 (26,3) | 0,523 | ||
| Enfermedad multivaso | 31 (72,1) | 12 (27,9) | 0,313 | ||
| Arteria responsable CD o CX | 70 (83,3) | 14 (16,7) | 0,042b | 0,63 (0,25-1,57) | 0,321 |
| Flujo TIMI pre-ICP 0-1 | 91 (77,1) | 27 (22,9) | 0,552 | ||
| Circulación colateral | 37 (82,2) | 8 (17,8) | 0,316 | ||
| Tiempo de isquemiaa | 222 [164-293] | 221 [185-329] | 0,459 | ||
| Inhibidores de GPIIb/IIIa | 86 (77,5) | 25 (22,5) | 0,767 | ||
| Uso de stent | 104 (77,6) | 30 (22,4) | 0,657 | ||
| Diámetro del stent (mm) | 3,4 ± 0,5 | 3,2 ± 0,4 | 0,284 | ||
| Descenso del ST tras la ICP ≥ 50% | 70 (80,5) | 17 (19,5) | 0,235 | ||
| Flujo TIMI II-III tras la ICP | 105 (80,8) | 25 (19,2) | 0,001b | 0,64 (0,25-1,61) | 0,341 |
| cTFC tras la ICP | 27 [20-41] | 25 [21-43] | 0,772 | ||
| FEVI ≥ 35% al alta | 103 (83,7) | 20 (16,3) | 0,001b | 0,91 (0,87-0,95) | < 0,001b |
| Trombo coronario no fresco | 67 (80) | 17 (20) | 0,306 | ||
| Placa en aspirado coronario | 74 (82) | 16 (18) | 0,033b | 0,37 (0,17-0,78) | 0,009b |
CD: coronaria derecha; cTFC: TIMI frame count corregido; CX: circunfleja; FEVI: fracción de eyección del ventrículo izquierdo; GPIIb/IIIa: glucoproteína IIb/IIIa; HR: hazard ratio; IAMCEST: infarto de miocardio con elevación del segmento ST; IC95%: intervalo de confianza del 95%; ICP: intervención coronaria percutánea; MACE: eventos cardiovasculares adversos mayores (muerte, infarto recurrente, revascularización urgente y/o trombosis del stent); TIMI: Thrombolysis in Myocardial Infarction.
Las variables continuas se presentan como medias ± desviación estándar o como mediana [intervalo intercuartílico] y las variables categóricas, como n (%).
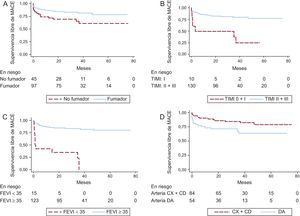
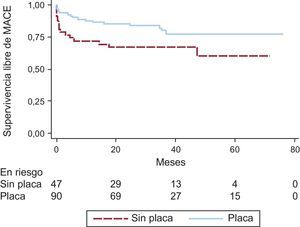
Las curvas de supervivencia para MACE fueron significativamente diferentes con respecto a: hábito tabáquico, arteria responsable del infarto, flujo TIMI tras la ICP primaria, FEVI al alta y presencia de placa en el aspirado coronario (figuras 3 y 4). Las tasas de supervivencia libre de MACE a 5 años fueron: el 82,5% de los fumadores frente al 66,7% de los no fumadores (p = 0,036); el 83,3% de los pacientes con infarto de las arterias coronaria derecha o circunfleja frente al 68,5% de aquellos con infarto de la arteria descendente anterior (p = 0,042); el 80,8% de los pacientes con flujo TIMI II-III frente al 30,0% de los que presentaron flujo final TIMI 0-I (p < 0,001); el 83,7% de los pacientes con FEVI ≥ 35% frente al 26,7% de los que tenían FEVI < 35% antes del alta hospitalaria (p < 0,001), y el 82,2% de los pacientes cuyas muestras contenían placa frente al 66,0% de aquellos con aspirados sin placa (p = 0,033).
Curvas de Kaplan-Meier comparativas de las tasas de supervivencia libre de MACE. A: pacientes fumadores frente a no fumadores. B: pacientes con flujo TIMI II-III tras la intervención coronaria percutánea frente a pacientes con flujo TIMI final 0-I. C: pacientes con FEVI ≥ 35% frente a pacientes con FEVI < 35% al alta. D: pacientes con infartos de las arterias CX o CD frente a pacientes con infartos de la DA. CD: coronaria derecha; CX: circunfleja; DA: descendente anterior; FEVI: fracción de eyección del ventrículo izquierdo; MACE: eventos adversos cardiovasculares mayores; TIMI: Thrombolysis in Myocardial Infarction.
Curvas de Kaplan-Meier comparativas de las tasas de supervivencia libre de MACE de los pacientes con síndrome coronario agudo con elevación del ST cuyos aspirados coronarios contienen fragmentos de placa frente a aquellos sin placa. MACE: eventos adversos cardiovasculares mayores.
Las variables asociadas a la aparición de eventos adversos en el análisis univariable se pusieron a prueba en el modelo de regresión de Cox multivariable; la presencia de fragmentos de placa en el aspirado (hazard ratio [HR] = 0,37; intervalo de confianza del 95% [IC95%], 0,18-0,77; p = 0,008) y la FEVI (HR = 0,92; IC95%, 0,88-0,95; p < 0,001) resultaron predictores independientes de MACE a largo plazo (tabla 3). El índice C de Harrell del modelo con las 5 variables (placa en el aspirado coronario, hábito tabáquico, flujo TIMI tras la ICP, FEVI y arteria responsable del infarto) fue de 0,723, lo cual indica una buena capacidad predictiva de MACE. La variable «placa en el aspirado coronario» mejora la capacidad de discriminación del modelo con solo 4 variables (C = 0,708).
DISCUSIÓNEl principal hallazgo de este estudio es la asociación entre la presencia de ateroma en los aspirados coronarios de pacientes con IAMCEST y la supervivencia libre de eventos que, hasta donde sabemos, no se ha publicado previamente. La presencia de fragmentos de placa en el aspirado coronario comunicada en estos pacientes oscila entre el 39 y el 57%10,18–20. En nuestra serie, la proporción fue ligeramente superior (63%), lo cual puede deberse a la utilización de técnicas de inmunohistoquímica que facilitaron su identificación.
Solo en una pequeña serie19 de 49 pacientes, se estudió la asociación entre la presencia de ateroma en el aspirado coronario y algún factor relacionado con el pronóstico. En dicha serie se analizan el grado de opacificación o blush miocárdico, el tamaño del infarto estimado analíticamente (pico de creatincinasa y su isoenzima MB) y la FEVI. En el grupo de pacientes con placa en el aspirado (57,1%), se halló una mayor proporción de blush miocárdico 3 (el 82,1 frente al 52,4%; p = 0,025), menores concentraciones de creatincinasa (1.705 ± 1.647 frente a 2,629 ± 2,013 U/l; p = 0,042) y una FEVI mayor (0,59 ± 0,10 frente a 0,52 ± 0,08; p = 0,012). Estos hallazgos estarían en concordancia con los nuestros, dado de que la presencia de ateroma se asoció a marcadores pronósticos favorables.
En nuestra serie, 5 variables se asociaron con la aparición de MACE a largo plazo: FEVI al alta, flujo TIMI tras la ICP, arteria responsable del infarto, tabaquismo y presencia de placa de ateroma en el aspirado coronario. La influencia de los primeros 3, así como el efecto protector del tabaquismo, coincide con lo publicado por otros autores en series amplias de pacientes con infarto agudo de miocardio21–23, aunque la causa de esta última asociación no está aclarada. En el modelo de regresión multivariable de Cox se incluyeron estas 5 variables, y fueron la FEVI y la presencia de placa en el aspirado las que resultaron predictoras independientes de MACE a largo plazo. La aspiración de placa se asoció inversamente a la tasa acumulada de MACE.
Con base en estos resultados, se postula que la presencia de placa de ateroma en los aspirados coronarios se asocia con un mejor pronóstico en pacientes con IAMCEST. La causa de esta asociación no se puede aclarar con nuestros datos. Solo se puede especular que los aspirados que contienen fragmentos de ateroma podrían identificar un grupo de pacientes con placas más grandes y/o más friables, en contraposición a otro grupo con más componente trombótico pero con menos ateroma. Este hecho podría ser reflejo de 2 mecanismos diferentes en la oclusión coronaria: el primero, resultado principalmente del sustrato de la pared arterial (rotura de la placa) y el segundo, dependiente sobre todo de factores sistémicos en la sangre circulante. Sin embargo, la obtención de placa también podría ser la consecuencia de una aspiración más completa o exitosa, aunque en nuestra serie el peso del aspirado se asoció inversamente a la presencia de fragmentos de ateroma, lo cual hace poco probable esta última teoría.
Por otra parte, en la mayoría de los casos, se identificaron fragmentos de placa a través de la tinción diferencial de macrófagos con anticuerpos específicos (CD68). La tinción con CD68 resulta ser la técnica más útil para este fin, aunque en algunos casos (17%) la placa no contenía macrófagos y fue la presencia de fibras musculares lisas, células endoteliales, cristales de colesterol o depósitos de hierro lo que permitió identificarlos.
Está documentado que la proporción de macrófagos presentes en la placa después de la endarterectomía carotídea también puede predecir la reestenosis. Helling et al.24 encontraron que los pacientes con placas ricas en macrófagos tienen menor riesgo de reestenosis (odds ratio [OR] = 0,43; IC95%, 0,26-0,72), independiente de otros factores. También la existencia de un núcleo lipídico grande (> 40%) se asocia a menor riesgo de reestenosis (OR = 0,40; IC95%, 0,19-0,81) en dicho estudio. Nuestros datos no nos permiten explorar esta hipótesis, dado que el seguimiento no incluyó una angiografía, lo cual podría representar un objetivo potencial de la investigación.
Varios autores han realizado análisis histológicos de los aspirados coronarios de pacientes con IAMCEST en series de tamaño variado, centrándose en diferentes aspectos histopatológicos11,12,18,19,25–28. La mayor serie es la publicada por Kramer et al.12, con 1.315 pacientes. En ese estudio, el 40% de los aspirados coronarios contenía trombo lítico u organizado (> 1 día), y esta característica histológica se asoció de manera independiente con la mortalidad a largo plazo (HR = 1,83; IC95%, 1,14-2,93; p = 0,01). Sin embargo, los autores reconocen que el perfil de riesgo de los pacientes con trombo de larga evolución puede ser diferente del de los pacientes con trombo fresco. La presencia de placa no se asoció con la supervivencia en esta serie, en la que no se realizaron análisis inmunohistoquímicos. En nuestros casos, dicho análisis fue fundamental para la caracterización del aspirado.
En otro estudio de 892 pacientes11, el riesgo de recuperación incompleta del ST tendió a ser mayor entre los pacientes con trombo antiguo (OR = 1,33; IC95%, 0,95-1,85; p = 0,097), y la recuperación del ST fue un fuerte predictor de mortalidad a largo plazo en esta serie. Aunque nuestros datos no respaldan la relación entre la edad del trombo y el resultado clínico, sí hubo asociación entre la edad del trombo y el tiempo de isquemia, de modo que el tiempo de isquemia total (inicio del dolor-balón) en pacientes con trombo antiguo era casi el doble que el de los pacientes con trombo fresco (4,3 y 2,4 h respectivamente; p = 0,007).
LimitacionesNuestro estudio presenta varias limitaciones. En primer lugar, el pequeño número de pacientes, lo que aumenta la probabilidad de pasar por alto asociaciones entre las variables. Ello nos impide también analizar de manera independiente los componentes de la variable combinada MACE. En segundo lugar, la formación del trombo arterial depende no solo de la trombogenicidad de la pared vascular, sino también de factores circulantes y de las características del flujo sanguíneo, que no han sido evaluados. En tercer lugar, la técnica de aspiración no permite la recuperación completa del material trombótico de la mayoría de los pacientes con IAMCEST.
CONCLUSIONESLa principal conclusión de este estudio es que la presencia de fragmentos de placa de ateroma en el aspirado coronario de pacientes con IAMCEST puede proporcionar información pronóstica adicional, y el estudio inmunohistoquímico con CD68 es un buen método para detectarlos. La presencia de placa podría estar asociada a una evolución más favorable, independientemente de otros factores de riesgo ya conocidos, y su ausencia podría constituir un marcador para aplicar estrategias preventivas más intensivas en cuanto al uso de fármacos antiagregantes y anticoagulantes.
- -
La relación entre la histología del aspirado coronario y la evolución de los pacientes con IAMCEST solo se ha analizado en un estudio previo, en el que la edad del trombo fue predictor de mortalidad.
- -
En las series publicadas, más de un tercio de los aspirados contiene fragmentos de placa; sin embargo, desconocemos los factores que determinan su presencia y si esta tiene alguna relación con el pronóstico.
- -
La principal aportación de este estudio es que la presencia de fragmentos de placa de ateroma en el aspirado coronario de pacientes con IAMCEST puede proporcionar información pronóstica adicional.
- -
El estudio inmunohistoquímico con CD68 es de gran ayuda para identificarlos.
Ninguno.
Este trabajo ha sido posible gracias a la colaboración del equipo de enfermería de hemodinámica y a los médicos de cardiología de nuestro centro que participaron en la recopilación de la información clínica de los pacientes. Mención especial a Diego García Fresnadillo, técnico del laboratorio de anatomía patológica, por el procesamiento de las muestras.