Cuando tenemos que decidir el mejor régimen antiagregante para un paciente al que realizamos una intervención coronaria percutánea (ICP), son muchas las variables que debemos tener en cuenta para intentar aportar un mejor pronóstico con la reducción de las complicaciones isquémicas, pero sin que ello suponga un incremento no asumible del número de eventos hemorrágicos.
El objetivo que buscamos con la antiagregación en los pacientes sometidos a ICP es triple: reducir la carga trombótica y el riesgo de no reflujo en los pacientes agudos (en un ambiente claramente inestable), reducir el daño derivado de la angioplastia (rotura de placa, disección iatrogénica, oclusión de ramas laterales, embolización distal) y, por último, prevenir la trombosis del stent, complicación cada vez menos incidente con los stents actuales, pero con gran trascendencia pronóstica1.
Es por esto que el cuadro clínico que determina la revascularización es un aspecto clave a la hora de decidir intensidad y duración de la antiagregación. Así, los síndromes crónicos (placas estables sin componente trombótico o rotura de placa) son «menos demandantes» de fármacos antiagregantes potentes y, en la mayoría de los casos, requieren periodos más cortos de tratamiento antiagregante plaquetario doble (TAPD) que cuando se revasculariza a un paciente por un síndrome coronario agudo (SCA)2,3. Los SCA son los grandes beneficiarios del prasugrel y el ticagrelor, así como de regímenes prolongados de antiagregación plaquetaria más allá del año3,4.
Pero cada vez tenemos más claro que no todo es la presentación clínica y debemos considerar siempre la extensión de la enfermedad coronaria y la complejidad de la ICP realizada.
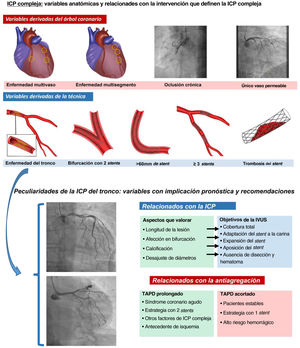
ANTIAGREGACIÓN EN LESIONES COMPLEJASEs escasa la información sobre la duración óptima de la TAPD para pacientes sometidos a una ICP compleja, bien por extensión de la enfermedad, bien por la complejidad de la técnica. Dentro de este epígrafe de lesiones complejas se incluye el abordaje de al menos 3 lesiones, implante de 3 o más stents, lesiones largas con implante de stent> 60 mm, bifurcaciones tratadas con 2 stents, oclusiones crónicas y la enfermedad del tronco común (figura 1). Lo que sabemos es que estas lesiones complejas se asocian con peor pronóstico, fundamentalmente en el primer año, por la presencia de más eventos isquémicos5. Algunos estudios indican que la TAPD prolongada aporta un mejor pronóstico a estos pacientes por reducción de eventos isquémicos sin aumento significativo de las complicaciones hemorrágicas; este beneficio de la TAPD prolongada se encuentra especialmente en pacientes con puntuación DATP ≥ 2 (mayor reducción de infarto y eventos isquémicos mayores respecto a pacientes con TAPD de 12 meses de duración)5.
Un aspecto nunca comentado pero real es que las lesiones complejas, además del mayor riesgo isquémico intrínseco, se pueden asociar con resultados de la intervención no tan buenos. En estas lesiones, la infraexpansión de los stents, la falta de aposición, la cobertura de las placas no completa, etc., pueden producirse en mayor medida que en lesiones favorables y son, sin duda, variables relacionadas con peor pronóstico isquémico. Estos resultados subóptimos de la ICP muchas veces no se reflejan en los informes clínicos por ser incluso desconocidos. Sin duda, una de las principales limitaciones de la angiografía es la valoración del resultado de la ICP en este tipo de lesiones.
Volviendo a la antiagregación plaquetaria en este campo, la última guía europea de infarto agudo de miocardio sin elevación del segmento ST3 va más allá y se posiciona de una manera importante recomendando la prolongación de la TAPD (indicación IIa A) para pacientes con alto riesgo isquémico, basada en el juicio clínico, la historia del paciente y la anatomía coronaria. Así, los autores nos invitan a tener en cuenta una serie de criterios clínicos de riesgo (diabetes mellitus, recurrencia de infarto, enfermedad multivaso, enfermedad polivascular o insuficiencia renal moderada) o angiográficos (antes mencionados). El posicionamiento actual de esta guía es recomendar para estos pacientes la prolongación de la TAPD siempre que el riesgo hemorrágico no sea alto.
Por lo tanto, ya no es solo la presentación clínica lo que va a determinar qué pacientes se beneficiarán en mayor medida de prolongar la TAPD, sino que lo son también las características angiográficas y la técnica percutánea.
Los nuevos antiagregantes plaquetarios deben ser los fármacos electivos siempre en el SCA si no hay contraindicación, al igual que en los regímenes prolongados de TAPD si el riesgo hemorrágico no es alto3. Pero, para complicar más lo que empezábamos a tener claro, surgen estudios en esta población en los que la monoterapia con antiagregantes plaquetarios potentes reduce los sangrados mayores sin que se presenten más eventos isquémicos respecto a los pacientes con TAPD. Así, datos del Twilight en pacientes sometidos a ICP compleja muestran que los pacientes con ticagrelor en monoterapia a partir de los 3 meses, frente a los que toman ticagrelor y ácido acetilsalicílico durante 12 meses, presentan una menor incidencia de sangrados mayores (el 1,1 frente al 2,6%; hazard ratio [HR]=0,41; intervalo de confianza del 95% [IC95%], 0,21-0,80), sin diferencia en eventos isquémicos (muerte, infarto o ictus) (el 3,8 frente al 4,9%; HR=0,77; IC95%, 0,52-1,15) ni en trombosis del stent6. Debemos destacar que solo se revascularizó por un infarto agudo de miocardio al 30% de estos pacientes, y en el Twilight predominaban los pacientes estables. Por lo tanto, parece que en este tipo de lesiones el ticagrelor en monoterapia sería igual de eficaz que la TAPD, pero aportando más seguridad.
PECULIARIDADES ANATÓMICAS Y TÉCNICAS DE LA ICP DEL TRONCOHay enfermedad del tronco coronario en el 5% de los cateterismos realizados en pacientes isquémicos. En España, cada año se trata con ICP en torno a 4.000 pacientes con enfermedad del tronco7.
Su abordaje debe ser exquisito, por la trascendencia derivada de complicaciones durante y después del procedimiento y por la implicación pronóstica que conlleva obtener un buen resultado. Sin duda, los stents actuales han disminuido la trombosis subaguda y tardía y son un instrumento indispensable que ha contribuido a gran parte de las mejoras pronósticas. Pero hay otros aspectos importantes que deben tenerse en cuenta a la hora de realizar ICP del tronco: este segmento siempre implica grandes diámetros, discordancia importante entre segmentos proximales y distales y en un porcentaje muy elevado de los casos es necesario el abordaje de una bifurcación, sin duda, la más importante del árbol coronario. Los potenciales problemas técnicos son obvios: riesgo de infraexpansión o mala aposición de los stents, la presencia de 2 o 3 capas de stent a nivel de la carina (cuando el abordaje del tronco se hace con 2 stents), aspectos que se han relacionado con mayor incidencia de eventos isquémicos al suspender la TAPD8.
Por lo tanto, es fundamental conseguir un resultado óptimo, que al fin y al cabo se va a relacionar con mejor pronóstico. La imagen intracoronaria, con ecografía intravascular (IVUS) o con tomografía óptica computarizada, es uno de los pilares básicos para ayudarnos a conseguir este propósito (figura 1). Por un lado, estas técnicas nos aportan información diagnóstica relevante (diámetros, calcificación, excentricidad de la lesión, afectación de los ostium coronarios de la descendente anterior y circunfleja) que nos ayudará sin duda a diseñar la mejor estrategia terapéutica. Pero, además, suple la gran limitación de la angiografía convencional a la hora de valorar un resultado tras la ICP y permite diagnosticar la infraexpansión y la mala aposición de los stents, tan frecuentes en esta lesión. La optimización de la ICP del tronco, guiada fundamentalmente por IVUS, ha demostrado mejora del pronóstico de estos pacientes frente al de aquellos cuya ICP se realizó solo con angiografía9, hasta el punto de que la última guía europea de revascularización la recomienda con indicación IIa10.
El panel superior muestra las variables anatómicas y las relacionadas con la técnica, que definen la ICP compleja. En la parte inferior se muestran aspectos importantes de la ICP del tronco. Se describen las variables anatómicas que pueden optimizarse con el uso del IVUS en la ICP del tronco coronario izquierdo, así como los aspectos clínicos y técnicos que pueden orientar a prolongar o acortar la duración del TAPD. ICP: intervención coronaria percutánea; IVUS: ecografía intravascular; TAPD: tratamiento antiagregante plaquetario doble.
Por estas razones (enfermedad ateroesclerótica en el segmento más trascendente del árbol coronario, por las características técnicas de la ICP y el riesgo de trombosis del stent, que sigue produciéndose en un 0,7-3% en el seguimiento a 3-5 años11,12), siempre surge la duda de cómo y cuánto antiagregar a estos pacientes.
La enfermedad del tronco obviamente siempre se incluye en las lesiones complejas, pero a pesar de la importancia del problema, volvemos a tener poca información relevante que nos decante por recomendar un régimen antiagregante plaquetario sobre otro. En primer lugar, porque estos pacientes están infrarrepresentados en el campo de las lesiones complejas y, segundo, porque la investigación alrededor de la ICP del tronco se ha realizado sobre todo para mostrar su eficacia y su seguridad frente a la cirugía, hasta hace unos años casi la única estrategia de revascularización para estos pacientes11,12.
Por ello, la información a favor o en contra de los regímenes prolongados de TAPD en la ICP del tronco es escasa y muchas veces discordante. La discordancia de los datos está explicada en gran medida por el pequeño número de pacientes analizados y por tratarse de análisis post hoc de estudios diseñados con otros objetivos.
Por estas razones, debemos considerar de gran valor los hallazgos publicados recientemente por Cho et al. en Revista Española de Cardiología13. Los autores analizan, en 1.827 pacientes de 2 registros multicéntricos y prospectivos que se sometieron a ICP del tronco con stents de segunda generación, el efecto pronóstico de prolongar el TAPD. La prolongación del TAPD (> 12 meses) se asoció con menor incidencia de eventos isquémicos. Concretamente la HR ajustada por eventos isquémicos (muerte cardiaca, infarto o trombosis del stent) fue significativamente mayor en pacientes con TAPD <6 meses (HR=4,51; IC95%, 2,96-6,88) y en el que se indicó TAPD de 6 a 12 meses (HR=1,92; IC95%, 1,23-3,00) que para los pacientes cuyo TAPD se prolongó más allá del año. Este importante beneficio clínico no se acompañó de más eventos hemorrágicos en el grupo con prolongación del TAPD, que mostraron una incidencia especialmente baja. Esta similar y baja incidencia de sangrados en el medio plazo en pacientes con ICP del tronco también ha sido publicada por otros grupos14.
Debemos hacer algún comentario sobre los buenos resultados publicados en el artículo de Cho et al.13. En primer lugar, se trata de un grupo con amplia experiencia en la ICP del tronco (lo demuestra el alto número de pacientes tratados, así como los artículos relevantes publicados en este campo), variable a tener en cuenta siempre. El 75,4% de los pacientes fueron tratados por un SCA. Respecto a la técnica, la estrategia electiva fue la angioplastia con 1 stent (83,3%) y se usó el IVUS en el 60,7%. Estos aspectos son muy importantes y deben valorarse al intentar reproducir los resultados.
Por otro lado, la baja incidencia de eventos hemorrágicos puede explicarse por aspectos quizás más sesgados: uso de la definición de sangrado Thrombolysis in Myocardial Infarction (TIMI); muy baja penetración de los nuevos antiagregantes plaquetarios (5,4%) en una población en la que predomina el SCA y la enfermedad multivaso está presente en el 70,1%; la TAPD prolongada se indicaba a pacientes que no habían sufrido eventos hemorrágicos, por lo que se trata de una población seleccionada. Pero este último planteamiento no se debe considerar una limitación, sino quizás más bien una estrategia. Como los autores plantean, sus hallazgos deben interpretarse como provisionales y generadores de hipótesis y, obviamente, confirmarse en ensayos clínicos dirigidos a resolver esta cuestión.
Para concluir y a modo de resumen, es cierto que la indicación del TAPD está determinada fundamentalmente por el cuadro clínico pero, con la información disponible y las recomendaciones de las guías de práctica clínica, quizás deberíamos plantear una prolongación del TAPD en los casos de lesiones complejas o la ICP del tronco siempre que nuestro paciente no haya tenido eventos hemorrágicos a los 6 o 12 meses. Estas estrategias van a reducir los eventos isquémicos en los pacientes con más riesgo, probablemente asumiendo costes bajos.
Pero es indudable que nos falta más información relevante, estudios definitivos que analicen esta cuestión en esta población concreta y compleja, y que al fin y al cabo reafirmen las recomendaciones actuales. Mientras esperamos esta información, individualicemos el régimen antiagregante plaquetario para cada paciente. Además de valorar el cuadro clínico y el riesgo isquémico y hemorrágico, debemos tener en cuenta la anatomía coronaria con la extensión de la enfermedad y la complejidad de la ICP. Todo esto debe llevarnos a recomendar el mejor régimen antiagregante plaquetario para cada uno de nuestros pacientes. Eso sí, sin olvidar que estas recomendaciones no deben ser estáticas y deben adaptarse a las eventualidades clínicas que puedan surgir.
FINANCIACIÓNNinguna.
CONFLICTO DE INTERESESJ.M. Ruiz-Nodar declara haber recibido honorarios por ponencias de AstraZeneca, Biosensor y Terumo.
AGRADECIMIENTOSA Marta Terol Ballester por la realización de las ilustraciones de este manuscrito.