La función o score de Framingham tradicional subestima el riesgo cardiovascular en ciertas poblaciones. Extender el horizonte temporal a 30 años y evaluar la relación con la presencia de placas ateroscleróticas carotídeas podría mejorar la estratificación de riesgo. Los objetivos fueron: a) determinar qué porcentaje de pacientes analizados con el score tradicional reclasifica aplicando el Framingham a 30 años; b) analizar la prevalencia de placa aterosclerótica carotídea, y c) determinar la capacidad diagnóstica del score a 30 años para detectar placas carotídeas.
MétodosSe realizó un eco-Doppler carotídeo y se calculó el score de Framingham a 10 y 30 años (basado en lípidos e índice de masa corporal) para eventos cardiovasculares «duros» en una población de pacientes en prevención primaria. Se determinó la prevalencia de placa carotídea. Se realizo un análisis ROC.
ResultadosSe incluyó a 305 sujetos (edad 48 ± 11 años; el 52%, varones). Las funciones a 30 años basadas en lípidos e índice de masa corporal reclasificaron el 70 y el 63% de la población respectivamente. La prevalencia de placa carotídea fue del 28,5% y se asoció en forma gradual con la categoría de riesgo. El área bajo la curva y el punto de corte óptimo del score a 30 años para detectar placa carotídea fueron 0,862 y 26% (basado en lípidos) y 0,845 y 22% (basado en el índice de masa corporal).
ConclusionesEl score a 30 años reclasificó a un gran número de pacientes y discriminó entre sujetos con o sin evidencia de placas carotídeas.
Palabras clave
La enfermedad cardiovascular es la primera causa de morbimortalidad1. La evaluación del riesgo cardiovascular es la manera más adecuada de discriminar entre individuos que requieren medidas intensivas en el control de sus factores de riesgo y quienes, por su muy bajo riesgo, no las necesitan. Como consecuencia de los resultados de estudios epidemiológicos de grandes dimensiones, surgieron modelos multivariables predictivos a partir de los cuales se diseñaron ecuaciones de predicción clínica2,3,4,5,6,7. Los scores de riesgo cardiovascular son herramientas muy útiles en la práctica clínica, pero tienen limitaciones relacionadas con la calibración y capacidad de discriminación del modelo8,9. Estas variaciones dependen de factores poblacionales, étnicos e individuales. Por lo tanto, es fundamental que los nuevos scores de riesgo se valoren en poblaciones diferentes de las involucradas en su diseño. La cohorte estudiada en la ciudad estadounidense de Framingham comenzó en 1948 y determinó la publicación del score de riesgo más comúnmente utilizado, el score de Framingham a 10 años (SF10)2,10. El tercer informe del Panel de Expertos del National Cholesterol Education Program (NCEP) sobre la detección, evaluación y tratamiento del colesterol sanguíneo elevado en adultos (Adult Treatment Panel III) incorporó el SF10 como una herramienta fundamental en la estratificación del riesgo cardiovascular a partir del cual se determinan los objetivos o metas terapéuticas11. Sin embargo, dicho score presenta algunas debilidades, fundamentalmente el hecho de subestimar el riesgo cardiovascular en ciertas poblaciones, como en los jóvenes o en las mujeres. Teniendo en cuenta que la mayoría de los eventos cardiovasculares ocurren en poblaciones de riesgo bajo o moderado12, surge la necesidad de contar con herramientas predictivas más eficaces. Una opción es extender el periodo para predecir los eventos vasculares, lo que da al médico y el paciente otra perspectiva del problema. Recientemente se ha publicado un nuevo score (basado en los descendientes de la cohorte de Framingham original) que extiende el horizonte temporal de 10 a 30 años (SF30)13. Se diseñaron dos modelos, uno basado en las concentraciones lipídicas en sangre (colesterol total y colesterol unido a lipoproteínas de alta densidad) y el otro basado en el índice de masa corporal. Otra alternativa es incorporar nuevos elementos pronósticos (biomarcadores o métodos diagnósticos que identifiquen aterosclerosis subclínica) a la estimación del riesgo cardiovascular basada en factores de riesgo clásicos. El diagnóstico de placa aterosclerótica carotídea (PAC) es un objetivo subrogado y constituye un predictor independiente de eventos coronarios. Desafortunadamente, por la escasa disponibilidad de dichos recursos o por el aumento en los costos, la detección de PAC no se puede efectuar en todos los centros asistenciales. Teniendo en cuenta las consideraciones anteriormente expresadas, los objetivos de nuestro trabajo fueron: a) determinar a cuántos pacientes analizados con el SF10 se reclasificaba al aplicar el SF30; b) analizar la prevalencia de PAC en una población estratificada por el SF30, y c) determinar el punto de corte óptimo (PCO) del SF30 que discrimine entre sujetos con o sin evidencias de PAC.
MétodosSe realizó un estudio descriptivo transversal de una muestra de población consecutiva obtenida en el consultorio de prevención cardiovascular del servicio de cardiología del Hospital Italiano de Buenos Aires entre el 1 de enero y el 20 de junio de 2010.
Criterio de inclusiónCualquier sujeto que concurrió al consultorio de prevención cardiovascular mayor de 20 y menor de 60 años (límite de edad que permite calcular el riesgo mediante el SF30).
Criterios de exclusión1. Enfermedad cardiovascular previa (infarto agudo de miocardio, angina inestable, angina crónica estable, cirugía de revascularización miocárdica, angioplastia coronaria, accidente cerebrovascular, enfermedad vascular periférica, enfermedad de la aorta o cualquiera de sus ramas).
2. Antecedentes personales de diabetes mellitus.
3. Tratamiento hipolipemiante previo.
Se calculó el SF10, definiendo como de riesgo bajo, moderado o alto si el riesgo era < 10%, entre 10 y 19% y ≥ 20%. Se realizó también el SF30 basado en los lípidos (SF30L) y el SF30 basado en el índice de masa corporal (SF30I) para eventos «duros»: infarto agudo de miocardio, muerte de origen coronario y accidente cerebrovascular. Se calculó a cuántos pacientes se reclasificaba por la nueva puntuación; se definió de bajo riesgo si el riesgo era ≤ 12% y de alto riesgo si era ≥ 40%. Dichos puntos surgen de la publicación original realizada por Pencina et al13 en 2009. Se definió PAC cuando se detectaba una placa aterosclerótica en las arterias carótidas en forma no invasiva mediante imágenes ultrasónicas en modo bidimensional, con un ecógrafo Logiq Book XP (General Electric®) con un transductor lineal de 7,5MHz. Se consideró placa cuando se cumplían los siguientes requisitos: a) espesor de la pared anormal (definida como un espesor medio-intimal > 1,5 mm); b) estructura anormal (protrusión hacia la luz, pérdida de alineación con la pared adyacente), y c) ecogenicidad anormal de la pared. Se comparó la prevalencia de PAC entre las diferentes categorías de riesgo. Se realizo un análisis ROC (receiver operating characteristic); se determinó el área bajo la curva con el objeto de valorar la precisión del SF30 para discriminar entre sujetos con o sin PAC. Para determinar el PCO del SF30L y del SF30I para detectar PAC se utilizó el índice de Younden que corresponde a la máxima distancia vertical entre la curva ROC y la línea de chance estadística (punto CJ)14. Se calcularon sensibilidad, especificidad, valor predictivo positivo y valor predictivo negativo. Los datos continuos entre dos grupos se analizaron con la prueba de la t si la distribución de las variables era normal (ANOVA con más de dos grupos) o con la de Wilcoxon-Mann-Withney si no lo era. El análisis de los datos categóricos se realizó con la prueba de la χ2. Para analizar la concordancia entre dos métodos de clasificación se utilizó el índice de kappa de Cohen. Las variables continuas se expresaron como media ± desviación estándar, mientras que las variables categóricas se expresaron como porcentajes. Se definió como estadísticamente significativo un valor de p < 0,05.
El estudio se realizó según las recomendaciones en investigación médica señaladas por la declaración de Helsinki, las guías de buenas prácticas clínicas y las normativas del comité de ética local.
ResultadosSe incluyó en total a 305 pacientes. Las características de la población pueden observarse en la Tabla 1.
Tabla 1. Características de la población
| Varones (n=160) | Mujeres (n=145) | Total (n=305) | |
| Variables continuas | |||
| Edad, años | 45±12 | 51±9 | 48±11 |
| Presión arterial sistólica, mmHg | 127±14 | 126±12 | 126±12 |
| Colesterol total, mg/dl | 220±47 | 226±38 | 223±43 |
| cLDL, mg/dl | 147±40 | 147±40 | 147±40 |
| cHDL, mg/dl | 41±10 | 56±13 | 48±14 |
| Triglicéridos, mg/dl | 154±94 | 119±60 | 136±81 |
| Apolipoproteína B, mg/dl | 110±31 | 108±27 | 110±31 |
| Apolipoproteína A1, mg/dl | 147±32 | 163±28 | 147±32 |
| Proteína C reactiva, mg/dl | 1,26±1,15 | 1,38±1,21 | 1,34±1,19 |
| Índice de masa corporal | 27,6±3 | 25,3±4 | 26,5±4 |
| Glucemia, mg/l | 98±11 | 94±10 | 96±12 |
| Variables categóricas | |||
| Fumadores | 38 (24) | 30 (21) | 68 (22) |
| Tratamiento antihipertensivo | 52 (33) | 38 (26) | 90 (29,5) |
| SF10 | |||
| Bajo riesgo | 106 (66) | 138 (95) | 244 (80) |
| Riesgo moderado | 46 (29) | 7 (5) | 53 (17) |
| Alto riesgo | 8 (5) | 0 | 8 (3) |
| SF30L | |||
| Bajo riesgo | 32 (20) | 39 (27) | 71 (23) |
| Riesgo moderado | 82 (51) | 95 (66) | 177 (58) |
| Alto riesgo | 46 (29) | 11 (7) | 57 (19) |
| SF30I | |||
| Bajo riesgo | 39 (24) | 48 (33) | 87 (29) |
| Riesgo moderado | 81 (51) | 96 (66) | 177 (58) |
| Alto riesgo | 40 (25) | 1 (1) | 41 (13) |
cHDL: colesterol unido a lipoproteínas de alta densidad; cLDL: colesterol unido a lipoproteínas de baja densidad; SF10: score de Framingham a 10 años; SF30I: score de Framingham a 30 años basado en el índice de masa corporal; SF30L: score de Framingham a 30 años basado en lípidos.
Los datos expresan media ± desviación estándar o n (%).
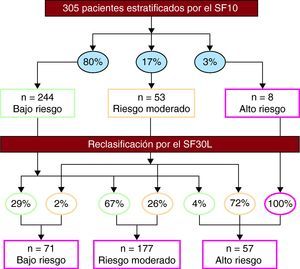
Según el SF30L, el 23, el 58 y el 19% de los pacientes tenían riesgo bajo, moderado y alto respectivamente. Dicho score reclasificó al 70% de la población analizada con el SF10 (Figura 1). Se recategorizó al 68 y el 3,6% de las mujeres de bajo riesgo (n=138) como riesgo moderado y alto, y al 65 y el 5,7% de los varones con bajo riesgo (n=106), como riesgo moderado y alto respectivamente.
Figura 1. Reestratificación de la población según el score de Framingham a 30 años basado en los lípidos (SF30L). Los porcentajes mostrados en los óvalos indican la proporción de sujetos distribuidos según las categorías de riesgo basado en el score de Framingham a 10 años (SF10) (arriba) y el SF30L (abajo).
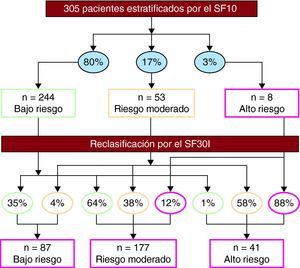
Aplicando el SF30I, el 29, el 58 y el 13% de los pacientes tenían riesgo bajo, moderado y alto respectivamente. Dicha función reclasificó al 63% de la población analizada con el SF10 (Figura 2). El 66% de las mujeres de bajo riesgo se recategorizó como riesgo moderado, y el 61 y el 2,8% de los varones de riesgo bajo, como riesgo moderado y alto respectivamente.
Figura 2. Reestratificación de la población según el score de Framingham a 30 años basado en el índice de masa corporal (SF30I). Los porcentajes mostrados en los óvalos indican la proporción de sujetos distribuidos según las categorías de riesgo basado en el score de Framingham a 10 años (SF10) (arriba) y el SF30I (abajo).
La concordancia en la clasificación como «bajo» o «no bajo» riesgo fue muy baja al comparar el SF10 con el SF30L (kappa=0,13) y con el SF30I (kappa=0,16).
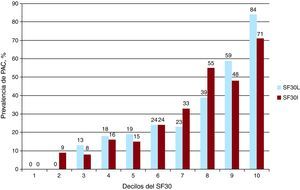
Prevalencia de placa aterosclerótica carotídea según las categorías de riesgoLa prevalencia general de PAC fue del 28,5%. Al analizar a la población con el SF10, la prevalencia de PAC fue del 19, el 60 y el 100% en los sujetos con riesgo bajo, moderado y alto respectivamente (p < 0,0001). Utilizando el SF30L, la prevalencia fue la siguiente: riesgo bajo, 0; riesgo moderado, el 23%; riesgo alto, el 81% (p < 0,0001). Por otro lado, la prevalencia de PAC aplicando el SF30I fue del 2, el 31 y el 76% en los sujetos con riesgo bajo, moderado y alto respectivamente (p < 0,0001). Los resultados fueron similares al analizar a la población según el sexo, aunque la prevalencia en la categoría de alto riesgo fue más alta en las mujeres (Tabla 2). Se encontró una correlación positiva entre los deciles del SF30 y la prevalencia de PAC (Figura 3).
Tabla 2. Prevalencia de placa aterosclerótica carotídea según las categorías de riesgo del score de Framingham a 10 y 30 años
| SF10 (%) | SF30L (%) | SF30I (%) | |
| Total | |||
| Bajo riesgo | 19 | 0 | 2 |
| Riesgo intermedio | 60 | 23 | 31 |
| Alto riesgo | 100 | 81 | 76 |
| Varones | |||
| Bajo riesgo | 18 | 0 | 3 |
| Riesgo intermedio | 57 | 21 | 27 |
| Alto riesgo | 100 | 78 | 75 |
| Mujeres | |||
| Bajo riesgo | 20 | 0 | 2 |
| Riesgo intermedio | 86 | 25 | 33 |
| Alto riesgo | — | 91 | 100 |
SF30I: score de Framingham a 30 años basado en el índice de masa corporal; SF30L: score de Framingham a 30 años basado en los lípidos.
Figura 3. Relación entre los deciles del score de Framingham a 30 años y la prevalencia de placa aterosclerótica carotídea. PAC: placa aterosclerótica carotídea; SF30: score de Framingham a 30 años; SF30I: score de Framingham a 30 años basado en el índice de masa corporal; SF30L: score de Framingham a 30 años basado en los lípidos.
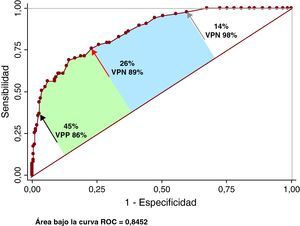
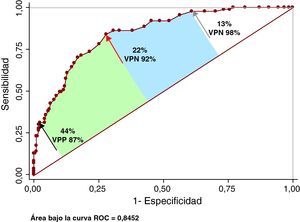
Análisis ROCEl área bajo la curva del SF30L para detectar PAC fue 0,862 (intervalo de confianza [IC] del 95%, 0,818-0,905; Younden, 0,53) y el PCO ≥ 26% (sensibilidad, 76%; especificidad, 77%; valor predictivo positivo, 57%; valor predictivo negativo, 89%) (Figura 4). Se exploró un punto de corte de elevada sensibilidad (14%; sensibilidad, 97,7%), y otro de elevada especificidad (45%; especificidad, 97,7%). El valor predictivo negativo del primero fue del 98% y el valor predictivo positivo del segundo, el 86%. El área bajo la curva del SF30I para detectar PAC fue 0,845 (IC del 95%, 0,798-0,891; Younden, 0,55) y el PCO ≥ 22% (sensibilidad, 84%; especificidad, 72%; valor predictivo positivo, 54%; valor predictivo negativo, 92%) (Figura 5). Se analizó un punto de corte de elevada sensibilidad (13%; sensibilidad, 97,7%), y otro de elevada especificidad (44%; especificidad, 97,7%). El valor predictivo negativo del primero fue del 98% y el valor predictivo positivo del segundo, el 87%.
Figura 4. Precisión del score de Framingham a 30 años basado en los lípidos para detectar placa aterosclerótica carotídea. La flecha roja indica la ubicación del punto de corte óptimo, la flecha negra, el punto de corte exploratorio de elevada especificidad y la flecha gris, el de elevada sensibilidad. Véase explicación en el texto. ROC: receiver operating characteristic; VPN: valor predictivo negativo; VPP: valor predictivo positivo.
Figura 5. Precisión del score de Framingham a 30 años basado en el índice de masa corporal para detectar placa aterosclerótica carotídea. La flecha roja indica la ubicación del punto de corte óptimo, la flecha negra, el punto de corte exploratorio de elevada especificidad y la flecha gris, el de elevada sensibilidad. Véase explicación en el texto. ROC: receiver operating characteristic; VPN: valor predictivo negativo; VPP: valor predictivo positivo.
DiscusiónLa mayoría de las ecuaciones de riesgo utilizadas en todo el mundo estiman el riesgo de desarrollar un evento cardiovascular en los siguientes 10 años. Utilizando este horizonte temporal, aproximadamente el 80% de los eventos cardiovasculares se producen en individuos con bajo riesgo basal12. El SF10 es incapaz de identificar a sujetos con riesgo vascular elevado entre varones menores de 40 años y clasifica a la mayoría de las mujeres menores de 70 años como con bajo riesgo cardiovascular15,16. En los últimos años, se han desarrollado dos estrategias para resolver dicho problema. La primera de ellas es encontrar algún biomarcador que mejore el poder predictivo de un modelo basado en los factores de riesgo tradicionales7. La segunda estrategia es la detección de aterosclerosis carotídea subclínica o en otro territorio vascular mediante estudios de imágenes (p. ej., score de calcio coronario por tomografía computarizada, el índice tobillo-brazo o el espesor íntima-media/placa carotídea por ultrasonido)17,18,19. Un metaanálisis mostró que el riesgo relativo de infarto agudo de miocardio aumenta el 10% por cada 0,1 mm de incremento del espesor íntima-media independientemente de los factores de riesgo clásicos20. Existe además una correlación entre el espesor íntima-media y el riesgo cardiovascular estimado por el SF1021,22. En un trabajo realizado en Argentina publicado previamente, se reclasificó a 1 de cada 2 pacientes considerados inicialmente como con bajo riesgo cardiovascular por diferentes tablas de predicción clínica al detectar PAC por ecografía Doppler23. La prevalencia de placas carotídeas detectadas en nuestro estudio es menor que la del trabajo anteriormente comentado (el 28,5 frente al 53%), pero en sintonía con otras publicaciones internacionales24, probablemente por tratarse de distintas poblaciones o por considerar «placa carotídea» con diferentes criterios. En nuestro estudio la detección de PAC se asoció en forma gradual con la categoría de riesgo independientemente del score utilizado; sin embargo, la prevalencia de PAC en la categoría de bajo riesgo fue significativamente mayor al utilizar la función a 10 años (aproximadamente, 1 de cada 5 pacientes). Una reciente revisión que incluyó a 13.145 sujetos demostró que la incorporación del espesor íntima-media y la presencia o no de PAC a un modelo conformado con los factores de riesgo tradicionales mejoraba la predicción de eventos cardiovasculares25. La presencia de PAC fue más predictiva del riesgo de cardiopatía isquémica que el espesor mediointimal; esto reafirma que al detectar una placa no estamos valorando sólo un objetivo subrogado, sino además un proceso que, en sí mismo, confirma el comienzo de la enfermedad aterosclerótica. En dicho estudio, se reclasificó al 37,5% de los pacientes con un riesgo del 5-10% (basado en factores de riesgo clásicos) y el 38% de los sujetos con un riesgo del 10-20% al considerar la información del eco-Doppler carotídeo. Sin embargo, a pesar de que las principales guías de práctica clínica europeas y norteamericanas reconocen que estas técnicas son herramientas útiles para la estratificación del riesgo cardiovascular, no las incorporan «formalmente» en las recomendaciones finales y desaconsejan su utilización generalizada11,26,27. Las excepciones son el consenso de la Sociedad Americana de Ecocardiografía28 y las guías canadienses recientemente publicadas, que formalmente clasifican como de alto riesgo a los pacientes con aterosclerosis subclínica, y recomiendan medidas preventivas tan intensivas como en cualquier otro paciente en prevención secundaria29. Teniendo en cuenta la realidad sanitaria de muchos países, la posibilidad de generalizar la utilización de la ecografía Doppler carotídea para detectar aterosclerosis incipiente y, por consiguiente, «ajustar» el riesgo de nuestros pacientes es al menos discutible30. La posibilidad de contar con ecuaciones que predigan los eventos en un horizonte temporal mayor, pero basado en los factores de riesgo tradicionales, poco costosos y fáciles de obtener, constituye una opción interesante. En los sujetos del estudio prospectivo de Framingham que estaban libres de enfermedad cardiovascular a la edad de 50 años, el riesgo de que apareciera un evento durante el transcurso de toda su vida (hasta los 95 años) era del 51,7% (IC del 95%, 49,3-54,2%) en los varones y del 39,2% (IC del 95%, 37-41,4%) en las mujeres, con una mediana de sobrevida de 30 y 36 años respectivamente31. La evaluación del riesgo a largo plazo es de particular relevancia en las personas más jóvenes, ya que si observamos únicamente el riesgo a corto plazo desalentaríamos las modificaciones en el estilo de vida y al eventual tratamiento en muchos de los casos. En nuestro estudio, el SF30L reclasificó al 70% de la población total y al 71% del subgrupo con bajo riesgo. Del mismo modo, mediante el SF30I, se reclasificó al 73% de la totalidad de los sujetos y al 75% del subgrupo con bajo riesgo. La concordancia entre las funciones a 30 y a 10 años en clasificar o no a la población como con bajo riesgo fue baja. Probablemente la motivación en la implementación (y en su intensidad) de las medidas preventivas por parte del médico y la adherencia por parte del paciente difieran si se encuadra el riesgo cardiovascular basal de una manera u otra.
En nuestro estudio, el área bajo la curva ROC del SF30L y del SF30I para discriminar entre individuos con o sin PAC fue buena. Los puntos de corte óptimos del 26 y el 22% para los SF30 basados en lípidos y en el índice de masa corporal respectivamente tuvieron una elevada sensibilidad. El valor predictivo negativo fue elevado, lo que indica que si el SF30 se encuentra por debajo del PCO, la probabilidad de presentar PAC es muy baja. Un valor de corte exploratorio del 13-14% aumenta la sensibilidad, lo que implica una mayor seguridad para descartar PAC. Por otro lado, un punto de corte del 44-45% aumenta la especificidad y, por lo tanto, el valor predictivo positivo para la detección de placa. Por lo tanto, los puntos exploratorios comentados «sensibilizan» los resultados del SF30 porque recategorizarían automáticamente a los sujetos con un PCO < 13-14% o ≥ 44-45% a un estrato de muy bajo riesgo o muy alto riesgo respectivamente. Al observar la curva ROC, quedarían tres zonas con implicancias clínicas distintas. Los extremos, por debajo del punto exploratorio de elevada especificidad y por arriba del punto exploratorio de elevada sensibilidad, confirman o descartan con mucha precisión la presencia de PAC. La zona comprendida entre el PCO y el punto exploratorio de elevada especificidad corresponde a los puntos con mayor incertidumbre en los que la detección de PAC podría agregar información pronóstica. Finalmente, la zona entre el punto de elevada sensibilidad y el PCO corresponde a puntos de corte que discriminan aceptablemente entre sujetos con o sin placas carotídeas y la solicitud de otro método para confirmar la presencia de PAC quedará en manos del médico, según su juicio clínico y la realidad sanitaria del centro en el cual trabaja.
LimitacionesEn nuestro estudio se denominó PAC según la definición del grupo ARIC. Sin embargo, no existe en la literatura una definición uniforme y clara32. Cambiar la definición de placa podría modificar nuestros resultados. En la actualidad, algunas recomedaciones de expertos consideran aterosclerosis subclínica carotídea ante la presencia de placa y/o un espesor mediointimal > 1 mm. El análisis de este último dato no se incluyó en este trabajo.
Este estudio no fue desarrollado para validar si la reclasificación del riesgo es correcta. Para ello se necesitaría un estudio de cohortes con 30 años de seguimiento.
Consideramos que podría existir un sesgo de selección en la toma de la muestra, ya que los pacientes que acuden al consultorio de prevención cardiovascular no necesariamente representan a la población general. Estudios que se están desarrollando en nuestro centro ampliarán los conocimientos sobre este tema en una muestra más representativa y se comunicarán oportunamente.
La pequeña proporción de pacientes con alto riesgo en nuestro trabajo no permitiría sacar conclusiones sobre este subgrupo de pacientes.
Implicaciones clínicasLa medición del colesterol total y del colesterol unido a lipoproteínas de alta densidad es de bajo coste y la determinación del índice de masa corporal no implica gasto alguno; por lo tanto, el SF30 podría utilizarse en la gran mayoría de los centros médicos con el fin de mejorar las estrategias en prevención primaria reduciendo en una proporción elevada de pacientes la necesidad de la pesquisa de aterosclerosis subclínica.
ConclusionesEn esta población en prevención primaria, el nuevo SF30 reclasificó a un gran número de pacientes, indistintamente del modelo utilizado (basado en los lípidos o en el índice de masa corporal). Se observó además una fuerte asociación entre el riesgo estimado por el SF30 y la prevalencia de PAC. El SF30 resultó útil para predecir el diagnóstico de PAC y tal vez mejorar la estratificación de riesgo cardiovascular en una población con bajo riesgo según el SF10 tradicional, aunque esta última hipótesis debería probarse con estudios diseñados para la validación de funciones de riesgo.
Conflicto de interesesNinguno.
Recibido 6 Julio 2010
Aceptado 5 Noviembre 2010
Autor para correspondencia: Gascón 450, Ciudad Autónoma de Buenos Aires, C1181ACH Argentina. walter.masson@hospitalitaliano.org.ar