Existen pocos temas de actualidad equiparables a la posibilidad de la tecnología actual para desarrollar las mismas capacidades que el ser humano, incluso en medicina. Esta capacidad de simular los procesos de inteligencia humana por parte de máquinas o sistemas informáticos es lo que conocemos hoy en día como inteligencia artificial (IA). Este artículo pretende aclarar diferentes términos que todavía nos resultan lejanos como IA, machine learning (aprendizaje automático, AA), deep learning (aprendizaje profundo, AP), data science o big data; describir en profundidad el concepto de IA y sus tipos, las técnicas de aprendizaje y la metodología que se utiliza en el AA, el análisis en imagen cardiaca con AP, la aportación de esta revolución tecnológica a la estadística clásica, sus limitaciones actuales, sus aspectos legales y, fundamentalmente, sus aplicaciones iniciales en cardiología. En este sentido se ha realizado una búsqueda detallada en PubMed de la evolución en el último lustro de las contribuciones de la IA a las diferentes áreas de aplicación en cardiología, y se ha identificado un total de 673 artículos originales. Se describen en detalle 19 ejemplos de diferentes áreas de la cardiología que utilizando IA han mostrado mejoras diagnósticas y terapéuticas, y que facilitarán la comprensión de la metodología AA y AP.
Palabras clave
Existen pocos temas de actualidad equiparables a la posibilidad que tiene la tecnología actual para desarrollar las mismas capacidades que el ser humano, incluso en medicina. Esta capacidad de simular los procesos de la inteligencia humana por parte de las máquinas o sistemas informáticos es lo que conocemos hoy en día como inteligencia artificial (IA). La IA empieza a estar muy desarrollada en otras disciplinas profesionales y nuestro reto actual debe ser trasladar todo este desarrollo al ámbito médico y en concreto a la cardiología.
Este artículo pretende aclarar al lector diferentes términos que todavía nos resultan lejanos y misteriosos, como la mencionada IA, el machine learning o aprendizaje automático (AA), el deep learning o aprendizaje profundo (AP), la ciencia de datos o data science y el big data o datos masivos; describir en profundidad el concepto de IA y sus tipos, las técnicas de aprendizaje y la metodología que se utiliza en AA, el análisis en imagen cardiaca con AP, la aportación de esta revolución tecnológica sobre la estadística clásica, sus limitaciones actuales, sus aspectos legales y, fundamentalmente, sus aplicaciones iniciales en cardiología.
CIENCIA DE DATOSLos términos ciencia de datos, big data, IA y AA son diferentes, aunque pertenezcan a una misma disciplina: el análisis y la extracción de información de los datos. Sin embargo, son conceptos que en ocasiones se utilizan indistintamente y de forma ambigua.
El término big data fue acuñado por primera vez en 2005 por R. Magoulas, que lo describió como un volumen masivo de datos que por tamaño supera al software tradicional de almacenaje y tratamiento. El big data gravita en torno a 7 uves: volumen, velocidad, variedad, veracidad, validez, volatilidad y valor de los datos. Es decir, el big data genera información a gran velocidad, controlando la integridad de los datos y con mucha variedad en cuanto al tipo y la naturaleza de los estos (texto, imágenes, vídeos, diferentes sistemas, diferentes proveedores, etc.). En cardiología, el big data sería viable desde un marco de colaboración nacional, europeo o mundial, en el que entidades hospitalarias homogeneizaran y compartieran datos para la creación de repositorios de gran volumen. Estos grandes repositorios de datos servirían de apoyo en nuestra práctica diaria en el establecimiento de protocolos, diagnóstico estandarizado y temprano de enfermedades, pronóstico de la evolución de enfermedades y planificación del tratamiento de nuestros pacientes1.
Este tipo de tratamiento de la información no sería posible sin los recientes avances tecnológicos en IA. La IA utiliza herramientas capaces de identificar los patrones existentes en los datos. La IA se define por primera vez en la década de los años cincuenta, y engloba múltiples subdisciplinas, desde los sistemas expertos o la robótica hasta el AA. Es justamente este último término sobre el que vamos a hacer énfasis en esta revisión debido a los grandes avances experimentados en los últimos años.
El término machine learning fue acuñado por primera vez en 1959 por A.L. Samuel2, y su objetivo es desarrollar algoritmos que permitan que unos sistemas informáticos tomen decisiones y aprendan de su resultado; que estos sistemas sean capaces de aprender a hacer algo sin haber sido programados explícitamente para ello.
Dentro de las técnicas de AA existe cada día mayor interés por los modelos de AP3. Estos basan su poder predictivo en redes neuronales (RN) artificiales y se caracterizan por disponer de múltiples capas de procesamiento (transformaciones) de la información, lo que les permite analizar conjuntos de datos con patrones de mayor complejidad. Estos algoritmos están permitiendo avances muy importantes en el reconocimiento de voz y de imágenes, aspecto este último muy relevante en cardiología.
La ciencia de datos es el campo en el que se pueden englobar todos los aspectos relacionados con la obtención del conocimiento existente en los datos. Involucra métodos científicos, procesos y sistemas para extraer conocimiento o una mejor comprensión de los datos, normalmente aplicando técnicas novedosas en el tratamiento como la IA. Aunque es frecuente utilizar como sinónimos IA y AA, no lo son. La IA cubre un ámbito más amplio de esta revolución tecnológica incluyendo AA y AP (figura 1A). En el panel derecho de la figura 2 se muestra el interés que despiertan estos conceptos durante los últimos 3 años, con un interés cada vez más alto por el AA, la IA, la ciencia de datos y el AP. En España, sur de Europa y Sudamérica sigue apareciendo big data como el término más relevante; en Estados Unidos, Canadá, Reino Unido, norte de Europa y Australia es machine learning; en China y Japón, deep learning.
A: diagrama de Venn de los términos más comúnmente empleados en las disciplinas de la ciencia de datos. B: búsquedas totales (fuente: Google Trends), en los últimos 5 años completos, de términos relacionados con inteligencia artificial y ciencia de datos; el eje vertical del diagrama representa la proporción de un tema con respecto al total de búsquedas sobre los temas. C: término más buscado en cada país en el mismo periodo.
A día de hoy es difícil encontrar una definición universal de lo que se conoce como IA. A menudo se refiere al campo de las ciencias de la computación que trata de imitar los procesos cognitivos humanos, la capacidad de aprendizaje y el almacenamiento de conocimiento. Otras definiciones lo estudian en un sentido más amplio, a través de la comprensión y construcción de entidades inteligentes, generalmente entendidas como software informático. Centrándonos en el tipo de tareas, se podría considerar la IA como sistemas automáticos capaces de, por ejemplo, traducir un documento, reconocer a una persona por sus rasgos faciales o conducir un automóvil. La IA no se limita a imitar tareas humanas, sino que en algunos casos es capaz de superar al mejor experto en la materia tomando decisiones con menores tasas de error que una persona o identificando patrones imperceptibles para el ojo humano4. Por lo tanto, la IA permite analizar información con una aproximación diferente de la tradicional. Ya no nos limitamos a describir la información de la que disponemos para dar respuesta a lo sucedido. La IA permite responder otras preguntas: ¿qué sucedió? (diagnosticar), ¿qué pasará? (predecir) y ¿qué debería hacer? (prescribir).
Dentro de las áreas de aplicación de la IA más relevantes, con aportación en el ámbito de la salud, se pueden citar las siguientes: el reconocimiento automático de voz y el procesamiento de lenguaje natural, los algoritmos de predicción, recomendación o diagnóstico, la visión artificial y el análisis de imagen, la robótica y la IA y los sistemas expertos.
Reconocimiento automático de voz y procesamiento de lenguaje naturalEl objetivo de estas disciplinas es desarrollar mecanismos para la comunicación entre personas y máquinas utilizando lenguajes naturales. En el ámbito médico el reconocimiento automático de voz ya se está empleando para el registro de información clínica de pacientes5. Asimismo, el procesamiento de lenguaje natural está permitiendo, como ya se ve en varios ejemplos en España en el ámbito de la cardiología, clasificar enfermedades o elegir la cohorte más adecuada para un estudio clínico analizando registros de historial médico6.
Algoritmos de predicción, recomendación o diagnósticoEsta probablemente sea el área más madura en el mundo de la medicina y la cardiología, AA y AP. El mayor interés reside tanto en la automatización de tareas repetitivas, como puede ser la evaluación de una prueba diagnóstica; como en la generación de conocimiento a través del análisis de datos clínicos. Una parte importante de este artículo se centra en describir la metodología a seguir en este tipo de estudios y casos de uso en cardiología.
Visión artificial y análisis de imagenEn esta disciplina científica se incluyen los métodos para adquirir, procesar, analizar y comprender las imágenes del mundo real con el fin de producir información numérica o simbólica para que puedan ser tratados por un ordenador. Estas técnicas han experimentado una auténtica revolución en los últimos años gracias a la aplicación de algoritmos de AP y es una de las disciplinas que más están aportando a la medicina hoy en día, y por ende en cardiología como se detalla más adelante.
Robótica e inteligencia artificialLa robótica y la IA es un área cuyo objetivo es construir sistemas físicos con comportamiento inteligente. Lleva mucho tiempo desarrollándose, pero está teniendo un nuevo auge apoyada en las distintas áreas descritas (reconocimiento automático de voz, visión artificial, etc.). En el área cardiovascular se está desarrollando desde hace años en el ámbito de la cirugía; el sistema quirúrgico Da Vinci es un claro ejemplo7.
Sistemas expertosEn IA, un sistema experto es un sistema computacional (software) que emula la capacidad de tomar decisiones de un humano experto. Estos sistemas están basados en reglas o incluso en casos clínicos. Desde hace tiempo, también en cardiología, se están desarrollando sistemas expertos médicos que tratan de simular el razonamiento del especialista y de proporcionar el diagnóstico probable y el manejo del paciente8.
EL APRENDIZAJE AUTOMÁTICO: TÉCNICASEl AA es un área de la ciencia de datos que forma parte de lo que hoy conocemos como IA, en la que se crean sistemas que aprenden automáticamente, entendiendo por «aprender» la capacidad de reconocer patrones complejos de manera autónoma, sin necesidad de intervención humana, en conjuntos de datos de cualquier tipo, ya sean numéricos, visuales, texto, etc. A medida que la experiencia de estos sistemas aumenta, es decir, se les suministran nuevos datos, su desempeño mejora hasta un límite que puede o no ser superior a la capacidad humana en dicha tarea.
Aunque existen varias técnicas de aprendizaje AA, suelen agruparse en 2 tipos: aprendizaje supervisado y no supervisado.
Las técnicas de aprendizaje supervisado son, sin lugar a duda, los métodos más empleados en AA y aquellos con mejores resultados. En estos procedimientos se cuenta con un conjunto de datos del que se conoce la variable respuesta que se quiere predecir (un diagnóstico, parámetro, segmentación, etc.) a través del correcto etiquetado de cada registro. En función del tipo de predicción, se emplean algoritmos de clasificación o algoritmos regresivos. En el primer caso la meta es identificar 2 o más clases a través de una serie de variables. Por contra, los algoritmos regresivos buscan aproximarse lo más posible a un valor continuo.
En las técnicas de aprendizaje no supervisado, no se cuenta con la información sobre la variable que se quiere predecir. Estas técnicas deben aprender de las relaciones entre los elementos de un conjunto de datos y clasificarlos sin apoyarse en etiquetas o categorías. Para ello, estos procedimientos buscan estructuras, patrones o características en los datos de origen que puedan ser reproducibles en nuevos conjuntos de datos. Los métodos de agrupamiento o clustering son los más empleados para esta tarea.
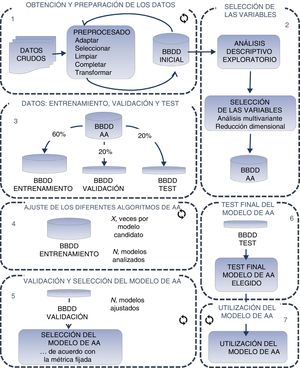
EL APRENDIZAJE AUTOMÁTICO: METODOLOGÍAConstruir un modelo AA no se reduce solo a utilizar un algoritmo de aprendizaje sobre una base de datos, sino que es todo un proceso9,10, que suele involucrar los pasos que se muestran en la figura 2.
Las primeras etapas son comunes a la estadística convencional; partiendo de datos brutos (raw data) se pasa a una información con datos estructurados (preprocesado), y se construye una base de datos inicial (paso 1 de la figura 2). A partir de esta base de datos realizamos un análisis descriptivo y exploratorio, con el objetivo de identificar y seleccionar las variables más significativas, sobre las que aplicaremos directamente los algoritmos AA (paso 2 de la figura 2).
La siguiente etapa, que se puede ya considerar específica de las técnicas AA, es la división del conjunto de datos en 3 subconjuntos: entrenamiento, validación y test; en porcentajes habituales del 60, el 20 y el 20% respectivamente (paso 3 de la figura 2).
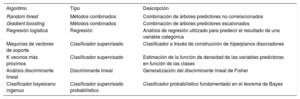
El conjunto de entrenamiento es el que usaremos para ajustar los distintos algoritmos AA seleccionados (paso 4 de la figura 2). Existe una amplia gama de algoritmos de clasificación y regresión11 (tabla 1), desde técnicas lineales más clásicas como la regresión logística o el análisis discriminante lineal, a otras más modernas como los algoritmos de tipo agregación o bagging(random forest) y de empaquetado o boosting(xgboost). Además, se pueden utilizar técnicas de submuestreo y sobremuestreo cuando, como a menudo ocurre en datos de salud, hay una categoría con muchos más casos que otra. Ningún algoritmo es en principio mejor que otro, su capacidad para realizar un buen ajuste dependerá de las características de nuestros datos (número de variables, linealidad, normalidad, valores faltantes, variables continuas o categóricas, etc.).
Algoritmos más utilizados en machine learning
| Algoritmo | Tipo | Descripción |
|---|---|---|
| Random forest | Métodos combinados | Combinación de árboles predictores no correlacionados |
| Gradient boosting | Métodos combinados | Combinación de árboles predictores escalonados |
| Regresión logística | Regresión | Análisis de regresión utilizado para predecir el resultado de una variable categórica |
| Máquinas de vectores de soporte | Clasificador supervisado | Clasificador a través de construcción de hiperplanos disociadores |
| K vecinos más próximos | Clasificador supervisado | Estimación de la función de densidad de las variables predictoras en función de las clases |
| Análisis discriminante lineal | Discriminante lineal | Generalización del discriminante lineal de Fisher |
| Clasificador bayesiano ingenuo | Clasificador supervisado probabilístico | Clasificador probabilístico fundamentado en el teorema de Bayes |
Realizado el ajuste, se utiliza el subconjunto de datos de validación para evaluar la calidad del modelo (paso 5 de la figura 2). Para ello trataremos de maximizar la métrica que más interese para nuestro caso particular: área bajo la curva ROC, exhaustividad, precisión, exactitud u otras (figura 3). Es común que este proceso de entrenamiento-validación se repita un número de veces aleatorizando ambos subconjuntos, lo que se conoce como k-folds. El objetivo es optimizar los parámetros internos del algoritmo empleado, evaluar la robustez del modelo y saber si nuestro modelo está subajustando o sobreajustando nuestros datos, tratando de encontrar un equilibrio entre ambos escenarios.
Construido un modelo final, se emplea el subconjunto de datos de test para comprobar que el modelo AA final se comporta según lo previsto con datos que no han sido utilizados para su construcción y validación (paso 6 de la figura 2). Si este resultado difiere del obtenido en el conjunto de validación, probablemente el conjunto de datos utilizado para el entrenamiento es insuficiente y se debe ampliar si se quiere un estimador fiable antes de generalizar su utilización (paso 7 de la figura 2).
Para la implementación del AA, los lenguajes de programación de código abierto más usados en la actualidad son Python y R. Ambas plataformas disponen de librerías como Scikit-learn (Python) o Caret (R) con implementaciones de las técnicas y algoritmos más utilizadas.
EL APRENDIZAJE PROFUNDO Y LA IMAGEN CARDIACAEl análisis de imagen es el campo en el que la IA está avanzando a mayor velocidad y, por lo tanto, es de gran interés en cardiología. El análisis que a diario hacemos de las diferentes imágenes cardiológicas puede ser tedioso y consume gran parte de nuestro tiempo. Existen ya herramientas para el tratamiento automático de imágenes, basados en RN, que podrían mejorar el rendimiento de nuestro quehacer diario.
Las RN3 son un tipo de algoritmos de IA que guardan analogía con el proceso de aprendizaje que se da en las propias neuronas del cerebro. Desde su formulación como modelo computacional, han ido surgiendo algoritmos de entrenamiento y arquitecturas de redes que han mejorado considerablemente la precisión y la eficiencia del aprendizaje con cada vez menores cantidades de datos para su entrenamiento. Cuando estas arquitecturas constan de numerosas capas de neuronas, es cuando actualmente se utiliza el término AP. En la actualidad, entre las RN más empleadas se encuentran las convolutional neural networks, las recursive neural networks, las generative adversarial networks o las U-nets, cada una con diferentes usos y subtipos de arquitecturas. Las RN son además muy flexibles a la hora de utilizarlas en contextos supervisados, no supervisados o de aprendizaje por refuerzo. Para su implementación, se dispone de diferentes plataformas de código abierto como TensorFlow, Pytorch, Keras o Caffe. Como desventajas de las técnicas de AP, se puede destacar su alto coste computacional. Además, se requiere un alto grado de pericia para su ajuste correcto y, en el caso del aprendizaje supervisado, se necesita contar con un conjunto de imágenes informadas manualmente, lo cual en ocasiones puede resultar muy costoso.
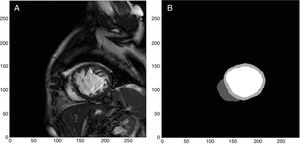
Dentro del campo de la imagen cardiaca existen diferentes objetivos a la hora de emplear técnicas de IA. Estos pasan por la segmentación e identificación de las diferentes estructuras del corazón (figura 4)12,13, la clasificación de imágenes catalogadas con diferentes afecciones, la detección y segmentación de lesiones, el registro de imágenes o la clasificación de tejidos a partir de imagen histológica. Otro tipo de tareas se relacionan con la generación de imágenes artificiales lo más realistas posible.
Ejemplo de segmentación e identificación automáticas del ventrículo izquierdo y derecho realizado en nuestro servicio a partir de imágenes obtenidas con una resonancia Philips Achieva 1.5 T12 mediante deep learning. A partir de imágenes originales (A), la red neuronal libre empleada13 es capaz de identificar y segmentar los ventrículos izquierdo y derecho (B, color blanco para el ventrículo izquierdo, color gris claro para el miocardio del ventrículo izquierdo y, color gris oscuro para el ventrículo derecho).
La investigación con técnicas de AP aplicadas en la imagen cardiológica ha crecido considerablemente en los últimos 3 años. Sin embargo, el uso de técnicas de AP en imagen médica ha calado algo más en otras disciplinas, como la neurología o la neumología14. Entre los retos que probablemente se explorarán en los próximos años se encuentran el análisis combinado con diferentes fuentes de imagen, la incorporación de datos clínicos e informes médicos o el estudio de la evolución temporal de imágenes cardiacas.
LIMITACIONES DEL APRENDIZAJE AUTOMÁTICO Y EL APRENDIZAJE PROFUNDOLa principal característica de la IA en el contexto de los modelos AA o AP es el hecho de que el aprendizaje se basa en la identificación de patrones en conjuntos de datos. Esta filosofía es a la vez su punto fuerte, pues los ordenadores son extremadamente eficientes y precisos para encontrar dichos patrones cuando estos existen, pero es a la vez una limitación. En primer lugar, porque la cantidad de datos que se requieren para obtener un modelo fiable puede llegar a ser muy grande. Esto puede ser un problema en medicina, donde los sistemas de recogida automática de datos están comenzando a implantarse, deben cumplir los criterios legales y éticos establecidos, y algunas enfermedades poco frecuentes necesariamente cuentan con pocos estudios. Por otro lado, aun contando con algoritmos con buenos resultados para un conjunto de datos, los modelos de AA y AP adolecen de la incapacidad de detectar y clasificar correctamente casos que no hayan visto previamente. En relación con esto, la fiabilidad y la calidad de la fuente de datos es fundamental para que un algoritmo sea realista y correcto. Si existe sesgo en el propio conjunto de datos empleado para ajustar el modelo, es posible que este no se generalice bien a otras poblaciones15. Este problema no es nuevo en nuestro quehacer diario, en el que hemos aceptado escalas de riesgo basadas en datos de otras poblaciones, por ejemplo, la de Framingham para riesgo cardiovascular, dando lugar a resultados erróneos sobrestimando o subestimando el riesgo al aplicarla a otras poblaciones16. Existen ya iniciativas para estandarizar los requisitos que debe cumplir un algoritmo de IA para su posible aplicación práctica17. Por todas estas razones, parece claro que se va a necesitar un especial esfuerzo en la integración de conjuntos de datos procedentes de diferentes poblaciones.
Otra limitación importante es la opacidad e interpretabilidad de los modelos de AA y en especial, del AP. Estas técnicas se emplean como «cajas negras» a las que se dan unos inputs para obtener una predicción como output. Así, las máquinas nos ofrecen respuestas en forma de predictores, pero no una explicación biológica. Aunque existen diferentes metodologías para poder interpretar los resultados de un modelo y verificar su correcto funcionamiento a través del análisis de los pesos específicos de parámetros o variables, resaltar las partes más discriminantes o la explicación individualizada de cada predicción18, a día de hoy no es posible saber de forma clara por qué los modelos de AA y AP más complejos toman una determinada decisión, lo que dificulta la generación de conocimiento y la aplicabilidad de la IA en un ámbito tan crítico como es la medicina.
EL APRENDIZAJE AUTOMÁTICO Y LA ESTADÍSTICA CLÁSICA: SIMILITUDES Y DIFERENCIASAunque los campos de los que provienen son diferentes, ambas especialidades guardan rasgos comunes, aunque con distinta finalidad.
El pilar de la estadística clásica es la inferencia. Extender lo observado en una muestra a toda la población, generalmente creando un modelo matemático que define la relación entre las variables. El AA basa su fortaleza en la predicción basada en la información disponible, sin necesidad de tener que conocer cuáles son los mecanismos que relacionan entre sí las variables. Estas características no son exclusivas, ya que en mayor o menor medida ambas disciplinas usan técnicas inferenciales para mejorar sus resultados (AA) o algoritmos predictivos para corroborar conclusiones inferenciales (estadística).
Las técnicas de AA, comparadas con las estadísticas, no requieren suposiciones previas sobre las variables, tienen la capacidad de manejar casos en los que hay datos faltantes y mejoran su fiabilidad cuando se dispone de grandes volúmenes de datos al detectar relaciones complejas entre variables.
ASPECTOS LEGALES Y ÉTICOS DE LA INTELIGENCIA ARTIFICIALExisten cuestiones a la hora de aplicar la IA en el mundo de la medicina no estrictamente relacionadas con la calidad de los algoritmos del AA y AP. Estas tienen que ver con los problemas legales del tratamiento automático de datos personales o cómo aplicar el AA en el día a día de la práctica clínica.
Prácticamente todas las técnicas de IA estudiadas hasta la fecha requieren una determinada cantidad de datos para entrenar y validar los modelos predictivos. En nuestro caso, la información empleada es especialmente sensible, ya que generalmente consiste en datos personales y clínicos de pacientes. Por ello, el uso adecuado de esta información desde un punto de vista legal es un aspecto crítico.
La protección de los datos de carácter personal es un derecho fundamental recogido en la Constitución Española; sin embargo, se reconoce la posibilidad de utilización de dichos datos bajo ciertas condiciones si con ello se da un servicio a la sociedad. Si tanto la organización que recoge los datos como la que los trata tienen residencia en España, desde 2018 deben ajustarse a la Ley Orgánica 3/2018, de 5 de diciembre, de Protección de Datos Personales y garantía de los derechos digitales19. Según esta, se permite el uso de datos personales con fines estadísticos, siempre y cuando los resultados sean de carácter agregado. Además, también es necesario adoptar medidas para anonimizar y proteger dichos datos y se reconocen una serie de derechos de los interesados como el de ser informado, el de acceso o el de rectificación. Por todo ello, dado que la utilización de servicios de computación en la nube es muy habitual en IA por su flexibilidad y mayor potencia computacional, los proveedores más importantes han adaptado sus políticas de procesado de datos para suministrar un servicio completamente seguro. Además de suscribirse al Código de Conducta CISPE (Cloud Infrastructure Services Providers in Europe) para garantizar los estándares de protección de datos apropiados asociados con la legislación. Asimismo, en situaciones en las que se emplee un modelo de IA como herramienta diagnóstica o de toma de decisiones, es obligado informar al paciente y obtener su consentimiento.
La discriminación sutil inherente a la prestación de servicios de salud puede significar también un problema a la hora de desarrollar y aplicar modelos de IA15. Por ejemplo, se considera la edad al racionar recursos escasos como el trasplante cardiaco. Tal consideración puede llevar a profecías autocumplidas: si los médicos retiramos la atención a los pacientes por su edad avanzada, los sistemas AA pueden concluir que la atención de los pacientes mayores es siempre fatal. Por otro lado, también es posible que los modelos de AA permitan ayudar a resolver disparidades en la prestación de asistencia médica si se pudieran construir algoritmos para compensar sesgos conocidos o identificar áreas de investigación necesarias.
Existe una amplia discusión sobre cómo la IA afectará al flujo de trabajo del personal médico. La IA no tiene por qué eliminar puestos de trabajo, sino más bien desplazar tareas de la práctica médica. Trabajos rutinarios y fatigantes pueden ser llevados a cabo por máquinas para liberar tiempo y permitir a los profesionales médicos su desempeño en las tareas más complejas y sensibles. Sin embargo, el empleo de herramientas diagnósticas automáticas puede conllevar problemas de sesgo en la toma de decisiones y en la depuración de responsabilidades en caso de error. Un médico puede inclinarse a revisar una prueba diagnóstica de modo más relajado si un algoritmo previamente ha catalogado el caso como negativo. El diseño de sistemas de toma de decisiones que involucren máquinas y humanos es un aspecto crucial para la IA, existen modelos intermedios entre la práctica clínica convencional y los sistemas totalmente automatizados, cada uno con diferentes características de eficiencia en coste y tiempo, riesgo o interpretabilidad20. La implementación de estos sistemas será un área en la que el papel del clínico como validador será fundamental.
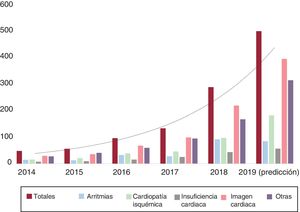
INTELIGENCIA ARTIFICIAL EN LA CARDIOLOGÍALos ejemplos de IA, utilizando AA o AP, comienzan a ser numerosos en cardiología21. Esta sección presenta una evolución de las contribuciones de IA a las diferentes áreas de aplicación en cardiología (figura 5).
Evolución en las publicaciones referenciadas en PubMed sobre inteligencia artificial, machine learning y deep learning según el área de interés en cardiología. En el material adicional se describen los detalles de las publicaciones por áreas de interés y la metodología de búsqueda empleada.
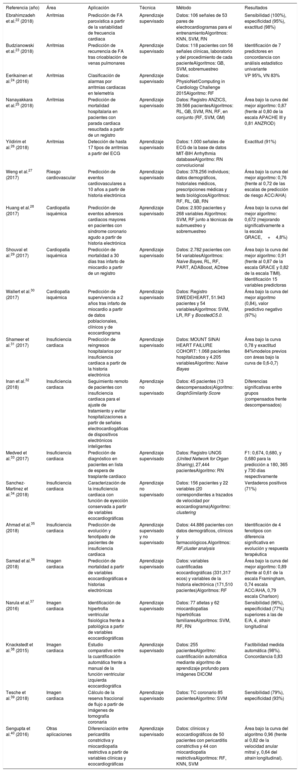
En el material adicional de este artículo, se incluye la lista de contribuciones de las técnicas descritas en varias áreas de la cardiología en los últimos 5 años completos y de enero a marzo 2019, y una descripción detallada de las publicaciones que hemos considerado de mayor interés y que facilitarán la compresión de los modelos AA y AP (tabla 2)22–40. Es importante reseñar que muchas de las publicaciones revisadas son resultado de iniciativas habituales en IA como retos promovidos en conferencias24,41 y datathons. El datathon es un concurso público y abierto, en el que personas interesadas en el tema, desde novatos a expertos, trabajan conjuntamente con bases de datos comunes con un objetivo concreto previamente establecido. Los participantes deben encontrar una solución al objetivo marcado en los conjuntos de datos proporcionados. Las soluciones más precisas y creativas son premiadas y de acceso público.
Contribuciones relevantes de la inteligencia artificial en las diferentes áreas de aplicación de la cardiología
| Referencia (año) | Área | Aplicación | Técnica | Método | Resultados |
|---|---|---|---|---|---|
| Ebrahimzadeh et al.22 (2018) | Arritmias | Predicción de FA paroxística a partir de la variabilidad de frecuencia cardiaca | Aprendizaje supervisado | Datos: 106 señales de 53 pares de electrocardiogramas para el entrenamientoAlgoritmos: KNN, SVM, RN | Sensibilidad (100%), especificidad (95%), exactitud (98%) |
| Budzianowski et al.23 (2018) | Arritmias | Predicción de recurrencia de FA tras crioablación de venas pulmonares | Aprendizaje supervisado | Datos: 118 pacientes con 56 señales clínicas, laboratorio y del procedimiento de cada pacienteAlgoritmos: GB, SVM, sobremuestreo | Identificación de 7 predictores en concordancia con análisis estadístico univariante |
| Eerikainen et al.24 (2016) | Arritmias | Clasificación de alarmas por arritmias cardiacas en telemetría | Aprendizaje supervisado | Datos: PhysioNet/Computing in Cardiology Challenge 2015Algoritmo: RF | VP 95%, VN 83% |
| Nanayakkara et al.25 (2018) | Arritmias | Predicción de mortalidad hospitalaria en pacientes con parada cardiaca resucitada a partir de un registro | Aprendizaje supervisado | Datos: Registro ANZICS, 39.566 pacientesAlgoritmos: RL, GB, SVM, RN, RF, en conjunto (RF, SVM, GM) | Área bajo la curva del mejor algoritmo: 0,87 (frente al 0,80 de la escala APACHE III y 0,81 ANZROD) |
| Yildirim et al.26 (2018) | Arritmias | Detección de hasta 17 tipos de arritmias a partir del ECG | Aprendizaje supervisado | Datos: 1.000 señales de ECG de la base de datos MIT-BIH Arrhythmia databaseAlgoritmo: RN convolucional | Exactitud (91%) |
| Weng et al.27 (2017) | Riesgo cardiovascular | Predicción de eventos cardiovasculares a 10 años a partir de historia electrónica | Aprendizaje supervisado | Datos: 378.256 individuos; datos demográficos, historiales médicos, prescripciones médicas y tests biológicosAlgoritmos: RF, RL, GB, RN | Área bajo la curva del mejor algoritmo: 0,76 (frente al 0,72 de las escalas de predicción de riesgo ACC/AHA) |
| Huang et al.28 (2017) | Cardiopatía isquémica | Predicción de eventos adversos cardiacos mayores en pacientes con síndrome coronario agudo a partir de historia electrónica | Aprendizaje supervisado | Datos: 2.930 pacientes y 268 variables Algoritmos: SVM, RF junto a técnicas de submuestreo y sobremuestreo | Área bajo la curva del mejor algoritmo: 0,672 (mejorando significativamente a la escala GRACE,+4,8%) |
| Shouval et al.29 (2017) | Cardiopatía isquémica | Predicción de mortalidad a 30 días tras infarto de miocardio a partir de un registro | Aprendizaje supervisado | Datos: 2.782 pacientes con 54 variablesAlgoritmos: Naive Bayes, RL, RF, PART, ADABoost, ADtree | Área bajo la curva del mejor algoritmo: 0,91 (frente al 0,87 de la escala GRACE y 0,82 de la escala TIMI). Identificación 15 variables predictoras |
| Wallert et al.30 (2017) | Cardiopatía isquémica | Predicción de supervivencia a 2 años tras infarto de miocardio a partir de datos poblacionales, clínicos y de ecocardiograma | Aprendizaje supervisado | Datos: Registro SWEDEHEART, 51.943 pacientes y 54 variablesAlgoritmos: SVM, LR, RF y BoostedC5.0. | Área bajo la curva del mejor algoritmo (0,84), valor predictivo negativo (97%) |
| Shameer et al.31 (2017) | Insuficiencia cardiaca | Predicción de reingresos hospitalarios por insuficiencia cardiaca a partir de la historia electrónica | Aprendizaje supervisado | Datos: MOUNT SINAI HEART FAILURE COHORT: 1.068 pacientes hospitalizados y 4.205 variablesAlgoritmo: Naive Bayes | Área bajo la curva 0,78 y exactitud 84%modelos previos con áreas bajo la curva de 0,6-0,7) |
| Inan et al.32 (2018) | Insuficiencia cardiaca | Seguimiento remoto de pacientes con insuficiencia cardiaca para el ajuste de tratamiento y evitar hospitalizaciones a partir de señales electrocardiogáficas de dispositivos electrónicos inteligentes | Aprendizaje no supervisado | Datos: 45 pacientes (13 descompensados)Algoritmo: GraphSimilarity Score | Diferencias significativas entre grupos (compensados frente descompensados) |
| Medved et al.33 (2017) | Insuficiencia cardiaca | Predicción de diagnóstico en pacientes en lista de espera de trasplante cardiaco | Aprendizaje supervisado | Datos: Registro UNOS (United Network for Organ Sharing), 27,444 pacientesAlgoritmo: RN | F1: 0,674, 0,680, y 0,680 para la predicción a 180, 365 y 730 días respectivamente |
| Sanchez-Martinez et al.34 (2018) | Insuficiencia cardiaca | Caracterización de la insuficiencia cardiaca con función de eyección conservada a partir de variables ecocardiográficas | Aprendizaje no supervisado | Datos: 156 pacientes y 22 variables (20 correspondientes a trazados de velocidad por ecocardiograma)Algoritmo: clustering | Verdaderos positivos (71%) |
| Ahmad et al.35 (2018) | Insuficiencia cardiaca | Predicción de evolución y fenotipado de pacientes de insuficiencia cardiaca | Aprendizaje supervisado y no supervisado | Datos: 44.886 pacientes con datos demográficos, clínicos y farmacológicos.Algoritmos: RF,cluster analysis | Identificación de 4 fenotipos con diferencia significativa en evolución y respuesta terapéutica |
| Samad et al.36 (2018) | Imagen cardiaca | Predicción de mortalidad a partir de variables ecocardiográficas e historias electrónicas | Aprendizaje supervisado | Datos: variables cuantificadas ecocardiográficas (331,317 ecos) y variables de la historia electrónica (171,510 pacientes)Algoritmos: RF | Área bajo la curva del mejor algoritmo: 0,89 (frente al 0,61 de la escala Framingham, 0,74 escala ACC/AHA, 0,79 escala Charlson) |
| Narula et al.37 (2016) | Imagen cardiaca | Identificación de hipertrofia ventricular fisiológica frente a patológica a partir de variables ecocardiográficas | Aprendizaje supervisado | Datos: 77 atletas y 62 miocardiopatías hipertróficas familiaresAlgoritmos: SVM, RF, RN | Sensibilidad (96%), especificidad (77%) superiores a las de E/A, é, strain longitudinal |
| Knackstedt et al.38 (2015) | Imagen cardiaca | Estudio comparativo entre la cuantificación automática frente a manual de la función ventricular izquierda ecocardiográfica | Aprendizaje supervisado | Datos: 255 pacientesAlgoritmo: cuantificación automática mediante algoritmo de aprendizaje profundo para imágenes DICOM | Factibilidad medida automática (98%). Concordancia 0,83 |
| Tesche et al.39 (2018) | Imagen cardiaca | Cálculo de la reserva fraccional de flujo a partir de imágenes de tomografía coronaria | Aprendizaje supervisado | Datos: TC coronario 85 pacientesAlgoritmo: SVM | Sensibilidad (79%), especificidad (93%) |
| Sengupta et al.40 (2016) | Otras aplicaciones | Diferenciación entre pericarditis constrictiva y miocardiopatía restrictiva a partir de variables clínicas y ecocardiográficas | Aprendizaje supervisado | Datos: clínicos y ecocardiográficos de 50 pacientes con pericarditis constrictiva y 44 con miocardiopatía restrictivaAlgoritmos: RF, KNN, SVM | Área bajo la curva del algoritmo 0,96 (frente al 0,82 de la velocidad anular mitral y, 0,64 del strain longitudinal). |
ACC/AHA: American College of Cardiology/American Heart Association; ECG: electrocardiograma; FA: fibrilación auricular; GB: gradient boosting; KNN: K vecinos más próximos; RF: random forest; RL: regresión logística; RN: red neuronal; SVM: máquinas de vectores de soporte.
Una de las aplicaciones más extendidas de AA en cardiología es la predicción de arritmias cardiacas. Un gran número de estudios abordan modelos predictivos de aparición de fibrilación auricular, incluso paroxística, por su significación y sus implicaciones clínicas, utilizando aprendizaje supervisado con sistemas predictivos de AA compuestos de diferentes subprocesos: preprocesado de señal, extracción de variables significativas y algoritmos de clasificación22,42. Modelos similares de AA se han desarrollado en la mejora de la gestión de alarmas de telemonitorización24, para predecir la aparición de arritmias ventriculares43,44, en la predicción a la respuesta de procedimientos de ablación invasivos como la crioablación23, incluso para predecir la mortalidad tras parada cardiaca resucitada25. Se han empleado técnicas de AP con gran éxito en la detección de diferentes tipos de arritmias a partir del análisis directo de imágenes o señales electrocardiográficas26. Otra aplicación ha sido la búsqueda de fenotipos para clasificar miocardiopatías hipertróficas con diferente riesgo arrítmico utilizando aprendizaje no supervisado45.
Cardiopatía isquémicaLa IA se ha aplicado a los datos habituales de la historia electrónica proveniente de atención primaria para predecir el riesgo de enfermedad cardiovascular en la población general, y se ha mostrado superior a las escalas de riesgo utilizadas tradicionalmente27. Asimismo, se han aplicado técnicas de aprendizaje supervisado en la predicción pronóstica de la cardiopatía isquémica estable46, en el síndrome coronario28 o la predicción de mortalidad de enfermos con infarto de miocardio analizando resultados de hospitales individuales29 o grandes registros como el SWEDEHEART30. Los resultados son dispares debido al tamaño de las muestras, lo que demuestra que las técnicas de AA obtienen mejores resultados con tamaños de muestra grandes.
Insuficiencia cardiacaLos sistemas de AA podrían permitir optimizar los ingresos hospitalarios evitables por insuficiencia cardiaca identificando de manera más precisa qué pacientes son susceptibles de descompensación cardiaca tras el alta hospitalaria que las escalas de riesgo clásico31,47; este es un ejemplo de resultados contradictorios de la experiencia inicial en este campo tecnológico48 que apunta a la importancia en el ajuste en la metodología de los sistemas49. Asimismo, hay estudios iniciales que abordan la utilidad de la IA como sistema de gestión en la telemonitorización remota de pacientes con IC. Los estudios realizados hasta el momento han mostrado que la utilización de AA es factible50, y que es posible que pueda mejorar la evolución clínica de estos pacientes32. Otra área importante es el trasplante cardiaco, en el que se han aplicado sistemas AA para predecir la probabilidad de muerte o trasplante de pacientes incluidos en lista de espera o la predicción de éxito del paciente trasplantado33. Es reseñable que se puede predecir la respuesta clínica a la resincronización cardiaca utilizando sistemas de AA51.
Un excelente ejemplo de combinación de metodología de AA y AP en este campo es la probabilidad de clasificación de la disfunción diastólica analizando medidas ecocardiográficas52. Esta investigación, junto con otros ejemplos que han utilizado aprendizaje no supervisado34,53, ha demostrado que estos procedimientos pueden facilitar la estandarización e interpretación de enfermedades cardiacas complejas, como el diagnóstico de insuficiencia cardiaca con función sistólica conservada, ayudando a la toma de decisiones.
Otro estudio realizado con una gran cantidad de datos del Swedish Heart Failure Registry ha sido capaz de identificar 4 tipos de fenotipos con diferentes evoluciones y respuestas terapéuticas a partir de técnicas no supervisadas35.
Imagen cardiacaLos ejemplos de IA utilizando datos provenientes de imagen comienzan a marcar tendencia y serán responsables de una nueva revolución en el mundo de la imagen cardiaca. Se han empleado con éxito técnicas de AA que utilizan los datos generados de la cuantificación de imágenes cardiacas para, por ejemplo, predecir la mortalidad cardiovascular a partir de bases de datos ecocardiográficos extensas36. Se han desarrollado modelos similares de AA para diferenciar los patrones ecocardiográficos de hipertrofia ventricular fisiológica propia de los atletas de la patológica propia de la miocardiopatía hipertrófica familiar37.
Aparte de los métodos de AA, la metodología de AP se ha utilizado para el análisis directo sobre imágenes en varios dominios de aplicación diferentes. La mayor parte de los esfuerzos se han enfocado en tareas de segmentación del tejido y estructuras anatómicas cardiacas (p. ej., el endocardio; figura 4), que por lo general es el paso previo para realizar cualquier otro tipo de estudio, como la detección de lesiones o la clasificación por enfermedades. El primer estudio puramente realizado con AP data de 2013, y en él se aplicó a la segmentación del ventrículo izquierdo a partir de ecocardiografía54. Los concursos tipo datathon se han utilizado sistemáticamente desde 2009 como herramienta de explotación de imágenes cardiacas, principalmente con objetivos de segmentación del ventrículo izquierdo y derecho, a partir de diferentes imágenes, fundamentalmente resonancia magnética y tomografía computarizada14,41,55. Durante los últimos años, no se ha cesado en la publicación de arquitecturas de RN que han ido mejorando el estado de la técnica en la segmentación del corazón; tanto en 256,57 como en 3 dimensiones41,58,59. Incluso se han realizado estudios científicos comparativos de la determinación automática del endocardio y cálculo de la fracción de eyección del ventrículo izquierdo a partir de algoritmos de AP aplicados directamente a imágenes DICOM frente a la determinación manual, con excelente similitud y el consecuente ahorro de tiempos38.
En el campo de la imagen ecocardiográfica, se han realizado ya avances para implementar una interpretación totalmente automática, a través de la identificación de vistas, la segmentación de la imagen, la cuantificación de estructuras y funciones y la detección de afecciones60.
Entre otros resultados obtenidos en los últimos años relacionados con tareas no de segmentación, se puede citar como ejemplos el cálculo de la reserva fraccional de flujo a partir de imágenes de tomografía computarizada coronaria39, la medición de calcio en arterias coronarias61, la cuantificación y caracterización de tejidos de arterias coronarias y carótida62,63, la mejora o generación de imágenes cardiacas64, la detección de estenosis y ateroesclerosis65 o la diferenciación de la pericarditis constrictiva de la miocardiopatía restrictiva40.
Otras aplicacionesLa IA se está utilizando ampliamente en otros dominios de aplicación diferentes, hecho que refleja su amplio espectro de uso. La búsqueda de patrones abarca multitud de funcionalidades, desde la predicción del riesgo cardiovascular a partir del análisis de fondo de ojo4 a la predicción del fallo renal agudo tras cirugía cardiaca66, etc. Estos patrones pueden identificar mejor los grupos de pacientes con riesgo no similar, y su incorporación a la práctica clínica puede ayudar a eliminar indeterminaciones y mejorar el resultado clínico.
CONCLUSIONESAunque a menudo se identifica la IA como un concepto futurista y lejano, lo cierto es que es una tecnología que ya se emplea hoy en todo tipo de áreas, entre ellas, la cardiología. Gracias a la digitalización de grandes cantidades de datos, el desarrollo de algoritmos de AA y la mejora de la capacidad de cálculo de los ordenadores de las últimas décadas, la IA puede abrir excelentes oportunidades para la automatización de tareas, la aplicación de la medicina de precisión o el avance en la investigación a través de la detección de patrones complejos en bases de datos médicas67. Un caso particular es el del análisis de imagen médica, en el que las técnicas de AP han supuesto una auténtica revolución y su aplicación en el área de la cardiología está ya obteniendo excelentes resultados. Sin embargo, aún queda un largo camino que recorrer para aplicar de manera generalizada estas técnicas en la práctica clínica, para lo cual será fundamental la generación de grandes bases de datos con información de calidad y la evaluación e integración de la IA en contextos clínicos realistas; por ello, conocer en qué consiste la IA y sus aplicaciones en nuestro campo se antoja esencial para la cardiología presente y futura.
FINANCIACIÓNEl presente trabajo ha sido financiado por el Instituto de Salud Carlos III (Ministerio de Ciencia, Innovación y Universidades) dentro del CIBERCV, por el que están contratados P.I. Dorado-Díaz. y J. Sampedro-Gómez.
CONFLICTO DE INTERESESV. Vicente-Palacios es trabajador de Philips Healthcare Ibérica. El resto de los investigadores declaran no tener conflictos de intereses.
Los autores de este artículo queremos agradecer a Antonio Sánchez, Rafael Vidal, Manuel Jiménez-Navarro y Purificación Galindo la revisión del manuscrito previa a su envío para evaluación a Revista Española de Cardiología. Sus comentarios y recomendaciones fueron de gran ayuda y contribuyeron, sin duda, en la elaboración de este artículo.