La terapia de resincronización cardiaca se asocia a mejora de la calidad de vida y reducción de la morbimortalidad de los pacientes con disfunción ventricular grave y QRS ancho. Sobre su papel en la reducción de arritmias ventriculares, hay más discusión.
MétodosSe comparó la incidencia de arritmias ventriculares en pacientes portadores de desfibrilador automático implantable con función de resincronización cardiaca, según el grado de respuesta ecocardiográfica a la resincronización. Se clasificó a los pacientes en tres subgrupos: superrespondedores, respondedores y no respondedores.
ResultadosSe incluyó a 196 pacientes seguidos durante una mediana de 30,1 [intervalo intercuartílico, 18,0-55,1] meses. Se documentó presencia de arritmias ventriculares en 37 pacientes (18,8%); 3 pacientes (5,9%) del grupo de superrespondedores presentaron arritmias ventriculares, en comparación con 14 (22,2%) del grupo de respondedores y 20 (24,4%) del grupo de no respondedores (p = 0,025). En el análisis multivariable, el implante del dispositivo en prevención secundaria (odds ratio = 4,04; intervalo de confianza del 95%, 1,52-10,75; p = 0,005), la ausencia de superrespuesta ecocardiográfica (odds ratio = 3,81; intervalo de confianza del 95%, 1,04-13,93; p = 0,043), un QRS > 160ms (odds ratio = 2,39; intervalo de confianza del 95%, 1,00-1,35; p = 0,049) y el tratamiento con amiodarona (odds ratio = 2,47; intervalo de confianza del 95%, 1,03-5,91; p = 0,041) fueron los únicos predictores independientes de aparición de arritmias ventriculares.
ConclusionesLos pacientes superrespondedores a la terapia de resincronización cardiaca presentan una disminución significativa en la incidencia de arritmias ventriculares respecto a los demás pacientes. Pese a ello, los episodios arrítmicos no llegan a desaparecer por completo en este subgrupo.
Palabras clave
Se ha demostrado que la terapia de resincronización cardiaca (TRC) mejora la calidad de vida y reduce las hospitalizaciones y la mortalidad de los pacientes con disfunción ventricular grave y QRS ancho en el electrocardiograma de superficie1–4.
El grado de remodelado ventricular con la estimulación biventricular es muy variable, y se ha descrito que hasta un 20-30% de los pacientes presentan una reducción muy significativa de volúmenes ventriculares y práctica normalización de la fracción de eyección del ventrículo izquierdo (FEVI). A tales pacientes se los ha denominado superrespondedores (SR), pues presentan una disminución de mortalidad y eventos cardiovasculares durante el seguimiento respecto a los respondedores leves o no respondedores (NR)5–6.
Sin embargo, el papel de la TRC en la reducción de las arritmias ventriculares está en discusión, y hay gran controversia al respecto. Algunos trabajos confirman que la TRC se asocia a reducción de muerte súbita y arritmias ventriculares7–11, principalmente cuando hay remodelado positivo y el seguimiento es largo. También existen trabajos en los que no hay reducción de arritmias ventriculares o incluso aumentan12–15. La reducción de arritmias ventriculares se relaciona con remodelado ventricular positivo, mejoría de la fracción de eyección y reducción de los volúmenes ventriculares, el estrés parietal y la activación neurohormonal. El incremento en la incidencia de arritmias ventriculares se produce por un cambio en la secuencia de activación desde epicardio a endocardio, con un aumento en la dispersión de la repolarización transmural, alargamiento del intervalo QT y riesgo de arritmias polimorfas tipo torsade de pointes.
El objetivo del estudio es analizar y comparar la incidencia de arritmias ventriculares en pacientes portadores de desfibrilador automático implantable (DAI) con TRC según el tipo de respuesta ecocardiográfica. En caso de ausencia o muy baja incidencia de arritmias ventriculares en pacientes considerados SR, sería planteable, en el momento del recambio del dispositivo, cambiarlo por un marcapasos en vez de un DAI, con el consecuente ahorro económico, de vital importancia en la actualidad.
MÉTODOSSelección de pacientes y diseñoSe realizó un análisis retrospectivo de los pacientes a los que se había implantado un DAI-TRC. Se incluyó a todos los pacientes con un DAI-TRC implantado en nuestro centro entre junio de 1999 y febrero de 2012. Los criterios de inclusión fueron: pacientes con insuficiencia cardiaca y clase funcional de la New York Heart Association ≥ II, fracción de eyección de ventrículo izquierdo (FEVI) ≤ 35%, QRS ≥ 120ms y tratamiento médico óptimo.
Se analizaron las siguientes variables: edad, sexo, clase funcional de la New York Heart Association, tipo de cardiopatía, infarto de miocardio previo, FEVI, anchura de QRS, diámetros telesistólico y telediastólico del ventrículo izquierdo, grado de insuficiencia mitral, implante en prevención primaria o secundaria, presencia de fibrilación auricular, tipo de trastorno de la conducción, posición final del electrodo en dos proyecciones diferentes (apical, medial o basal en proyección posteroanterior y anterior, lateral o posterior en proyección lateral), umbral de electrodo de ventrículo izquierdo, tratamiento farmacológico de la insuficiencia cardiaca, tratamiento antiarrítmico y presencia de diabetes mellitus o insuficiencia renal crónica, definida como aclaramiento de creatinina < 50ml/min.
Seguimiento de los pacientesSe siguió a los pacientes semestral o anualmente en consultas ambulatorias de DAI. También se siguió mediante monitorización a distancia a los pacientes con dispositivos dotados de dicha tecnología. Asimismo se interrogaron los dispositivos en cualquier visita al servicio de urgencias por algún síntoma relacionado con el DAI. Tres electrofisiólogos expertos (IFL, JTR y VCU) revisaron y analizaron todos los episodios de arritmia ventricular.
Clasificación de los pacientesSe clasificó como SR16 a los pacientes cuya FEVI medida a los 12 meses del implante se hubiera al menos duplicado respecto a la obtenida en el momento del implante o fuera ≥ 45%. De los pacientes con seguimientos < 1 año, se usaron los datos del último ecocardiograma realizado. Se clasificó como respondedores (R)17 a los pacientes cuya FEVI medida a los 12 meses tras el implante se hubiera incrementado en ≥ 5 puntos respecto a la medida inicialmente. De los pacientes con seguimientos < 1 año, se usaron los datos del último ecocardiograma realizado. Se consideró NR a los demás pacientes.
EcocardiogramasTodos los estudios se realizaron con un ecocardiógrafo Philips iE33®. Se realizó a todos los pacientes un ecocardiograma basal en el momento del implante y otro 12 meses después. Se recogieron las siguientes medidas: FEVI mediante regla de Simpson, diámetros telesistólico y telediastólico del ventrículo izquierdo y grado de insuficiencia mitral. Tres ecocardiografistas expertos (SMS, VMP e IGL) revisaron todos los estudios.
Programación de los dispositivosSe definió como arritmia ventricular cualquier episodio detectado por el DAI que requiriera tratamiento mediante estimulación antitaquicardia o choque. La programación del DAI quedó a criterio del médico responsable. No obstante, la forma habitual de programación en nuestro centro se basa en intervalos de detección largos y puntos de corte para taquicardia y fibrilación altos, lo cual reduce el riesgo de que se produzcan terapias evitables o inapropiadas18,19. También es habitual la programación mediante secuencias de estimulación antitaquicardia en zona de taquicardia ventricular y estimulación antitaquicardia durante o antes de la carga en zona de fibrilación ventricular20. No se consideró arritmia ventricular la no sostenida o la terapia considerada inapropiada.
Análisis estadísticoPara evaluar la normalidad de las distintas variables incluidas en el análisis, se empleó el test de Kolmogorov-Smirnov. Las variables cuantitativas se presentan como media ± desviación estándar y mediana [intervalo intercuartílico] en caso de distribución no normal. Las variables categóricas se muestran como frecuencias absolutas y porcentaje. Las características basales en los tres subgrupos de pacientes se compararon mediante la prueba de la χ2 para variables categóricas y mediante análisis de la varianza para variables cuantitativas, con corrección de Bonferroni para comparaciones múltiples ajustadas. El cálculo de la odds ratio (OR) para arritmias ventriculares se hizo mediante prueba de la χ2. Con el fin de valorar el efecto independiente de las distintas variables en la incidencia de arritmias ventriculares, se construyó un modelo de regresión logística incluyendo todas las variables con valor de p < 0,10 en el análisis univariable. Se realizó una curva de Kaplan-Meier para comparar la tasa de supervivencia libre de eventos por subgrupos mediante log rank test. También se analizó la mortalidad según subgrupos mediante log rank test. Todos los cálculos estadísticos se realizaron con el programa SPSS 15.0 para Windows (SPSS Inc.; Chicago, Illinois, Estados Unidos).
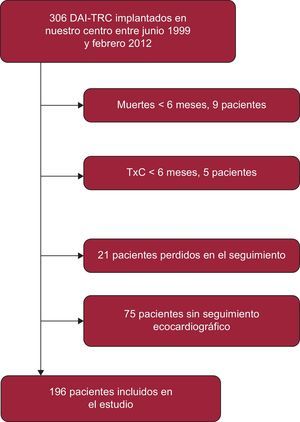
RESULTADOSSe implantó un DAI-TRC a un total de 306 pacientes entre junio de 1999 y febrero de 2012. De ellos, se excluyó a 9 pacientes que fallecieron en los primeros 6 meses, 5 pacientes que recibieron trasplante cardiaco en el mismo periodo, 21 pacientes perdidos en el seguimiento y 75 pacientes sin seguimiento ecocardiográfico adecuado (figura 1), de modo que 196 pacientes constituyeron la población de estudio. No se observaron diferencias significativas entre los grupos de pacientes incluidos y excluidos del análisis en cuanto a las características basales principales: edad (p = 0,6), sexo (p = 0,07), clase funcional de la New York Heart Association (p = 0,5), cardiopatía de base (p = 0,08), infarto agudo de miocardio previo (p = 0,1), fibrilación auricular (p = 0,2), implante en prevención secundaria (p = 0,2), anchura del QRS (p = 0,5) y FEVI inicial (p = 0,08). Únicamente se encontró una mayor proporción de casos con bloqueo de rama izquierda en el grupo de pacientes incluidos en el análisis respecto a los pacientes excluidos (el 80,1 frente al 66%; p = 0,004).
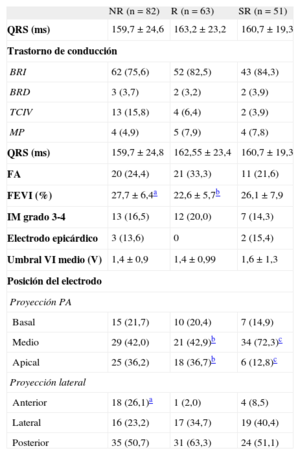
Las características basales de los pacientes según el tipo de respuesta ecocardiográfica a la TRC se muestran en las tablas 1 y 2.
Características clínicas basales de los pacientes según tipo de respuesta a la terapia de resincronización cardiaca
| NR (n = 82) | R (n = 63) | SR (n = 51) | |
| Edad (años) | 62,0 ± 9,7 | 62,4 ± 10,6 | 64,7 ± 8,3 |
| Varones | 72 (87,8) | 55 (87,3) | 40 (78,4) |
| Diabetes mellitus | 28 (36,8) | 23 (40,4) | 13 (26,5) |
| Clase funcional de la NYHA | |||
| II | 18 (22,0) | 16 (25,4) | 8 (15,7) |
| III | 61 (74,4) | 46 (73,0) | 42 (82,4) |
| IV | 3 (3,7) | 1 (1,6) | 1 (2,0) |
| Cardiopatía | |||
| Idiopática | 37 (45,1) | 34 (54,0) | 32 (62,7) |
| Isquémica | 45 (54,9) | 29 (46,0) | 17 (33,3)* |
| Otras | 0 | 0 | 2 (4) |
| IAM previo | 42 (51,2) | 23 (36,5) | 11 (21,6)* |
| Implante en prevención secundaria | 16 (19,5) | 16 (25,4) | 5 (9,8) |
| Insuficiencia renal (CrCl < 50 ml/min) | 27 (35,5) | 20 (35,1) | 13 (26,5) |
| Tratamiento farmacológico | |||
| IECA/ARA-II | 72 (94,7) | 49 (87,5) | 45 (91,8) |
| Bloqueadores beta | 72 (94,7) | 52 (91,2) | 46 (93,9) |
| ARM | 57 (75,0) | 40 (70,2) | 35 (71,4) |
| Tratamiento antiarrítmico | |||
| Amiodarona | 34 (44,7) | 17 (29,8) | 13 (26,5)* |
| Sotalol | 5 (6,6) | 2 (3,5) | 2 (4,1) |
ARA–II: antagonistas del receptor de la angiotensina II; ARM: antagonista del receptor de mineralcorticoides; CrCl: aclaramiento de creatinina; IAM: infarto agudo de miocardio; IECA: inhibidor de la enzima de conversión de la angiotensina; NR: no respondedores; NYHA: New York Heart Association; R: respondedores; SR: superrespondedores.
Los datos expresan n (%) o media ± desviación estándar.
Características electrocardiográficas, ecocardiográficas y relacionadas con el implante del dispositivo de los pacientes según tipo de respuesta a la terapia de resincronización cardiaca
| NR (n = 82) | R (n = 63) | SR (n = 51) | |
| QRS (ms) | 159,7 ± 24,6 | 163,2 ± 23,2 | 160,7 ± 19,3 |
| Trastorno de conducción | |||
| BRI | 62 (75,6) | 52 (82,5) | 43 (84,3) |
| BRD | 3 (3,7) | 2 (3,2) | 2 (3,9) |
| TCIV | 13 (15,8) | 4 (6,4) | 2 (3,9) |
| MP | 4 (4,9) | 5 (7,9) | 4 (7,8) |
| QRS (ms) | 159,7 ± 24,8 | 162,55 ± 23,4 | 160,7 ± 19,3 |
| FA | 20 (24,4) | 21 (33,3) | 11 (21,6) |
| FEVI (%) | 27,7 ± 6,4a | 22,6 ± 5,7b | 26,1 ± 7,9 |
| IM grado 3-4 | 13 (16,5) | 12 (20,0) | 7 (14,3) |
| Electrodo epicárdico | 3 (13,6) | 0 | 2 (15,4) |
| Umbral VI medio (V) | 1,4 ± 0,9 | 1,4 ± 0,99 | 1,6 ± 1,3 |
| Posición del electrodo | |||
| Proyección PA | |||
| Basal | 15 (21,7) | 10 (20,4) | 7 (14,9) |
| Medio | 29 (42,0) | 21 (42,9)b | 34 (72,3)c |
| Apical | 25 (36,2) | 18 (36,7)b | 6 (12,8)c |
| Proyección lateral | |||
| Anterior | 18 (26,1)a | 1 (2,0) | 4 (8,5) |
| Lateral | 16 (23,2) | 17 (34,7) | 19 (40,4) |
| Posterior | 35 (50,7) | 31 (63,3) | 24 (51,1) |
BRI: bloqueo de rama izquierda; BRD: bloqueo de rama derecha; TCIV: trastorno de conducción intraventricular; MP: ritmo de marcapasos; FA: fibrilación auricular, FEVI: fracción de eyección del ventrículo izquierdo; IM: insuficiencia mitral; PA: posteroanterior; NR: no respondedores; R: respondedores; SR: superrespondedores.
Los datos expresan n (%) o media ± desviación estándar.
Hubo un menor porcentaje de pacientes SR con cardiopatía isquémica e infarto agudo de miocardio previo en comparación con los pacientes NR. El porcentaje de pacientes en tratamiento con amiodarona fue inferior en el grupo de SR que entre los NR. No hubo diferencias entre grupos en cuanto a la toma de fármacos habituales para el tratamiento de la insuficiencia cardiaca o la presencia de insuficiencia renal crónica o diabetes mellitus. El posicionamiento apical del electrodo de ventrículo izquierdo ocurrió en mayor porcentaje en los grupos de NR y R que en el de SR. Asimismo, en los pacientes NR, el posicionamiento anterior fue más frecuente que en los R.
De los 196 pacientes incluidos, se consideró SR a 51 (26%), R a 63 (32%) y NR a 82 (42%) de acuerdo con los criterios ecocardiográficos expuestos anteriormente.
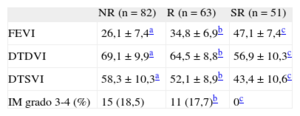
Los pacientes SR mostraron una mejoría estadísticamente significativa de todos los parámetros ecocardiográficos (FEVI y diámetros telediastólico y telesistólico del ventrículo izquierdo) en comparación con los pacientes R y NR (tabla 3).
Comparación de parámetros ecocardiográficos en el seguimiento entre pacientes superrespondedores, respondedores y no respondedores
| NR (n = 82) | R (n = 63) | SR (n = 51) | |
| FEVI | 26,1 ± 7,4a | 34,8 ± 6,9b | 47,1 ± 7,4c |
| DTDVI | 69,1 ± 9,9a | 64,5 ± 8,8b | 56,9 ± 10,3c |
| DTSVI | 58,3 ± 10,3a | 52,1 ± 8,9b | 43,4 ± 10,6c |
| IM grado 3-4 (%) | 15 (18,5) | 11 (17,7)b | 0c |
DTDVI: diámetro telediastólico del ventrículo izquierdo; DTSVI: diámetro telesistólico del ventrículo izquierdo; FEVI: fracción de eyección del ventrículo izquierdo; IM: insuficiencia mitral; NR: no respondedores; R: respondedores; SR: superrespondedores.
Los datos expresan n (%) o media ± desviación estándar.
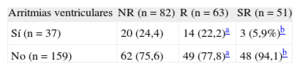
Tras una mediana de seguimiento de 30,1 [18,0-55,1] meses, 37 pacientes (18,8%) presentaron arritmias ventriculares; 3 pacientes (5,9%) del grupo de SR, frente a 14 (22,2%) del grupo de R y 20 (24,4%) del grupo de NR (tabla 4).
Incidencia de arritmias ventriculares según el tipo de respuesta ecocardiográfica
| Arritmias ventriculares | NR (n = 82) | R (n = 63) | SR (n = 51) |
| Sí (n = 37) | 20 (24,4) | 14 (22,2)a | 3 (5,9%)b |
| No (n = 159) | 62 (75,6) | 49 (77,8)a | 48 (94,1)b |
NR: no respondedores; R: respondedores; SR: superrespondedores.
Los datos expresan n (%).
La probabilidad de presentar una arritmia ventricular en el grupo de R en comparación con el grupo de SR fue OR = 4,6 (intervalo de confianza del 95% [IC95%], 1,2-16,9; p = 0,015). Es decir, hubo una reducción del 78,2% en el riesgo de presentar arritmias ventriculares del grupo de SR en comparación con el de R. En el grupo de NR fue OR = 5,2 (IC95%, 1,5-18,4; p = 0,006) en comparación con el grupo de SR, de modo que hubo una reducción del 80,8% en el riesgo de arritmias ventriculares del grupo de SR. No hubo diferencias significativas en el riesgo de arritmias entre R y NR (OR = 1,1; IC95%, 0,7-1,7; p = 0,8).
Durante el seguimiento murieron 40 pacientes (20,4%). No hubo diferencias significativas entre los subgrupos de respuesta ecocardiográfica (p = 0,92).
Debido a que entre R y NR no observamos diferencias estadísticamente significativas en cuanto a la recurrencia de arritmias, dichos grupos se agruparon en uno solo (no SR) para la curva de supervivencia libre de arritmias ventriculares y los análisis univariable y multivariable.
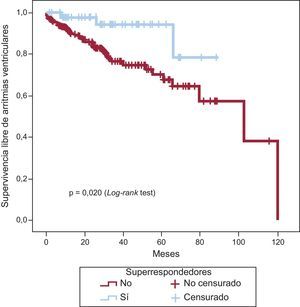
El análisis mediante curva de Kaplan-Meier para probabilidad acumulada de arritmias ventriculares (figura 2) mostró que los pacientes SR presentaban menor riesgo de eventos arrítmicos (p = 0,020) que los otros dos grupos analizados conjuntamente.
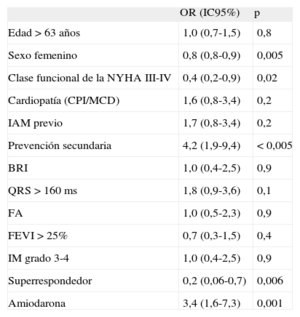
En el análisis univariable (tabla 5), el sexo femenino (OR = 0,8; IC95%, 0,8-0,9), la superrespuesta ecocardiográfica (OR = 0,20; IC95%, 0,06-0,70) y clase funcional de la New York Heart AssociationIII-IV (OR = 0,4; IC95%, 0,2-0,9) fueron las únicas variables estadísticamente significativas protectoras contra la arritmia ventricular, mientras que el implante de DAI en prevención secundaria (OR = 4,2; IC95%, 1,9-9,4) y el tratamiento con amiodarona (OR = 3,4; IC95%, 1,6-7,3) se asociaron a mayor riesgo de taquicardia ventricular durante el seguimiento.
Análisis univariable de predicción de arritmias ventriculares según variables clínicas
| OR (IC95%) | p | |
| Edad > 63 años | 1,0 (0,7-1,5) | 0,8 |
| Sexo femenino | 0,8 (0,8-0,9) | 0,005 |
| Clase funcional de la NYHA III-IV | 0,4 (0,2-0,9) | 0,02 |
| Cardiopatía (CPI/MCD) | 1,6 (0,8-3,4) | 0,2 |
| IAM previo | 1,7 (0,8-3,4) | 0,2 |
| Prevención secundaria | 4,2 (1,9-9,4) | < 0,005 |
| BRI | 1,0 (0,4-2,5) | 0,9 |
| QRS > 160 ms | 1,8 (0,9-3,6) | 0,1 |
| FA | 1,0 (0,5-2,3) | 0,9 |
| FEVI > 25% | 0,7 (0,3-1,5) | 0,4 |
| IM grado 3-4 | 1,0 (0,4-2,5) | 0,9 |
| Superrespondedor | 0,2 (0,06-0,7) | 0,006 |
| Amiodarona | 3,4 (1,6-7,3) | 0,001 |
BRI: bloqueo de rama izquierda; CPI: cardiopatía isquémica; FA: fibrilación auricular; FEVI: fracción de eyección del ventrículo izquierdo; IAM: infarto agudo de miocardio; IC95%: intervalo de confianza del 95%; IM: insuficiencia mitral; MCD: miocardiopatía dilatada; NYHA: New York Heart Association; OR: odds ratio.
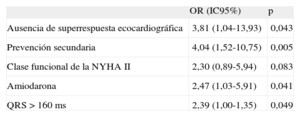
Finalmente se realizó un análisis multivariable. No se pudo incluir de dicho análisis el sexo, pues no había ninguna mujer con recurrencia de arritmia ventricular en el seguimiento. En este análisis, la ausencia de superrespuesta a la TRC (OR = 3,81; IC95%, 1,04-13,93; p = 0,043), el implante del dispositivo en prevención secundaria (OR = 4,04; IC95%, 1,52-10,75; p = 0,005), el tratamiento con amiodarona (OR = 2,47; IC95%, 1,03-5,91; p = 0,041) y el QRS > 160ms (OR = 2,39; IC95%, 1,00-1,35; p = 0,049) fueron los únicos factores independientes predictores de arritmias ventriculares (tabla 6).
Análisis multivariable de predicción de arritmias ventriculares
| OR (IC95%) | p | |
| Ausencia de superrespuesta ecocardiográfica | 3,81 (1,04-13,93) | 0,043 |
| Prevención secundaria | 4,04 (1,52-10,75) | 0,005 |
| Clase funcional de la NYHA II | 2,30 (0,89-5,94) | 0,083 |
| Amiodarona | 2,47 (1,03-5,91) | 0,041 |
| QRS > 160 ms | 2,39 (1,00-1,35) | 0,049 |
IC95%: intervalo de confianza del 95%; NYHA: New York Heart Association; OR: odds ratio.
En el estudio, se pretende comparar la incidencia de eventos arrítmicos ventriculares en pacientes portadores de DAI con TRC según la respuesta ecocardiográfica en cuanto a remodelado ventricular.
Actualmente el principal factor de decisión para implantar DAI es la FEVI, y se ha establecido en general que una FEVI ≤ 35% es indicación de implante21. Por dicho motivo, para los pacientes con DAI-TRC, en caso de mejoría de la FEVI al final de la vida del dispositivo, en especial en el grupo de SR, cambiar el DAI por un marcapasos-TRC podría ser una opción que considerar, con el consecuente ahorro económico.
En los pacientes SR, definidos como aquellos cuya FEVI fue ≤ 45% o al menos se duplicó respecto a la basal, se encontró una incidencia de arritmias ventriculares del 5,9% tras una mediana de seguimiento de 30,1 [18,0-55,1] meses.
Los mecanismos de asociación entre insuficiencia cardiaca, dilatación ventricular izquierda y arritmias ventriculares son complejos. La evidencia científica indica que el grado de remodelado inverso se asocia con la presencia de arritmias ventriculares. En el estudio Survival and Ventricular Enlargement, los cambios en el tamaño y la función del ventrículo fueron predictores de extrasístoles ventriculares y taquicardia ventricular22. Las terapias farmacológicas, como bloqueadores beta e inhibidores de la enzima de conversión de la angiotensina, también reducen la incidencia de arritmias ventriculares y muerte súbita23.
El papel de la TRC en la reducción de arritmias ventriculares está en discusión. En el estudio CONTAK-CD, en el que se comparó el uso de DAI-TRC frente a DAI convencional en 490 pacientes con insuficiencia cardiaca y clase funcional de la New York Heart AssociationII-IV, ambos grupos mostraron similar incidencia de choque apropiado tras 6 meses de seguimiento: el 15% de los pacientes con TRC frente al 16% del grupo de DAI convencional24.
De manera análoga, en el estudio MIRACLE ICD25 tampoco hubo diferencias entre los pacientes con TRC y con DAI convencional en cuanto a choque apropiado o terapia de estimulación antitaquicardia. El número de pacientes incluidos fue de 369 y el seguimiento volvió a ser relativamente corto (6 meses).
Sí se ha obtenido beneficio con seguimientos más largos. En el estudio CARE-HF extendido, en el que se siguió a los pacientes durante 3 años, la terapia con TRC sin DAI se asoció a reducción de muerte súbita (el 4,3% anual sin TRC frente al 2,5% anual con TRC)7. Parece que la reducción de arritmias con TRC se produce a medio o largo plazo. Analizando las curvas de Kaplan-Meier, no hay separación hasta transcurridos 2 años de seguimiento.
Teóricamente, la reducción de arritmias ventriculares por la TRC se produce por la mejora en el remodelado cardiaco, la reducción de la isquemia miocárdica y el estrés de pared y un cambio favorable en el estado neurohormonal del paciente26. Además las arritmias ventriculares se producen por reentradas en áreas de fibrosis miocárdica con conducción lenta. La estimulación ventricular izquierda puede estimular dichas zonas precozmente o modificar el vector de despolarización de tal modo que se reduzca la incidencia de taquicardia ventricular27. Por ello la localización del cable ventricular izquierdo es de vital importancia.
No obstante, el grado de remodelado ventricular debe ser el factor predictor de eventos ventriculares más importante. En 2009, Markowitz et al8 describieron que hubo reducción de la incidencia de extrasistolia ventricular, taquicardia ventricular no sostenida y episodios de taquicardia ventricular o fibrilación ventricular en pacientes R.
Posteriormente, Shahrzad et al10 describieron que la incidencia de arritmias ventriculares en pacientes portadores de DAI-TRC se reduce en pacientes R, definidos como mejora de la FEVI ≥ 5 puntos o reducción del diámetro telediastólico de al menos el 10%.
En un subestudio del MADIT-CRT9, se dividió a los pacientes del grupo de TRC en dos subgrupos según el grado de respuesta (reducción del volumen telesistólico del ventrículo izquierdo > 25% frente a < 25%). La probabilidad de arritmia ventricular, tras 2 años de seguimiento, fue menor en el grupo de pacientes R (12%) que en los de DAI convencional (21%) y pacientes NR (28%).
En este estudio, la incidencia de arritmias ventriculares en el grupo de SR (5,9%) fue inferior a la de los R (22,2%) y los NR (24,4%). Hubo una reducción significativa de la incidencia de arritmia ventricular entre SR y los demás grupos, sin diferencias entre R y NR. Es decir, solo los pacientes con un grado muy significativo de remodelado ecocardiográfico tras la TRC presentan una disminución clara del riesgo de recurrencia de arritmias ventriculares en el seguimiento. Esto podría explicar la heterogeneidad de los resultados de los estudios realizados hasta la fecha, que generalmente emplean puntos de corte de remodelado ventricular menos estrictos para clasificar a los pacientes como R.
La presencia de disfunción sistólica se asocia con aumento del riesgo de arritmias ventriculares y muerte súbita. Los SR a la TRC representan un subgrupo especial de pacientes posiblemente en estadios menos avanzados de su cardiopatía y con una geometría ventricular más conservada. En estos pacientes, el remodelado ventricular inverso y la recuperación de la función sistólica tras el implante se asocian también a una disminución del riesgo de arritmias, que no llega a desaparecer por completo. Es posible que exista un remodelado positivo, con mejoría de la fracción de eyección, que incluso puede llegar a normalizarse, pero pueden persistir áreas de fibrosis o conducción lenta, que pueden ser circuitos potenciales o reales para el desarrollo de arritmias ventriculares.
En nuestro estudio, a pesar de la superrespuesta a la TRC, hubo una incidencia de arritmia ventricular del 5,9% tras una mediana de seguimiento de 30,1 [18,0-55,1] meses, lo cual hace que no sea prudente el cambio del DAI por marcapasos en el momento de recambiar el dispositivo.
LimitacionesSe trata de un estudio retrospectivo observacional y realizado en un solo centro durante un periodo muy largo (13 años), por lo que está sometido a sesgos no controlados.
Entre los factores predictores de arritmia ventricular, se encuentra el tratamiento con amiodarona. Evidentemente hay un sesgo, ya que los pacientes que presentaron arritmias ventriculares recibieron con más frecuencia dicho tratamiento.
No se encontraron diferencias en cuanto a mortalidad entre los subgrupos. Además de que el objetivo del estudio no era ese, el tiempo de seguimiento puede ser corto para que la TRC muestre diferencias de supervivencia.
CONCLUSIONESSe encontraron cuatro factores que predicen de manera independiente la aparición de arritmias ventriculares en el seguimiento de pacientes con TRC: QRS > 160ms, el implante del DAI en prevención secundaria, el tratamiento con amiodarona y la clasificación ecocardiográfica distinta de SR.
Los pacientes SR presentan una clara reducción en la incidencia de arritmias ventriculares en comparación con los demás grupos. Aun así, existe un porcentaje no despreciable de pacientes SR que continúan presentando episodios arrítmicos durante el seguimiento, por lo que, para este subgrupo de pacientes, no resulta razonable prescindir del DAI en el momento del recambio.
CONFLICTO DE INTERESESNinguno.