Palabras clave
INTRODUCCIÓN
La enfermedad cardiovascular es la causa más importante de morbilidad y mortalidad en todo el mundo y el infarto del miocardio con elevación del segmento ST (IAMCEST) es la principal causa de muerte en México1. Aproximadamente el 9% de los nuevos eventos ocurren en sujetos menores de 45 años de edad, en quienes el componente genético se estima en un 20-60%2. Se ha determinado que existe una disminución de la actividad fibrinolítica en sujetos jóvenes menores de 45 años con infarto agudo de miocardio (IAM)3.
El inhibidor del activador del plasminógeno tipo 1 (PAI-1) es el principal inhibidor fisiológico de la actividad del sistema fibrinolítico mediante la inhibición del activador del plasminógeno tisular (tPA) y del inhibidor del activador tipo urocinasa (uPA), por lo que un incremento en su concentración plasmática se asocia a eventos trombóticos4. El polimorfismo que consiste en una sola inserción/deleción de una base guanina en la región promotora en la posición 675 da como resultado la presencia de los alelos 4G o 5G y tiene una acción reguladora de la concentración plasmática de PAI-15,6. Los individuos homocigotos para el alelo 4G (4G/4G), presentan concentraciones de PAI-1 más elevadas que los sujetos homocigotos para el alelo 5G (5G/5G); las concentraciones en individuos heterocigotos 4G/5G7 son intermedias. La deleción del alelo (4G) produce una incapacidad de unirse a una proteína de represión transcripcional y un incremento en la expresión de PAI-1, lo cual favorece una disminución en la actividad del sistema fibrinolítico.
Los resultados acerca del riesgo del polimorfismo 4G/5G en el desarrollo del IAM son contradictorios; algunos estudios han demostrado incremento8-12 y otros, disminución13 o no han podido confirmar asociación alguna14-16. El incremento de la concentración plasmática de PAI-1 se asocia con el aumento de mortalidad17, así como al desarrollo de un segundo IAM en pacientes menores de 45 años18.
Existen diferencias en las frecuencias alélicas del polimorfismo 4G/5G entre las diversas poblaciones del mundo, y se registra un porcentaje mayor del alelo 4G entre la asiática (59%)19 y la caucásica (51%)20, española (47%)21, india (54%)22, mexicana (34%)23 y africana (25%)24, lo que produce también variación en la concentración plasmática de PAI-1 de una población a otra, así como su interacción con otros factores reguladores como triglicéridos, glucosa, insulina, hipertensión y tabaquismo25,26; esto contribuye a diferencias en la susceptibilidad al desarrollo de enfermedades cardiovasculares entre los grupos poblacionales, y es mayor el porcentaje en amerindios (15-20%) y caucásicos (20-25%) que en africanos (1-5%)27.
Debido a la baja frecuencia del alelo 4G en nuestra población y a la variabilidad de la frecuencia del polimorfismo 4G/5G, nosotros decidimos evaluar su participación en el desarrollo del IAMCEST en sujetos jóvenes (edad ≤ 45 años), y la influencia en la regulación de la concentración plasmática de PAI-1.
MÉTODOS
En un diseño de casos y controles apareados por edad y sexo, incluimos a pacientes consecutivos con diagnóstico de IAMCEST ingresados a la Unidad de Cuidados Intensivos Cardiovasculares del Hospital de Cardiología del Centro Médico Nacional Siglo XXI durante el periodo de enero de 2006 a marzo de 2007.
Los criterios de diagnóstico de IAMCEST (ESC/ AHA/ACC)28,29 fueron dolor torácico durante 20 min o más; elevación de la isoenzima MB de la creatincinasa (CK-MB) o troponinas en el percentil 99 o más, y elevación del segmento ST en dos derivaciones contiguas de 2 mm en V1-3 y 1 mm en el resto de las derivaciones.
Todos los pacientes firmaron hoja de consentimiento informado para participar en el estudio. El protocolo fue aprobado por el Comité de Ética y de Investigación del Instituto Mexicano del Seguro Social conforme a los principios éticos de la Declaración de Helsinki.
Formaron el grupo control los sujetos presumiblemente sanos donadores de sangre en el mismo centro médico, quienes —por Norma Oficial Mexicana (NOM-003-SSA2-1993) para la disposición de sangre humana y sus componentes con fines terapéuticos— no deben tener factores de riesgo, aunque para ambos grupos los factores de riesgo se definieron de acuerdo con ESC de la siguiente manera:
- Diabetes mellitus: sujetos con una determinación de glucemia en ayunas > 126 mg/dl o con tratamiento médico previo con hipoglucemiantes.
- Dislipemia: concentraciones de colesterol > 200 mg/dl o tratamiento médico establecido.
- Hipertensión arterial sistémica: cuantificación de presión arterial sistólica de 140 mmHg y diastólica de 90 mmHg o tratamiento médico antihipertensivo previamente establecido.
Se excluyó a los pacientes con enfermedades trombofílicas conocidas, valvulopatías y cardiopatías congénitas asociadas conocidas.
Determinación de la concentración plasmática de PAI-1
Se obtuvo la muestra sanguínea 6 semanas tras el IAMCEST, con un mínimo de estasis en un tubo conteniendo citrato como anticoagulante, en un horario de las 8.00 a las 9.00 para evitar variaciones debidas al ritmo circadiano. La muestra fue centrifugada a 3.000 g durante 25 min a 4 °C para evitar contaminación del plasma con plaquetas. Se almacenó en alícuotas de 0,5 ml a -70 °C hasta su uso. La concentración plasmática de PAI-1 se determinó mediante técnica inmunoenzimática (ELISA) (Coaliza PAI-1, Chromogenix, Milán, Italia).
Determinación genotípica
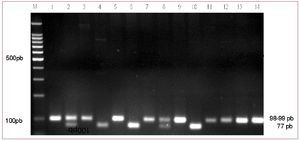
El ADN genómico se obtuvo de sangre periférica (concentrado leucocitario), utilizando un equipo comercial QIAamp DNA Blood mini kit (QIAGEN, Hilden, Alemania), acorde a las instrucciones del fabricante. La genotipificación del polimorfismo 4G/5G en el promotor del PAI-1 se realizó mediante la amplificación con técnica de reacción en cadena de la polimerasa (PCR), con los siguientes oligonucleótidos: 5'-CACAGAGAGAGTCTGGCCACGT-3' (sense)y 5' CCAACAGAGGACTCTTGGTCT-3' (antisense)30. La amplificación se realizó en un volumen final de 50 μl, 0,06 mol de cada nucleótido, 1 U de Taq ADN polimerasa, 1,5 mmol de MgCl2 y 0,1 mmol de cada dNTP (Promega, Madison, Wisconsin, Estados Unidos), bajo las siguientes condiciones térmicas: desnaturalización inicial a 94 °C por 3 min, seguido por 30 ciclos (desnaturalización a 94 °C de 30 s, una alineación a 60 por 30 s, y una extensión a 72 °C por 30 s), seguidos de una extensión lineal por 1 min a 72 °C. Se obtuvo un producto amplificado de 99 pb (5G) y 98 pb (4G). El producto fue restringido mediante la adición de 1 U de la enzima específica Bsl I (New England Biolabs, Beverly, Massachusetts, Estados Unidos) a 25 μl del producto amplificado e incubado a 55 °C para asegurar su completa restricción. Los fragmentos de ADN fueron separados mediante electroforesis de un gel de agarosa al 4% (BIO-RAD laboratorios Hercules, California, Estados Unidos) y teñido mediante bromuro de etidio (fig. 1). Las muestras se realizaron por duplicado en todos los casos para confirmar los resultados y algunas fueron secuenciadas.
Fig. 1. Análisis del gen de inhibidor del activador del plasminógeno tipo-1 en un gel de agarosa correspondiente a la región polimórfica 4G/5G. M representa el marcador de peso molecular 100 pb; las líneas 1, 3, 5, 7, 9, 11 y 13 representan el fragmento polimórfico amplificado correspondiente a 99-98 pb. Las líneas 4, 6 y 10 representan fragmentos del producto amplificado digerido por la enzima BslI (77, 22 pb), correspondientes al genotipo 5G/5G; las líneas 2 y 8 representan fragmentos del producto amplificado digeridos (98, 77, 22 pb), correspondientes al genotipo 4G/5G y las líneas 12 y 14 representan fragmentos del producto amplificado (98 pb) correspondientes al genotipo 4G/4G.
Análisis estadístico
Las variables continuas se expresan como medias ± desviación estándar; las variables categóricas, en porcentajes. Las diferencias con significación estadística entre las variables continuas se determinaron mediante la prueba de la t de Student y entre las variables categóricas, mediante la prueba de la χ2. La significación estadística o diferencia entre las medias de las concentraciones plasmáticas de PAI-1 entre los genotipos se determinaron mediante el análisis de varianza (ANOVA). El riesgo independiente se estimó con odds ratio (OR) con intervalo de confianza (IC) del 95% entre los factores de riesgo cardiovasculares convencionales y la presencia del polimorfismo 4G/5G mediante el análisis de regresión logística. Se consideró que había diferencia estadística cuando el valor de p fue ≤ 0,05. El análisis estadístico se realizó mediante el paquete estadístico SPSS (Statistical Package for the Social Sciences) versión 13 (SPSS Inc, Chicago, Illinois, Estados Unidos) y EpiInfo versión 3.3.2. 2005.
RESULTADOS
Estudiamos 127 casos con diagnóstico de IAMCEST y 127 controles de edad ≤ 45 años apareados por edad y sexo. Encontramos una alta prevalencia de factores de riesgo convencionales en el grupo de casos. Las variables asociadas al IAMCEST fueron tabaquismo —OR = 12,64 (IC del 95%, 6,46-25)—, hipertensión —OR = 5,63 (IC del 95%, 2,68-12,01)—, diabetes mellitus —OR = 5,58 (IC del 95%, 2,52-12,63)—, dislipemia —OR = 5,79 (IC del 95%, 2,69-12,68)— y antecedente familiar de enfermedad cardiovascular —OR = 5,52 (IC del 95%, 2,78-11,09)—. La distribución de la localización del IAM se muestra en la tabla 1.
En el grupo de casos encontramos que el genotipo más frecuente fue el heterocigoto 4G/5G (50,4%), seguido del homocigoto para 5G (42,5%); el menor fue el homocigoto 4G (7,1%). La frecuencia alélica en el grupo de IAMCEST fue para el alelo 4G (32,3%) y (67,7%) para el alelo 5G. En el grupo control el genotipo 4G/4G fue del 13,4%; el 4G/5G, el 30%, y el 5G/5G, el 56,6%. La frecuencia del alelo 5G fue del 71,6% en el grupo control. Se identificó una diferencia con significación estadística en la distribución genotípica (p < 0,002), pero no se identificó una diferencia con significación estadística en la frecuencia alélica entre los pacientes con IAMCEST y el grupo control (p = 0,46). En el análisis univariable se identificó riesgo de IAMCEST en los sujetos portadores del alelo 4G (4G/4G y 4G/5G) comparado con los homocigotos para el alelo 5G (5G/5G), con OR = 1,77 (IC del 95%, 1,04-3) (tabla 2). No se encontró significación estadística entre las medias del porcentaje de fracción de eyección del ventrículo izquierdo (p = 0,58).
La concentración de creatincinasa (CK) estuvo en una media de 956 ± 767 U/l en los sujetos portadores del alelo 5G, mientras que en los portadores del alelo 4G fue 1.756 ± 1.661 U/l (p = 0,01). La concentración de troponina I (TnI) fue una media de 8,5 ± 8,4 ng/dl en los sujetos portadores del alelo 5G, mientras que los sujetos portadores del alelo 4G fue 15,6 ± 13,08 ng/dl (p = 0,05). En cuanto al estado inflamatorio, la concentración de fibrinógeno fue mayor en los sujetos portadores del alelo 4G (585 ± 187 mg/dl) que en los individuos con el alelo 5G (471 ± 133 mg/dl) (p = 0,02). La cifra de leucocitos en los sujetos del grupo 4G fue 10.754 ± 2.232 y en los del grupo 5G, 10.436 ± 3.113 (p = 0,64). En cuanto a la reperfusión, se efectuó un total de 38 procedimientos de angioplastia coronaria transluminal percutánea (ACTP), de los cuales 24 se llevaron acabo en sujetos portadores del alelo 5G; se consideró exitosos a 21 (87,5%), mientras que se efectuaron 14 en sujetos portadores del alelo 4G, 8 (57,1%) en forma exitosa (p = 0,05) (tabla 3).
En el análisis multivariable de regresión logística, cuatro variables mantuvieron su independencia como factores de riesgo de IAMCEST: ser portador del alelo 4G (4G/4G+4G/5G), el tabaquismo y el antecedente de enfermedad cardiovascular e hipertensión arterial (tabla 4).
Los sujetos homocigotos para 4G mostraron concentraciones mayores que los sujetos homocigotos para el alelo 5G. Las máximas concentraciones de PAI-1 se identificaron en los portadores homocigotos para el alelo 4G (74,8 ± 11,7 ng/100 ml), mientras que para los heterocigotos 4G/5G fueron 51,2 ± 10,9 ng/ml, y las más bajas fueron las de los heterocigotos del alelo 5G (39,2 ± 7,74 ng/ml) (p < 0,001).
Se realizó un análisis de asociación de los factores de riesgo con los valores de PAI-1 identificando el tercer tercil de mayor riesgo en comparación con los dos terciles inferiores con diferencias respecto a la hipertensión (p = 0,05), el tabaquismo (p = 0,02) y el alelo 4G (p = 0,01). En un análisis de regresión logística obtuvieron significación estadística el alelo 4G (OR = 5,52; IC del 95%, 2,08-17,05; p = 0,001) y el tabaquismo (OR = 5,05; IC del 95%, 1,82-12,24; p = 0,002).
DISCUSIÓN
La etiología de la enfermedad cardiovascular es multifactorial, y destacan factores genéticos y ambientales. Un incremento en los valores de PAI-1 en placas aterosclerosas vulnerables asociado a una respuesta inflamatoria aumentada puede ser la mezcla necesaria para un fenómeno aterotrombótico, como es el IAMCEST, en pacientes jóvenes en quienes se espera encontrar lesiones inicialmente no obstructivas. Estudios previos han demostrado una asociación entre la presencia del polimorfismo 4G/5G en la región promotora del gen PAI-1 y el desarrollo de IAM9,17,18; sin embargo, esto no ha sido corroborado por otros investigadores12,15, lo que ha originado resultados controvertidos al respecto. En nuestro conocimiento, éste es el primer estudio realizado en nuestra población que evalúa la participación del polimorfismo 4G/5G en pacientes de edad ≤ 45 años con IAMCEST.
En la mayoría de las poblaciones estudiadas en el mundo, la frecuencia mayor corresponde al alelo 4G, en comparación con el alelo 5G. Sin embargo, en los sujetos de nuestro grupo control, pudimos observar una frecuencia del alelo 4G del 28%, una de las más bajas reportadas en comparación con las identificadas en otras series, pero similar a la descrita en la población afroamericana24
(25%) y japonesa (30%)31. La baja frecuencia del alelo 4G obtenida en nuestro estudio en el grupo control concuerda con los resultados previamente obtenidos por Ruiz-Quezada et al23. La población incluida en nuestro estudio (mestiza mexicana) es una mezcla étnica indígena, negra y española, lo que podría explicar la diferencia obtenida entre la frecuencia alélica en nuestra población y las otras poblaciones estudiadas.
Nuestros resultados demuestran que el alelo 4G es un factor de riesgo para el desarrollo de IAMCEST, en concordancia con publicaciones previas8-12. Sin embargo, difiere de los resultados obtenidos en otras poblaciones32,33, en sujetos jóvenes (≤ 45 años) o sólo representó un riesgo moderado en sujetos con antecedentes de tabaquismo22.
También se ha demostrado variabilidad en las concentraciones plasmáticas de PAI-1 en los diferentes grupos étnicos en todo el mundo5,7,14, que en algunas razas están determinadas por el polimorfismo 4G/5G14, mientras que en otras influyen factores ambientales como el tabaquismo34, componentes del síndrome metabólico como la dislipemia, la obesidad y las concentraciones de insulina35, o la interacción de ambos36,37, que representa un incremento del riesgo de enfermedad cardiovascular. Festa et al25 demostraron previamente que las diferencias étnicas en la distribución del polimorfismo 4G/5G son determinantes en las concentraciones plasmáticas circulantes de PAI-1. En el presente estudio, los sujetos homocigotos para el alelo 4G (4G/4G) obtuvieron las mayores concentraciones plasmáticas de PAI-1, mientras que las intermedias se observaron en los sujetos heterocigotos (4G/5G) y la menores, en homocigotos del alelo 5G (5G/5G), por lo que la interacción con otros factores de riesgo tradicionales es necesaria para el desarrollo de IAMCEST. De ahí la importancia de identificar esta combinación como una estrategia de prevención primaria, desde etapas tempranas de la vida. El tabaquismo en pacientes jóvenes portadores del alelo 4G puede tener mayor impacto en la frecuencia del IAM, por lo que las campañas para el abandono tabáquico en este grupo de pacientes deberían intensificarse y podría planearse realizar estudios de escrutinio en estos pacientes.
En nuestro estudio las concentraciones plasmáticas de PAI-1 6 semanas después fueron más elevadas en los sujetos con alelo 4G, tal como publicaron Serrano Ríos et al38, en pacientes con síndrome metabólico. Dicho incremento se ha asociado con IAM, y aunque desciende en forma progresiva, persisten elevados hasta 6 meses, como demostraron Panahloo et al39, por lo que esto coincide con lo propuesto por Sobel et al40 en que la sobreexpresión de PAI-1 produce una disminución del contenido de fibras lisas musculares en la placa aterosclerosa, lo que origina una disminución en el colágeno y las proteínas de la matriz extracelular, con decremento en la resistencia en el ateroma, y así se produce el desarrollo de una placa vulnerable, su rotura y con ello el IAM. Shindo et al41 demostraron un incremento significativo en la expresión de PAI-1 en el ateroma de pacientes con IAM, comparados con los pacientes con angina de pecho estable, por lo que los valores de PAI-1 incrementados pueden ser parte de los factores desencadenantes del IAM. Por otra parte, el incremento en las concentraciones de PAI-1 favorece un estado de hipofibrinolisis mediante la inhibición del activador del plasminógeno tisular (tPA) y con ello una disminución en la transformación de plasminógeno a plasmina; esta enzima es clave en la regulación del sistema fibrinolítico4.
De esta manera podríamos hipotetizar que la presencia del alelo 4G se asocia a las altas concentraciones de PAI-1 y con ello dos mecanismos favorecen el infarto: placa vulnerable y disminucion de la fibrinolisis, lo que cobra interés en pacientes jóvenes como una explicación de los mecanismos fisiopatológicos del IAMCEST.
CONCLUSIONES
El alelo 4G es un factor independiente de aparición de IAMCEST en sujetos jóvenes, al igual que los factores de riesgo tradicionales, por lo que identificar este y otros factores podría ser útil en la prevención primaria. Los valores de PAI-1 son más elevados en pacientes con el alelo 4G, por lo cual pudiera ser factor desencadenante del IAMCEST.
AGRADECIMIENTOS
El autor agradece por el apoyo económico al Fondo para el Fomento de la Investigación FOFOI-IMSS, México (FP 2005/1/I/174 para I.I.S.), (2005/6/1/444 para I.I.S.) y a la Secretaría de Investigación y Posgrado (SIP) 20060622.
ABREVIATURAS
AP: angina de pecho.
IAMCEST: infarto agudo de miocardio con elevación del segmento ST.
PAI-1: inhibidor del activador del plasminógeno tisular tipo 1.
Véase editorial en págs. 347-9
Full English text available from: www.revespcardiol.org
Correspondencia: Dra. I. Isordia Salas.
Apartado Postal B 32. Coahuila N.o 5 México DF. CP 06703 México.
Correo electrónico: irmaisordia@yahoo.com.mx
Recibido el 11 de abril de 2008.
Aceptado para su publicación el 11 de diciembre de 2008.