Los cambios hormonales se reconocen como un factor desencadenante de la disección coronaria espontánea (DCE). Sin embargo, se desconoce si la exposición al tratamiento con hormonas exógenas (TH) en el momento del diagnóstico tiene algún impacto clínico. Se estudió en mujeres con DCE la asociación entre la TH y los eventos clínicos a corto plazo.
MétodosSe incluyó a mujeres con DCE del registro DISCO-IT/SPA (dissezioni spontanee coronariche Italian-Spanish). Se identificó a las mujeres en TH (estrógenos, progestágenos o gonadotropinas) al momento del diagnóstico y se comparó sus resultados a corto plazo con aquellas sin TH activa. El evento compuesto medido fue infarto de miocardio no fatal o intervención coronaria percutánea no planificada durante los primeros 28 días después del cateterismo índice.
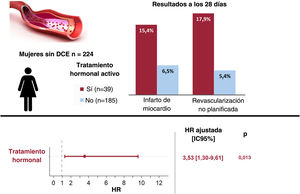
ResultadosDe 224 mujeres que sufrieron una DCE (media de edad, 52,0±10,0 años), 39 (17,4%) estaban en TH y 185 (82,6%) no. No se observaron diferencias significativas entre ambos grupos en la demografía, la presentación clínica, las características angiográficas o el tratamiento inicial. Todas las pacientes en TH sistémico (n=36, 92%) lo suspendieron al diagnóstico. El evento compuesto se produjo en 7 pacientes (17,9%) con TH en comparación con 14 (7,6%) sin TH (p=0,039). Tras un ajuste multivariable, el TH se mantuvo asociado con el evento compuesto registrado en los primeros 28 días de seguimiento (HR=3,53; IC95%, 1,30-9,61; p=0,013).
ConclusionesEn mujeres con DCE, la exposición al TH en el momento de la presentación clínica se asoció con eventos cardiovasculares recurrentes a corto plazo, como infarto de miocardio no fatal o revascularización percutánea no planificada.
Palabras clave
La disección coronaria espontánea (DCE) es una causa del síndrome coronario agudo con un claro predominio femenino (81-92%)1. La incidencia notificada ha aumentado en los últimos años, en parte debido al mayor reconocimiento de este cuadro clínico y la mejora del diagnóstico con técnicas de imagen2. Estudios recientes señalan que la DCE es la causa fundamental de hasta el 35% de todos los infartos de miocardio en mujeres menores de 50 años y la etiología más común del infarto de miocardio (IM) relacionado con el embarazo3.
A pesar de los avances recientes en la comprensión de la patología de la DCE, los mecanismos fisiopatológicos continúan poco claros4. Las hipótesis que abarcan la posible participación de las hormonas sexuales en la DCE están respaldadas por el claro predominio femenino en la enfermedad y su relación con el embarazo5–7. Las explicaciones causales incluyen cambios en el tejido conjuntivo inducidos por hormonas, como la pérdida de la estructura de las fibras elásticas, la degeneración del colágeno, la hipertrofia del músculo liso, el estrés de cizallamiento y la modificación en la composición de mucopolisacáridos y proteínas de la túnica media arterial8,9.
La participación del tratamiento con hormonas (TH) exógenas en la DCE y la evolución clínica posterior de las pacientes que siguen este tratamiento sigue siendo objeto de debate10,11. Hasta la fecha, los datos sobre el impacto del TH antes, durante o después de un evento de DCE son escasos12,13. El objetivo de este estudio es investigar si la exposición previa al TH de mujeres con DCE influyó en los resultados clínicos a corto plazo en cuanto a IM no mortal y/o revascularización percutánea no planificada.
MÉTODOSDiseño del estudio y poblaciónDISCO-IT/SPA (DIssezioni Spontanee COronariche ITalian-SPAnish) es un registro observacional, internacional, multicéntrico y retrospectivo que incluyó a pacientes con DCE de 26 centros. Se incluyó a las pacientes en el registro entre el 1 de enero de 2009 y el 31 de diciembre de 2019. En el presente análisis se incluyó a mujeres con presentación clínica compatible con síndrome coronario agudo y características coronariográficas que cumplieran los criterios de DCE6. Todos los casos fueron confirmados y clasificados angiográficamente por un laboratorio central, como se ha descrito con anterioridad14,15. Se excluyó a las pacientes con cardiopatía ateroesclerótica significativa (estenosis angiográfica ≥ 50%) en otros segmentos coronarios o con una placa complicada preexistente revelada por imagen intracoronaria. Se diseñó un formulario electrónico concreto de notificación de caso16 y un formulario de consentimiento informado.
Los datos demográficos, la exposición al TH, la presentación clínica, los hallazgos angiográficos, el tratamiento y los resultados se extrajeron de los documentos de origen clínico o se recopilaron de historias clínicas, entrevistas con las pacientes y visitas de seguimiento. La exposición a TH se evaluó mediante entrevista directa con la paciente o comprobando el sistema de receta electrónica, pero no necesariamente los dos. El TH podía incluir estrógenos, progestágenos o gonadotropinas y la paciente tenía que haber estado en tratamiento en el momento de producirse la DCE, sin concreción del momento de inicio. Las indicaciones clínicas para estos tratamientos englobaban anticoncepción, tratamiento de reemplazo hormonal frente a síntomas climatéricos o infertilidad. La DCE asociada con el embarazo se definió como la presentación del evento inicial durante el embarazo o durante los 12 meses posteriores al parto17. Un administrador de datos especializado (L. Lo Salvio) supervisó la verificación de la fuente, el control de calidad y las consultas del centro de coordinación a los centros participantes para reducir el sesgo. El estudio fue aprobado por los comités de revisión institucional y se llevó a cabo de conformidad con la Declaración de Helsinki.
Seguimiento y resultadosLos eventos adversos se notificaron en una sección específica del formulario electrónico de notificación de caso. Para confirmar el evento, el centro coordinador revisó las coronariografías y la información clínica disponible (presentación clínica, electrocardiograma de 12 derivaciones, valores de troponina I). Los resultados clínicos incluyeron muerte por cualquier causa, IM no mortal (cuarta definición universal de IM18), cualquier revascularización no planificada, ictus o eventos hemorrágicos del Bleeding Academic Research Consortium (BARC). El éxito de la intervención coronaria percutánea (ICP) se definió como flujo Thrombolysis in Myocardial Infarction (TIMI) de grado 2-3 con estenosis residual < 30% (después del implante del stent/andamiaje) o < 50% (después de angioplastia simple con balón) en el primer cateterismo. El resultado compuesto primario fue IM no mortal (cuarta definición universal de IM)18 o ICP no planificada en cualquier momento después del cateterismo inicial y en los primeros 28 días de seguimiento (4 semanas). Dado que la mayoría de las pacientes con este tratamiento suspendieron el TH, se decidió analizar el resultado primario a los 28 días para explorar una relación más directa con la exposición. También se notifican los resultados tras 12 meses de seguimiento.
Análisis estadísticosLa variable de agrupamiento fue el TH (2 grupos). Las variables no cualitativas se resumen con medias y se compararon por medio de pruebas ANOVA o de Kruskal-Wallis según la normalidad de las distribuciones. Las variables cualitativas se expresan como porcentajes y se compararon utilizando las pruebas exacta de Fisher o de la χ2 en caso necesario. Se trazaron curvas de Kaplan-Meier del tiempo hasta la manifestación del resultado compuesto de cada grupo y se compararon utilizando la prueba de rangos logarítmicos. El ajuste multivariable se realizó mediante regresión de Cox, incluyendo la edad y las covariables con un nivel de significación < 0,20 en el análisis univariante junto con los considerados clínicamente relevantes.
En un análisis complementario, se utilizó la probabilidad inversa de ponderación del tratamiento (inverse probability of treatment weighting [IPTW]), un método de índice de propensión, para ajustar las variables de referencia que se distribuyeron de manera diferente entre los grupos. Esto se siguió de una regresión de Cox multivariable para controlar por factores de confusión conocidos o potenciales relacionados con el resultado (infarto agudo de miocardio con elevación del segmento ST [IAMCEST], enfermedad multivaso, angiotipo 2A y 3, flujo TIMI 3 o tratamiento antiagregante plaquetario doble). La IPTW se estimó utilizando un modelo de regresión logística que incluía todos los posibles factores de confusión basales que se distribuyeron de manera diferente entre los grupos (edad, tabaquismo, hipertensión, dislipemia y migrañas). Luego se llevó a cabo una evaluación del equilibrio, comparando la distribución de las covariables de referencia medidas entre los grupos utilizando diferencias estandarizadas antes (brutas) y después (ponderadas) de la IPTW. Por regla general, una diferencia estandarizada < 0,10 puede considerarse un desequilibrio entre los grupos insignificante19. Además, se utilizó la prueba de sobreidentificación respecto al equilibrio de covariables para evaluar el resultado de la IPTW. La significación estadística se estableció en p ≤ 0,05 (prueba bilateral) para las comparaciones y medidas de asociación. Todos los análisis estadísticos se realizaron con Stata IC 15.1 (Stata Corp, Estados Unidos).
RESULTADOSSe inscribió a 302 pacientes en el registro; 267 (88,4%) eran mujeres. De ellas, 43 (16,1%) fueron excluidas por falta de datos clave (TH) o seguimiento mínimo insuficiente. Estas pacientes no mostraron diferencias con aquellas con los datos completos (tabla 1 del material adicional). Así, en este estudio se incluyó a 224 mujeres con datos completos y un seguimiento mínimo de 28 días. En general, la media de edad fue 52,0±10,0 (intervalo, 29-84) años. Recibieron TH 39 pacientes (17,4%) durante una mediana de 3 [intervalo intercuartílico, 1-7] años, que en la mayoría de los casos fue anticoncepción oral (51,3%) (tabla 1). Solo las 3 pacientes con un dispositivo intrauterino continuaron el tratamiento después de los eventos, al menos durante el primer mes que se comprobó esta variable.
Tipo y duración del tratamiento hormonal en el momento de la disección coronaria espontánea
| Tipo | Pacientes (n=39) | Duración |
|---|---|---|
| Tratamiento de reemplazo hormonal (combinada) | 12 (30,8) | 3,8±4,6 |
| Anticoncepción oral combinada | 20 (51,3) | 7,5±7,8 |
| Anticoncepción oral con progestágenos | 2 (5,1) | 3±2 |
| Progestágeno tópico (DIU) | 3 (7,7) | 1,7±1,2 |
| Fertilidad (gonadotropinas, estrógenos y progestágenos) | 2 (5,1) | 1,1±1,2 |
DIU: dispositivo intrauterino.
Los valores expresan n (%) o media±desviación estándar.
Las características basales de las pacientes con y sin TH en el momento del evento fueron similares, excepto por el hecho de una mayor prevalencia de migrañas y una menor prevalencia de dislipemia en el grupo con TH (tabla 2). En cuanto a la presentación clínica, el 47,8% presentó IAMCEST y el 47,3%, IM sin elevación del segmento ST (IMSEST). Las principales características angiográficas de ambos grupos, como el angiotipo de DCE, no fueron muy diferentes (tabla 3). La mayoría de las pacientes (n=142; 63,4%) recibieron un tratamiento conservador como estrategia inicial, sin diferencias importantes entre los grupos. Por otro lado, de las 82 pacientes intervenidas (36,6%), se consideró con éxito el 72,0% de las ICP según el análisis del laboratorio central. Se practicó cirugía de revascularización coronaria como primera opción terapéutica a 1 paciente (0,5%). Los medicamentos administrados, como el tratamiento antiagregante plaquetario, no fueron diferentes entre los 2 grupos (tabla 4). La mediana de estancia hospitalaria fue 6 [5-8] días. En el momento del alta, se había revascularizado a 101 pacientes (45,1%) (ICP, n=100; revascularización coronaria, n=1). No hubo muertes.
Características clínicas basales y presentación clínica
| Características | Con tratamiento hormonal(n=39) | Sin tratamiento hormonal(n=185) | p |
|---|---|---|---|
| Edad (años) | 46,5 ± 8,0 | 53,2 ± 10,0 | 0,089 |
| Factores de riesgo cardiovascular | |||
| Diabetes mellitus | 1 (2,6) | 3 (1,6) | 0,541 |
| Hipertensión | 8 (20,5) | 65 (35,1) | 0,073 |
| Tabaquismo | 13 (33,3) | 44 (23,8) | 0,213 |
| Dislipemia | 8 (20,5) | 72 (39,1) | 0,035 |
| Otros antecedentes médicos | |||
| Hipotiroidismo | 7 (18,0) | 25 (13,5) | 0,472 |
| Migraña | 13 (33,3) | 33 (17,8) | 0,034 |
| Depresión | 6 (15,4) | 29 (15,9) | 0,943 |
| Antecedes obstétricos/ginecológicos | |||
| Asociación con el embarazo | 1 (2,6) | 3 (1,6) | 0,541 |
| Estado posmenopáusico | 5 (12,8) | 82 (44,3) | 0,066 |
| Presentación clínica | |||
| IAMCEST | 22 (56,4) | 85 (45,9) | 0,141 |
| IAMSEST | 13 (33,3) | 93 (50,3) | 0,054 |
| Parada cardiaca | 2 (5,1) | 8 (4,3) | 0,687 |
| FEVI (%) | 55,7±9,5 | 53,9±8,6 | 0,276 |
FEVI: fracción de eyección del ventrículo izquierdo; IAMCEST: infarto de miocardio con elevación del segmento ST; IAMSEST: infarto de miocardio sin elevación del segmento ST.
Los valores expresan n (%) o media±desviación estándar.
Características angiográficas y primera opción de tratamiento
| Características angiográficas | Con tratamiento hormonal(n=39) | Sin tratamiento hormonal(n=185) | p |
|---|---|---|---|
| Vaso culpable | |||
| Principal izquierda | 1 (2,6) | 5 (2,7) | 1 |
| DAI | 22 (56,4) | 104 (56,2) | 0,982 |
| CI | 8 (20,5) | 39 (21,1) | 0,937 |
| CD | 8 (20,5) | 37 (20) | 0,942 |
| Longitud de la lesión (mm) | 44±23,6 | 40,3±24,5 | 0,872 |
| Enfermedad multivaso | 5 (12,8) | 20 (10,8) | 0,717 |
| Clasificación de Adlam | |||
| Tipo 1 | 7 (17,9) | 27 (14,6) | 0,596 |
| Tipo 2A | 13 (37,1) | 49 (26,5) | 0,385 |
| Tipo 2B | 6 (15,4) | 45 (24,3) | 0,226 |
| Tipo 3 | 2 (5,1) | 10 (5,4) | 0,976 |
| Tipo 4 | 11 (28,2) | 54 (29,2) | 0,945 |
| Angiotipos 2A y 3 | 15 (38,5) | 59 (31,9) | 0,428 |
| Uso de TCO | 8 (20,5) | 20 (10,8) | 0,096 |
| Flujo TIMI al inicio del estudio | |||
| Flujo TIMI 0 | 10 (25,6) | 47 (25,5) | 0,975 |
| Flujo TIMI 1 | 5 (12,8) | 20 (10,9) | 0,717 |
| Flujo TIMI 2 | 10 (25,6) | 28 (15,2) | 0,112 |
| Flujo TIMI 3 | 14 (35,9) | 89 (48,4) | 0,164 |
| Primera opción de tratamiento | |||
| Tratamiento médico | 24 (61,5) | 118 (63,8) | 0,880 |
| ICP | 15 (38,5) | 67 (36,2) | |
| Derivación coronaria | 0 | 1 (0,54) | |
| Éxito de la ICP | 10 (66,7) | 49 (73,1) | 0,532 |
CD: arteria coronaria derecha; CI: arteria circunfleja izquierdo; DAI: arteria descendente anterior izquierda; ICP: intervención coronaria percutánea; TCO: tomografía de coherencia óptica; TIMI: Thrombolysis in Myocardial Infarction.
Los valores expresan n (%) o media±desviación estándar.
Tratamiento farmacológico recibido
| Fármaco | Con tratamiento hormonal(n=39) | Sin tratamiento hormonal(n=185) | p |
|---|---|---|---|
| HNF | 31 (79,5) | 142 (76,8) | 0,545 |
| Anti-GPIIb/IIIa | 2 (5,1) | 15 (8,1) | 0,227 |
| Tratamiento antiagregante plaquetario simple | 11 (28,2) | 46 (24,9) | 0,687 |
| Tratamiento antiagregante plaquetario doble | 28 (71,8) | 139 (75,1) | 0,707 |
| Bloqueadores beta | 29 (74,4) | 156 (84,3) | 0,430 |
| Antagonistas del calcio | 4 (10,3) | 18 (9,7) | 0,526 |
Anti-GPIIb/IIIa: inhibidores de la glucoproteína IIb/IIIa; HNF: heparina no fraccionada.
Los valores expresan n (%).
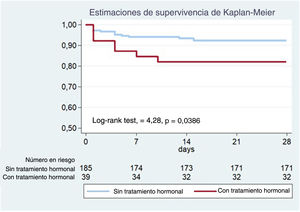
El objetivo primario compuesto después del cateterismo inicial y durante los primeros 28 días de seguimiento se produjo en mayor proporción en el grupo con TH: 7 (17,9%) frente a 14 (7,6%) pacientes; log-rank test, 4,28; p=0,0386 (figura 1, tabla 5). Las 7 pacientes con eventos en el grupo con TH estaban en anticoncepción oral (n=4) o tratamiento de reemplazo hormonal (n=3) y ninguna tenía un embarazo reciente/actual. Más pacientes en TH requirieron ICP no planificada: 7 (17,9%) frente a 10 (5,4%; p=0,007), y la indicación más común fue dolor torácico con evidencia de isquemia en el electrocardiograma (87,5%). De las que requirieron ICP no planificada, la mayoría (n=13; 72,2%) experimentó una progresión clara de la disección inicial con empeoramiento del flujo angiográfico. Además, se observó una tendencia hacia una mayor incidencia de IM en el grupo con TH (el 15,4 frente al 6,5%, p=0,063). No parece que las diferencias observadas en los resultados clínicos estuvieran influidas por haberse sometido a ICP o por un tratamiento conservador (tabla 5). Después del ajuste multivariable en el análisis de regresión de Cox, el TH se mantuvo significativamente asociado con el resultado compuesto (hazard ratio [HR] ajustada = 3,53; intervalo de confianza del 95% [IC95%], 1,30-9,61; p=0,013) (tabla 2 del material adicional). En concordancia, la IPTW, seguida de una nueva regresión de Cox multivariable, arrojó HR ajustada = 3,65 (IC95%, 1,51-8,80; p=0,999) (tabla 3 del material adicional).
Resultados clínicos a los 28 días y a los 12 meses de seguimiento
| Con tratamiento hormonal(n=39) | Sin tratamiento hormonal(n=185) | p | |
|---|---|---|---|
| Eventos adversos a los 28 días | |||
| Resultado compuesto | 7 (17,9) | 14 (7,6) | 0,043 |
| Infarto de miocardio no mortal | 6 (15,4) | 12 (6,5) | 0,063 |
| ICP no planificada | 7 (17,9) | 10 (5,4) | 0,007 |
| Muertes | 0 | 0 | - |
| Ictus o AIT | 0 | 1 (0,5) | 0,914 |
| Hemorragia BARC 1 o 2 | 1 (2,6) | 3 (1,6) | 0,541 |
| Resultado compuesto a los 28 días por el primer tratamiento elegido | |||
| Tratamiento médico (n=142) | 4/24 (16,7) | 8/118 (6,8) | 0,121 |
| ICP (n=82) | 3/15 (20) | 6/67 (8,9) | 0,353 |
| Eventos adversos a los 12 meses | |||
| Resultado compuesto | 8 (20,5) | 20 (10,8) | 0,095 |
| Infarto de miocardio no mortal | 6 (15,4) | 15 (8,1) | 0,156 |
| ICP no planificada | 8 (20,5) | 13 (7,0) | 0,008 |
| Muertes | 0 | 0 | - |
| Ictus o AIT | 0 | 1 (0,5) | 0,914 |
| Hemorragia BARC 1 o 2 | 1 (2,6) | 3 (1,6) | 0,541 |
AIT: accidente isquémico transitorio; BARC: Bleeding Academic Research Consortium; ICP: intervención coronaria percutánea.
Los valores expresan n (%).
Los resultados a 12 meses también se presentan en la tabla 5. Aunque la diferencia absoluta en el resultado compuesto continuó siendo grande entre las pacientes con y sin TH, ya no fue estadísticamente significativa (el 20,5 frente al 10,8%; p=0,095). La incidencia de IM no mortal tampoco fue estadísticamente diferente (el 15,4 frente al 8,1%; p=0,156). En cambio, la diferencia en la ICP no planificada se mantuvo significativa (el 20,5 frente al 7,0%; p=0,008). No se registraron muertes durante el primer año de seguimiento de la población del estudio.
DISCUSIÓNEn nuestro registro multicéntrico de DCE, estar en TH en el momento del evento inicial de DCE se asoció con un mayor riesgo de IM no mortal o revascularización percutánea no planificada a corto plazo (figura 2). Este hallazgo puede ser útil para identificar a las pacientes con mayor riesgo de eventos recurrentes tempranos, que pueden beneficiarse de una estrecha vigilancia durante el ingreso por la DCE.
Figura central. Las mujeres en tratamiento hormonal activo en el momento de presentarse la DCE mostraron un aumento de la tasa de eventos a los 28 días. El tratamiento hormonal fue un factor pronóstico independiente de MACE. HR ajustada por edad, tabaquismo, enfermedad multivaso, angiotipos 2A y 3 y tratamiento antiagregante plaquetario doble. DCE: disección coronaria espontánea; HR: hazard ratio; IC95%, intervalo de confianza del 95%; MACE: eventos cardiovasculares mayores.
Las hormonas femeninas exógenas ocasionan varios efectos en el sistema cardiovascular. Desde el punto de vista clínico, se ha demostrado que el tratamiento de reemplazo hormonal y algunas formas de anticoncepción oral aumentan el riesgo de tromboembolia venosa e ictus en la población sana, mientras que solo las segundas se han asociado con un mayor riesgo de IM20,21. Los efectos de los estrógenos en las arterias varían en función de la etapa de la vida reproductiva y protegen contra la aparición de ateroesclerosis a las mujeres premenopáusicas22. Además, se sabe que las pacientes en TH (estrógenos y progestágenos) pueden experimentar modificaciones sutiles de la pared arterial causadas por la fragmentación de las fibras de reticulina, la degeneración del colágeno, la pérdida de la ondulación normal de las fibras elásticas, la hipertrofia de las células del músculo liso y los cambios en el contenido de mucopolisacáridos y la composición proteica de la túnica media. Todos estos factores pueden contribuir a un debilitamiento de esta y, en última instancia, favorecer la disección8,23. Además, las hormonas femeninas contribuyen a la retención de líquidos y la reducción de la resistencia periférica, lo que produce un aumento del gasto cardiaco e, hipotéticamente, facilita las hemorragias en la túnica media y la rotura de la íntima24.
La modificación de la estructura de la pared vascular asociada con el TH puede ser causa de un incremento de la fragilidad vascular en pacientes que ya tienen propensión a la DCE y actuar como desencadenante del evento agudo de DCE o como factor pronóstico de progresión clínica precoz. En este sentido, Antonutti et al.12 ya habían descrito una asociación del TH con la DCE recurrente de novo en el seguimiento a largo plazo, pero carecía de potencia estadística (n=60 mujeres) para confirmarlo en análisis multivariable. En una cohorte prospectiva de pacientes con DCE no ateroesclerótica de 22 centros de Norteamérica (n=750), no se encontró que el TH activo estuviera asociado con peores resultados (el 10% de las pacientes inscritas). Sin embargo, su población de estudio era diferente de la nuestra, ya que tenía un perfil de menos riesgo, caracterizado por una menor proporción de IAMCEST e ICP25. En un estudio de cohortes que utilizó el Mayo Clinic SCAD “Virtual”’ Multi-Center Registry (n=563), Kok et al.26 comunicaron que el 17% de las pacientes recibían hormonas exógenas. Nuestro estudio, con similar prevalencia del uso de estos tratamientos, muestra que la exposición previa al TH se asoció con tasas de reinfarto o revascularización coronaria percutánea no planificada considerablemente mayores durante el seguimiento a corto plazo. A los 12 meses de seguimiento, la diferencia ya no era estadísticamente significativa, pero continuaba siendo clínicamente relevante (el 20,5 frente al 10,8%). La limitada potencia estadística del estudio exige la confirmación de sus hallazgos en cohortes mayores y prospectivas.
El estado hormonal de las mujeres varía a lo largo de la vida. Nuestro estudio se centró en la exposición al TH y sus implicaciones a corto plazo después del diagnóstico de DCE independientemente de la edad y el estado hormonal. Es pertinente un análisis específico del efecto de estos tratamientos exógenos en la DCE según el estado hormonal basal de las pacientes. Lamentablemente se carecía de la potencia para obtener los datos, pero estamos dispuestos a buscarlos en el futuro. El estado menopáusico no se asoció con los resultados en nuestro estudio. Del mismo modo, Díez-Villanueva et al.27 mostraron que las mujeres posmenopáusicas con DCE tenían resultados hospitalarios similares a los de las premenopáusicas, aunque tenían características clínicas y angiográficas diferentes. En cuanto a cambios hormonales abruptos, Saw et al.5 encontraron que la DCE periparto se asoció significativamente con eventos adversos cardiovasculares mayores (MACE) a 30 días. Esta observación, junto con otros estudios que revelan los peores resultados de la DCE asociada con el embarazo, respaldan la relación entre los cambios hormonales y un peor pronóstico a corto plazo en pacientes con DCE. En este sentido, todas las mujeres que tomaban el TH sistémico en nuestro estudio lo suspendieron después del ingreso, lo que podría haber tenido un efecto deletéreo que se tradujo en la ocurrencia de eventos adversos a corto plazo.
Al estudiar el papel de las hormonas en la fisiopatología de la DCE, también se puede considerar un posible vínculo con la disfunción endotelial vascular. Anteriormente informamos de que las pacientes con DCE tienen una peor función endotelial que los controles emparejados28. Sin embargo, los datos sobre la función endotelial de pacientes tratadas con TH son heterogéneos a causa de la amplia variedad de modalidades de tratamiento y formas disponibles. Mientras que parece que el tratamiento de reemplazo hormonal no altera la función endotelial29, los anticonceptivos orales han mostrado resultados mixtos dependiendo de las dosis y las formas de combinación30. Por desgracia, la función endotelial vascular no se evaluó sistemáticamente en nuestro registro, por lo que no se puede explorar esta posible asociación. Está justificado un estudio específico que evalúe la interacción entre la función endotelial y el TH y las concentraciones hormonales en pacientes con DCE.
Además, los antecedentes de migraña fueron más frecuentes en las pacientes con TH de nuestra cohorte, mientras que la dislipemia fue menos frecuente en este grupo. Las pacientes en TH tendieron a ser más jóvenes (46,5 frente a 53,2 años; p=0,089) y premenopáusicas (el 87 frente al 56%; p=0,066), lo que podría explicar la mayor prevalencia de migrañas y la menor propensión a la dislipemia. Además, a veces se prescribe el TH para las crisis jaquecosas, lo que mejora el control de los lípidos en la sangre como efecto secundario31. Según Kok et al., la migraña podría ser más común entre las pacientes con DCE que en la población normal, lo que podría reflejar una propensión preexistente a la lesión vascular en estas pacientes. Sin embargo, aparte de experimentar con mayor frecuencia dolor torácico durante el primer mes, las pacientes con DCE con migraña no tuvieron un pronóstico diferente26. De manera similar, no se encontró ninguna asociación entre la migraña y los resultados clínicos adversos en nuestro estudio. Además, el análisis complementario realizado con el método IPTW se ajustó con todas estas variables basales.
Limitaciones del estudioLos hallazgos de este estudio podrían verse afectados por varias limitaciones inherentes a su naturaleza retrospectiva. A pesar de la implementación de un modelo multivariable y la IPTW, no se puede excluir la influencia de factores de confusión desconocidos. Del mismo modo, dado el diseño del estudio, que solo incluyó a pacientes que habían sufrido la enfermedad y habían sobrevivido a ella, no se puede excluir el sesgo de selección potencial (incluido el sesgo del colisionador [collider bias]). Además, la poca potencia estadística impide la exclusión de los errores de tipos 1 y 2, la realización de un análisis más detallado del tipo y la duración del TH y establecer su relación con los resultados. De hecho, el estudio de subpoblaciones de una afección médica ya poco frecuente a menudo genera tamaños de muestra y potencia estadística escasos, lo que dificulta la obtención de conclusiones sólidas sobre los hallazgos. En una proporción de pacientes (16,1%) no se recogió la información sobre el TH y, en consecuencia, se las excluyó, lo cual no mostró diferencias brutas con las incluidas (tabla 1 del material adicional). La exposición estudiada reunió distintos tipos de TH, con posibles implicaciones clínicas diferentes. No se evaluó el mantenimiento del TH después del evento y durante el seguimiento a largo plazo, por lo cual no se pudo evaluar objetivamente el impacto de estos tratamientos en los eventos recurrentes a largo plazo.
CONCLUSIONESEl presente estudio observacional muestra que las mujeres con DCE y exposición previa a TH pueden tener mayor riesgo de IM no mortal o revascularización coronaria no planificada después del cateterismo inicial y durante los primeros 28 días de seguimiento. Nuestros hallazgos, junto con los de otros estudios, ayudarán a caracterizar un perfil de alto riesgo de las pacientes con DCE que pueden merecer un ingreso más prolongado y una vigilancia más estrecha. Queda por aclarar el papel preciso del TH y los cambios hormonales endógenos en la patogénesis de la DCE.
FINANCIACIÓNR. Mori recibió una beca educativa de la Sociedad Europea de Cardiología (APP000019660). Este es un proyecto de investigación iniciado por un investigador. Solo la base de datos electrónica del registro se financia con una subvención de la Fundación Interhospitalaria de Investigación Cardiovascular.
CONTRIBUCIÓN DE LOS AUTORESR. Mori y F. Macaya contribuyeron por igual a este trabajo. R. Mori: recopilación de datos, análisis formal, redacción del borrador original. F. Macaya: formulación, recopilación de datos, metodología, supervisión, redacción del borrador original, revisión crítica. F. Giacobbe: recopilación de datos, metodología, análisis formal, revisión y edición. V. Moreno, G. Quadri, D. Chipayo, M. Bianco, P. Salinas, C. Rolfo, H. Mejía-Rentería, A. Boi, G. Tirado Conte, C. Cavallino, L. Nombela, S. Cinconze, P. Jiménez-Quevedo, M. Pavani, A. Chinaglia e I.J. Núñez Gil: recopilación, revisión y edición de datos. M.E. Fuentes-Ferrer: análisis formal, metodología, supervisión. E. Cerrato y N. Gonzalo: recopilación de datos, metodología, supervisión, revisión crítica clave. A. Fernández-Ortiz, F. Varbella y J. Escaned: recursos, supervisión, revisión y edición.
CONFLICTO DE INTERESESNo hay conflictos de intereses que declarar referentes a este artículo.
- –
La DCE tiene un predominio femenino y es una causa importante de IM en mujeres jóvenes y en el puerperio. Se sospecha que las hormonas femeninas participan en el desarrollo de la enfermedad, pero se desconoce el impacto del TH exógeno en pacientes con DCE.
- –
En este registro multicéntrico, el TH se asoció con mayores tasas de eventos adversos cardiovasculares mayores a corto plazo, como IM no mortal o revascularización percutánea no planificada. Estar en TH activo en el momento de la DCE podría conllevar un mayor riesgo de eventos recurrentes tempranos.