Los objetivos del estudio son analizar en población española la asociación entre dos variantes genéticas (rs2200733 y rs7193343) y el riesgo de sufrir fibrilación auricular y realizar una revisión sistemática y un metanálisis de estas asociaciones.
MétodosEstudio de casos y controles con 257 casos de fibrilación auricular y 379 controles. Los casos eran donantes del Banco Nacional de ADN; los controles participaron en un estudio transversal de base poblacional. La genotipificación se realizó mediante pruebas TaqMan. Se realizó una búsqueda bibliográfica sistemática, dos revisores independientes extrajeron la información necesaria. Se realizó un metanálisis, un análisis de heterogeneidad y de metarregresión para identificar las variables que explicaran la heterogeneidad entre estudios.
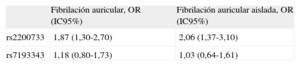
ResultadosEn nuestra población se observa una asociación entre el rs2200733 y la presencia de fibrilación auricular (odds ratio = 1,87; intervalo de confianza del 95%, 1,30-2,70), pero no con el rs7193343 (odds ratio = 1,18; intervalo de confianza del 95%, 0,80-1,73). En el metanálisis, se observó una asociación de ambas variantes con la fibrilación auricular: odds ratio = 1,71 (intervalo de confianza del 95%, 1,54-1,90) para el rs2200733 y odds ratio = 1,18 (intervalo de confianza del 95%, 1,11-1,25) para el rs7193343. En la asociación entre el rs2200733 y la fibrilación auricular se observó heterogeneidad entre estudios, parcialmente relacionada con el diseño del estudio, con mayor magnitud de asociación en estudios de casos y controles (odds ratio = 1,83) que en cohortes (odds ratio = 1,41).
ConclusionesLas variantes rs2200733 y rs7193343 se asocian con mayor riesgo de fibrilación auricular. Los estudios de casos y controles tienden a sobrestimar la magnitud de la asociación entre estas variantes genéticas y la fibrilación auricular.
Palabras clave
La fibrilación auricular (FA) es la arritmia más frecuente en la práctica clínica1,2 y se asocia con mayores riesgo de mortalidad e incidencia de enfermedad cerebrovascular3. Entre los factores que aumentan el riesgo de sufrir FA, se encuentran la edad, la hipertensión, las miocardiopatías y las valvulopatías. Existe una forma de FA denominada aislada que se presenta en pacientes < 60 años sin evidencias clínicas o ecocardiográficas de enfermedad cardiovascular y que tiene un buen pronóstico.
Hay una importante agregación familiar en la aparición de FA, lo que indica la relevancia de factores genéticos4. Se han descrito formas familiares, que son poco frecuentes, y se han identificado mutaciones en diferentes genes, relacionados generalmente con los canales iónicos4. Sin embargo, en la mayoría de las FA que encontramos en la población, la susceptibilidad individual está relacionada con múltiples genes, variantes genéticas y factores ambientales. En los últimos años los estudios de asociación de genoma completo han identificado variantes genéticas comunes que se asocian con mayor riesgo de FA5,6. Los dos loci que con más constancia se han asociado con FA se encuentran en la región 4q25, en desequilibrio de ligamiento con el gen PITX2, en la que destaca el polimorfismo de un solo nucleótido rs2200733, y en la región 16q22, asociada al gen ZFHX3, con el polimorfismo de un solo nucleótido rs7193343. Una de las limitaciones de este tipo de estudios es las variaciones que puede haber entre diversas poblaciones. Algunos metanálisis han analizado la evidencia disponible y la existencia de heterogeneidad entre estudios, pero sin analizar sus causas7,8.
Los objetivos de este estudio son: a) analizar la asociación entre las dos variantes genéticas mencionadas anteriormente, rs2200733 y rs7193343, y la probabilidad de FA en población española, y b) realizar una revisión sistemática y un metanálisis sobre la asociación entre estas dos variantes genéticas y el riesgo de FA analizando si hay heterogeneidad entre estudios y sus posibles causas.
MÉTODOSAnálisis de asociación entre las variantes rs2200733 y rs7193343 y la fibrilación auricular en población españolaDiseño del estudioSe diseñó un estudio de casos y controles. Los casos se obtuvieron de pacientes con FA que habían donado muestras biológicas al Banco Nacional de ADN y en dos hospitales participantes en el proyecto. Uno de los nodos del Banco Nacional de ADN recogió muestras de enfermedades cardiovasculares y, entre ellas, de FA. Se reclutó a los pacientes del Banco Nacional de ADN entre febrero de 2007 y diciembre de 2009, en cuatro hospitales. Además, se incluyó a pacientes con FA de dos hospitales que reclutaron los casos durante el año 2011. Los pacientes con FA tenían edades entre 18 y 70 años en el momento del diagnóstico, eran de origen caucásico y tenían FA documentada en al menos un registro electrocardiográfico. Se definió como FA aislada la que se presenta en pacientes < 60 años sin evidencias clínicas o ecocardiográficas de enfermedad cardiovascular. El reclutamiento de los casos se realizó prospectivamente incluyendo todos los casos de FA diagnosticados durante el periodo de estudio, y retrospectivamente contactando únicamente con los casos diagnosticados de FA aislada y solicitando su participación en el estudio.
Se seleccionó aleatoriamente a los controles de un estudio transversal de base poblacional realizado en España, que incluyó población de 19 a 75 años de origen caucásico entre 2000 y 20019. La presencia de FA se descartó por la ausencia de síntomas de sospecha y un electrocardiograma normal.
Todos los casos y los controles firmaron un consentimiento informado antes de su inclusión en el estudio. El estudio fue aprobado por el Comité de Ética de Investigación Clínica del Hospital Universitario Sant Joan de Reus y el Comité Científico del Banco Nacional de ADN.
GenotipificaciónEl ADN se aisló de células mononucleares de sangre periférica mediante un método estandarizado de columnas descrito previamente10. Para la genotipificación de las dos variantes genéticas, se utilizó el método de discriminación alélica mediante pruebas TaqMan (Life Technologies Ltd.; Paisley, Reino Unido) en el equipo ABI 7900HT Real Time PCR System (Life Technologies Ltd.).
Otras variablesSe recogió información sobre los antecedentes de hipertensión y consumo de tabaco. La hipertensión de definió como una determinación de presión arterial sistólica ≥ 140mmHg o diastólica ≥ 90mmHg o la toma de medicación antihipertensiva. Se consideró fumador a la persona que había fumado ≥ 1 cigarrillo/día de promedio durante la última semana y también a los ex fumadores de < 1 año. Se midió el peso y la talla y se calculó el índice de masa corporal (peso en kilogramos dividido por el cuadrado de la estatura en metros).
De un subgrupo de los pacientes con FA, se disponía de los siguientes datos ecocardiográficos: diámetro telediastólico y telesistólico del ventrículo izquierdo, grosor del septo y la pared posterior del ventrículo izquierdo y diámetro anteroposterior de la aurícula izquierda. La ecocardiografía se realizó e interpretó en los centros hospitalarios donde se reclutaron los casos de FA siguiendo protocolos internacionales estandarizados.
Análisis estadísticoSe realizó un control de calidad de los datos de genotipo analizando el equilibrio de Hardy-Weinberg. Se comprobó la normalidad de las variables continuas. Para la comparación entre grupos, se utilizó la prueba de la χ2 para variables categóricas y la de la t de Student o análisis de varianza para variables continuas. Para el análisis multivariable, se utilizó la regresión logística. Se consideró que la asociación era estadísticamente significativa cuando p < 0,05.
Revisión sistemática y metanálisisRevisión de la bibliografíaSe realizó en la base de datos PubMed una búsqueda bibliográfica de los artículos previamente publicados sobre el tema de interés hasta el 31 de marzo de 2013. La estrategia de búsqueda se basó en los siguientes términos: (rs2200733 o rs7193343 o 4q25 o 16q22 o PITX2 o ZFHX3) y («atrial fibrillation» o «supraventricular arrhythmias») («genetics» o «polymorphisms»). Se analizaron además las revisiones sobre: «Atrial fibrillation» y «genetics», y la bibliografía de los artículos finalmente seleccionados para identificar algún artículo no identificado en la búsqueda inicial.
En un primer paso, dos revisores independientes (AF y RE) analizaron el título y el resumen de los artículos identificados y seleccionaron los candidatos a revisión de todo el artículo. Los mismos revisores, de manera independiente, extrajeron la información necesaria para realizar el metanálisis y evaluar la calidad de la evidencia presentada. En caso de discordancia, se tomó una decisión consensuada entre los dos revisores.
En los artículos en que se incluía más de una población o estudio, se consideraron los resultados de los estudios individuales incluidos. En el caso de estudios que participaran en varias publicaciones, se consideró únicamente el resultado del artículo que incluyera el mayor número de sujetos.
Evaluación cualitativa de la evidencia disponibleSe siguieron las recomendaciones STREGA para evaluar la calidad y la transparencia de la información disponible de los diferentes estudios11. Esta guía define 22 ítems que se debe describir o comentar en los diferentes apartados de los manuscritos. Los dos revisores asignaron un 1 o un 0 atendiendo a la presencia o ausencia de una descripción adecuada de cada uno de esos ítems. Se discutieron las discordancias y se resolvieron por consenso. A mayor valor de este indicador, mayor la calidad de la información presentada en el artículo.
Evaluación cuantitativa de las asociaciones de interés: metanálisisDe cada estudio seleccionado, se obtuvieron los datos sobre: diseño del estudio (casos y controles; cohorte), tipo de FA (todas; aislada; recurrencia tras ablación), número de casos y controles incluidos, estimación del riesgo asociado a cada variante genética y su intervalo de confianza del 95% (IC95%), si la estimación del riesgo estaba ajustada por variables de confusión o no, la frecuencia alélica del alelo de riesgo en la población control, el origen étnico, la edad y el porcentaje de mujeres y de hipertensos.
Se realizó un metanálisis de los estudios seleccionados anteriormente y se incluyeron también los datos de nuestro estudio usando la función meta.DSL del paquete de R rmeta mediante el método de efectos aleatorios de DerSimonian y Laird12. Además, se realizó un análisis de sensibilidad repitiendo el metanálisis eliminando un estudio cada vez para detectar si alguno de los incluidos tenía un peso muy influyente en la magnitud de la asociación observada. Los análisis se estratificaron analizando la FA total y la aislada.
Análisis de la heterogeneidad y de sus causas: metarregresiónLa presencia de heterogeneidad se analizó mediante el estadígrafo I2 que describe el porcentaje de la variación entre estudios que se debe a heterogeneidad y no al azar13. Para analizar sus causas, se realizó un análisis de metarregresión bajo un modelo de efectos mixtos, y se analizó qué factores podían explicar la heterogeneidad entre estudios. Los potenciales factores analizados son: diseño del estudio (casos y controles frente a cohorte), número de casos incluidos (n ≥ 500 frente a n < 500), ajuste por variables de confusión, origen étnico y STREGA (mediana de la puntuación STREGA, < 18 frente a ≥ 18). En caso de identificar alguna variable que explicara la heterogeneidad, se repetía el metanálisis estratificando por esta variable.
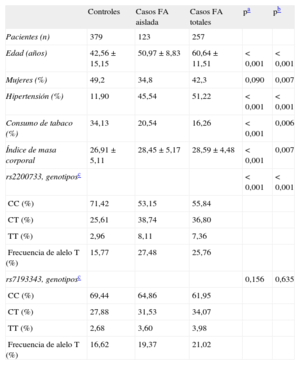
RESULTADOSAnálisis de asociación entre las variantes rs2200733 y rs7193343 y la fibrilación auricular en población españolaLas características sociodemográficas, los antecedentes de factores de riesgo y las frecuencias genotípicas y alélicas de las variantes genéticas analizadas en el grupo de pacientes con FA (total y aislada) y el grupo de controles se presentan en la tabla 1. En la tabla 2 se presentan los resultados de la asociación entre el rs2200733 y el rs7193343 y la presencia de FA (total y aislada); se observa una asociación estadísticamente significativa entre el rs2200733 y la FA, pero no entre el rs7193343 y la FA. Realizamos un análisis en una submuestra de casos (n = 150) y controles (n = 150) apareados por edad y sexo, y los resultados fueron similares a los observados en el total de la muestra.
Características sociodemográficas, antecedentes de factores de riesgo y frecuencias genotípicas y alélicas de las variantes genéticas analizadas en el grupo de pacientes con fibrilación auricular y el grupo de controles
| Controles | Casos FA aislada | Casos FA totales | pa | pb | |
| Pacientes (n) | 379 | 123 | 257 | ||
| Edad (años) | 42,56 ± 15,15 | 50,97 ± 8,83 | 60,64 ± 11,51 | < 0,001 | < 0,001 |
| Mujeres (%) | 49,2 | 34,8 | 42,3 | 0,090 | 0,007 |
| Hipertensión (%) | 11,90 | 45,54 | 51,22 | < 0,001 | < 0,001 |
| Consumo de tabaco (%) | 34,13 | 20,54 | 16,26 | < 0,001 | 0,006 |
| Índice de masa corporal | 26,91 ± 5,11 | 28,45 ± 5,17 | 28,59 ± 4,48 | < 0,001 | 0,007 |
| rs2200733, genotiposc | < 0,001 | < 0,001 | |||
| CC (%) | 71,42 | 53,15 | 55,84 | ||
| CT (%) | 25,61 | 38,74 | 36,80 | ||
| TT (%) | 2,96 | 8,11 | 7,36 | ||
| Frecuencia de alelo T (%) | 15,77 | 27,48 | 25,76 | ||
| rs7193343, genotiposc | 0,156 | 0,635 | |||
| CC (%) | 69,44 | 64,86 | 61,95 | ||
| CT (%) | 27,88 | 31,53 | 34,07 | ||
| TT (%) | 2,68 | 3,60 | 3,98 | ||
| Frecuencia de alelo T (%) | 16,62 | 19,37 | 21,02 |
C: citosina; FA: fibrilación auricular; T: timina.
Salvo otra indicación, los datos expresan media ± desviación estándar.
Probabilidad de fibrilación auricular correspondiente a las diferentes variantes genéticas analizadas definiendo un modelo aditivo
| Fibrilación auricular, OR (IC95%) | Fibrilación auricular aislada, OR (IC95%) | |
| rs2200733 | 1,87 (1,30-2,70) | 2,06 (1,37-3,10) |
| rs7193343 | 1,18 (0,80-1,73) | 1,03 (0,64-1,61) |
IC95%: intervalo de confianza del 95%; OR: odds ratio.
Incremento de la probabilidad de fibrilación auricular por la presencia de cada alelo de riesgo (T).
Resultados ajustados por edad, sexo, índice de masa corporal, antecedentes de hipertensión y consumo de tabaco.
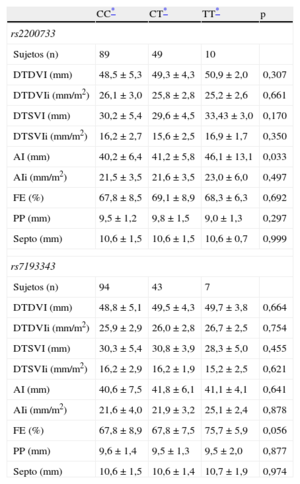
En el subgrupo de pacientes con FA y datos ecocardiográficos de la aurícula izquierda (n = 148), se observó una asociación entre el rs2200733 y el diámetro anteroposterior, de modo que el alelo de riesgo de FA también se asoció con mayor tamaño de la aurícula izquierda (tabla 3). Esta asociación dejaba de ser estadísticamente significativa cuando el diámetro auricular se indexaba por superficie corporal. No se observó asociación entre el rs7193343 y las variables ecocardiográficas recogidas.
Diferencias en las características ecocardiográficas de los casos de fibrilación auricular según su genotipo
| CC* | CT* | TT* | p | |
| rs2200733 | ||||
| Sujetos (n) | 89 | 49 | 10 | |
| DTDVI (mm) | 48,5 ± 5,3 | 49,3 ± 4,3 | 50,9 ± 2,0 | 0,307 |
| DTDVIi (mm/m2) | 26,1 ± 3,0 | 25,8 ± 2,8 | 25,2 ± 2,6 | 0,661 |
| DTSVI (mm) | 30,2 ± 5,4 | 29,6 ± 4,5 | 33,43 ± 3,0 | 0,170 |
| DTSVIi (mm/m2) | 16,2 ± 2,7 | 15,6 ± 2,5 | 16,9 ± 1,7 | 0,350 |
| AI (mm) | 40,2 ± 6,4 | 41,2 ± 5,8 | 46,1 ± 13,1 | 0,033 |
| AIi (mm/m2) | 21,5 ± 3,5 | 21,6 ± 3,5 | 23,0 ± 6,0 | 0,497 |
| FE (%) | 67,8 ± 8,5 | 69,1 ± 8,9 | 68,3 ± 6,3 | 0,692 |
| PP (mm) | 9,5 ± 1,2 | 9,8 ± 1,5 | 9,0 ± 1,3 | 0,297 |
| Septo (mm) | 10,6 ± 1,5 | 10,6 ± 1,5 | 10,6 ± 0,7 | 0,999 |
| rs7193343 | ||||
| Sujetos (n) | 94 | 43 | 7 | |
| DTDVI (mm) | 48,8 ± 5,1 | 49,5 ± 4,3 | 49,7 ± 3,8 | 0,664 |
| DTDVIi (mm/m2) | 25,9 ± 2,9 | 26,0 ± 2,8 | 26,7 ± 2,5 | 0,754 |
| DTSVI (mm) | 30,3 ± 5,4 | 30,8 ± 3,9 | 28,3 ± 5,0 | 0,455 |
| DTSVIi (mm/m2) | 16,2 ± 2,9 | 16,2 ± 1,9 | 15,2 ± 2,5 | 0,621 |
| AI (mm) | 40,6 ± 7,5 | 41,8 ± 6,1 | 41,1 ± 4,1 | 0,641 |
| AIi (mm/m2) | 21,6 ± 4,0 | 21,9 ± 3,2 | 25,1 ± 2,4 | 0,878 |
| FE (%) | 67,8 ± 8,9 | 67,8 ± 7,5 | 75,7 ± 5,9 | 0,056 |
| PP (mm) | 9,6 ± 1,4 | 9,5 ± 1,3 | 9,5 ± 2,0 | 0,877 |
| Septo (mm) | 10,6 ± 1,5 | 10,6 ± 1,4 | 10,7 ± 1,9 | 0,974 |
AI: diámetro anteroposterior de la aurícula izquierda; AIi: diámetro anteroposterior de la aurícula izquierda indexado por superficie corporal; C: citosina; DTDVI: diámetro telediastólico del ventrículo izquierdo; DTDVIi: diámetro telediastólico del ventrículo izquierdo indexado por superficie corporal; DTSVI: diámetro telesistólico del ventrículo izquierdo; DTSVIi: diámetro telesistólico del ventrículo izquierdo indexado por superficie corporal; FE: fracción de eyección; PP: grosor de la pared posterior; Septo: grosor del septo; T: timina.
Salvo otra indicación, los datos expresan media ± desviación estándar.
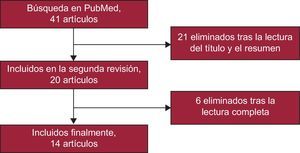
Con los criterios de búsqueda bibliográfica utilizados se identificaron inicialmente 41 artículos, de los cuales se seleccionaron finalmente 14. En la figura 1 se presenta el diagrama de flujo del resultado de la búsqueda bibliográfica y la selección de artículos realizada para este estudio. De los 14 artículos seleccionados, 10 analizaban la asociación entre el riesgo de FA y el rs220073314–23 y 4 analizaban el riesgo de FA asociado al rs71933436,24–26. Estos 14 artículos incluían un total de 27 estudios diferentes, 19 que analizan el rs2200733 y 8, el rs7193343. Por otra parte, 22 estudios utilizaron un diseño de casos y controles y 5, un diseño de cohortes.
El intervalo de valores en la evaluación cualitativa de los estudios según la adecuación a las guías STREGA fue de 15-21, y los valores obtenidos por cada estudio se presentan en las figuras 2 y 3.
Representación gráfica del resultado del metanálisis de la asociación entre el rs2200733 y la fibrilación auricular (forest plot), se incluye la magnitud de la asociación observada en los estudios individuales, su tamaño muestral, las variables de ajuste utilizadas y el resultado de la evaluación de los criterios STREGA. También se presentan los resultados del análisis de heterogeneidad (I2), el estimador de la asociación combinado en todos los estudios y estratificando según el diseño de casos y controles o de cohorte. BNADN: Banco Nacional de ADN; FA: fibrilación auricular; IC95%: intervalo de confianza del 95%; OR: odds ratio.
aEdad < 60 años.
bResultados del estudio presentado en este artículo.
c1: europea; 2: asiática.
dEstudio de cohorte.
Representación gráfica del resultado del metanálisis de la asociación entre el rs7193343 y la fibrilación auricular (forest plot), se incluye la magnitud de la asociación observada en los estudios individuales, su tamaño muestral, las variables de ajuste utilizadas y el resultado de la evaluación de los criterios STREGA. También se presentan los resultados del análisis de heterogeneidad (I2) y el estimador de la asociación combinado en todos los estudios. BNADN: Banco Nacional de ADN; FA: fibrilación auricular; IC95%: intervalo de confianza del 95%; OR: odds ratio.
aResultados del estudio presentado en este artículo.
b1: europea; 2: asiática.
cEstudio de cohorte.
En la figura 2 se presenta el resultado del metanálisis para la asociación entre el rs2200733 y la FA, y se observa una asociación estadísticamente significativa (odds ratio [OR] = 1,71; IC95%, 1,54-1,90). En el análisis de sensibilidad realizado eliminando un estudio cada vez, los resultados concordaron, con OR entre 1,62 y 1,75. Cuando analizamos la FA aislada, se incluyeron 6 estudios, y la magnitud de la asociación fue mayor (OR = 2,16; IC95%, 1,85-2,51). En el análisis de sensibilidad, al eliminar un estudio cada vez, las OR oscilaron entre 2,03 y 2,25.
Detectamos heterogeneidad en el metanálisis del polimorfismo de un solo nucleótido rs220733 (FA total, I2 = 88,52; FA aislada, I2 = 13,59). El análisis de metarregresión indicó que una de las variables que explica parcialmente esta heterogeneidad es el tipo de diseño estudio: casos y controles o cohorte. Al realizar el metanálisis estratificando por diseño del estudio, observamos que en los estudios de casos y controles continuaba habiendo heterogeneidad entre estudios (I2 = 51,69) y que la magnitud de la asociación era superior a la de los estudios de cohorte (OR = 1,83; IC95%, 1,63-2,06 frente a OR = 1,41; IC95%, 1,26-1,59), y además estos últimos no presentaban heterogeneidad entre ellos (figura 2).
El rs7193343 se asoció de manera estadísticamente significativa con la presencia de FA total (OR = 1,18; IC95%, 1,11-1,25) (figura 3). En el análisis de sensibilidad al eliminar un estudio cada vez, las OR oscilaron entre 1,17 y 1,20. No se observó heterogeneidad entre estudios (I2 = 8,98; p = 0,34). Cuando analizamos la FA aislada, se incluyeron únicamente dos estudios y la magnitud de la asociación fue similar (OR = 1,11; IC95%, 0,89-1,39).
Estimamos también el riesgo poblacional atribuible a estas dos variantes genéticas utilizando las OR del metanálisis y la prevalencia de los genotipos de nuestra población mediante la fórmula: riesgo atribuible poblacional = prevalencia de genotipo de riesgo × [(OR – 1) / OR]. El riesgo poblacional atribuible al polimorfismo rs2200733 fue del 13,77% y el del rs7193343, el 4,99%.
DISCUSIÓNEn este estudio hemos observado que existe una asociación entre el rs2200733 y el riesgo de FA en población española. Sin embargo, la asociación entre el rs7193343 y la presencia de FA no llega a la significación estadística. Al realizar una revisión sistemática y un metanálisis de la evidencia disponible, se observa que existe asociación entre las dos variantes genéticas analizadas y el riesgo de FA, pero la magnitud de la asociación es mayor en el caso del rs2200733. Además, hemos observado que existe heterogeneidad entre los estudios que analizan la asociación entre el rs2200733 y el riesgo de FA, y que esta heterogeneidad se explica parcialmente por el diseño del estudio.
Recientemente se han identificado hasta nueve variantes genéticas asociadas con el riesgo de FA8. En nuestro estudio se ha analizado únicamente dos de estas variantes (rs2200733 y rs7193343) porque son las que más se han identificado en los estudios de asociación de genoma completo como asociadas con FA y las que presentan mayor magnitud de asociación.
El rs2200733 está en la región 4q25, en la que se encuentra el gen PITX2. Este gen es un factor de transcripción que tiene un papel clave en el desarrollo fetal del corazón27, y también se expresa en el corazón adulto regulando la expresión de genes relacionados con los canales iónicos28. Se ha observado que pacientes con FA presentan menor expresión de este gen en el tejido auricular miocárdico, lo que se traduce en un remodelado auricular eléctrico y estructural que favorece la arritmogénesis29. Los resultados que hemos observado en la población española analizada concuerdan mucho con los resultados del metanálisis e indican asociación entre la presencia de la variante rara y mayor probabilidad de presentar FA.
Por otra parte, algunos estudios en modelos murinos han observado que los portadores del alelo de riesgo del polimorfismo rs2200733 presentan remodelado auricular29. En nuestro estudio, el grupo de homocigotos para el alelo de riesgo de esta variante tenían mayor tamaño auricular, aunque esta asociación desaparecía cuando se corregía por superficie corporal. Hay que destacar que los datos ecocardiográficos de las medidas de la aurícula izquierda disponibles eran de un subgrupo de pacientes y que la metodología utilizada en su medición no estaba diseñada específicamente para valorar esta asociación, al no tratarse de uno de los objetivos definidos del estudio. Se requieren estudios adecuadamente diseñados para confirmar la asociación entre el rs2200733 y el remodelado auricular.
El rs7193343 se encuentra en la región 16q22 en la que se encuentra el gen ZFHX3. El gen ZFHX3 regula la diferenciación neuronal y muscular, y es un gen supresor tumoral en varios tipos de cáncer. Aunque se expresa en el corazón de ratones30 su función en el tejido cardiaco no se conoce. Esta variante se asocia con FA en el metanálisis, pero no de manera significativa en la población española, probablemente debido al reducido tamaño de la muestra de nuestro estudio y a que la magnitud de la asociación observada es menor. Con el tamaño de muestra de nuestro estudio (257 casos y 379 controles), únicamente podríamos detectar como estadísticamente significativas asociaciones con OR ≥ 1,63. Existe otra variante en esta región, el rs2106261, que está en desequilibrio de ligamiento con el rs7193343 (R2 = 0,77 en población caucásica del estudio HapMap), que también se ha analizado en algunos estudios y en dos metanálisis7,8 y presenta una magnitud de asociación similar a la observada en nuestro estudio (OR = 1,24 y OR = 1,22 respectivamente). Por lo tanto, los datos indican que las dos variantes proporcionan una información similar.
Nuestro estudio tiene dos características diferenciales. Por una parte, se ha analizado de manera independiente el fenotipo de FA aislada, y se ha observado que, en el caso del rs2200733, la magnitud de la asociación es superior a la observada para todas las FA.
Por otra parte, se ha analizado la presencia de heterogeneidad entre estudios y sus causas. Hemos observado que el tipo de diseño del estudio explica parte de la heterogeneidad observada en la asociación entre el rs2200733 y la FA, de modo que los estudios de casos y controles presentan mayor magnitud de la asociación que los estudios de cohortes, y además entre los casos y los controles continúa habiendo heterogeneidad. La heterogeneidad entre los estudios de casos y controles probablemente está relacionada con la variada calidad de esos estudios31 y la magnitud observada en los estudios de casos y controles, probablemente mayor que la de los estudios de cohorte, también es un fenómeno conocido31.
El conocimiento de las bases genéticas de la FA puede contribuir a identificar nuevas dianas terapeúticas y el desarrollo de nuevos fármacos. Desde el punto de vista clínico, también puede contribuir a mejorar la capacidad de predicción de la aparición de FA en el futuro. Recientemente, un estudio realizado con datos del Women's Health Study ha observado que la inclusión de información genética en la función predictiva mejora la capacidad de discriminación y la reclasificación del riesgo de FA32. Otra aplicación clínica pendiente de exploración y validación es la capacidad para identificar a los pacientes que sufrirán una recurrencia de la FA después de una ablación por radiofrecuencia.
LimitacionesEntre las limitaciones de nuestro estudio, hay que señalar que el tamaño de la muestra de la población española es pequeño, aunque los resultados observados concuerdan con los del metanálisis realizado. La distribución de edades y sexos en los controles poblacionales era diferente que la de los casos; esta diferencia podría influir en los resultados. De todos modos, en los análisis ajustados y apareados por edad y sexo, se observan resultados muy similares y consistentes. La asociación entre las variantes genéticas de interés y el remodelado auricular tiene las limitaciones ya comentadas, y hay que confirmar los hallazgos en estudios específicamente diseñados para evaluar esa hipótesis.
CONCLUSIONESLas variantes genéticas rs2200733 y rs7193343 se asocian con mayor riesgo de FA. Estas variantes podrían tener utilidad clínica en la estimación del riesgo de FA. Por otra parte, los estudios de casos y controles tienden a sobrestimar la magnitud de la asociación entre estas variantes genéticas y la presencia de FA.
FINANCIACIÓNFinanciado por una beca de investigación clínica de la Sociedad Española de Cardiología, el Instituto de Salud Carlos III-Fondo Europeo del Desarrollo Regional (Red de Investigación Cardiovascular RD12/0042; PI09/90506), AGAUR (2009 SGR 1195).
CONFLICTO DE INTERESESNinguno.
Al Banco Nacional de ADN.