La diabetes mellitus tipo 2 y la enfermedad cardiovascular constituyen actualmente problemas importantes de salud pública en el mundo. La obesidad se está convirtiendo también en una epidemia mundial y con ello se produce una mayor prevalencia del síndrome metabólico. El mejor control metabólico en la diabetes tipo 2 debería reducir las complicaciones de la enfermedad. Aunque el cambio de estilo de vida es crucial para mejorar la evolución de la diabetes tipo 2 y de los pacientes con riesgo cardiometabólico, los avances farmacológicos son útiles también para mejorar el control. Se presentan aquí dos nuevos avances del tratamiento farmacológico. El primero es el desarrollo de análogos de incretina para el tratamiento de los pacientes con diabetes tipo 2. El Segundo es el desarrollo de bloqueantes del receptor de endocannabinoides para tratar el sobrepeso y el riesgo cardiometabólico. Es probable que ambos avances mejoren el control metabólico en los pacientes con una alta vulnerabilidad a la enfermedad cardiovascular.
Palabras clave
La diabetes mellitus tipo 2 y la enfermedad cardiovascular (ECV) continúan siendo problemas de salud pública mundiales importantes. Es muy preocupante observar que la incidencia de la diabetes tipo 2 está aumentando en los EE.UU.1 y también en todo el mundo2. Hay también una prevalencia creciente de la obesidad3–5. Dado que ésta es un mecanismo patogénico importante tanto para la diabetes tipo 2 como para la ECV, es probable que sea especialmente responsable de gran parte del aumento de la diabetes tipo 2 y de la estabilización de la mortalidad por ECV en la población6,7. La diabetes ocupa el sexto lugar entre las causas de mortalidad más frecuentes en EE.UU., y en 2002 produjo 224.000 muertes8. Dado que alrededor del 90%-95% de los pacientes con diabetes mellitus presentan una enfermedad de tipo 2, su tasa de mortalidad anual es superior a 200.000. Las proyecciones publicadas recientemente por la Federación Internacional de Diabetes (FID) sugieren que en la actualidad hay más de 180 millones de individuos en todo el mundo con diabetes tipo 2, y se prevé que esta cifra se incremente hasta más de 330 millones al llegar al año 2025. Además, a pesar de los muchos avances realizados en la prevención y el tratamiento de la ECV, ésta continúa siendo la primera causa de mortalidad en los EE.UU.9. El NHANES III (1999–2002) puso de relieve que más de 70 millones de norteamericanos (34,2%) presentan síndrome metabólico10 y en el 2002, un total de 927.000 norteamericanos fallecieron por causas relacionadas con la ECV.
La enfermedad coronaria y la enfermedad cerebrovascular son de 2 a 3 veces más frecuentes en los individuos diabéticos que en los no diabéticos. La principal causa de mortalidad en la diabetes tipo 2 es la ECV, que supone más de dos terceras partes del total de fallecimientos. Este alto riesgo en la diabetes se debe en parte a una mayor prevalencia de los factores de riesgo tradicionales para la ECV, como dislipidemia e hipertensión, a menudo de manera combinada con el síndrome metabólico coexistente11. Se ha involucrado a la hiperglucemia en el desarrollo de la aterosclerosis, de manera independiente de otros factores de riesgo para la ECV. Sin embargo, estos otros factores de riesgo se dan con frecuencia en relación con la obesidad visceral, que puede ser la causa subyacente, o al menos un desencadenante del síndrome metabólico. Así pues, la diabetes tipo 2, y el síndrome metabólico constituyen problemas de salud importantes en los países desarrollados y han alcanzado en la actualidad unas proporciones epidémicas en muchos países desarrollados. Juntos están dando lugar a una epidemia de ECV12.
A lo largo de la próxima década, la enfermedad macrovascular aparecerá como una importante amenaza mundial para la futura salud pública, que comportará un enorme coste económico y social. El control metabólico adecuado de la diabetes tipo 2 y la prevención de la ECV requerirán un mayor esfuerzo en diversas estrategias, como un cambio serio del estilo de vida y dejar de fumar. Además, cualquier avance de la farmacología podrá ser de utilidad.
Así pues, es importante mantenerse al día de los avances que se producen en el tratamiento de estos trastornos, con objeto de intentar reducir la morbilidad y la mortalidad causadas tanto por la diabetes como por la ECV. En esta revisión se abordarán dos avances farmacológicos reciente que pueden ser útiles para reducir el riesgo: en primer lugar, la potenciación de los efectos de la incretina en pacientes con diabetes mellitus tipo 2 y en segundo lugar la reducción del peso y del riesgo cardiometabólico en los individuos con obesidad y/o diabetes tipo 2.
POTENCIADORES DE INCRETINALa nutrición enteral proporciona un estímulo insulinotrópico significativamente más potente si se compara con una exposición intravenosa a glucosa, que cause una elevación de la glucemia similar13. A esto se la ha denominado efecto incretina. Las incretinas explican hasta un 60% de la respuesta de insulina posprandial. Los dos péptidos intestinales predominantes identificados que producen un efecto de este tipo son el péptido de tipo glucagón 1 (GLP-1) y el péptido inhibitorio dependiente de glucosa (GIP).
Péptido de tipo glucagón 1El péptido de tipo glucagón 1 (GLP-1) es uno de los varios productos peptídicos cuyo código se encuentra en el gen del pre-proglucagón. En las células pancreáticas, el principal producto producido a partir de este gen es el glucagón. En cambio, el GLP-1 es producido en las células L situadas en las regiones distales del intestino delgado y el colon. Tiene dos formas circulantes, la 7–37 amida y la 7–36 amida. El GLP-1 tiene una semivida corta, puesto que es degradado rápidamente por la enzima multifuncional dipeptidil dipeptidasa IV (DPP-IV)14 y no es eliminada por el riñón. La liberación de GLP-1 es desencadenada por la presencia de nutrientes en el estómago y el intestino proximal, y se cree que es inducida por controles neurales o humorales, y no por los propios nutrientes15.
El GLP-1 se encaja en un receptor acoplado a proteína G estructuralmente diferenciado. Este receptor es expresado ampliamente y se encuentra en las células a y b de los islotes, el tejido nervioso central y periférico, el corazón, el riñón, el pulmón y el tubo digestivo. El GLP-1 retarda el vaciado gástrico, reduce la motilidad gástrica16 y fomenta la saciedad17. Además, el GLP-1 es una incretina potente, que estimula la secreción de insulina de manera dependiente de la glucosa18. También activa la proteincinasa A, potencia la transcripción génica, aumenta la síntesis de insulina y estimula la proliferación de las células b en los animales y en cultivos celulares19. Algunos datos recientes han puesto de manifiesto que tiene una actividad en la regulación del crecimiento y la diferenciación de las células b20,21 y en una reducción de la apoptosis con prolongación de la supervivencia de las células β, tanto en los roedores como en el ser humano22,23. El GLP-1 inhibe también la liberación de glucagón21,24–26. Además, reduce el consumo de alimento de los animales y del ser humano27–30 y su administración crónica intraventricular cerebral en la rata provoca una pérdida de peso31. El deterioro de la secreción de insulina que se observa en la diabetes tipo 2 vuelve a la normalidad con la administración de GLP-1 exógeno, como pone de manifiesto la normalización de la primera fase de secreción de insulina32. Una característica importante del efecto insulinotrópico del GLP-1 es que se observa tan sólo en respuesta a la glucosa plasmática elevada. Esto difiere de la liberación de insulina inducida por las sulfonilureas, q puede ser independiente de la glucemia, lo cual plantea el riesgo de hipoglucemia33. Esta dependencia de la glucosa constituye una ventaja respecto a los secretagogos de insulina actualmente utilizados. La supresión de glucagón depende también de la glucosa y desaparece cuando las concentraciones de ésta son normales o bajas34,35.
Los pacientes con diabetes tipo 2 presentan una disminución de la liberación de insulina, que se debe principalmente a la reducción de la secreción de GIP36, con una mejor preservación de la respuesta al GLP-1. La infusión de GLP-1 intravenosa de corta duración37 y la infusión subcutánea crónica en pacientes con diabetes tipo 2 mal controlada normalizó la glucemia y produjo una reducción de peso corporal de 1,9kg38. Los efectos del GLP-1 que producen saciedad y pérdida de peso y que potencian la respuesta insulinotrópica a la glucosa han llevado al desarrollo de sustancias miméticas del GLP-1 inhibidores de DPP-IV para el tratamiento de la diabetes.
ESTRATEGIAS RELACIONADAS CON EL GLP-1La rápida degradación del GLP-1 endógeno por el DPP-IV ha dificultado la evaluación clínica de su utilidad terapéutica y la exploración de su función fisiológica más amplia. Por consiguiente, se han elaborado análogos estructurales o derivados que prolongan la semivida del péptido circulante21. Además, el descubrimiento de la familia de péptidos de la exenatida en las secreciones salivares del lagarto denominado monstruo de Gila ha llevado al desarrollo de miméticos de GLP-1 (incretina) que son activos en el receptor de GLP-1, pero que presentan diferencias significativas en la homología de secuencia con el GLP-1. Una tercera estrategia es la de los inhibidores de la enzima catabólica DPP-IV.
ExenatidaExenatida es un péptido de 39 aminoácidos que se ha aislado del veneno de la glándula salivar de un lagarto (Heloderma suspectum, monstruo de Gila)39. Presenta una homología del 53% con el GLP-1 e interacciona con receptores exocrinos y endocrinos del páncreas. En los modelos animales, exenatida fue más potente que el GLP-140 y produjo una mayor respuesta máxima en la estimulación de la liberación de insulina dependiente de la glucosa41. Al igual que el GLP-1, exenatida inhibe también la secreción de glucagón, retarda el vaciado gástrico42, reduce la glucosa plasmática43, reduce el consumo de alimento, y en modelos animales fomenta la proliferación de células P y la neogénesis a partir de células precursoras26,44. Exenatida no potencia de forma aguda la actividad de la insulina en individuos no diabéticos y no inhibe la secreción ácida gástrica45. En pacientes con diabetes tipo 2 tratados durante 28 días con una combinación de sulfonilurea y/o metformina más exenatida, se han descrito disminuciones de la HbA1C de aproximadamente un 1%46. Se llevaron a cabo ensayos controlados y aleatorizados de fase III con exenatida en monoterapia y como tratamiento añadido a sulfonilurea47, metformina48, la combinación de metformina y sulfonilurea49, o tiazolidinedionas50. Estos estudios se llevaron a cabo durante 30 semanas. La HbA1C se redujo en un 0,8% a 1,0%, con una pérdida de peso de 1,5 a 3kg. En un estudio de extensión abierto hasta las 80 semanas, los pacientes perdieron 4–5kg de peso51. Se registró una hipoglucemia de leve a moderada al añadirla a sulfonilureas46,47 pero no al añadirla a metformina48. Exenatida fue autorizada en 2005 en los EE.UU. para el uso en la diabetes tipo 2 como monoterapia o como tratamiento añadido a metformina, sulfonilureas, la combinación de ambas o tiazolidinedionas. Su autorización está todavía pendiente en Europa.
LiraglutidaLiraglutida es un análogo de GLP-1 con una única sustitución Arg34Lys y la adición de un ácido glutámico y una cadena lateral de acilo graso de 16-C para proporcionar una unión no covalente a la albúmina52. Tan sólo un 1 a 2% de la liraglutida circula en forma libre53. Los ensayos aleatorizados de 12 semanas de duración han puesto de manifiesto un aumento significativo de la semivida plasmática y la eficacia en la reducción de la HbA1C cuando se evalúa en pacientes con diabetes tipo 2. Disminuye tanto la concentración de glucosa en ayunas como la posprandial. El tratamiento se asocia a una evitación del aumento de peso o a una reducción de peso moderada54–57. Se están realizando en la actualidad ensayos de fase III con este análogo.
Agonistas del receptor de GLP-1 de acción prolongadaSe ha intentado desarrollar un preparado de acción prolongada de un agonista del receptor de GLP-1. Se ha estudiado ya en ensayos clínicos una suspensión exendina-4 con microesferas de poliactida-glucolida. Las inyecciones administradas una vez por semana durante 15 semanas en 45 pacientes con diabetes tipo 2 pusieron de manifiesto una reducción de la glucosa y la HbA1C superior a la observada con la forma de acción corta58. Se están llevando a cabo estudios a más largo plazo.
Inhibidores de DPP-IVComo se ha mencionado antes, el GLP-1 es fragmentado e inactivado rápidamente por la proteasa DPPIV59,60. Tan sólo entre un tercio y la mitad del GLP-1 postprandial en el plasma de los individuos sanos y los pacientes con diabetes tipo 2 corresponde a GLP-1 activo, y el resto es el fragmento inactivo formado por truncación61. Una estrategia alternativa para el uso de un mimético de GLP-1 consiste en inhibir la degradación de GLP-1 con el empleo de inhibidores de la enzima catabólica DPP-IV. La enzima DPP-IV es una glucoproteína homodimérica de 110kDa que está anclada en la membrana celular por un dominio transmembrana. La enzima, que está unida fundamentalmente a la superficie de las células endoteliales y epiteliales, pertenece a la familia de las serina proteasas, con especificidad como prolilendopeptidasa62. En el ser humano, las concentraciones son máximas en el intestino, la médula ósea y el riñón. La parte extracelular de la molécula puede ser fragmentada y pasar a circular en el torrente circulatorio manteniendo su actividad. Durante el tratamiento con inhibidor de DPP-IV inhibidor, aumenta la proporción relativa de la forma activa.
Los estudios realizados en ratas con déficit de DPP-IV han puesto de manifiesto una elevación de las concentraciones de GLP-1 y de GIP63 y una mejora en el grado de tolerancia a la glucosa64.
La inhibición de la DPP-IV causa una elevación de las concentraciones de GLP-1 tanto en individuos sanos como en pacientes con diabetes tipo 265–67. Estos fármacos pueden administrarse por vía oral. Se han realizado estudios de fase III con diferentes inhibidores de DPP-IV, sitagliptina y vildagliptina. Con estos productos se han obtenido resultados clínicos bastante similares en cuanto a la mejora del control de la glucosa. Los ensayos de fase III realizados para valorar la eficacia y la seguridad de sitagliptina han incluido estudios controlados con placebo y doble ciego con el empleo del fármaco en monoterapia68, añadido a metformina69,70 o a sulfonilureas, añadido al tratamiento combinado de metformina y sulfonilureas, y añadido a tiazolidinedionas. Estos estudios utilizaron un tratamiento farmacológico de 24 semanas de duración. La HbA1c se redujo en alrededor de un 0,7%, partiendo de un valor basal del 8,3%. En los pacientes en los que la HbA1c basal era superior al 9%, se observó una reducción del 1,5%.
Los estudios clínicos de vildagliptina han puesto de manifiesto la eficacia de estas moléculas para reducir la HbA1c en alrededor de un 1% en pacientes con diabetes tipo 267. Con vildagliptina se han realizado ensayos similares de 24 semanas utilizando monoterapia71,72, la adición a metformina o sulfonilureas, la adición a la combinación de ambas, y la adición a tiazolidinedionas. Estos últimos estudios se han presentado en congresos sobre diabetes. Los resultados son muy comparables a los presentados antes para sitagliptina. Sitagliptina fue autorizada por la Food and Drug Administration (FDA) en octubre de 2006 para el uso en EE.UU., mientras que vidagliptina está siendo evaluada en la actualidad.
Dado que se han realizado estudios en roedores que han mostrado que las concentraciones elevadas de GLP-1 pueden aumentar la masa de células P, será interesante determinar si a largo plazo esto ocurre también con exenatida y con los inhibidores de DPP-IV en pacientes con diabetes tipo 2.
En la actualidad hay una controversia respecto a si las acciones terapéuticas de la inhibición de la DPP-IV se producen a través del GLP-1. Se han sugerido otras varias interpretaciones de sus efectos73–75. Por ejemplo, la secreción de GLP-1 está deteriorada en los pacientes con diabetes tipo 2, lo cual limita el posible aumento del GLP-1 inalterado que se produce como consecuencia de la inhibición de la DPP-IV36. Además, en el perro, los inhibidores de DPP-IV inhiben la secreción de GLP-1 por parte de las células L, debido tal vez a una inhibición de retroacción negativa76. Por otra parte, en ratas Zucker, la administración de un inhibidor de DPP-IV no modificó la rapidez del vaciado gástrico, que es un dato característico de la acción del GLP-1. Así pues, la administración de un inhibidor de DPP-IV puede amortiguar la secreción de GLP-1.
Los posibles riesgos del uso clínico de inhibidores de DPP-IV han sido abordados por Mest y Mentlein77. La utilidad clínica y la seguridad de estos productos como posibles elementos terapéuticos para la diabetes y la reducción de peso están a la espera de una evaluación más detallada en el ser humano. Hay otros varios péptidos que son sustratos de la DPP-IV como los siguientes: péptido insulinotrópico dependiente de glucosa (GIP), polipéptido intestinal vasoactivo, somatostatina, polipéptido activador de adenilato ciclasa hipofisaria y NPY. La DPP-IV, también denominada CD26, puede inactivar asimismo otras proteínas importantes como hormonas gastrointestinales, citocinas, quimiocinas y neuropéptidos, adenosina desaminasa, proteína gp120 de VIH, fibronectina, colágeno, receptor de quimiocina CXCR4, y tirosina fosfatasa CD45. Estas interacciones sugieren funciones importantes todavía desconocidas en la regulación inmunitaria, la adhesión celular y la señalización78,79. Demuth et al80 han resumido parte de la posible complejidad debida a la inhibición de la DPP-IV.
En la actualidad se están desarrollando otros nuevos inhibidores de DPP-IV como los siguientes: análogos de inhibidores reversibles, inhibidores covalentes e inhibidores heterocíclicos no peptídicos reversibles80.
bloqueantes de receptores de endocannabinoidesLos endocannabinoides (ECB), y en particular anandamida y 2-araquidonoil-glicerol, son lípidos endógenos capaces de unirse, y posteriormente activar, los receptores de cannabinoides (CB) CB1 y CB2. Estos receptores, que pertenecen a la familia acoplada a proteínas G81 se descubrieron a comienzos de los años noventa, cuando se estaba investigando el modo de acción ventricular del principal componente psicoactivo del cannabis, el delta-9-tetrahidrocannabinol, al que se unen con gran afinidad.
El CB1 es el receptor de CB más abundante en el tejido de los mamíferos, y alcanza su máxima concentración en algunas áreas cerebrales, aunque también está presente en muchos órganos periféricos, como el tejido adiposo82, el hígado83, las células p84 y el sistema cardiovascular85,86. La estimulación del receptor CB1 por sus agonistas, incluidos los ECB, conduce a una inhibición de la liberación del neurotransmisor en las neuronas centrales y periféricas (del sistema autónomo y sensitivas). En las células que no son neuronas, hay varias funciones que se han asociado a la estimulación del CB1, como la regulación de la proliferación, la diferenciación, la motilidad y la apoptosis, posiblemente a través de una modulación de la expresión de diversos factores de crecimiento. Los ECB son biosintetizados tras el remodelado dependiente de Ca2+ de los fosfolípidos de membrana, que va seguido de la hidrólisis enzimática de precursores lipídicos específicos87,88. Esto significa que los ECB no se almacenan en las neuronas antes de su liberación, sino que son liberados "según la demanda" de manera inmediata tras su biosíntesis de novo. Las concentraciones basales de ECB apenas son detectables puesto que estas sustancias sólo son producidas "cuando y donde son necesarias" y luego son inactivadas rápidamente por las enzimas hidrolíticas.
Por lo que respecta a su posible función biológica, el cuadro general que está surgiendo a partir de los estudios llevados a cabo en los últimos 10 años es el de que los ECB son producidos, y los receptores CB1 estimulados, en respuesta a estímulos estresantes, con objeto de facilitar el establecimiento de una homeostasis de equilibrio estable de otros neurotransmisores, mediadores, hormonas y citocinas. En consecuencia, la estimulación del receptor CB1 es de corta duración, se limita a las células o tejidos que han sufrido un estrés o una lesión, y normalmente termina cuando el organismo se ha recuperado de una situación de "desequilibrio" transitoria. Sin embargo, algunos estados patológicos crónicos conducen a una sobreestimulación de larga duración de la síntesis de ECB (o a una hipoestimulación de su degradación), lo cual da lugar a una sobreactivación permanente de los receptores CB1 que puede contribuir a producir los síntomas de dichos trastornos.
El sistema de ECB está presente en el cerebro y en localizaciones periféricas que intervienen en el control del equilibrio energético y el peso corporal, así como en las neuronas del sistema mesolímbico que participan en el refuerzo por gratificación y en el traslado de la motivación a la acción. En el sistema nervioso central, los receptores CB 1 son necesarios para inducir el consumo de alimento tras un período corto de deprivación alimentaria y, cuando son activados, estimulan también preferentemente la ingestión de alimentos de sabor agradable89–91. Su estimulación da lugar a una modulación de la liberación y/o expresión de algunos mediadores hipotalámicos anorexígenos y orexígenos, así como de dopamina en la cubierta del núcleo accumbens. Es importante señalar que, a nivel periférico, se ha demostrado que la activación de CB1 estimula la lipogénesis en los adipocitos y que los bloqueantes del receptor CB1 son moduladores positivos integrales en la secreción de adiponectina.
En cuatro estudios de fase 3 llevados a cabo en un total de más de 6.000 individuos con obesidad/sobrepeso se ha investigado la efectividad del fármaco en lo relativo al peso corporal y los factores de riesgo metabólicos. En dos de los estudios se investigó el efecto de rimonabant en pacientes obesos no diabéticos con o sin comorbilidades, en uno se estudió a pacientes obesos con diabetes tipo 2 tratados con monoterapia (biguanidas o sulfonilureas), mientras que en otro se estudió a pacientes obesos con dislipidemia. A los pacientes de los cuatro estudios se les asignó aleatoriamente un tratamiento doble ciego con placebo, rimonabant 5mg o rimonabant 20mg una vez al día. Rimonabant 20mg (R20) indujo una reducción significativa del peso corporal y el perímetro de cintura en comparación con placebo. Las alteraciones de los triglicéridos, el colesterol de lipoproteínas de alta densidad (C-HDL), la glucosa en ayunas y la insulina mejoraron. Durante el segundo año, se mantuvieron los cambios del peso y el perímetro de cintura, mientras que la elevación del C-HDL y la disminución de los triglicéridos aumentaron. Se presenta a continuación una breve descripción de cada ensayo.
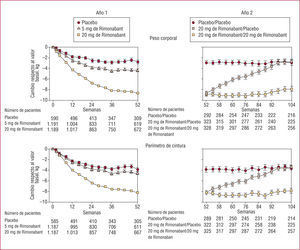
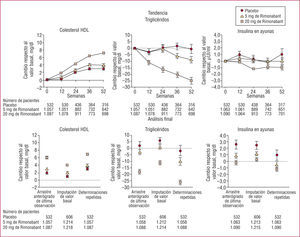
Rio North America (RioNA)Este estudio de 2 años se llevó a cabo en pacientes obesos con o sin comorbilidades92, pero excluyendo a los pacientes con diabetes tipo 2. Al final del año 1, el grupo de R20 presentaba una pérdida de 6,3kg de peso, mientras que en el grupo placebo, la pérdida era de 1,6kg. El perímetro de cintura disminuyó en 6,1cm en el grupo de R20 y en 2,5cm en el de placebo. El porcentaje de pacientes en los que se produjo una reducción de peso de al menos un 5% respecto a la situación basal ascendió al 48,6% en el grupo de R20 en comparación con el 20,0% en el grupo de placebo, mientras que el porcentaje de los que perdieron al menos un 10% fue del 25,2% con R20 y del 8,5% con placebo. El C-HDL aumentó en un 7,2% y los triglicéridos disminuyeron en un 13,2% con R20. La insulina en ayunas disminuyó también de manera significativa.
Durante el segundo año, el cambio del peso y del perímetro de cintura se mantuvo en el grupo que continuó tomando R20, mientras que los cambios del C-HDL y del perímetro de cintura se intensificaron. El grupo tratado previamente con el fármaco y que pasó luego a placebo al final del segundo año había vuelto a los valores basales para todos los parámetros evaluados. Los cambios del peso y el perímetro de cintura se indican en la figura 1 y los cambios de los lípidos y la insulina en la figura 2.
Cambio respecto al valor basal del peso corporal y el perímetro de cintura a lo largo de los años 1 y 2 del ensayo RIO-North America. Tomada de Pi-Sunyer, et al92.
Cambio respecto al valor basal a lo largo de 1 año en las concentraciones de colesterol de lipoproteínas de alta densidad (HDL), triglicéridos e insulina en ayunas. Tomada de Pi-Sunyer, et al92.
El Rio Europe se llevó a cabo en personas obesas con o sin comorbilidades, pero excluyendo a las que presentaban diabetes tipo 293. El estudio se realizó durante 2 años. Los resultados fueron muy similares a los del ensayo RioNA. Hubo una reducción de peso de 6,6kg en el grupo de R20, en comparación con 1,8kg en el grupo de placebo, y el perímetro de cintura disminuyó en 6,5cm con R20, en comparación con 2,4cm con placebo. A 1 año, el 50,9% de los participantes habían perdido al menos un 5% del peso basal y el 27,4% habían perdido al menos un 10%, en comparación con el 19,2% y el 7,3% en el grupo placebo. Hubo un aumento del 8,9% en el C-HDL y una disminución del 15,1% en los triglicéridos. Se produjo también una disminución de la glucosa y la insulina en ayunas. Al igual que en el ensayo RioNA, en el segundo año, los participantes que continuaron con el tratamiento de R20 mantuvieron la reducción de peso y del perímetro de cintura y presentaron mejoras adicionales en los valores de C-HDL y triglicéridos, mientras que los que pasaron a placebo mostraron una reversión a los valores basales de peso, perímetro de cintura, C-HDL y triglicéridos.
Rio LipidsEste estudio de 1 año se llevó a cabo en individuos obesos con dislipidemia94. La reducción de peso en el grupo de R20 fue de 5,4kg y la reducción del perímetro de cintura fue de 5,8cm. Se produjo un aumento del C-HDL del 8,1% y una disminución de los triglicéridos del 12,4%. La proporción de partículas de LDL pequeñas y densas disminuyó de manera significativa, mientras que las partículas menos aterógenas aumentaron de número. La tolerancia a la glucosa oral mejoró también significativamente (tanto la glucosa como la insulina). La adiponectina aumentó en un 57% y la PCR disminuyó de manera significativa.
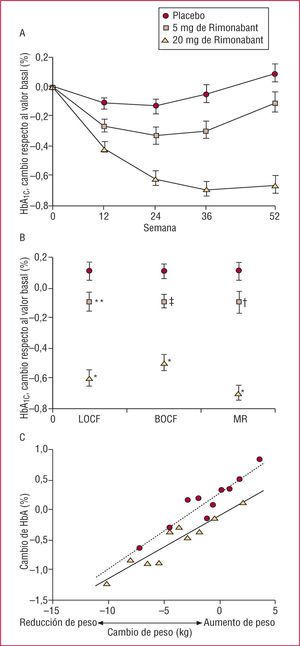
Rio DiabetesEl Rio Diabetes fue un estudio de 1 año en pacientes obesos con diabetes tipo 295. El peso se redujo en 5,3kg en el grupo de R20 en comparación con 1,4kg en el grupo de placebo, mientras que el perímetro de cintura disminuyó en 5,2cm con R20 frente a 1,9cm con placebo. La HbA1C aumentó, pasando del 7,2% al 7,3% con placebo, mientras que disminuyó, pasando del 7,3% al 6,7% con R20. Nuevamente, se apreció una elevación el C-HDL, una disminución de los triglicéridos y un descenso de 2,3mm Hg en la presión arterial sistólica. El cambio de la HbA1C se presenta en la figura 3.
Cambios de la concentración de HbA1C a lo largo de 1 año en el ensayo RIO-Diabetes. Tomada de Scheen, et al95.
(A) Cambio medio (EEM) respecto al valor basal de las concentraciones de HbA1C a lo largo de 1 año. (B) Cambio medio (EEM) respecto al valor basal de las concentraciones de HbA1C: arrastre anterógrado de la última observación (LOCF), arrastre anterógrado de la observación basal (BOCF) y medidas repetidas (MR). *p<0,0001, †p=0,03, ‡p=0,04, §p=0,05 frente a placebo. (C) Análisis de regresión lineal entre los cambios de la HbA1C y los del peso corporal, excluyendo a los pacientes con una pérdida de peso extrema (> 11,2kg), en los pacientes tratados con placebo o con 20mg de rimonabant. Los datos de cambio de peso entre el valor más bajo y el más alto se dividieron en diez grupos de un tamaño muestral aproximadamente igual (deciles) y dentro de cada decil se calculó el cambio medio de peso y el cambio medio de HbA1C. Los pares de valores de cambio medio (peso, HbA1C) se representaron gráficamente y la recta de regresión indica la relación entre pérdida de peso y HbA1C.
Así pues, se ha demostrado que rimonabant es un instrumento efectivo para reducir el peso en individuos obesos sin complicaciones, individuos obesos con lípidos elevados o pacientes obesos con diabetes tipo 2. En todos los estudios, el número de individuos que presentaban un síndrome metabólico se redujo con el tratamiento de rimonabant. Por lo que respecta a los acontecimientos adversos y la seguridad, rimonabant a dosis de 20mg al día presentó acontecimientos adversos en un 5,9% de los casos, en comparación con el 4,2% observado con placebo96. Los abandonos fueron de un 13,8 frente a un 7,2% durante el primer año. Los abandonos del segundo año fueron de un 4,7% en ambos grupos. A todos los pacientes se les administró el cuestionario Hospital Anxiety Depression Questionnaire (HAD)97 (Zigmond AS) y no hubo diferencias entre los grupos, ni al inicio de los ensayos, ni durante o al final de éstos. El cuestionario Impact of Weight on Quality of Life-Lite, administrado también siguiendo un diseño doble ciego, mostró una mejoría estadísticamente significativa en el grupo de R2098.
La cuantificación de la prevalencia de los criterios del NCEP ATPIII respecto a la presencia del síndrome metabólico puso de manifiesto en cada uno de los estudios que esta prevalencia se reducía significativamente en los pacientes tratados con rimonabant 20mg en comparación con placebo. Rimonabant 5mg produjo unos resultados intermedios entre los de placebo y los de rimonabant 20mg.
Las náuseas han sido el acontecimiento adverso más frecuente en estos ensayos. Pero esto no motivó abandonos del tratamiento. Los acontecimientos adversos que llevaron a un abandono fueron de tipo psiquiátrico, neurológico o digestivo. En el ámbito psiquiátrico, las alteraciones del estado de ánimo y la ansiedad fueron algo mayores en el grupo R20 que en el grupo de placebo. En el sistema nervioso hubo una mayor incidencia de cefaleas. En el segundo año, ni en el ensayo RioNA ni en el Rio Europe se observaron diferencias en la frecuencia de abandonos entre los grupos de R20 y placebo. Rimonabant ha sido autorizado para el uso en Europa y en algunos lugares de Latinoamérica. La indicación de la Agencia Europea del Medicamento especifica: "para el tratamiento de pacientes obesos (IMC>30kg/m2) o con sobrepeso (IMC>27kg/m2) y factores de riesgo asociados, como la diabetes tipo 2 o la dislipidemia, conjuntamente con dieta y ejercicio"99. Se indica la precaución de no utilizarlo en pacientes con una enfermedad psiquiátrica grave ni en pacientes que estén tomando antidepresivos.
Globalmente, los resultados de estos ensayos sugieren que, al fomentar la reducción de peso y mejorar el perfil lipídico y glucémico, rimonabant puede ser un instrumento importante en el control de los factores de riesgo cardiovascular en pacientes con sobrepeso/obesidad96,100.
CONCLUSIÓNEs posible que los avances farmacológicos que pueden mejorar el control de la glucosa en la diabetes tipo 2 y reducir el riesgo cardiometabólico en pacientes con obesidad, diabetes tipo 2 y el síndrome metabólico faciliten una mejora del control de la diabetes y reduzcan el riesgo cardiometabólico en los pacientes vulnerables. El uso de los nuevos productos solos o en combinación con otros ya más establecidos puede mejorar los resultados de morbilidad en estos trastornos.