Un número creciente de investigaciones sobre las ómicas en nutrición ha dado lugar a recientes avances en la epidemiología y la prevención de las enfermedades cardiovasculares. En el ensayo PREDIMED se identificaron asociaciones significativas entre los metabolitos relacionados con la dieta y las enfermedades cardiovasculares que después se han reproducido en cohortes independientes. Entre los metabolitos identificados destacan las concentraciones plasmáticas de ceramidas, acilcarnitinas, aminoácidos de cadena ramificada, triptófano, vías del ciclo de la urea y el lipidoma. Estos metabolitos y sus vías asociadas se han relacionado con la incidencia tanto de enfermedades cardiovasculares como de diabetes mellitus tipo 2. Algunas líneas futuras de investigación en nutrición de precisión deberían incluir: a) el desarrollo de índices multimetabolómicos más sólidos para predecir el riesgo a largo plazo de enfermedades cardiovasculares y mortalidad; b) la incorporación de poblaciones más diversas y una gama más amplia de patrones dietéticos, y c) la realización de más estudios traslacionales para salvar la brecha entre los estudios de nutrición de precisión y sus aplicaciones clínicas.
Palabras clave
La metabolómica es el estudio sistemático de las transformaciones químicas en las que intervienen metabolitos de pequeño tamaño molecular en una célula o un organismo1. El análisis de los perfiles metabolómicos de cada persona permite evaluar las huellas metabolómicas relacionadas con las diferentes exposiciones alimentarias. La metabolómica proporciona información útil sobre las vías metabólicas que relacionan la exposición a alimentos con el riesgo de enfermedades crónicas, como la diabetes mellitus tipo 2 (DM2) y las enfermedades cardiovasculares (ECV). También contribuye a que se puedan elaborar nuevas hipótesis para la prevención y el tratamiento de enfermedades aplicando el paradigma de la medicina y la nutrición personalizadas2. Este enfoque experimentó un avance importante gracias a un artículo de 2015 en el que se presentó un algoritmo para determinar la ingestión posprandial óptima de glucosa en función de las características de cada persona3. La investigación posterior ha explorado las diferencias interindividuales en las respuestas metabólicas4. Estudios recientes han respaldado el potencial de la nutrición de precisión para fomentar una salud cardiovascular óptima5.
En esta revisión narrativa se analizan los avances recientes en las técnicas y métodos de la nutrición de precisión, sus consecuencias en cuanto a la epidemiología y la prevención de las enfermedades cardiometabólicas y las perspectivas futuras de la investigación en este campo.
ASPECTOS METODOLÓGICOSMetabolómica, metabotipaje y métodos de aprendizaje automáticoLa modelización computacional avanzada, y en especial los modelos de aprendizaje automático penalizados, que integran datos multidimensionales —incluidos los de alimentación, estilo de vida y ómicas— permite obtener una evidencia sólida que respalda asociaciones válidas entre la alimentación y el riesgo de ECV. Las firmas multimetabolómicas, que captan los patrones generales de alimentación, pueden predecir el riesgo a largo plazo de eventos mayores de ECV, más allá de lo que aportan los factores de riesgo tradicionales. Estas firmas metabolómicas reflejan tanto el consumo alimentario como las respuestas homeostáticas del organismo a la exposición a los alimentos. Dado que los datos metabolómicos en líquidos corporales se miden de forma objetiva, permiten superar algunas de las limitaciones del consumo alimenticio declarado por la propia persona.
Los análisis metabolómicos son cruciales para identificar nuevas vías metabólicas que subyacen en las relaciones entre la alimentación y la aparición de eventos de ECV. En un estudio clave del ensayo PREDIMED se elaboró una firma multimetabolómica formada por 67 metabolitos plasmáticos, que se replicó en 3 grandes cohortes de Estados Unidos (Nurses’ Health Studies I y II y Health Professionals Follow-up Study [NHS/NHS2/HPFS]). Se observó una adecuada correlación entre esta firma y la adherencia a una dieta mediterránea (MedDiet) y su asociación prospectiva con la ECV, tanto en las cohortes de Estados Unidos como en la de España, incluso después de ajustar por adherencia a la MedDiet declarada por los participantes6, lo cual pone de manifiesto el enorme potencial de predicción del riesgo de ECV a largo plazo.
Métodos metabolómicosLos metabolitos pueden estudiarse mediante diversas técnicas analíticas. La metabolómica dirigida consiste en medir un grupo seleccionado de metabolitos predefinidos (p. ej., aminoácidos, lípidos, azúcares y otras moléculas pequeñas). En cambio, los enfoques metabolómicos no dirigidos implican la elaboración de perfiles globales del metaboloma con un planteamiento de generación de hipótesis, incluido el descubrimiento de nuevos biomarcadores. Uno de los métodos más ampliamente utilizados es la cromatografía líquida-espectrometría de masas (LC-MS), que puede aplicarse a enfoques tanto dirigidos como no dirigidos. Mediante la espectrometría de masas en tándem (MS/MS), se generan espectros de fragmentación que proporcionan información estructural sobre moléculas desconocidas. Estos datos facilitan las predicciones de posibles estructuras moleculares mediante aprendizaje automático. A continuación, las estructuras predichas se ordenan en una lista en función de las coincidencias probables y se confirman utilizando patrones de referencia7,8.
La identificación de perfiles metabolómicos permite asociar estos perfiles a la aparición de nuevos casos de ECV o DM2. Esto se ha evaluado en diversos estudios anidados dentro del ensayo PREDIMED, utilizando miles de muestras biológicas procedentes de múltiples cohortes para su reproducción6,9-13. Uno de los mayores retos de la metabolómica es identificar metabolitos desconocidos relacionados con la alimentación o la enfermedad, ya que aún existen muchas lagunas en el conocimiento de cómo se degradan metabolitos importantes.
Para subsanar estas lagunas, los investigadores utilizan la química computacional a fin de aprovechar la promiscuidad enzimática —la capacidad de las enzimas de catalizar reacciones secundarias inesperadas, más allá de su función principal— y proponen así nuevas reacciones aún no registradas en las bases de datos14,15.
En la cohorte del Jackson Heart Study, los análisis metabolómicos mediante LC-MS identificaron 124 metabolitos conocidos y desconocidos asociados con la aparición de DM2, incluida una posible relación entre los valores bajos de serina y las elevaciones de alanina y desoxiceramidas. Además, la investigación reveló la existencia de asociaciones entre metabolitos derivados de la alimentación y variantes genéticas asociadas con enfermedades, con lo que se arrojó luz sobre genes relacionados con enfermedades como la insuficiencia cardiaca (IC) en personas de edad avanzada12,16,17.
MetabotipajeEl metabotipaje consiste en determinar el fenotipo de los procesos metabólicos de personas, grupos o poblaciones para conocer mejor sus perfiles metabolómicos y cómo estos perfiles se relacionan con el riesgo de enfermedad o la respuesta o ausencia de respuesta a las intervenciones18. Los metabotipos se han identificado principalmente utilizando datos bioquímicos y clínicos, pero aún faltan herramientas para integrar los datos ómicos. Las tecnologías ómicas permiten identificar y caracterizar metabotipos de interés mediante métodos estáticos y dinámicos. En los estudios dinámicos, se han utilizado métodos de descomposición tensorial como CANDECOMP/PARAFAC para analizar aportes alimentarios, como los de una dieta a base de carne de vacuno, y ello ha permitido predecir los metabotipos19. Este método permite un enfoque de ingeniería inversa para determinar qué tipos de alimentación pueden lograr una adherencia específica a determinados metabotipos. La individualización de la composición de macronutrientes de la dieta para adaptarla a los fenotipos de resistencia a la insulina puede mejorar significativamente los marcadores de riesgo, lo que pone de relieve que la nutrición de precisión es una alternativa factible a las guías dietéticas generales20,21.
Las interacciones entre la alimentación, el microbioma y las características genéticas del huésped son cruciales22. Por ejemplo, tras una intervención de 2 meses con MedDiet se observó un aumento significativo de la concentración plasmática posprandial de butirato, que mostró una correlación con la sensibilidad a la insulina23. Será necesaria más investigación en personas con diferentes fenotipos de metabolitos y enterotipos. Las pruebas ómicas de la saliva, aunque infrautilizadas, han producido resultados prometedores para relacionar la alimentación y el estilo de vida con la enfermedad. La composición de la saliva se ve muy influida por la edad y la diversidad del microbioma oral, pero no por el índice de masa corporal24.
Redes metabólicas y microbiotaLas redes metabólicas son modelos computacionales que representan procesos metabólicos y abarcan miles de reacciones internas con anotaciones funcionales y taxonómicas. Es probable que la microbiota intestinal desempeñe un papel fundamental en la fisiopatología de la ECV25. Las redes metabólicas son de especial interés para determinar la composición y la función de la microbiota intestinal, que puede intervenir en los efectos de la alimentación en las ECV. El primer análisis exhaustivo de la microbiota intestinal y sus características funcionales se llevó a cabo en el estudio AGORA, en el que se investigaron inicialmente 773 cepas26. Después el análisis se amplió a 7.302 cepas (AGORA2)27. El proyecto AGREDA, llevado a cabo en la Tecnun (Universidad de Navarra), amplió el estudio AGORA centrándose en las vías de degradación relacionadas con la alimentación, concretamente en la degradación de polifenoles, y demostró un rendimiento superior en la predicción de los metabolitos de salida específicos del tipo de alimentación basándose en la microbiota intestinal en comparación con las reconstrucciones actuales28.
El análisis funcional estándar consiste en integrar las redes metabólicas de la microbiota intestinal y los datos de composición bacteriana para obtener una puntuación de la actividad de las reacciones y los subsistemas metabólicos. Una herramienta bioinformática que permite realizar esta tarea es q2-metnet29, que es capaz de predecir la capacidad de una persona de metabolizar diferentes compuestos.
Una estrategia más avanzada son los análisis en estado estacionario30. En este enfoque, cada taxón se trata como un compartimento bien diferenciado dentro del sistema, junto con un compartimento extracelular donde se examinan todas las entradas y salidas. A continuación, se contextualiza a cada persona en función de su abundancia intestinal, determinada mediante secuenciación 16S, y de la disponibilidad de compuestos alimentarios. El resultado principal es la predicción de la producción de metabolitos microbianos a partir de modelos de optimización basados en restricciones, aunque se parte del supuesto de una cantidad constante de bacterias en el intestino.
Los modelos metabólicos dinámicos abordan las limitaciones del supuesto de estado estacionario. Para ello tienen en cuenta la variación de la composición bacteriana e incluyen efectos reguladores como las interacciones entre nutrientes y microbios y de los microbios entre sí. Estos modelos integran la modelización basada en agentes, la modelización basada en restricciones y el aprendizaje automático con sistemas bayesianos. Este planteamiento es capaz de predecir la manera en que los distintos metabolitos pueden modificar la abundancia relativa de varios taxones, aunque serán necesarios nuevos desarrollos30.
Biomarcadores derivados de los alimentosEl Dietary Biomarker Development Consortium (DBDC) es una importante iniciativa para el descubrimiento y la validación de biomarcadores derivados de los alimentos mediante metabolómica31. El consorcio está formado por 3 centros clínicos (University of California, Davis; Harvard T.H. Chan School of Public Health y el Fred Hutchinson Cancer Research Center, todos ellos en Estados Unidos) y un Centro de Coordinación de Datos (Duke University, Estados Unidos). El DBDC lleva a cabo actualmente estudios sistemáticos de alimentación controlada para identificar patrones de metabolitos en sangre y orina asociados con alimentos de consumo habitual en la población estadounidense. Estos metabolitos se validarán en poblaciones que viven en entornos no controlados. El objetivo global es crear un catálogo exhaustivo de metabolitos plasmáticos y urinarios sensibles, específicos y robustos para los alimentos de consumo habitual en el MyPlate del Departamento de Agricultura de Estados Unidos. Estos biomarcadores podrán utilizarse en futuros estudios observacionales y ensayos clínicos para evaluar el consumo de alimentos, realizar un seguimiento de la adherencia a la dieta y evaluar los objetivos de las intervenciones dirigidas a mejorar la calidad de la alimentación.
Múltiples determinantes de las firmas metabolómicas de los patrones de alimentaciónLas firmas multimetabolómicas de los patrones de alimentación reflejan los efectos combinados del consumo de alimentos, las respuestas biológicas y otros factores que tienen efectos metabólicos. Es probable que los estudios que integran todos estos aspectos muestren una capacidad predictiva superior a la de cualquier evaluación parcial32. En este contexto, se han analizado las firmas metabolómicas sanguíneas para determinar su adherencia a 8 patrones de alimentación que incluyen dietas recomendadas por las guías (MedDiet, Alternative Healthy Eating Index, Dietary Approaches to Stop Hypertension), dietas provegetarianas o basadas en productos vegetales y dietas basadas en mecanismos como el patrón alimentario empírico para la inflamación y el índice alimentario empírico para la hiperinsulinemia33. Se ha demostrado que estas firmas se correlacionan de manera reproducible con los patrones alimentarios correspondientes en diversas poblaciones de distintas edades, sexos, etnias y hábitos alimentarios, utilizando diferentes plataformas técnicas. Sus asociaciones con la aparición de casos nuevos de DM2 se han reproducido en múltiples cohortes.
METABOLÓMICA Y DIETA MEDITERRÁNEAMetabolitos plasmáticos y enfermedades cardiovasculares en el ensayo PREDIMEDEl PREDIMED es un ensayo aleatorizado multicéntrico español (2003-2010) en el que se evaluaron los efectos de la MedDiet para la prevención primaria de las ECV. Anteriormente se ha publicado una información detallada sobre el estudio34. De forma resumida, se asignó a 7.447 participantes de entre 55 y 80 años con alto riesgo de ECV pero sin una enfermedad manifiesta a 1 de 3 intervenciones alimentarias: a) MedDiet complementada con aceite de oliva virgen extra; b) MedDiet complementada con una mezcla de frutos secos, o c) un grupo de control que recibió una dieta baja en grasas. El objetivo primario fue la ECV grave (infarto de miocardio no mortal, ictus no mortal o muerte cardiovascular). Se recogieron muestras de sangre antes de la intervención y al cabo de 1 año tras una noche en ayunas. Las alícuotas de plasma con EDTA se conservaron a −80°C.
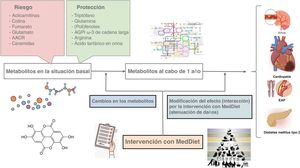
En el primer estudio de casos y cohortes (2013-2017) anidado dentro del ensayo PREDIMED, se determinaron los metabolitos plasmáticos de 232 pacientes tanto al inicio como tras 1 año de seguimiento con el objetivo primario de ECV y en una subcohorte aleatoria de 783 participantes (figura 1). La continuación de este proyecto (2017-2021) incluyó una serie de 3 estudios de casos y controles en los que se evaluaron diferentes objetivos de ECV: fibrilación auricular (473 casos), IC (214 casos) y arteriopatía periférica (169 casos). La continuación actualmente en curso (2022-2026) consiste en un estudio de casos y cohortes con un seguimiento ampliado (11 años), en el que se incluyen 606 casos de ECV (infarto de miocardio, ictus, IC o muerte debida a ECV) y una subcohorte aleatoria de 679 participantes, con especial atención a los metabolitos urinarios, en particular los compuestos fenólicos35-38. Este estudio contribuirá al desarrollo de una firma de varios metabolitos y varios fluidos corporales (orina y plasma) para predecir el riesgo de ECV.
Figura central. Se diseñaron varios subestudios anidados dentro del ensayo aleatorizado PREDIMED, financiados por los institutos nacionales de salud, para comprender mejor los beneficios para la salud de las intervenciones con MedDiet en la prevención del riesgo cardiometabólico mediante la determinación de perfiles metabolómicos. Los diseños de cohortes de casos con determinación repetida de los perfiles metabolómicos (al inicio y al cabo de 1 año) permitieron comprobar: a) los efectos de los metabolitos basales en los eventos de ECV; b) el efecto de la intervención (MedDiet) en los cambios en los metabolitos al cabo de 1 año; c) los efectos de los cambios en los metabolitos (entre el inicio y al cabo de 1 año) en los eventos de ECV posteriores (al cabo de 1 año), y d) la modificación del efecto (posible atenuación) mediante la intervención con MedDiet (interacción) en las asociaciones entre los metabolitos plasmáticos y los eventos de ECV. Todas estas evaluaciones se aplicaron también al riesgo de diabetes mellitus tipo 2 con diseños análogos. AACR: aminoácidos de cadena ramificada; AGPI: ácidos grasos poliinsaturados; EAP: enfermedad arterial periférica; ECV: enfermedad cardiovascular; MedDiet: dieta mediterránea.
Además de los estudios sobre metabolómica y DM2, en los últimos años se han obtenido resultados cruciales en estudios metabolómicos anidados en el PREDIMED en los que se valoraron como desenlace las ECV, gracias a una colaboración multidisciplinaria de 10 años de los equipos españoles del estudio PREDIMED (investigadores principales en las universidades de Navarra, Rovira i Virgili y de Barcelona, España), Harvard T. H. Chan School of Public Health (Departamento de Nutrición, Prof. Frank B. Hu, Estados Unidos) y el Broad Institute (Plataforma Metabolómica, Prof. Clary Clish, Estados Unidos). Durante los últimos 10 años se ha celebrado cada año un simposio internacional, alternándose a cada lado del Atlántico, para examinar estos resultados. El 10 simposio se celebró en Tecnun (Universidad de Navarra, San Sebastián, España) en junio de 2024.
Entre los principales hallazgos sobre el riesgo de ECV en los estudios anidados en el estudio PREDIMED (figura 1) se encuentran los siguientes:
- •
2 aminoácidos de cadena ramificada (leucina e isoleucina) se asociaron con un mayor riesgo de ECV (asociación más intensa con el ictus que con la enfermedad coronaria) y este riesgo elevado se mitigó mediante la intervención con MedDiet39.
- •
Las acilcarnitinas de cadena corta y media se asociaron con un mayor riesgo de ECV, que se atenuó con las intervenciones de MedDiet40.
- •
La concentración plasmática de triptófano se asoció con menor riesgo de ECV, mientras que el ácido quinurénico se asoció con un riesgo superior. La asociación inversa entre la intervención de MedDiet y la ECV se atenuó mediante ajustes en función de los cambios en el triptófano plasmático, lo que indica una posible explicación de la protección proporcionada por la MedDiet suplementada con aceite de oliva virgen extra41,42.
- •
La concentración plasmática de glutamina se asoció con menor riesgo de ECV, mientras que el glutamato plasmático predijo un mayor riesgo tanto de ECV grave43 como de IC, pero no de fibrilación auricular44.
- •
Una menor disponibilidad de arginina, un precursor del óxido nítrico, puede limitar su producción. Una mayor disponibilidad total de arginina, que se refleja en la concentración plasmática de 3 metabolitos del ciclo de la urea, como [arginina / (ornitina+citrulina)], se asoció con menor riesgo de ECV45,46.
- •
Varias ceramidas plasmáticas se asociaron con mayor riesgo de ECV, que se atenuaba con las intervenciones de MedDiet47. Este descubrimiento, que se reprodujo después48, puede mejorar la predicción del riesgo vascular.
- •
La colina plasmática y la vía de la colina (N-óxido de trimetilamina, betaína, colina, fosfocolina y α-glicerofosfocolina) se asociaron con un mayor riesgo de eventos graves de ECV, IC y fibrilación auricular49,50.
- •
Los ésteres de colesterol mostraron una asociación inversa con el riesgo de ECV. Una menor longitud de la cadena y una mayor saturación de los lípidos mostraron asociaciones directas con un mayor riesgo de eventos de ECV. Las fosfatidilcolinas (PC) poliinsaturadas y los (PC)/lisoPC/PC-plasmalógenos predijeron un menor riesgo de ECV, mientras que las fosfatidiletanolaminas, los monoacilgliceroles/diacilgliceroles y los triacilgliceroles de cadena corta mostraron una asociación positiva con la ECV51-54.
- •
Algunos metabolitos del ciclo del ácido cítrico (ciclo de Krebs), en concreto el hidroxiglutarato, el fumarato y el malato, se asociaron con mayor riesgo de ECV y mejoraron la predicción del riesgo en comparación con la ecuación de Framingham55.
El ácido tartárico es un biomarcador óptimo de uva y vino porque se encuentra en cantidades iguales en el vino tinto y en el blanco, a diferencia de los polifenoles, que están hasta 10 veces menos concentrados en el vino blanco36-38. En un subestudio anidado dentro del ensayo PREDIMED, se ha utilizado el ácido tartárico urinario para evaluar las asociaciones de la ingesta de alcohol moderada a ligera con los eventos de ECV. Además, el ácido tartárico muestra una correlación inversa con los biomarcadores de ateroesclerosis y probablemente tenga propiedades antiinflamatorias38,56-58. Los (poli)fenoles pueden tener efectos bioactivos en función de la genética del individuo y/o de la capacidad de la microbiota para producir determinados metabolitos59. La determinación de múltiples metabolitos urinarios, mediante un método novedoso basado en LC-MS, proporcionó una evidencia adicional que indicaba que los metabolitos fenólicos urinarios podrían conferir una protección intensa contra las ECV57,58. Otros enfoques de metabotipaje con (poli)fenoles de la dieta pueden contribuir a mejorar la cardiología preventiva desde una perspectiva de nutrición de precisión59.
La MedDiet y el microbioma intestinalLa adherencia a la MedDiet a largo plazo se asocia con componentes taxonómicos y funcionales específicos del microbioma intestinal60. La protección conferida contra las ECV por la MedDiet depende de la composición microbiana intestinal, con un efecto protector significativamente mayor en las personas con una menor abundancia de Prevotella copri61. Sin embargo, los conocimientos sobre el papel funcional del microbioma intestinal en las enfermedades cardiometabólicas siguen siendo escasos. La falta de coherencia de los resultados puede deberse al pequeño tamaño de las muestras, el control insuficiente de los factores de confusión y la variabilidad en el diseño y el análisis de los estudios. Son pocos los estudios que han explorado las características de las cepas microbianas en relación con las enfermedades sistémicas crónicas, a pesar de que los mecanismos patogénicos pueden ser específicos de las cepas más que de las especies. MicroCardio es un consorcio internacional de microbiomas, creado en 2021, que procesa y analiza datos estandarizados y examina las asociaciones entre metagenomas y la DM2 a escala mundial, y ha revelado firmas microbianas sólidas transversales en diversas cohortes con resolución a escala de cepa62. Estos avances proporcionan análisis reproducibles tanto de la comunidad como de las cepas, y ofrecen nuevas perspectivas respecto a mecanismos de acción en el microbioma. En los estudios en curso del Consorcio MicroCardio se investigan actualmente las relaciones entre los patrones de alimentación saludables, el microbioma intestinal, los metabolitos microbianos, las ECV y la DM2.
Edulcorantes no nutritivos y riesgo cardiometabólicoA pesar de la sustitución del azúcar por edulcorantes no nutritivos (ENN), el porcentaje de adultos con obesidad ha aumentado de forma constante, y es posible que esto haya contribuido a producir el posterior incremento de las ECV. Es necesario revaluar el papel de los ENN. Inicialmente se pensó que los ENN eran inertes o incluso beneficiosos. Sin embargo, se ha observado que inducen una intolerancia a la glucosa dependiente del microbioma en ratones63. Concretamente, la sacarina puede potenciar las vías de degradación de los glucanos, un fenómeno también observado en los microbiomas de pacientes con obesidad. En un ensayo clínico aleatorizado, la sacarina y la sucralosa indujeron respuestas glucémicas perjudiciales (restringidas al periodo de consumo)64. Los análisis longitudinales mediante factorización tensorial revelaron cambios taxonómicos y funcionales significativos en la microbiota a lo largo del tiempo asociados a la ingesta de ENN65. Los ratones libres de gérmenes convencionalizados con microbiomas de participantes con respuestas glucémicas normales o elevadas a los ENN mostraron respuestas glucémicas similares a las de sus donantes humanos. Los efectos variables de varios ENN en las respuestas glucémicas han demostrado que algunos ENN podrían inducir respuestas glucémicas perjudiciales específicamente para cada persona y en dependencia del microbioma. Un factor clave parece ser la composición inicial del microbioma. Serán necesarios más esfuerzos en genética y metabotipaje para comprender mejor los mecanismos que relacionan la ingesta de ENN con la DM2 y el riesgo de ECV64,65.
PREDIMED-Plus: reducción de consumo de energía y ejercicio añadidos a la dieta mediterráneaEl estudio PREDIMED-Plus es un ensayo español de prevención primaria de la ECV en el que se incluyó a 6.874 varones y mujeres con síndrome metabólico, de entre 55 y 75 años, asignados aleatoriamente a 2 grupos: uno en el que se aplicó una intervención en varios dominios, con reducción del peso, incluyendo una MedDiet de energía reducida, promoción de la actividad física y apoyo conductual; y otro, un grupo de control, en el que se aplicó la asistencia habitual junto con recomendaciones generales sobre la MedDiet sin ninguna restricción calórica. El reclutamiento comenzó en el centro de Navarra en 2013. Otros 22 centros se unieron al ensayo durante el periodo 2014-2015. Todos los participantes completaron un periodo de intervención de 6 años en diciembre de 2022, y se añadieron 2 años adicionales de observación. El ensayo finaliza en diciembre de 2024. El grupo de intervención mostró una mayor adherencia a la MedDiet, un menor peso corporal y una reducción de los factores de riesgo de ECV66, así como cambios a los 3 años en la grasa total, la masa magra y la grasa visceral en el sentido previsto67. Varios proyectos financiados en curso anidados en el PREDIMED-Plus pueden hacer avanzar la nutrición de precisión para comprender mejor las relaciones entre las firmas multiómicas, la intervención en varios dominios y el riesgo de enfermedad cardiometabólica68.
LÍPIDOS, METABOLITOS Y RIESGO CARDIOMETABÓLICOLípidos sanguíneos, ingesta de lípidos y enfermedades cardiovasculares: nuevas vías de investigaciónLas ECV son la principal causa de mortalidad en todo el mundo, mientras que la demencia ocupa el tercer lugar en Estados Unidos y Europa69. La demencia de inicio temprano puede detectarse mediante biomarcadores ligados al riesgo cardiovascular. Los valores del colesterol unido a lipoproteínas de baja densidad (cLDL) se asocian con un mayor riesgo de demencia, mientras que el colesterol unido a lipoproteínas de alta densidad (cHDL) muestra relaciones inversas70-72. Aunque las cifras de cHDL bajas son factor de riesgo de enfermedad coronaria, su relación causal sigue sin estar clara, con resultados discordantes en recientes metanálisis y estudios de aleatorización mendeliana73-76. La mejora de la función de las HDL puede ser más importante para la prevención que el simple aumento de las concentraciones de HDL. El cHDL disfuncional, como es el caso de la disminución de su capacidad de expulsión del colesterol, se asocia con mayor riesgo de ECV71,77-80. En un estudio de casos y controles emparejados anidado en el estudio PREDIMED, la baja capacidad de expulsión de colesterol, las partículas de HDL con capacidad antioxidante/antiinflamatoria reducida y las bajas concentraciones de apoA-I y esfingosina-1-fosfato unida a HDL se asociaron con mayor riesgo de enfermedad coronaria independientemente del cHDL y otros factores de riesgo.
Basándose en una evaluación sistemática de la evidencia disponible, la Organización Mundial de la Salud actualizó sus recomendaciones sobre el consumo de grasas, y aconseja reducir la ingesta de grasas saturadas y fomenta su sustitución por grasas insaturadas, principalmente para prevenir la incidencia de las ECV81. La certidumbre de estas recomendaciones se considera de baja a moderada, debido a las limitaciones de los estudios en los que se basa. El efecto específico de sustituir las grasas saturadas de los productos lácteos, como la mantequilla, por ácidos grasos insaturados de origen vegetal es objeto de controversia82-87. En un proyecto reciente se integraron datos de diferentes tipos de estudios para generar una evidencia más sólida sobre el efecto cuantitativo de sustituir la grasa saturada derivada de productos lácteos por grasa vegetal insaturada54. Este trabajo se basó en datos de lipidómica derivados de los estudios que participaron en el proyecto. Se utilizó un ensayo controlado aleatorizado en el que se sustituyó la grasa saturada de origen lácteo por aceites y grasas para untar de origen vegetal durante varios meses para obtener una puntuación multilipídica (MLS) que reflejase los cambios inducidos por la dieta en 45 metabolitos lipídicos. La aplicación de la MLS en grandes estudios poblacionales demostró que estos cambios en el lipidoma relacionados con la alimentación se asociaban a riesgos sustancialmente menores de ECV y DM2. En este estudio también se utilizaron datos lipidómicos del estudio PREDIMED para evaluar si los beneficios de la intervención con MedDiet, que tiene un alto contenido de grasas insaturadas de origen vegetal, dependen de los valores de MLS previos a la intervención. Es de destacar que, aunque no se detectó ninguna modificación del efecto en el riesgo de ECV, las personas que tenían una MLS inicial adversa fueron las que mostraron una mayor reducción del riesgo de DM2 en respuesta a la intervención con MedDiet54, lo cual refuerza la evidencia que indica un efecto causal de la sustitución de las grasas saturadas lácteas por grasas insaturadas vegetales en la reducción del riesgo cardiometabólico. Además, los resultados específicos del estudio PREDIMED indican que el perfil lipidómico podría ser útil para adaptar las intervenciones sobre las grasas alimentarias para los grupos con mayor riesgo.
HDL, microARN y nanodiscos en la prevención cardiovascularLos microARN (miARN) son moléculas pequeñas no codificantes que regulan la función del ARN mensajero mediante la hibridación88. Están emergiendo como posibles biomarcadores y dianas farmacológicas. De hecho, en estudios prospectivos en el ser humano, se ha descrito que los miARN circulantes se asocian a la incidencia de ECV89,90. Tiene interés señalar que el perfil de miARN-HDL de los pacientes con hipercolesterolemia familiar fue diferente del de un grupo de control91. Además, la infusión de ciertos miARN puede prevenir la formación de placas, y el silenciamiento del miARN-33 es una estrategia prometedora para abordar la ECV ateroesclerótica92.
Como prueba de concepto, en el Instituto de Investigación del Hospital del Mar (España), bajo la dirección de la Dra. M. Fitó, se ha completado con éxito el diseño y desarrollo de una nanopartícula sintética de lipoproteína de alta densidad (sHDL) que incorpora un antagonista de ácido nucleico bloqueado dirigido a un miARN candidato. En modelos in vitro, se observaron efectos individualizados de estos nanodiscos en la capacidad de expulsión del colesterol en macrófagos y la excreción de moléculas proinflamatorias en líneas celulares endoteliales mediante el silenciamiento de un miARN candidato utilizando un antagonista, de acuerdo con hallazgos anteriores que lo habían indicado93,94.
Productos lácteos, metabolómica y enfermedades cardiometabólicasActualmente se están estudiando diferentes grupos de alimentos para identificar firmas metabolómicas y sus asociaciones con las ECV o la DM2. Por ejemplo, los datos procedentes de evaluaciones alimentarias subjetivas del consumo de lácteos son contradictorios y poco coherentes. Parece que los lácteos fermentados tienen una relación inversa con la DM2, mientras que el total de productos lácteos no muestra ninguna asociación95. En algunos estudios se ha descrito una asociación positiva o nula entre la mantequilla y las ECV, pero se ha observado una relación inversa con la DM2. Los ácidos grasos de la grasa láctea medidos objetivamente mostraron una asociación inversa con la DM2 que también se confirmó en los análisis metabolómicos realizados con 82 metabolitos identificados en las cohortes británicas Fenland y EPIC-Norfolk96,97.
Carne roja, metabolómica y enfermedades cardiometabólicasEl consumo de carne roja se ha asociado repetidamente con mayor riesgo de enfermedades no transmisibles, como la DM298 y las ECV99. Una combinación de metabolitos es más eficaz que los metabolitos individuales para clasificar los hábitos alimentarios100. Es probable que los biomarcadores metabolómicos plasmáticos que subyacen a la asociación entre el consumo de hierro del grupo hemo y la DM2 proporcionen un claro apoyo fisiopatológico a la asociación perjudicial entre el consumo de carne roja y la enfermedad cardiometabólica100. Recientemente se ha descubierto que la ingesta de hierro del grupo hemo explica más del 50% de la asociación entre el consumo de carne roja no procesada y el riesgo de DM2, y se han identificado algunos metabolitos plasmáticos, como la L-valina y el ácido úrico, que son posibles mediadores de la relación entre el hierro del grupo hemo y la DM2101.
Metabolitos, mortalidad y longevidadLos predictores del riesgo de mortalidad y de la longevidad basados en múltiples metabolitos pueden aportar más información sobre los mecanismos que subyacen a estos factores102,103. En 4 cohortes prospectivas, un estilo de vida saludable (no fumar, mantener un peso saludable, la práctica regular de ejercicio, una alimentación de gran calidad y un consumo moderado de alcohol)104 se reflejó en una firma metabolómica que muestra que estos hábitos saludables pueden aumentar la esperanza de vida hasta 14 años después de la edad de 50 años105. Además, en 11.634 participantes estadounidenses del NHS/NHS2/HPFS y 1.878 participantes del estudio PREDIMED, 75 metabolitos mostraron asociación positiva con la mortalidad por cualquier causa, mientras que 32 tuvieron una asociación negativa con la mortalidad por cualquier causa103. Concretamente, los triacilgliceroles con cadenas más largas y menos saturadas se asociaron con mayor longevidad. Las diferencias en las cantidades de nucleósidos, aminoácidos y varias subclases de lípidos también predijeron la mortalidad a largo plazo.
RESUMEN Y FUTURAS LÍNEAS DE INVESTIGACIÓNLos recientes avances de las tecnologías ómicas y los métodos de aprendizaje automático han acelerado la investigación sobre nutrición de precisión y enfermedades cardiometabólicas. Los análisis metabolómicos han contribuido en gran medida a la prevención de las enfermedades cardiometabólicas al mejorar nuestra comprensión de las vías y los mecanismos bioquímicos. El seguimiento ampliado del estudio PREDIMED respecto a la mortalidad (hasta 2019) será fundamental para identificar firmas de múltiples metabolitos asociadas con la mortalidad total y de causa cardiovascular a largo plazo en pacientes con alto riesgo. El estudio PREDIMED-Plus examinará los efectos de la intervención en múltiples dominios contra la DM2 tras 7 años de seguimiento, así como contra la enfermedad renal crónica106. Las ECV (el objetivo primario) se evaluarán a los 8 años. La recopilación de abundantes datos alimentarios y de estilo de vida, muestras biológicas107 y datos metabolómicos permitirá profundizar en las vías metabólicas que subyacen en la alimentación y las enfermedades cardiometabólicas68.
La integración de la metabolómica de múltiples líquidos corporales en grandes ensayos y estudios de cohorte en los que se usan variables de valoración «duras» consistentes en eventos clínicos permitirá profundizar en nuestro conocimiento de los mecanismos en el ámbito de los sistemas1. Este enfoque ayudará a diseñar intervenciones alimentarias basadas en el estilo de vida mediterráneo más eficaces para mejorar la salud cardiometabólica. En el simposio se destacaron las orientaciones futuras de la investigación en nutrición de precisión, entre ellas: a) el desarrollo de biomarcadores metabólicos más sólidos para predecir el riesgo de enfermedades cardiometabólicas y la mortalidad a largo plazo; b) la inclusión de poblaciones y patrones alimentarios más diversos procedentes de distintas culturas, y c) la necesidad de potenciar la investigación traslacional para salvar la distancia entre la ciencia de la nutrición y las aplicaciones clínicas.
FINANCIACIÓNEl ensayo PREDIMED fue financiado por el Ministerio de Sanidad de España (Instituto de Salud Carlos III [ISCIII], a través de la subvención de la Red PREDIMED RD 06/0045, 2006-2013, coordinada por M.A. Martínez-González; y una subvención anterior de la red RTIC-G03/140, 2003-2005, coordinada por R. Estruch). Se recibieron subvenciones adicionales del Ministerio de Economía y Competitividad-Fondo Europeo de Desarrollo Regional (Proyectos CNIC-06/2007, CIBER 06/03, PI06-1326, PI07-0954, PI11/02505, SAF2009-12304) y de CIBER Fisiopatología de la Obesidad y Nutrición (CIBERobn). Además, los estudios de perfiles metabolómicos anidados en el ensayo PREDIMED fueron financiados por subvenciones del NIDDK y el NHBLI (R01HL118264, R01DK127601, R01DK102896 y U2CDK129670).
El ensayo PREDIMED-Plus (2014-2019) fue financiado inicialmente por una subvención del Consejo de Investigación Europeo a M.A. Martínez-González (https://cordis.europa.eu/project/id/340918/es, consultado el 6 de septiembre de 2024). Los estudios de perfiles metabolómicos anidados en el ensayo PREDIMED-Plus fueron financiados por una subvención del NIDDK (1R01DK127601), y las instituciones oficiales españolas para la financiación de la investigación científica biomédica, CIBER Fisiopatología de la Obesidad y Nutrición (CIBEROBN) e Instituto de Salud Carlos III (ISCIII), a través del Fondo de Investigación para la Salud (FIS), con 6 proyectos FIS coordinados dirigidos por J. Salas-Salvadó y Josep Vidal, entre los que se incluyen los siguientes proyectos: PI13/00673, PI13/00492, PI13/00272, PI13/01123, PI13/00462, PI13/00233, PI13/02184, PI13/00728, PI13/01090, PI13/01056, PI14/01722, PI14/00636, PI14/00618, PI14/00696, PI14/01206, PI14/01919, PI14/00853, PI14/01374, PI14/00972, PI14/00728, PI14/01471, PI16/00473, PI16/00662, PI16/01873, PI16/01094, PI16/00501, PI16/00533, PI16/00381, PI16/00366, PI16/01522, PI16/01120, PI17/00764, PI17/01183, PI17/00855, PI17/01347, PI17/00525, PI17/01827, PI17/00532, PI17/00215, PI17/01441, PI17/00508, PI17/01732, PI17/00926, PI19/00957, PI19/00386, PI19/00309, PI19/01032, PI19/00576, PI19/00017, PI19/01226, PI19/00781, PI19/01560, PI19/01332, PI20/01802, PI20/00138, PI20/01532, PI20/00456, PI20/00339, PI20/00557, PI20/00886 y PI20/01158. Otra financiación para el estudio PREDIMED-Plus fue la subvención para el Proyecto de Acción Especial titulado: Implementación y evaluación de una intervención intensiva sobre la actividad física Cohorte PREDIMED-Plus (J. Salas-Salvadó); la subvención Recercaixa (2013ACUP00194) (J. Salas-Salvadó), y las subvenciones de INSA-Unidad de Excelencia María de Maeztu (subvención CEX2021-001234-M financiada por MICIN/AEI/FEDER, EU).
DECLARACIÓN SOBRE EL USO DE INTELIGENCIA ARTIFICIALNo se han utilizado aplicaciones de inteligencia artificial para redactar este manuscrito.
CONTRIBUCIÓN DE LOS AUTORESM.A. Martínez-González redactó la versión inicial. Todos los autores participaron sustancialmente en la concepción y el diseño del trabajo y en la obtención, el análisis y la interpretación de los datos para el trabajo, realizaron una revisión crítica del manuscrito en cuanto a contenido intelectual importante y dieron su aprobación final a la versión a publicar. Todos los coautores aceptaron responsabilizarse de todos los aspectos del trabajo y garantizar que las cuestiones relativas a la exactitud o integridad de cualquier parte del trabajo se hayan investigado y resuelto adecuadamente.
CONFLICTO DE INTERESESM. Guasch-Ferré declara que el Centro de Investigación Metabólica Básica de la Fundación Novo Nordisk cuenta con el apoyo de una subvención sin restricciones de la Fundación Novo Nordisk (subvención n. NNF18CC0034900). J. Salas-Salvadó agradece el apoyo financiero de ICREA a través del programa ICREA Academia. O. Castañer agradece los contratos del ISCIII CP21/00097, PI20/00012, y la Red CIBER de Epidemiología y Salud Pública (CIBERESP). P. Mena recibió financiación del Consejo Europeo de Investigación en el marco del programa de investigación e innovación Horizonte 2020 de la Unión Europea (proyecto PREDICT-CARE, acuerdo de subvención n. 950050). F.J. Planes recibió apoyo del programa de investigación e innovación Horizonte 2020 de la Unión Europea (STANCE4HEALTH, subvención n. 816303). Todos los demás autores declaran no tener ningún conflicto de intereses.
AGRADECIMIENTOSAgradecemos a Andrés Moncada-Parra su colaboración en la elaboración del resumen gráfico y otras tareas de recopilación de la información utilizada para preparar la versión inicial del manuscrito.