El bloqueo del sistema renina-angiotensina con fármacos inhibidores de la enzima de conversión de la angiotensina o con antagonistas de los receptores de la angiotensina II ha demostrado su efectividad en hipertensos con y sin enfermedad cardiovascular previa. También en normotensos con alto riesgo vascular. Como además tienen efecto antiproteinúrico, se estima que estos agentes deben ocupar el primer escalón terapéutico en los pacientes con nefropatía diabética incipiente o establecida. Asimismo son agentes de primera línea en los casos de nefropatía no diabética con proteinuria > 0,5 g/24 h.
Los estudios comparativos entre inhibidores de la enzima de conversión de angiotensina y los antagonistas de los receptores tipo 1 de la angiotensina II parecen mostrar una efectividad similar, con mejor tolerabilidad de estos últimos. En pacientes con nefropatía, la combinación de ambos agentes muestra una mayor capacidad antiproteinúrica que la monoterapia, aunque se desconoce si este efecto es independiente de una mayor reducción de la presión arterial.
Palabras clave
El sistema renina-angiotensina (SRA) es importante en la regulación de la presión arterial (PA). Tanto los inhibidores de la enzima de conversión de angiotensina (IECA) como los antagonistas de los receptores tipo 1 de la angiotensina II (ARA-II) se han demostrado efectivos en el tratamiento de la hipertensión arterial (HTA)1. Además, muestran otros beneficios que podrían ser independientes de su efecto antihipertensivo, como se ha verificado en la nefropatía diabética y en la enfermedad renal crónica (ERC) de origen no diabético2,3.
Los IECA fueron incorporados al arsenal terapéutico antihipertensivo al comienzo de la década de los ochenta. El primer agente fue el captopril y lo hizo con una indicación preferente en el tratamiento de la HTA resistente. Posteriormente, se comprobó su utilidad en cualquier estadio de HTA esencial y, junto con otros fármacos de este grupo (enalapril, lisinopril, ramipril, trandolapril, etc.), fueron incluidos en el informe de 1988 del Joint National Committee como parte de los escalones terapéuticos de la HTA4. Pocos años más tarde, se demostró que captopril era efectivo para diferir la progresión de la enfermedad renal en diabéticos tipo 1 con nefropatía establecida5. Desde entonces quedó reconocido el efecto renoprotector de los IECA en este tipo de diabetes.
La adscripción de los ARA-II a la terapéutica antihipertensiva se produjo aproximadamente diez años más tarde. Aunque sus efectos clínicos parecían idénticos a los demostrados con los IECA, su mecanismo de acción no es enteramente igual, pues producen una inhibición más completa de la angiotensina II sin afectar a la convertasa. Esto se tradujo en una menor prevalencia de efectos secundarios, derivados principalmente de la ausencia de tos (un 5-20% con los IECA) y práctica ausencia de angioedema (un 0,1-0,2% con los IECA). Inicialmente, su indicación básica fue la sustitución de un tratamiento con IECA no tolerado a causa de la tos6. Sin embargo, en los años siguientes numerosos ensayos clínicos demostraron que los ARA-II tienen una efectividad antihipertensiva similar a la de los IECA7 y efectos cardioprotector8,9 y renoprotector2,10 comparables a los de esos fármacos.
En el presente trabajo se analizan las indicaciones y los posibles efectos adversos de los agentes bloqueadores del SRA en pacientes con HTA esencial, en diabéticos hipertensos, con o sin nefropatía establecida secundaria, y en los casos de nefropatía no diabética.
BLOQUEADORES DEL SRA EN LA HTA ESENCIALEl reciente informe de las sociedades europeas de cardiología e hipertensión ha establecido, al igual que el informe previo del año 2003, que los efectos beneficiosos del tratamiento antihipertensivo se deben, principalmente, a la reducción de la PA y son en gran parte independientes de los fármacos utilizados1. Los diuréticos tiacídicos, los bloqueadores beta, los antagonistas del calcio, los IECA y los ARA-II pueden ser útiles para controlar la PA y reducir de forma significativa la morbimortalidad cardiovascular. Cualquiera de estos fármacos es adecuado para iniciar el tratamiento antihipertensivo. Para obtener un objetivo de control de la PA<140/90mmHg, en al menos 2 de cada 3 casos será necesario utilizar combinaciones terapéuticas. La elección de un agente o combinación de agentes deberá tener en cuenta la presencia de lesiones subclínicas de órganos, enfermedad cardiovascular, enfermedad renal o diabetes asociadas, pues para cada uno de estos procesos algunos fármacos pueden tener un perfil de efectos más favorable. Asimismo, se prestará una atención especial a sus posibles efectos secundarios, puesto que son la causa más importante de la falta de adherencia terapéutica. En la tabla 1 se describen las situaciones clínicas que favorecen la prescripción de IECA y ARA-II y en la tabla 2, las contraindicaciones para esos mismos fármacos.
Situaciones clínicas con indicación preferente para el uso de IECA y ARA-II
| IECA | ARA-II |
| insuficiencia cardiacaDisfunción de ventrículo izquierdoTras infarto de miocardioHipertrofia de ventrículo izquierdoFibrilación auricularNefropatía diabéticaNefropatía no diabéticaProteinuria/microalbuminuriaSíndrome metabólico | Insuficiencia cardiacaTras infarto de miocardioHipertrofia de ventrículo izquierdoFibrilación auricularNefropatía diabéticaProteinuria/microalbuminuriaSíndrome metabólicoTos inducida por IECA |
ARA II: antagonistas de los receptores tipo 1 de la angiotensina II; IECA: Inhibidores de la enzima de conversión de angiotensina. Adaptada de Mancia et al1.
Contraindicaciones para el uso de IECA o ARA-II
| lECA | ARA-II |
| EmbarazoEdema angioneuróticoTos con cualquier IECA previoHiperpotasemia (> 5mEq/l)Estenosis de arteria renal bilateral | EmbarazoHiperpotasemia (> 5mEq/l)Estenosis de arteria renal bilateral |
ARA II: antagonistas de los receptores tipo 1 de la angiotensina II; IECA: Inhibidores de la enzima de conversión de angiotensina. Adaptada de Mancia et al1.
Los IECA son fármacos seguros y ofrecen una prevención cardiovascular primaria similar a la de los fármacos clásicos en HTA esencial y probablemente superior en casos con HTA y diabetes, como luego se verá. Además, han demostrado su efectividad en pacientes hipertensos de edad avanzada y en hipertensos o normotensos de alto riesgo cardiovascular con edad>55 años11-14. Se han comunicado resultados similares en pacientes con antecedentes de enfermedad cerebrovascular o cardiopatía isquémica15,16. Esos estudios no fueron comparativos entre dos estrategias antihipertensivas, sino de uso de IECA contra placebo. En los estudios frente a tratamiento activo, la PA fue ligeramente más baja, lo que ha permitido que se mantenga la controversia acerca de si el efecto cardioprotector de los IECA es independiente de su acción antihipertensiva17. Los IECA forman parte del tratamiento básico de la insuficiencia cardiaca y tienen una indicación preferente en la prevención secundaria tras un infarto de miocardio, sobre todo en casos de disfunción ventricular18.
Los ARA-II tienen muchas características comunes con los IECA, con la diferencia de su mejor tolerabilidad6,7. En ensayos recientes han mostrado un papel específico en algunas situaciones. En pacientes con HTA esencial e hipertrofia ventricular, se observó que ofrecían una protección cardiovascular superior al tratamiento con bloqueadores beta, especialmente en casos con diabetes6. Este mayor beneficio también se ha observado en pacientes con HTA sistólica aislada y en ancianos19,20. En la insuficiencia cardiaca, los ARA-II ofrecen una eficacia similar a los IECA y la combinación de ambos puede ocasionar un beneficio añadido9. En pacientes con disfunción ventricular tras un infarto de miocardio, los ARA-II pueden ser una alternativa de tratamiento21.
Muy recientemente se ha publicado un metaanálisis que recoge los estudios que comparan efectividad y tolerabilidad de IECA frente a ARA-II en pacientes con HTA esencial. Matchar et al7 seleccionaron 61 estudios clínicos que incluían al menos a 20 pacientes y tenían un tiempo de seguimiento mínimo de 12 semanas. El efecto antihipertensivo a largo plazo fue similar con ambos grupos farmacológicos. No se observaron diferencias en morbimortalidad cardiovascular, hipertrofia de ventrículo izquierdo, progresión a diabetes o enfermedad renal. Los efectos secundarios con los IECA fueron más pronunciados por la presencia de tos. La conclusión de los autores es que los IECA y los ARA-II tienen una efectividad antihipertensiva similar y los IECA, una peor tolerabilidad. Debe señalarse que el metaanálisis tiene numerosas limitaciones derivadas de la marcada heterogeneidad de los trabajos incluidos. En la mayoría, el número de pacientes analizados fue pequeño y los seguimientos superiores a 1 año, la excepción. Este estudio no responde adecuadamente a las preguntas básicas sobre estos dos grupos farmacológicos: ¿son igualmente efectivos IECA y ARA II? y ¿tienen efectos de protección vascular más allá de la reducción de las cifras de PA?
En relación con la efectividad antihipertensiva de la combinación IECA con ARA-II frente a la monoterapia apenas se han publicado estudios. Aunque parecería que hay un pequeño efecto adicional, la comparación no se ha hecho con dosis altas de los monocomponentes. Además, la duración de los estudios ha sido muy breve (6 semanas) y el número de pacientes incluidos, < 100 en todos los casos22. La reciente publicación del estudio ONTARGET ha confirmado estas previsiones. En pacientes con riesgo vascular elevado, la mayoría de ellos hipertensos, el bloqueo dual con ramipril y telmisartán no ocasionó ningún beneficio añadido respecto a los monocomponentes. Por el contrario, hubo una mayor proporción de efectos adversos23. Con estos datos, no se puede recomendar la combinación de un IECA con un ARA-II en HTA esencial.
BLOQUEADORES DEL SRA EN PACIENTES CON DIABETESHaremos referencia fundamentalmente a la diabetes mellitus tipo 2, que es 10–20 veces más frecuente que la de tipo 1 y se asocia con HTA en un 70-80% de los casos y con nefropatía en un 30-35% de los pacientes. La concomitancia de HTA y diabetes incrementa notablemente el riesgo cardiovascular y renal. En presencia de nefropatía diabética, el riesgo vascular es todavía mucho más alto. La reducción de la PA tiene un importante efecto de protección cardiovascular y, también aquí, puede ser independiente del fármaco utilizado24. Aunque los datos disponibles en la literatura son escasos, se admite que el beneficio cardiovascular y renal es superior si la PA se reduce a valores<130/80mmHg. También, que el tratamiento debe iniciarse cuando la PA está en valores normales altos (130/85mmHg)1,25,26. El objetivo de prevención de la nefropatía incluye, asimismo, la reducción de la proteinuria en la nefropatía establecida o de la microalbuminuria en la nefropatía incipiente.
Las evidencias disponibles indican que los IECA, por su efecto antihipertensivo y antiproteinúrico, difieren el deterioro de la función renal en pacientes con diabetes mellitus tipo 1 y nefropatía establecida5. También, que previenen el progreso de nefropatía incipiente a nefropatía establecida en la diabetes mellitus tipo 227. El estudio BENEDICT (The Bergamo Nephrologic Diabetes Complication Trial), realizado en 1.204 diabéticos tipo 2, hipertensos y normoalbuminúricos, demostró que el trandolapril disminuye la incidencia del progreso a microalbuminuria comparado con el verapamilo28. Ese trabajo ha abierto la opción de recomendar los IECA en la prevención primaria de la nefropatía diabética.
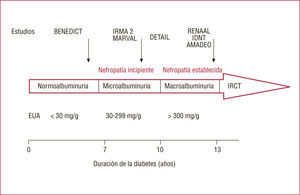
En diabetes mellitus tipo 2 con nefropatía establecida, los estudios se han realizado básicamente con ARA-II y han demostrado que este grupo farmacológico reduce la proteinuria y el ritmo de progresión de la insuficiencia renal, expresado por la duplicación de la cifra de creatinina sérica o la necesidad de diálisis por insuficiencia renal crónica (IRC) terminal2,10,29. Los ARA-II son igualmente efectivos en el tratamiento de la nefropatía incipiente29-31. Probablemente el efecto sea independiente del grado de control de la PA (tabla 3). El efecto renoprotector de los IECA respecto a los ARA-II ha sido escasamente analizado en pacientes diabéticos32. El estudio Detail (Diabetics Exposed Telmisartan and Enalapril Study Group) comparó la efectividad de telmisartán con la de enalapril en 250 diabéticos tipo 2 con nefropatía incipiente o establecida29. El grado de control de la proteinuria y el retraso en la progresión de la insuficiencia renal fueron similares con ambos fármacos. En otro estudio muy reciente denominado AMADEO (Study compAred telMisartan vs losArtan in hypertensive type-2 DiabEtic patients with Overt nephropathy), telmisartán a la dosis de 80mg fue más efectivo que losartán (100mg) para reducir la excreción urinaria de albúmina en 860 pacientes con nefropatía establecida. El seguimiento fue de 1 año y no hubo diferencias significativas en el grado de descenso de la PA33 (fig.1). Es verosímil que alguno de los subestudios del ONTARGET23, de próxima publicación, proporcionarán una importante información adicional, pues el 37% de los pacientes incluidos eran diabéticos.
Bloqueo del sistema renina-angiotensina en pacientes con diabetes mellitus. Estudios con IECA, ARA-II y la combinación de ambos
| Autor y ano | Fármacos | Pacientes | Resultados |
| Lewis et al5, 1993 | Captopril | DM1 con nefropatía establecida | Retraso en el ritmo de progresión de la IRC |
| Ravid et al27, 1 997 | Enalapril | DM2 con nefropatía incipiente | Retraso en el ritmo de progresión de la IRC |
| Ruggenenti et al28, 2004 | Trandolapril frente a verapamilo | DM2 con normoalbuminuria | Reducción del progreso a microalbuminuria con trandolapril |
| Parving et al30, 2001 | Irbesartán | DM2 con nefropatía incipiente | Retraso en la progresión de la nefropatía |
| Lewis et al2, 2001 | Irbesartán | DM2 con nefropatía establecida | Reducción del riesgo de alcanzar la IRCT |
| Brenner et al10, 2001 | Losartán | DM2 con nefropatía establecida | Reducción del riesgo de alcanzar la IRCT |
| Viberti et al31, 2002 | Valsartán | DM2 con nefropatía incipiente | Reducción de la EUA |
| Barnett et al29, 2004 | Telmisartán frente a enalapril | DM2 con nefropatía incipiente y establecida | Retraso similar en la progresión de la nefropatía |
| Mogensen et al34, 2000 | Candesartán+lisinopril | DM2 con nefropatía incipiente | Reducción adicional de la microalbuminuria |
| Jacobsen et al35, 2003 | Benazepril+losartán | DM1 con nefropatía establecida | Reducción adicional de la proteinuria |
| Rossing et al36, 2003 | Candesartán+IECA | DM2 con nefropatía establecida | Reducción adicional de la proteinuria |
| Song et al37, 2006 | Ramipril+candesartán | DM2 con nefropatía establecida | Reducción adicional de la proteinuria y TGFβ1 |
ARA-II: antagonistas de los receptores tipo 1 de la angiotensina II; DM: diabetes mellitus; EUA: excreción urinaria de albúmina; IECA: inhibidores de la enzima de conversión de angiotensina; IRC: insuficiencia renal crónica; IRCT: insuficiencia renal crónica terminal; TGFβ: factor beta de crecimiento transformador.
Diabetes mellitus tipo 2. Estudios más importantes de prevención de la nefropatía en sus diferentes fases evolutivas. IRCT: insuficiencia renal crónica terminal. EUA: excreción urinaria de albúmina expresada en mg/g de creatinina en una muestra aislada. BENEDICT28: The Bergamo Nephrologic Diabetes Complication Trial); IRMA 230: The Irbesartan in Patients with Type 2 Diabetes and Microalbuminuria); MARVAL31: Microalbuminuria Reduction with Valsartan study; DETAIL29: Diabetics Exposed Telmisartan and Enalapril Study Group; RENAAL10: The Reduction in End Points in NIDDM with the Angiotensin II Antagonist Losartan; IDNT2: Irbesartan Diabetic Nephropathy Trial; AMADEO33: Study compAred telMisartan (80mg) vs losArtan (100mg) in hypertensive type-2 DiabEtic patients with Overt nephropathy.
La combinación de ARA-II con IECA en nefropatía diabética ha sido poco estudiada. En ensayos con escaso número de pacientes y tiempos de seguimiento cortos, se ha comprobado que produce una reducción adicional del grado de proteinuria34-37. En la tabla 4 se describen las indicaciones de los bloqueadores del SRA en pacientes con HTA y diabetes1,38.
Indicaciones de IECA y ARA-II en pacientes diabéticos con hipertensión o nefropatía
| Objetivo: reducción de la PA a menos de 130/80mmHg y la proteinuria a menos de 0,5g/24h. En nefropatía incipiente, hay que disminuir el grado de microalbuminuria o pasar a normoalbuminuriaLa terapéutica antihipertensiva podría iniciarse en todos los casos con un IECA o un ARA-II. Los ARA-II serán la alternativa a los IECA (o viceversa) si hay intolerancia a uno de ellosEn la mayoría de los casos serán necesarias las combinaciones terapéuticas. El segundo escalón puede ser un diurético tiacídico o un diurético de asa si el filtrado glomerular estimado es<50ml/min/1,73m2. En el tercer escalón terapéutico, la adición de un antagonista del calcio puede ser más efectiva para reducir la PA. La combinación IECA+ARA-II tiene mayor efecto antiproteinúricoEn pacientes con diabetes mellitus tipo 1 y nefropatía establecida, los IECA retrasan la progresión de la insuficiencia renalEn pacientes con diabetes mellitus tipo 2 e hipertensión y normoalbuminuria, los IECA disminuyen la progresión a microalbuminuriaEn diabéticos tipo 2 con hipertensión y microalbuminuria (nefropatía incipiente), tanto los IECA como los ARA-II retrasan la progresión a macroalbuminuriaEn diabéticos tipo 2 con macroalbuminuria, hipertensión e insuficiencia renal (nefropatía establecida), los ARA-II difieren la progresión a insuficiencia renal terminalEl balance beneficio/riesgo de la combinación IECA+ARA-II ha sido poco estudiado en diabéticos |
ARA-II: antagonistas de los receptores tipo 1 de la angiotensina II; IECA: inhibidores de la enzima de conversión de angiotensina; PA: presión arterial.
Este concepto incluye diferentes tipos de nefropatía. La más frecuente es la nefropatía vascular, que comprende sobre todo a los pacientes con nefrosclerosis y ocasionalmente a aquellos con nefropatía isquémica. El término nefrosclerosis se aplica a la enfermedad renal que complica la HTA esencial. Hay algunas dudas sobre el efecto del aumento de la PA en la instauración de la lesión renal, pero muy pocas sobre su papel fundamental en la progresión de la insuficiencia renal una vez establecida. Pese a su enorme carga epidemiológica (tras la diabetes, es la principal causa de enfermedad renal terminal), la nefrosclerosis tiene una exigua representación en la literatura médica39. Los otros tipos de nefropatía no diabética, por orden de frecuencia, son las glomerulares (primitivas o secundarias), las túbulo-intersticiales y las enfermedades quísticas hereditarias.
El seguimiento a largo plazo del estudio MDRD (Modification Diet and Renal Disease) puso de manifiesto que la evolución a la enfermedad renal en fase terminal fue menos prevalente en los pacientes con una PA<120/80mmHg que los que tuvieron una PA<140/90mmHg. El beneficio para PA más bajas se vio sobre todo en pacientes con proteinuria>1g/24h40. Sin embargo, en otros ensayos de pacientes con nefropatía no diabética la asignación aleatoria a esos objetivos no se asoció a una menor progresión de la ERC41,42.
Los estudios de intervención terapéutica sobre las propiedades nefroprotectoras de los agentes antihipertensivos han sido muy numerosos. La mayoría se han llevado a cabo con IECA y algunos con ARA-II41,43-51 (tabla 5). Ambos han demostrado su capacidad para reducir la proteinuria y diferir el ritmo de progresión de la IRC. Distintos metaanálisis han confirmado la superioridad de los IECA frente a placebo u otros fármacos no bloqueadores del SRA. En el estudio de Jafar et al3 se analizó el efecto del tratamiento con IECA en 1.860 pacientes con nefropatía no diabética. Tras un segui miento de 2,2 años, los IECA disminuyeron en un 31% el riesgo relativo de desarrollar una IRC terminal. Sin embargo, al final del seguimiento hubo una mayor reducción de la PA (4,5/2,3mmHg) en el grupo adscrito a IECA. Posteriores exámenes de ese mismo estudio han revelado que el nivel óptimo de nefroprotección se obtiene con valores de PA sistólica entre 110 y 130mmHg y que la renoprotección con los IECA no es significativa cuando la proteinuria es<0,5g/24h52,53.
Principales estudios con IECA, ARA-II y su combinación en pacientes con nefropatía no diabética
| Autor y ano | Fármacos | Resultados |
| Hannedouche et al43, 1994 | Enalapril frente a bloqueadores beta | Mejor supervivencia renal con enalapril |
| Maschio et al44, 1996. Estudio AIPRI | Benazepril frente a placebo | Retraso en el ritmo de progresión de la IRC |
| GISEN Group45, 1997. Estudio REIN | Ramipril frente a placebo | Retraso en la progresión de la IRC |
| Agodoa et al41, 2001. Estudio AASK | Ramipril frente a amlodipino frente a metoprolol | Retraso en la progresión a IRC con ramipril en pacientes con proteinuria>0,3g/24h |
| Marín et al46 , 2001. Estudio ESPIRAL | Fosinopril frente a amlodipino | Mejor supervivencia renal con fosinopril |
| Hou et al47, 2006 | Benazepril frente a placebo | Reducción del riesgo de alcanzar la IRC terminal |
| Praga et al48, 2003. Estudio GLOMERULAAR | Losartán frente a amlodipino | Reducción de la proteinuria |
| Schmieder et al59, 2005 | Candesartán en dosis muy altas frente a las habituales | Reducción adicional de la proteinuria con dosis altas |
| Aranda et al60, 2005 | Telmisartán, dosis muy altas frente a las habituales | Reducción adicional de la proteinuria con dosis altas |
| Ruilope et al49, 2 0 0 0 | Valsartán+benazepril | Reducción adicional de la proteinuria con la combinación |
| Luño et al50, 2002 | Lisinopril+candesartán | Reducción adicional de la proteinuria con la combinación |
| Nakao et al51, 2003. Estudio COOPERATE | Losartán+trandolapril | Retraso en la progresión de la IRC con la combinación |
ARA-II: antagonistas de los receptores tipo 1 de la angiotensina II; IECA: inhibidores de la enzima de conversión de angiotensina; IRC: insuficiencia renal crónica.
Los estudios combinando un ARA-II y un IECA han demostrado descensos de la proteinuria de magnitud superior a la monoterapia y, además, en el estudio COOPERATE, un enlentecimiento en el ritmo de progresión de la insuficiencia renal48-51. Excepto en ese estudio51, la reducción de la PA obtenida con la monoterapia fue sensiblemente inferior, lo que pone en tela de juicio que la efectividad antiproteinúrica del bloqueo dual sea independiente del mejor control de la PA. Además, en dos metaanálisis recientes se verificó que en los pacientes tratados con la combinación se produjo una tasa de interrupción del tratamiento más alta que con la monoterapia54,55. Las causas más importantes fueron la hiperpotasemia y el deterioro agudo de la función renal. Aunque este efecto negativo no ha sido descrito en otros trabajos, se llama la atención sobre la necesidad de realizar nuevos estudios con diseño específico para delimitar riesgos y beneficios de la combinación terapéutica56. En este sentido, los recientes resultados del estudio ONTARGET han demostrado que el bloqueo dual (ramipril y telmisartán) produjo una proporción de alteraciones renales más alta que el ramipril (riesgo relativo [RR]=1,33; intervalo de confianza [IC] del 95%, 1,22-1,44; p<0,001), sobre todo a expensas del mayor número de casos con hiperpotasemia23.
No todos los estudios van en la misma dirección. Los resultados de un metaanálisis reciente ofrecen algún margen de duda sobre si la efectividad del bloqueo del SRA es independiente del grado de control de la PA57. En el trabajo se incluyeron estudios muy heterogéneos tanto en la etiología de la enfermedad renal como en el grado de insuficiencia renal (creatinina sérica entre 0,76 y 4,4mg/dl) y de albuminuria (de 7,2 a 3.100mg/24h). También en el tamaño muestral o en el tiempo de seguimiento. Es probable que el análisis conjunto de grados de enfermedad renal tan diferentes pueda ocasionar sesgos de alguna importancia, como se hizo patente en el acalorado debate que siguió a su publicación58.
En los últimos años, algunos estudios con corto número de pacientes han demostrado que dosis de ARA-II más altas de las utilizadas para el control de la HTA consiguen reducciones adicionales de la proteinuria con una buena tolerabilidad59,60. Para mejorar el nivel de evidencia en este campo, será necesario incrementar el número y la calidad de las investigaciones.
Las recomendaciones sobre la prescripción de bloqueadores del SRA en nefropatía no diabética son similares a las descritas en nefropatía diabética (tabla 4).
BENEFICIOS Y RIESGOS ASOCIADOS AL BLOQUEO DEL SISTEMA RENINAANGIOTENSINA EN LA ERCEl efecto antiproteinúrico, adicional al efecto antihipertensivo, convierte a los bloqueadores del SRA en fármacos de prescripción obligada en pacientes con ERC. Ningún otro agente antihipertensivo tiene un efecto antiproteinúrico bien demostrado. Aunque sea una variable intermedia, la proteinuria es, tras el control de la PA, el marcador de riesgo más importante en la progresión de la enfermedad renal. Otros dos hechos justifican su lugar preeminente en este tipo de pacientes. Primero, que la microalbuminuria y la proteinuria son también marcadores independientes de riesgo cardiovascular2,10,19, y segundo, que los IECA y los ARA-II han mostrado un beneficio añadido en pacientes con alto riesgo cardiovascular14,21. En las guías publicadas en los últimos años se reconoce que, en pacientes con nefropatía diabética y no diabética, el tratamiento con un agente bloqueador del SRA debe ocupar el primer escalón terapéutico1,38,61,62. Algunas revisiones recientes han puesto un gran énfasis en la necesidad de que todos los pacientes con ERC incluyan en su terapéutica este tipo de fármacos63. En nuestro país la prescripción de IECA y ARA-II en pacientes con enfermedad renal diabética o no diabética alcanza el 76% de los casos64.
El bloqueo del SRA en pacientes con función renal normal no suele acompañarse de cambios en los valores plasmáticos de creatinina. En enfermos con insuficiencia renal puede observarse un aumento en dichos valores en las primeras 2 semanas del tratamiento. Tal elevación suele estabilizarse a las 4–8 semanas63,65. Si la creatinina plasmática se incrementa un valor>3035% sobre los basales, es necesario suspender el tratamiento y descartar situaciones de hipovolemia, estenosis de arteria renal bilateral o uso de antiinflamatorios no esteroideos (tabla 6).
Beneficios y riesgos de la prescripción de IECA y ARA-II en pacientes con nefropatía diabética y no diabética
| En pacientes con nefropatía diabética, en el primer escalón de la terapéutica debería incluirse un IECA o un ARA-IIEn pacientes con nefropatía no diabética, en el primer escalón de la terapéutica debería incluirse un IECA o un ARA-II siempre que la proteinuria sea 0,5g/24hTras el inicio del tratamiento, en los pacientes con creatinina sérica>1,2mg/dl en mujeres o>1,4mg/dl en varones (o filtrado glomerular estimado<45–60ml/min/1,73m2), debe solicitarse, transcurridas 1–2 semanas, determinaciones de creatinina y potasio séricos. También se debe solicitarlas con cada incremento de dosisSuspender la medicación si el potasio sérico es>5,6mEq/l. En pacientes con insuficiencia renal crónica y seguimiento muy estricto, puede incrementarse la dosis de diurético de asa y establecer el umbral en 6mEq/l63Se debe suspender la medicación si aumenta la cifra de creatinina un 30-35% sobre el valor basalSe debe suspender la medicación en situaciones de depleción de volumen (vómitos, diarrea, sepsis grave, etc.)Los efectos adversos de los IECA y los ARA-II (o de su combinación) son menos frecuentes en pacientes jóvenes con nefropatía glomerular o diabética y función renal normal. Son más frecuentes con la combinación terapéutica y, sobre todo, en caso de insuficiencia renal, diabetes o edad avanzada y en pacientes con aterosclerosis generalizada que pueden tener estenosis de arteria renal bilateral concomitanteEl uso concomitante de suplementos de potasio y diuréticos retenedores de potasio incrementa el riesgo de hiperpotasemia. La prescripción simultánea con antiinflamatorios no esteroideos o inhibidores de la COX-2 aumenta el riesgo de deterioro de la función renal y de hiperpotasemia |
ARA-II: antagonistas de los receptores tipo 1 de la angiotensina II; IECA: inhibidores de la enzima de conversión de angiotensina; COX: ciclooxigenasa.
La incidencia de hiperpotasemia en pacientes con función renal conservada oscila entre el 0,1 y el 6%, pero en los casos con ERC avanzada puede oscilar entre el 5 y el 50%. Las situaciones de depleción de volumen y el uso de diuréticos ahorradores de potasio y de antiinflamatorios no esteroideos incrementan el riesgo de hiperpotasemia, sobre todo en los ancianos. La combinación de IECA y ARA-II incrementa el riesgo de hiperpotasemia23,54,55, aunque no todos los estudios llegan a esa conclusión56. El seguimiento de algunas recomendaciones sencillas puede evitar la mayoría de los efectos adversos (tabla 6).
CONCLUSIONESEl bloqueo del SRA con IECA y/o ARA-II permite añadir a su efecto reductor de la PA una capacidad antiproteinúrica que no poseen los demás fármacos antihipertensivos. Además, el bloqueo del SRA disminuye la morbimortalidad cardiovascular en enfermos en alto riesgo, entre los que se incluyen los pacientes con ERC66. Los IECA y los ARA-II deben ocupar el primer escalón en el manejo terapéutico de los casos de nefropatía diabética y no diabética. Son necesarios más estudios para verificar si el efecto renoprotector de la combinación de IECA y ARA-II es más importante que la monoterapia a dosis adecuadas, y también si es independiente del grado de control de la PA. Asimismo necesitamos delimitar la tolerabilidad de esta combinación, pues al menos en pacientes con alto riesgo cardiovascular no parece recomendable23. En relación con el estudio ONTARGET23, la próxima publicación de los datos del 13% de pacientes con microalbuminuria basal permitirá ampliar la información sobre este problema.