No hay ninguna especialidad en la historia de la medicina que haya asistido a un crecimiento y una innovación tan rápidos como la cardiología intervencionista, como consecuencia de combinarse la necesidad imperiosa de obtener mejores resultados en el tratamiento de la enfermedad coronaria (EC), la primera causa de muerte en todo el mundo, y la personalidad única de algunas personas notables que han impulsado su progreso.
Desde su primera aplicación en la ateroesclerosis periférica en 1963 y la primera angioplastia coronaria en 1977, el campo de la cardiología intervencionista ha evolucionado y se ha ampliado enormemente, de tal manera que en la práctica clínica contemporánea la angioplastia coronaria transluminal percutánea es una de las intervenciones que se realizan con más frecuencia. En este editorial se presenta una visión general del desarrollo de los stents coronarios desde su introducción a finales de la década de los ochenta, haciendo especial hincapié en los stents y los armazones bioabsorbibles actualmente disponibles.
¿POR QUÉ NO BASTA LA ANGIOPLASTIA SIMPLE CON BALÓN?En 1963, Dotter y su discípulo, Judkins, «recanalizaron» accidentalmente una arteria iliaca ocluida mientras realizaban una aortografía abdominal. Un año después, esta vez intencionadamente, usaron un catéter para realizar con éxito la primera angioplastia periférica transluminal percutánea. Más de una década después, en 1977, Gruentzig llevó a cabo la primera angioplastia coronaria transluminal percutánea con balón (o angioplastia con balón antiguo simple [ABAS], como posteriormente se denominó) en un varón sin sedación, con lo que se inició una verdadera revolución en el tratamiento de la EC.
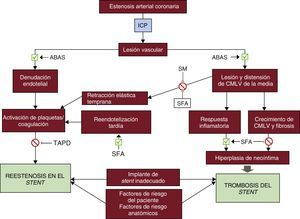
La ABAS puede alcanzar transitoriamente mayor diámetro luminal mediante la extrusión de la placa, pero la retracción elástica oblitera rápidamente esta ganancia. Pueden obtenerse cambios plásticos, más duraderos, con la disección de la placa, pero este mecanismo implica posibles riesgos de oclusión aguda del vaso. La posibilidad de una oclusión brusca obligó a los pioneros de la angioplastia coronaria a disponer de un equipo quirúrgico activado durante la realización de esas intervenciones. La denudación de la íntima inducida por el balón y el desgarro de la media exponían la matriz subendotelial al flujo sanguineo, lo cual fomentaba la agregación plaquetaria y la trombosis en la fase aguda y un remodelado vascular negativo crónico (retracción tardía), así como una hiperplasia de la neoíntima. La ganancia inicial insuficiente y la reestenosis llevaban a la pérdida casi completa del beneficio clínico en un 30-40% de los pacientes en los primeros 6-9 meses (figura 1). Estas limitaciones requerían nuevos avances tecnológicos, avances que culminaron con el desarrollo de los stents arteriales coronarios.
Fisiopatología de la reestenosis en el stent y de la trombosis del stent. La dilatación del vaso afectado mediante un ABAS causa una lesión mecánica en la pared vascular y las consecuentes denudación endotelial, lesión mecánica de la pared vascular con respuesta inflamatoria y fibrosis/hiperplasia de neoíntima, que son los principales mecanismos de la reestenosis en el stent y la trombosis del stent aguda o tardía. Los SM y los SFA pueden prevenir algunos de estos procesos adversos, pero son también un estímulo para la inflamación y la fibrosis. La reestenosis en el stent y la trombosis del stent pueden estar determinadas también por factores de riesgo del paciente (es decir, diabetes, tabaquismo), características anatómicas del vaso tratado (como las lesiones con gran calcificación, el diámetro del vaso, la presencia de ramas colaterales) o un implante de stent inadecuado (grosor de los struts, mala aposición del stent, diámetro de stent inadecuado). ABAS: angioplastia con balón antiguo simple; CMLV: células de músculo liso vascular; ICP: intervención coronaria percutánea; SFA: stent farmacoactivo; SM: stent metálico; TAPD: tratamiento antiagregante plaquetario doble.
Los stents coronarios se desarrollaron para evitar la retracción arterial y la reestenosis después de una dilatación con balón. Se pueden clasificar en 3 grandes familias: stents metálicos (SM), stents farmacoactivos (SFA) y armazones vasculares bioabsorbibles (AB).
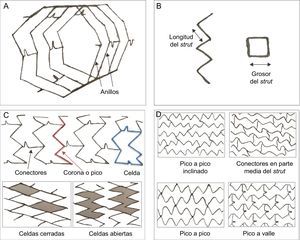
El SM ideal debería tener buenas flexibilidad y aplicabilidad, baja trombogenicidad, una fuerza radial intensa, buena radioopacidad en la fluoroscopia y buena biocompatibilidad, con objeto de asegurar unas tasas bajas de hiperplasia de la neoíntima y de trombosis del stent durante el seguimiento a largo plazo (figura 2). Las aleaciones de platino-cobalto, cobalto-cromo y otras han reemplazado en gran parte al acero inoxidable, pues ofrecen resistencia y visibilidad suficientes con struts más finos.
Estructura y diseño de los stents. A-C: la estructura básica de un stent está formada por struts (puntales), anillos, celdas, coronas y conectores; strut: elemento individual que forma las entidades estructurales mayores (celdas, anillos y coronaria); celda: pequeña estructura de un stent que se repite regularmente, delimitada por 2 capas de anillos y los conectores; puede ser abierta o cerrada; conectores: unen los anillos adyacentes y pueden ser rectos o curvos o pueden ser soldaduras que unen directamente los anillos; anillos y coronas: (1 corona = 2 struts) comprenden un grupo de celdas y se mantienen unidos por conectores. D: orientación del stent (en fase o fuera de fase) y conectores (pico a pico inclinados; parte media del eje; pico a pico fuera de fase; pico a valle en fase); el diseño y la geometría de esos componentes definen el funcionamiento mecánico de un stent: las coronas y los anillos determinan el sostén radial y la capacidad de expansión; el número de conectores determina la estabilidad longitudinal, la flexibilidad, la aplicabilidad, el acceso a las ramas laterales y la integridad longitudinal; el diseño de celdas abiertas con un reducido número de conectores proporciona mayor flexibilidad al stent, reduce la lesión arterial y disminuye la respuesta neointimal.
Un SFA tiene una estructura más compleja, en general con una cubierta de polímero que contiene un fármaco antiproliferativo alrededor de los struts del stent. El polímero puede ser duradero o bioabsorbible, y algunos stents recientes liberan el fármaco directamente. Un AB es una plataforma hecha de material bioabsorbible, magnesio o ácido poli-L-láctico (PLLA), recubierto de un polímero y un fármaco antiproliferativo.
STENTS METÁLICOSEn 1986, Puel y Sigwart establecieron otro hito en la historia de la ICP al implantar de manera independiente el primer stent coronario autoexpandible (Wallstent, Schneider AG; Bulach, Suiza). Al año siguiente, Palmaz y Schatz desarrollaron un stent expandible con balón (Palmaz-Schatz, Johnson & Johnson; New Brunswick, New Jersey, Estados Unidos), que se convirtió en el primer stent autorizado por la Food and Drug Administration (FDA) de Estados Unidos.
Los primeros stents se hicieron de acero inoxidable y, a pesar de sus struts gruesos y su poca flexibilidad, se evidenció su superioridad respecto a la ABAS, con eliminación de las complicaciones de oclusión brusca y reducción de la tasa de reestenosis que se confirmaron en 2 ensayos históricos publicados en 1993 (BENESTENT y STRESS1,2). Seguía habiendo un obstáculo para su adopción universal, la elevada incidencia de trombosis aguda y subaguda del stent, que obligaba a los médicos que los implantaban a utilizar dosis altas de fármacos anticoagulantes, lo cual implicaba unas tasas de hemorragia inaceptables. Este problema se superó al observarse con la ecografía intravascular que los stents requerían una presión elevada para su expansión completa y al introducirse el tratamiento antiagregante plaquetario combinado doble (TAPD), que combina ticlopidina o clopidogrel con ácido acetilsalicílico. Estos stents tenían todavía un riesgo significativo de reestenosis en el stent (RES), que era de un 15 a un 30% de las lesiones tratadas en un seguimiento a medio y largo plazo3.
STENTS FARMACOACTIVOSTras la identificación de que la hiperplasia de la neoíntima era el principal factor determinante de la RES, la respuesta lógica fue la aplicación de fármacos antiproliferativos. Posteriormente, además de actuar como un armazón vascular permanente, los stents evolucionaron rápidamente para pasar a ser plataformas eficientes de liberación local de fármacos. En 1999, Sousa implantó en Brasil el primer SFA, lo que inició el tercer cambio de paradigma revolucionario en la historia de la cardiología intervencionista.
Primera generación de stents farmacoactivosEl sirolimus y el paclitaxel fueron los 2 fármacos antiproliferativos utilizados inicialmente en los SFA de primera generación: respectivamente, CYPHER (Cordis, Milpitas, California, Estados Unidos) y TAXUS (Boston Scientific; Marlborough, Massachusetts, Estados Unidos). Ambos eran de acero inoxidable, tenían un grosor de los struts > 130 μm y se han evaluado en numerosos ensayos controlados y aleatorizados (ECA) (tabla 1)4, que han mostrado una reducción significativa de la RES, la pérdida de luz tardía y la tasa de revascularización de la lesión/vaso diana en comparación con los SM7,9,10. El entusiasmo inicial se vio alterado en 2006 cuando Camenzind publicó un metanálisis que indicaba un aumento del riesgo de muerte e infarto de miocardio (IM) relacionado con la trombosis del stent (TS) tardía y muy tardía11, relacionada posiblemente con un retraso de la endotelización secundario a la liberación del fármaco antiproliferativo y una reacción de hipersensibilidad contra el recubrimiento de polímero. La TS muy tardía, aunque actualmente se acepta que es una posible complicación de los SFA de primera generación, es una entidad muy poco frecuente, y numerosos metanálisis y registros han aportado datos tranquilizadores respecto al uso de estos dispositivos12.
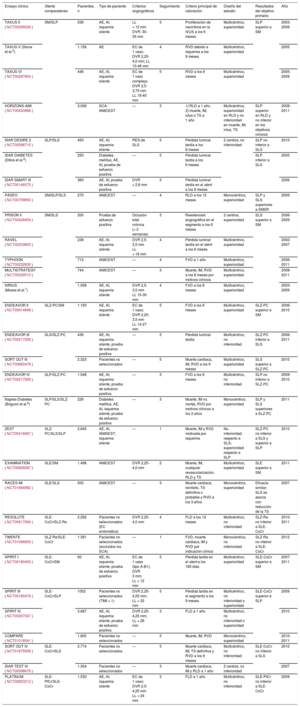
Principales ensayos controlados y aleatorizados que comparan los stents metálicos con la actual generación de stents metálicos liberadores de fármacos
| Ensayo clínico | Stents comparadores | Pacientes, n | Tipo de paciente | Criterios angiográficos | Seguimiento | Criterio principal de valoración | Diseño del estudio | Resultados del objetivo primario | Año |
|---|---|---|---|---|---|---|---|---|---|
| TAXUS II (NCT00299026) | SM/SLP | 536 | AE, AI, isquemia silente | LL < 12 mm DVR: 30-35 mm | 5 | Proliferación de neoíntima en la IVUS a los 6 meses | Multicéntrico, superioridad | SLP superior a SM | 2003-2009 |
| TAXUS V (Stone et al.5) | 1.156 | AE | EC de 1 vaso; DVR 2,25-4,0 mm; LL 10-46 mm | 4 | RVD debido a isquemia a los 9 meses | Multicéntrico, superioridad | 2005 | ||
| TAXUS VI (NCT00297804) | 446 | AE, AI, isquemia silente | EC de 1 vaso compleja; DVR 2,5-3,75 mm LL 18-40 mm | 5 | RVD a los 9 meses | Multicéntrico, superioridad | 2005-2009 | ||
| HORIZONS-AMI (NCT00433966) | 3.006 | SCA-IAMCEST | — | 3 | 1) RLD a 1 año; 2) muerte, IM, ictus o TS a 1 año | Multicéntrico, superioridad en RLD y no inferioridad en muerte, IM, ictus, TS | SLP superior en RLD y no inferior en los objetivos clínicos | 2009-2011 | |
| ISAR DESIRE 2 (NCT00598715) | SLP/SLS | 450 | AE, AI, isquemia silente | RES de SLS | 5 | Pérdida luminal tardía a los 8 meses | 2 centros, no inferioridad | SLP no inferior a SLS | 2010 |
| ISAR DIABETES (Dibra et al.6) | 250 | Diabetes mellitus, AE, AI, prueba de esfuerzo positiva | — | 5 | Pérdida luminal tardía a los 6 meses | SLP inferior a SLS | 2005 | ||
| ISAR SMART III (NCT00146575) | 360 | AE, AI, prueba de esfuerzo positiva | DVR < 2,8 mm | 5 | Pérdida luminal tardía en el stent a los 8 meses | 2006 | |||
| PASEO (NCT00759850) | SM/SLP/SLS | 270 | IAMCEST | — | 4 | RLD a los 12 meses | Monocéntrico, superioridad | SLP y SLS superiores a SMSR | 2009 |
| PRISON II (NCT00428454) | SM/SLS | 200 | Prueba de esfuerzo positiva | Oclusión total crónica (> 2 semanas) | 3 | Reestenosis angiográfica en el segmento a los 6 meses | 2 centros, superioridad | SLS superior a SM | 2006-2009 |
| RAVEL (NCT00233805) | 238 | AE, AI, isquemia silente | DVR 2,5-3,5 mm LL < 18 mm | 4 | Pérdida luminal tardía en el stent a los 6 meses | Multicéntrico, superioridad | 2002-2007 | ||
| TYPHOON (NCT00232830) | 712 | IAMCEST | — | 4 | FVD a 1 año | Multicéntrico, superioridad | 2006-2011 | ||
| MULTISTRATEGY (NCT00229515) | 744 | IAMCEST | — | 3 | Muerte, IM, RVD a los 8 meses por motivos clínicos | Multicéntrico, superioridad | 2008-2011 | ||
| SIRIUS (Moses et al.7) | 1.058 | AE, AI, isquemia silente | DVR 2,5-3,5 mm LL 15-30 mm | 4 | FVD a los 9 meses | Multicéntrico, superioridad | 2003-2009 | ||
| ENDEAVOR II (NCT00614848) | SLZ-PC/SM | 1.193 | AE, AI, isquemia silente | EC de 1 vaso; DVR 2,25-3,5 mm LL 14-27 mm | 5 | FVD a los 9 meses | Multicéntrico, superioridad | SLZ-PC superior a SM | 2006-2010 |
| ENDEAVOR III (NCT00217256) | SLS/SLZ-PC | 436 | AE, AI, isquemia silente, prueba de esfuerzo positiva | — | 5 | Pérdida luminal tardía | Multicéntrico, no inferioridad | SLZ-PC inferior a SLS | 2006-2011 |
| SORT OUT III (NCT00660478) | 2.323 | Pacientes no seleccionados | — | 5 | Muerte cardiaca, IM, RVD a los 9 meses | Multicéntrico, superioridad | SLS superior a SLZ-PC | 2010 | |
| ENDEAVOR IV (NCT00217269) | SLP/SLZ-PC | 1.548 | AE, AI, isquemia silente, prueba de esfuerzo positiva | — | 3 | FVD a los 9 meses | Multicéntrico, no inferioridad | SLP no inferior a SLZ-PC | 2009-2010 |
| Naples-Diabetes (Briguori et al.8) | SLP/SLS/SLZ-PC | 226 | Diabetes mellitus, AE, AI, isquemia silente, prueba de esfuerzo positiva | — | 3 | Muerte, IM no mortal, RVD por motivos clínicos a los 3 años | Monocéntrico, superioridad | SLP y SLS superiores a SLZ-PC | 2011 |
| ZEST (NCT00418067) | SLZ-PC/SLS/SLP | 2.645 | AE, AI, IAMSEST, isquemia silente | — | 1 | Muerte, IM y RVD motivada por isquemia | No inferioridad respecto a SLS; superioridad respecto a SLP | SLZ-PC no inferior a SLS y superior a SLP | 2010 |
| EXAMINATION (NCT00828087) | SLE/SM | 1.498 | IAMCEST | DVR 2,25-4,0 mm | 2 | Muerte, IM, cualquier revascularización, RLD y TS | Multicéntrico, superioridad | SLE superior a SM | 2011 |
| RACES MI (NCT01684982) | SLE/SLS | 500 | IAMCEST | — | 3 | Muerte cardiaca, reinfarto, TS definitiva o probable y RVD a los 3 años | Monocéntrico, superioridad | Eficacia similar; SLS se asocia con reducción de la TS | 2007 |
| RESOLUTE (NCT00617084) | SLE-CoCr/SLZ-Re | 2.292 | Pacientes no seleccionados (EC sintomática) | DVR 2,25-4,0 mm | 4 | FLD a los 12 meses | Multicéntrico, no inferioridad | SLZ-Re no inferior a SLE-CoCr | 2010-2011 |
| TWENTE (NCT01066650) | SLZ-Re/SLE-CoCr | 1.391 | Pacientes no seleccionados (excluidos los SCA) | — | 1 | FVD, muerte cardiaca, IM y RVD por indicación clínica | Monocéntrico, no inferioridad | SLZ-Re no inferior a SLE-CoCr | 2012 |
| SPIRIT I (NCT00180453) | SLE-CoCr/SM | 60 | AE, AI, isquemia silente, prueba de esfuerzo positiva | EC de 1 vaso (tipo A-B1); DVR 3 mm; LL < 12 mm | 5 | Pérdida tardía en el stent a los 180 días | Multicéntrico, superioridad | SLE-CoCr superior a SM | 2007-2011 |
| SPIRIT III (NCT00180479) | SLE-CoCr/SLP | 1002 | Pacientes no seleccionados (TIMI > 1) | DVR 2,25-4,25 mm; LL < 32 mm | 5 | Pérdida tardía en el segmento a los 9 meses | Multicéntrico, no inferioridad o superioridad | SLE-CoCr superior a SLP | 2009 |
| SPIRIT IV (NCT00307047) | 3.687 | AE, AI, isquemia silente, prueba de esfuerzo positiva | DVR 2,25-4,25 mm; LL < 28 mm | 3 | FLD a 1 año | Multicéntrico, no inferioridad o superioridad | 2010 | ||
| COMPARE (NCT01016041) | 1.800 | Pacientes no seleccionados | — | 5 | Muerte, IM, RVD | Monocéntrico, superioridad | 2010-2011 | ||
| SORT OUT IV (NCT01879358) | SLE-CoCr/SLS | 2.774 | Pacientes no seleccionados | — | 5 | Muerte cardiaca, IM, TS definitiva y RVD a los 9 meses | Multicéntrico, no inferioridad | SLE-CoCr no inferior a SLS | 2010 |
| ISAR TEST IV (NCT00598676) | 1.304 | Pacientes no seleccionados | — | 3 | Muerte cardiaca, IM y RLD a 1 año | 2 centros, no inferioridad | 2007 | ||
| PLATINUM (NCT00823212) | SLE-PtCr/SLE-CoCr | 1.530 | AE, AI, isquemia silente | EC de 1 vaso; DVR 2,5-4,25 mm LL < 24 mm | 3 | FLD a 1 año | Multicéntrico, no inferioridad | SLE-PtCr no inferior a SLE-CoCr | 2009 |
AE: angina estable; AI: angina inestable; DVR: diámetro del vaso de referencia; EC: enfermedad coronaria; FLD: fallo de la lesión diana definido como muerte cardiaca, IM del vaso diana o RLD; FVD: fallo del vaso diana definido como muerte cardiaca, IM del vaso diana o RVD; IAMCEST: infarto agudo de miocardio con elevación del segmento ST; IAMSEST: infarto agudo de miocardio sin elevación del ST; IM: infarto de miocardio; IVUS: ecografía intravascular; LL: longitud de la lesión; RES: reestenosis en el stent; RLD: revascularización de la lesión diana; RVD: revascularización del vaso diana; SCA: síndrome coronario agudo; SLE: stent liberador de everolimus; SLE-CoCr: stent de cobalto-cromo liberador de everolimus; SLE-PtCr: stent de platino-cromo liberador de everolimus; SLP: stent liberador de paclitaxel; SLS: stent liberador de sirolimus; SLZ: stent liberador de zotarolimus; SLZ-PC: stent liberador de zotarolimus basado en fosforilcolina; SLZ-Re: stent liberador de zotarolimus Resolute; SM: stent metálico; TIMI: Thrombolysis In Myocardial Infarction; TS: trombosis del stent.
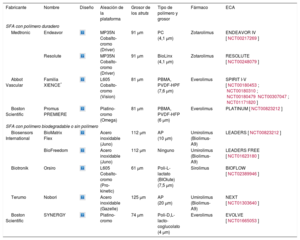
En los SFA de segunda generación, la plataforma se sustituyó por aleaciones metálicas (es decir, cobalto-cromo o platino-cromo), lo que permitió una reducción del grosor de los struts y una mayor flexibilidad (tabla 2). Los polímeros se hicieron de nuevas moléculas más biocompatibles, como zotarolimus, everolimus y novolimus (los fármacos de la familia limus), con una liberación del fármaco más rápida y, por lo tanto, una cobertura endotelial más temprana.
Actuales stents farmacoactivos de segunda generación con polímero duradero, con polímero biodegradable y sin polímero
| Fabricante | Nombre | Diseño | Aleación de la plataforma | Grosor de los struts | Tipo de polímero y grosor | Fármaco | ECA |
|---|---|---|---|---|---|---|---|
| SFA con polímero duradero | |||||||
| Medtronic | Endeavor | MP35N Cobalto-cromo (Driver) | 91 μm | PC (4,1 μm) | Zotarolimus | ENDEAVOR IV [NCT00217269] | |
| Resolute | MP35N Cobalto-cromo (Driver) | 91 μm | BioLinx (4,1 μm) | Zotarolimus | RESOLUTE [NCT00248079] | ||
| Abbot Vascular | Familia XIENCE* | L605 Cobalto-cromo (Vision) | 81 μm | PBMA, PVDF-HPF (7,6 μm) | Everolimus | SPIRIT I-V [NCT00180453; NCT00180310; NCT00180479NCT00307047; NCT01171820] | |
| Boston Scientific | Promus PREMIERE | Platino-cromo (Omega) | 81 μm | PBMA, PVDF-HFP (6 μm) | Everolimus | PLATINUM [NCT00823212] | |
| SFA con polímero biodegradable o sin polímero | |||||||
| Biosensors International | BioMatrix Flex | Acero inoxidable (Juno) | 112 μm | AP (10 μm) | Umirolimus (Biolimus-A9) | LEADERS [NCT00823212] | |
| BioFreedom | Acero inoxidable (Juno) | 112 μm | Ninguno | Umirolimus (Biolimus-A9) | LEADERS FREE [NCT01623180] | ||
| Biotronik | Orsiro | L605 Cobalto-cromo (Pro-kinetic) | 61 μm | Poli-L-lactato (BIOlute) (7,5 μm) | Sirolimus | BIOFLOW [NCT02389946] | |
| Terumo | Nobori | Acero inoxidable (Gazelle) | 125 μm | AP (20 μm) | Umirolimus (Biolimus-A9) | NEXT [NCT01303640] | |
| Boston Scientific | SYNERGY | Platino-cromo | 74 μm | Poli-D,L-lacto-coglucolato (4 μm) | Everolimus | EVOLVE [NCT01665053] | |
AP: ácido poliláctico; BIOlute: poli-L-lactato bioabsorbible liberadora de un fármaco limus; ECA: ensayo controlado y aleatorizado; HFP: hexafluoropropileno; L605: cobalto-cromo-tungsteno-níquel; MP35N: níquel, cobalto, cromo y molibdeno; PBMA: poli-(n-butilmetacrilato); PC: fosforilcolina; PVDF: fluoruro de polivinilideno.
La seguridad y la eficacia de los SFA de segunda generación se han evaluado en numerosos ECA, que han mostrado reducciones significativas de las tasas de IM, revascularización de la lesión diana y TS en comparación con los SFA de primera generación13–15. Como consecuencia de estos avances clínicos, los SFA de segunda generación han pasado a ser los más ampliamente utilizados en todo el mundo, y actualmente se acepta su uso como tratamiento percutáneo de elección para la EC, tras haber sustituido por completo a los SM y los SFA de primera generación (tabla 1)16. Sin embargo, a pesar de los importantes perfeccionamientos técnicos, sigue habiendo motivos de preocupación respecto a su seguridad a largo plazo. La TS tardía y muy tardía se redujo, con una incidencia inferior al 1% a 5 años, lo cual es inferior a la que se producía con los SM, pero continúa siendo motivo de preocupación, dado que conlleva la necesidad de TAPD durante 1 año e incluso más17,18. La persistencia de eventos tardíos y el intento de reducir al mínimo la duración y la intensidad del TAPD han impulsado el desarrollo de los dispositivos de tercera generación.
Stents farmacoactivos sin polímeroLa cubierta de polímero interviene en la patogenia del fallo del stent a largo plazo, al desencadenar un posible estímulo inflamatorio crónico causante de un retraso en el recubrimiento endotelial y TS. Así pues, se ha desarrollado una nueva estrategia para eliminar las complicaciones que se producen como consecuencia del polímero que ha conducido a los SFA sin polímero, que teóricamente pueden evitar estos efectos negativos a largo plazo, con lo que se reduce la tasa de TS y permite un TAPD más breve.
Sin embargo, dado que el polímero no solo actúa como portador del fármaco, sino que también modula su liberación, el desarrollo de los SFA sin polímero requería una nueva tecnología para mantener sin un vehículo de polímero la suficiente concentración del fármaco antiproliferativo con el paso del tiempo (tabla 2).
Por consiguiente, se modificó la superficie metálica del stent para que fuera porosa (poros de 5-15 nm) y se cargó el fármaco antiproliferativo directamente en esos poros durante el proceso de fabricación del SFA. Sin embargo, la liberación del fármaco era difícil de controlar y en algunos ECA pequeños, aunque se demostró la no inferioridad, no se documentó una mejora de los resultados clínicos en comparación con los SFA de segunda generación19. El fármaco puede transportarse también por nanopartículas en un compuesto de matriz, lo que puede facilitar la penetración más profunda del fármaco en las paredes vasculares en las que se produce una elución rápida (stent Cre8, CID Vascular; Saluggia, VC, Italia; y BioFreedom, Biosensors; Morges, Suiza) o puede aplicarse en microgotas mediante cristalización (VESTAsync, MIV therapeutics, Vancouver, Canadá). Hasta la fecha hay pocos ECA que hayan evaluado el rendimiento de los SFA sin polímero y serán necesarios ensayos más grandes sobre la eficacia y la seguridad a largo plazo. Otros stents de tercera generación parecen alcanzar el mismo objetivo con pequeñas manchas de polímero biodegradable en la superficie abluminal del stent (SYNERGY, Boston Scientific; Minneapolis, Minnesota, Estados Unidos).
Stents de polímero biodegradableLos SFA recubiertos de polímeros biodegradables (como PLLA) pueden aportar las ventajas de un SFA convencional en la fase inicial y comportarse como un SM en fases posteriores.
La degradación del polímero bioabsorbible se produce simultáneamente a la liberación controlada del fármaco antiproliferativo en la fase inicial tras el implante. Tras la liberación completa del fármaco y la biodegradación del polímero, en la arteria coronaria solo queda la plataforma metálica (tabla 2). Actualmente se usan varios polímeros bioabsorbibles que difieren en su biocompatibilidad, el tiempo de degradación y su distinta repercusión en la función endotelial, el crecimiento de las células de músculo liso y la trombogenicidad20,21.
A pesar de las ventajas teóricas y de los resultados iniciales alentadores, que muestran menores tasas de TS muy tardía que los SFA de primera generación y no inferioridad en eficacia y seguridad en comparación con los SFA de segunda generación, son necesarios resultados a largo plazo22,23.
Armazones totalmente bioabsorbiblesLa preocupación existente sobre los eventos adversos tardíos relacionados con la persistencia de las plataformas metálicas en el vaso coronario ha generado durante la última década cierto interés por la tecnología de stents totalmente bioabsorbibles, y es posible que esto constituya la cuarta revolución en la cardiología intervencionista. El fundamento que subyace a su uso consiste en crear un sostén mecánico transitorio en el vaso sanguíneo, con objeto de evitar la reestenosis inmediata y la retracción vascular, y permitir luego que se degrade con el paso del tiempo, con lo que se elimina el riesgo a largo plazo asociado con la presencia de un armazón metálico.
Estos dispositivos, denominados AB, aportan la liberación local del fármaco y el soporte mecánico de un SFA metálico permanente durante los primeros 12 meses y luego se reabsorben por completo al cabo de 24-36 meses, lo cual permite el restablecimiento de un diámetro luminal y una función vasomotora normales a lo largo de los años; de esta forma se elimina posibles fuentes de eventos adversos tardíos, con lo que podría reducirse la necesidad de un TAPD a largo plazo y podría realizarse una revascularización quirúrgica si fuera necesario.
Los AB pueden ser de una aleación metálica (aleación de magnesio o hierro) o una plataforma polimérica de un L-isómero de PLLA, cubierta por un polímero y un fármaco antiproliferativo. El primer AB farmacoactivo se implantó en 1995 y desde entonces se han estudiado aproximadamente 9 AB en ensayos clínicos (primer uso en el ser humano o ECA), pero la FDA o la CE han autorizado el uso solo de algunos, y el dispositivo con el que hay más experiencia y más larga (BVS ABSORB, ABSORB, Abbott; Minneapolis, Minnesota, Estados Unidos) ha sido retirado del mercado.
Cuando se realiza una angioplastia con un AB, la técnica utilizada para el implante, la elección de las lesiones y los pacientes apropiados, la técnica de predilatación y posdilatación y la elección de un TAPD individualizado se consideran cruciales para reducir la incidencia de TS24.
A pesar del optimismo inicial, continúan existiendo retos importantes para los AB de PLLA de primera generación. La fuerza radial de un AB es más débil que la de un SFA, por lo que la retracción puede ser un problema a causa de la rápida absorción. Para superar este problema, el diseño del stent requiere struts gruesos para mantener la fuerza radial, y esto podría conducir a una expansión incompleta y una reducción del diámetro de la luz tras el despliegue25. Los SM bioabsorbibles son cada vez más atractivos, puesto que tienen la posibilidad de superar la limitación de los stents de polímero biodegradable, con mayor fuerza radial y unos struts menos gruesos26.
La generación actual de AB de PLLA ha mostrado al año unas tasas de trombosis del dispositivo y de IM superiores. Estos datos se han confirmado en metanálisis y registros clínicos27 y corresponden principalmente al Absorb BVS, que hasta el momento es el armazón más utilizado y el único que dispone de la marca CE y la aprobación de la FDA. Dada la mayor incidencia de TS observada con el Absorb, Abbott ha limitado recientemente su uso a ensayos clínicos controlados o registros. Todavía queda mucho camino por recorrer antes de que los AB puedan utilizarse sistemáticamente en la práctica clínica.
¿LOS STENTS METÁLICOS AÚN MERECEN ESTAR EN EL LABORATORIO DE CATETERISMO?Los SFA aportan una clara ventaja respecto a los SM en cuanto a reestenosis. Los ECA y registros han coincidido en mostrar superioridad de los SFA de segunda generación respecto a los SMen cuanto a reestenosis clínica y angiográfica (tabla 1), con una reducción de las tasas de nueva revascularización y de eventos de TS, pero con unos resultados clínicos comparables (en muerte e IM espontáneo), según se ha observado recientemente en el ensayo NORSTENT28. A pesar de esta clara ventaja, la seguridad a largo plazo de los SFA depende de un TAPD de larga duración, lo que hace que los SM sean más atractivos en determinados contextos clínicos en que el paciente no puede completar el periodo recomendado de TAPD debido a la falta de adherencia, la necesidad de una intervención quirúrgica no cardiaca en el plazo de 1 año tras la ICP o un aumento del riesgo de hemorragia. En estas situaciones clínicas, el pequeño beneficio previsto con la reducción de las reestenosis puede quedar contrarrestado por la necesidad de mantener el tratamiento antiagregante plaquetario.
Debe resaltarse que el uso de un SM requiere una cuidadosa selección de los pacientes excluyendo determinadas características anatómicas coronarias (lesiones en bifurcación que requieran una estrategia de 2 stents, lesiones largas, afección de la coronaria principal izquierda o diámetro vascular pequeño, < 3 mm) y determinadas situaciones clínicas (tratamiento de oclusión total, oclusión de injerto de vena safena, IM con elevación del segmento ST) en las que se desaconseja el uso de SM28,29.
La reciente disponibilidad de los SFA sin polímeros en algunos países ha reducido aún más el ámbito en que puede ser necesario el uso de un SM. Los SM con una delgada capa (o manchas aisladas) de polímero abluminal biodegradable pueden ser una alternativa más segura.
CONCLUSIONES Y PERSPECTIVAS FUTURASNo podíamos haber previsto las repercusiones de nuestro trabajo hace tantos años. Los implantes de stents en arterias coronarias son el tratamiento de elección para la EC. Con la aparición de los stents, se ha resuelto la contribución mecánica a la reestenosis y la retracción aguda, lo cual hace que la cirugía de bypass de urgencia sea cosa del pasado. Hay un gran conjunto de evidencia que muestra una mejora significativa de la seguridad y la eficacia de los stents coronarios con la evolución de los dispositivos, y ello ha hecho que los SFA de segunda generación sean el tratamiento de elección para los pacientes que requieren una angioplastia coronaria. Los SM, que han dominado durante 15 años nuestros laboratorios de cateterismo, continúan siendo una opción para pacientes seleccionados, en especial los que no pueden completar el periodo de TAPD recomendado.
Actualmente el reto está en desarrollar la combinación adecuada de fármacos, plataformas y recubrimientos que permita eliminar por completo, y no solo reducir, las trombosis y las reestenosis.
CONFLICTO DE INTERESESNo se declara ninguno.
.