Palabras clave
INTRODUCCIÓN
La miocardiopatía hipertrófica (MCH) es un trastorno genético caracterizado por un ventrículo izquierdo (VI) hipertrófico, no dilatado y con regiones de desorganización de las fibras miocárdicas. La MCH se identifica normalmente por un aumento del grosor de la pared del VI, que generalmente se cuantifica mediante ecocardiografía o resonancia magnética (RM). La distribución de la hipertrofia puede adoptar diversas formas y varía enormemente de un paciente a otro, aunque por lo general es más prominente en el tabique interventricular. Además, el valor absoluto del grosor de la pared puede presentar también diferencias importantes: mientras que el grosor normal del VI es de 12 mm o menos, en la MCH suele ser de 15 mm o más (y puede alcanzar en casos extremos más de 30 mm). Sin embargo, se sabe que incluso personas con una mutación genética de la MCH pueden tener un espesor de la pared miocárdica normal1.
Por otra parte, el engrosamiento excesivo del músculo cardiaco puede darse ocasionalmente como parte de otras enfermedades, como los trastornos mitocondriales o la enfermedad de Fabry1.
Además de la MCH, otros casos en los que se produce un aumento del espesor parietal del VI (es decir, una hipertrofia) son la hipertrofia ventricular izquierda hipertensiva (HVI-HT) y el corazón de atleta (remodelado fisiológico). Todas estas formas pueden manifestarse en forma de fenotipos de hipertrofia cardiaca que pueden confundir el diagnóstico con la ecocardiografía convencional2,3. Recientemente se ha introducido el uso de las velocidades miocárdicas a través del Doppler tisular y del análisis de la deformación para diferenciar la MCH de otras formas de hipertrofia ventricular izquierda4-6.
En la MCH, aun cuando la función ventricular general parezca normal, la función miocárdica regional y el movimiento en el eje largo presentan un deterioro significativo. Todos los estudios de cuantificación de la deformación en la MCH han llegado a la conclusión de que la deformación regional está reducida globalmente en comparación con la de los sujetos normales7-9. Tradicionalmente, con el empleo de imágenes de strain de RM marcada o ecografía, se calculan los strains generales o regionales promediados en toda la población. Sin embargo, se ha señalado que la MCH (a diferencia de la HVI-HT o el corazón de atleta) se asocia a regiones de ausencia o reducción intensa de la deformación, mientras que otros segmentos muestran strains normales5. Esto da lugar a una reducción general al calcular el strain promediado. Con objeto de conservar la información diagnóstica aportada por la falta de homogeneidad de la amplitud y la localización espacial de la deformación regional en la MCH, proponemos calcular la distribución de los valores de strain en todo el VI, obtenidos con la RM marcada. Con la comparación de las distribuciones de ventrículos patológicos y normales es posible identificar con facilidad tanto una reducción general de la deformación como la presencia de segmentos con un strain anormal.
El objetivo del presente estudio es caracterizar, a partir de secuencias de RM marcada y un algoritmo de registro no rígido, la deformación sistólica regional en la MCH y compararla con otras formas de HVI como la HVI-HT y el corazón de atleta.
MÉTODOS
Población en estudio y obtención de datos
En total, se incluyó en el estudio a 44 participantes. De ellos, 12 (8 varones; edad, 61,4 ± 14,1 años) tenían un diagnóstico de MCH (con 4 casos obstructivos y 8 no obstructivos de hipertrofia septal asimétrica), 10 (6 varones; edad, 64,1 ± 16,6 años) tenían un diagnóstico de HVI-HT, 10 eran ciclistas entrenados sanos (10 varones; edad, 23,2 ± 3 años) y 12 eran sujetos de control sedentarios sanos (8 varones; edad, 28,7 ± 2,7 años). El diagnóstico de MCH se estableció mediante ecocardiografía en ausencia de otras causas de hipertensión sistémica o estenosis aórtica que pudieran llevar a una HVI. El diagnóstico de HVI-HT se basó en la evidencia de HVI concéntrica en la ecocardiografía y un aumento sostenido de la presión arterial sistólica (por encima de 140 mmHg) y/o la presión arterial diastólica (por encima de 90 mmHg) sin que hubiera otras causas de hipertensión secundaria. En todos los casos, el diagnóstico de HVI se confirmó en la RM. Las características basales de la población estudiada se indican en la tabla 1. El estudio se atuvo a lo establecido en la Declaración de Helsinki y se obtuvo el consentimiento informado de todos los participantes.
Los estudios de imagen se realizaron en apnea y con el empleo de un escáner General Electric Signa CVi-HDx de 1,5 T (General Electric, Milwaukee, Estados Unidos). Se aplicó un patrón de marcado de cuadrícula SPAMM empezando en la fase telediastólica. El grosor del corte fue de 8 mm, con una resolución en el plano de 0,78 × 0,78 mm y sin separaciones entre los cortes. El ángulo de flip del marcado fue de 20°, con un espaciado vertical y horizontal entre las marcas de 6 mm. Se reconstruyeron treinta fases por ciclo cardiaco; cada una de ellas estaba formada por entre 8 y 10 cortes en el eje corto y entre 3 y 6 cortes en el eje largo, cubriendo la totalidad del VI. Para algunas de las secuencias (24 de las 44) se obtuvieron imágenes de eje largo en forma de planos paralelos, mientras que las demás se obtuvieron en forma de tres planos radiales con orientaciones del plano de marcado de 0°, 45° y 90° respecto al eje central del VI.
La primera fase correspondía a la telediástole, y esta se definió como la fase de área intraventricular mínima (estimada visualmente en las imágenes de RM marcada). El número de fases sistólicas variaba de un individuo a otro, pero fue de aproximadamente un tercio del ciclo cardiaco. Para el registro y el análisis de la deformación, solamente se utilizaron las fases sistólicas más una fase diastólica, puesto que las marcas se desvanecían hasta llegar a niveles indetectables al llegar a la protodiástole (lo cual hacía imposible el seguimiento de la deformación miocárdica a partir de esa fase). Además, en los pacientes con MCH, se obtuvo una RM con realce tardío con gadolinio (RTG) 10 min después de la inyección de 0,2 mmol/kg de contraste de gadopentato de dimeglumina por vía intravenosa. Las imágenes de RTG se obtuvieron con el empleo de una secuencia de recuperación de inversión con un grosor de corte de 8 mm en la misma posición que las imágenes marcadas de eje corto en telediástole.
Análisis de los datos
El tensor de strain se calculó a partir de las secuencias de RM marcada, aplicando un algoritmo de registro no rígido10,11. En los casos en que se disponía de las proyecciones paralelas de eje largo, se utilizaron tanto las proyecciones de eje corto como las de eje largo10. A través del registro, se hallaron las correspondencias entre los puntos miocárdicos en la telediástole y los puntos miocárdicos en cada una de las fases sistólicas.
Con objeto de reducir el alto coste computacional del registro, utilizamos una estrategia de aceleración en dos niveles, en la que los registros de imágenes consecutivas en la secuencia se distribuyen en diferentes nodos multiprocesador de una infraestructura de Grid y, dentro de cada nodo, el proceso se optimiza con el empleo de diferentes técnicas de paralelización11,12. Esta estrategia de aceleración permitió aumentar de manera notable la rapidez del proceso de registro y reducir los tiempos de cálculo del strain a valores manejables (aproximadamente 1 min, en vez de 65 min por paciente). La infraestructura de Grid consistía en una agrupación SGI Altix ICE 8200 de 24 nodos, en la que cada uno de los nodos utilizaba dos procesadores Intel Xeon quad-core (CPU a 2,66 GHz; 16 GB de RAM), con un total de 192 CPU.
Se obtuvo el tensor de strain a partir de la expresión analítica del gradiente espacial del campo de desplazamiento (obtenido mediante el proceso de registro) y se proyectó en las direcciones radial y circunferencial correspondientes a la geometría del corazón en la telediástole (es decir, el estado no deformado). Los valores negativos indican un acortamiento (o adelgazamiento) y los valores positivos, un alargamiento (o engrosamiento). Para cada dirección y cada marco temporal, se promediaron los datos de strain para 16 regiones (excluido el ápex) según la segmentación estándar propuesta por la American Heart Association13. El strain máximo se determinó con la magnitud de strain máxima en la curva de strain. A continuación se obtuvo la distribución (histograma) de valores de strain máximo considerando la frecuencia, independientemente de la localización, de los valores de strain máximo de los segmentos.
La fibrosis miocárdica se evaluó mediante RTG. Dos observadores «ciegos» revisaron el conjunto de imágenes de RTG para determinar la posible presencia de hipercaptación en cada segmento miocárdico de los pacientes con MCH. La hipercaptación de contraste revela áreas de aumento del espacio intersticial en el miocardio, que en el caso de la MCH es probable que se deba a una fibrosis miocárdica.
Análisis estadístico
Las distribuciones de strain empíricas se compararon con una curva de Gauss. Algunas de ellas mostraban una ligera desviación respecto a una distribución normal. Se respaldó estas observaciones con la realización de una prueba de normalidad de Shapiro-Wilk. La homogeneidad de la varianza entre los diferentes grupos se analizó con el empleo de la prueba de Levene y la prueba de Brown-Forsythe. Con la aplicación de estas pruebas, llegamos a la conclusión de que no podía darse por supuesto que todas las varianzas fueran iguales. Por consiguiente, las comparaciones de los diferentes grupos de estudio se realizaron con el empleo de una prueba de Welch (es decir, una prueba de la t de Student para varianza desigual), que es robusta incluso cuando las distribuciones son sólo aproximadamente normales. La dispersión de strain (no normal con varianza homogénea) se comparó para los grupos con una prueba de la U de Mann-Whitney. Dado el carácter exploratorio y descriptivo del presente estudio, no se introdujeron ajustes por la realización de comparaciones múltiples. Los resultados se expresaron en forma de media ± desviación estándar, y las diferencias se consideraron estadísticamente significativas cuando el valor de p bilateral era < 0,05. El presente estudio tiene una potencia estadística suficiente (superior al 90%) para detectar diferencias significativas en los valores de strain.
RESULTADOS
Algunos segmentos específicos (14 en los voluntarios sanos, 9 en los pacientes con MCH y 6 en los pacientes con HVI-HT), correspondientes principalmente al nivel apical, fueron excluidos del análisis estadístico a causa de la baja calidad de las imágenes (baja marca de contraste que causaba artefactos de registro). Así pues, el total de segmentos evaluados fue de 675 (95,9%) de los 704.
En las tablas 2 y 3 se presentan los valores promediados del strain sistólico máximo radial y circunferencial en cada segmento para los grupos estudiados.
Los sujetos de control presentaron un patrón de strain regional que concuerda con el de estudios anteriores14-16. El strain radial fue máximo en la pared anterior y lateral. El strain circunferencial varió de manera más predecible (menor varianza), con tendencia a ser máximo en el tabique interventricular y aumentar gradualmente desde la base hacia el ápex.
Los atletas presentaron una disminución del strain radial en casi todos los segmentos miocárdicos en comparación con los controles, sobre todo en las paredes anterior y lateral. El strain circunferencial fue igual o ligeramente inferior al de los controles, excepto para las regiones anterior y anterolateral en los niveles medio y apical, donde hubo un aumento. En general, el strain radial fue inferior (17,4 ± 3,9 frente a 22,7 ± 4,5%; p = 0,0007) mientras que el strain circunferencial no mostró diferencias significativas respecto a los controles (-13,6 ± 2,9 frente a -13,6 ± 2,2%; p = 0,38).
Los pacientes con MCH presentaron una reducción significativa de los valores de strain en los 16 segmentos en comparación con los otros grupos. El strain radial fue generalmente mayor en la pared lateral que en el tabique interventricular. El strain radial se redujo especialmente en las regiones inferior e inferoseptal a nivel basal y medioventricular, y en el tabique y la pared lateral a nivel apical. En promedio, se obtuvo un valor medio inferior y una desviación mayor que en todos los demás grupos: en comparación con los controles (13,8 ± 5,2% frente a 22,7 ± 4,5%; p < 0,0001 en la dirección radial, y -9,2 ± 3,4% frente a -13,6 ± 2,2%; p < 0,0001 en la dirección circunferencial), en comparación con los atletas (13,8 ± 5,2% frente a 17,4 ± 3,9%; p < 0,0001 en la dirección radial, y -9,2 ± 3,4% frente a -13,6 ± 2,9%; p < 0,0001 en la dirección circunferencial), y en comparación con la HVI-HT (13,8 ± 5,2% frente a 20,1 ± 3,8%; p < 0,0001 en la dirección radial, y -9,2 ± 3,4% frente a -11,3 ± 3,1%; p = 0,04 en la dirección circunferencial).
Los pacientes con HVI-HT presentaron reducción del strain en comparación con los controles (20,1 ± 3,8% frente a 22,7 ± 4,5%; p = 0,09 en la dirección radial y -11,3 ± 3,1% frente a -13,6 ± 2,2%; p = 0,01 en la dirección circunferencial). Las diferencias fueron especialmente notables en el tabique interventricular, a nivel basal y medio, mientras que todos los demás segmentos no diferían de manera significativa.
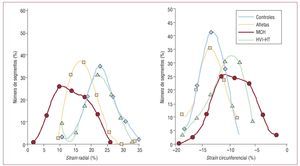
En la figura 1 se muestra para cada grupo de estudio la distribución del strain sistólico máximo radial (izquierda) y circunferencial (derecha), teniendo en cuenta todos los segmentos evaluados, con independencia de su ubicación. Cada curva de distribución muestra la proporción de segmentos (eje vertical) dentro del intervalo de valores de strain observados (eje horizontal). En la figura 1 se aprecia claramente que, mientras que la deformación en los controles, los atletas y la HVI-HT se concentra alrededor del valor medio, en la MCH coexisten segmentos con contracción normal y segmentos con ausencia o reducción significativa de la deformación, lo cual da lugar a una mayor variabilidad de los valores.
Fig. 1. Distribución del strain sistólico máximo radial (izquierda) y circunferencial (derecha) en el grupo control (rombos, línea azul), en atletas (cuadrados, línea beis), en el grupo de MCH (círculos, línea roja) y en el grupo de HVI-HT (triángulos, línea verde). Los valores positivos indican un engrosamiento y los negativos, un adelgazamiento. La dispersión significativamente mayor en la MCH es consecuencia de la coexistencia de segmentos con deterioro de la deformación y segmentos con contracción normal. HVI-HT: hipertrofia ventricular izquierda hipertensiva; MCH: miocardiopatía hipertrófica.
En la figura 2 se muestran los boxplots de la distribución de strain. En cada recuadro, la marca central es la mediana, los bordes del recuadro corresponden al primero y el tercer cuartil, las líneas se extienden hasta los valores de datos más extremos sin considerar los outliers, y estos se representan mediante cruces individuales.
Fig. 2.Boxplot de las distribuciones de strain sistólico máximo radial (izquierda) y circunferencial (derecha) en los distintos grupos de estudio. Los valores positivos indican engrosamiento y los negativos, adelgazamiento. El grupo con MCH era el que tenía una mediana de strain más baja y una mayor dispersión de los valores de strain. MCH: miocardiopatía hipertrófica.
En las tablas 4 y 5 se compara la dispersión (intragrupal) de los valores de strain máximo radial y circunferencial. La variabilidad del strain dentro de cada grupo de estudio se cuantificó determinando el coeficiente de variación (cociente de la desviación estándar respecto al valor absoluto de la media), la amplitud (diferencia entre el valor máximo y el mínimo) y el intervalo intercuartílico (diferencia entre los cuartiles tercero y primero) de la distribución de strain de cada individuo, y calculando el promedio en cada grupo. Sin embargo, debe señalarse que el coeficiente de variación (CV) es una forma de medir la dispersión más apropiada que la amplitud o el intervalo intercuartílico, puesto que se comparan conjuntos de datos con valores de media diferentes. La dispersión radial (tabla 4) fue mayor en los controles y en los pacientes con MCH que en los atletas o los pacientes con HVI-HT. Los pacientes con MCH presentaron un coeficiente de variación mayor (29,7 ± 5,3% frente a 21 ± 2,2%; p < 0,0001) que el de los controles, pero con amplitud inferior (15,8 ± 3,8 frente a 17,7 ± 1,5; p = 0,004). No hubo diferencias significativas entre MCH y controles en cuanto al intervalo intercuartílico. La dispersión circunferencial (tabla 5) fue significativamente mayor en el grupo de MCH que en los demás grupos.
En los pacientes con MCH pudimos identificar segmentos con una deformación muy escasa, mientras que estos segmentos no se hallaron en los controles, los atletas o los pacientes con HVI-HT (en los que los valores de strain estaban siempre por encima del 9% para la dirección radial y por debajo de -6,5% para la dirección circunferencial). La presencia de al menos un segmento con una deformación extremadamente baja (por debajo de 3,5 desviaciones estándar respecto a los controles) permitió diferenciar la MCH de la HVI-HT y del corazón de atleta con una sensibilidad del 84% y una especificidad del 100% al utilizar el strain radial, y con una sensibilidad del 100% y una especificidad del 100% al utilizar el strain circunferencial. Esta discriminación no es posible si se utiliza solamente el strain promedio general. Con el empleo del CV, el análisis ROC para la discriminación entre MCH y HVI-HT mostró que el valor de corte óptimo para el CV radial era el 24,7% (sensibilidad, 91,6%; especificidad, 85,7%; exactitud, 89,5%) y que para el CV circunferencial era del 24,5% (sensibilidad, 75%; especificidad, 100%; exactitud, 84,2%).
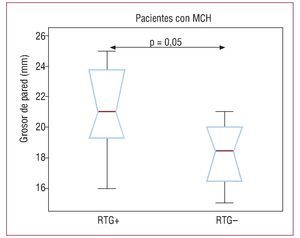
En los pacientes con MCH, estudiamos también la relación entre los segmentos que no se deformaban (determinados mediante el análisis de strain) y el grosor máximo y la fibrosis de la pared miocárdica en la telediástole (determinados mediante obtención de imágenes con RTG). Se observó RTG en 8 (67%) de los 12 pacientes con MCH. Más concretamente, se dio en 30 (16,4%) de los 183 segmentos analizados, con un predominio en las regiones más hipertróficas y la mayoría de las veces en los segmentos anteroseptales e inferoseptales. De los 30 segmentos con RTG, 18 (60%) eran segmentos sin deformación. Esto contrasta con lo observado en los segmentos sin RTG, de los que solamente 18 (11,8%) de 153 no presentaban deformación. Estos resultados se resumen en la tabla 6. La relación entre RTG y grosor máximo de la pared se muestra en la figura 3. En general, los pacientes con un RTG positivo presentaron un grosor máximo de pared telediastólico superior (21,1 ± 3,1 mm) al de los pacientes con un RTG negativo (18,2 ± 2,5 mm), pero la diferencia no fue estadísticamente significativa (p = 0,1).
Fig. 3. Boxplot en el que se muestra la relación entre el grosor de pared telediastólico máximo y la imagen con realce tardío con gadolinio (RTG) en el grupo de miocardiopatía hipertrófica (MCH). Los pacientes con RTG tenían mayor grosor de pared.
Se observaron segmentos sin deformación en 36 (19,7%) de los 183 analizados. Estos segmentos no tenían una distribución uniforme, aunque se detectaron con mayor frecuencia (69%) en el tabique interventricular y, por lo tanto, puesto que los pacientes con MCH tenían una hipertrofia asimétrica del tabique, en los segmentos miocárdicos de máximo grosor. En los segmentos sin deformación, la RTG se detectó en 18 (50%) de los 36. En cambio, de los 147 segmentos con deformación, solamente 12 (8,2%) presentaron una RTG. Estos resultados se muestran en la tabla 7.
DISCUSIÓN
Aunque todas las formas de HVI muestran un aumento del espesor del miocardio, cada una de las diversas etiologías tiene unas características específicas en lo que se refiere a las alteraciones de la deformación regional. Nuestros resultados, junto con los estudios previos, confirman que la deformación regional está alterada en la HVI y aportan información relativa a la heterogeneidad de las disfunciones regionales.
La MCH se caracteriza histológicamente por un desarreglo miofibrilar que da lugar a una disfunción local del miocardio y un potencial incremento del tejido fibroso intersticial17,18. Kim et al19 han demostrado que, con independencia de la hipertrofia miocárdica, la presencia de fibrosis regional se asocia a una disminución del strain (circunferencial). También se ha demostrado que la función regional se reduce en relación con el grado de hipertrofia7,20. Así pues, la variación regional de la desorganización miocárdica y la fibrosis pueden explicar la heterogeneidad de la función regional que se ha descrito con frecuencia en la MCH7,9,19,20.
Nuestros resultados pusieron de manifiesto que los pacientes con MCH mostraban una reducción significativa de los valores de strain en los 16 segmentos, incluso en ausencia de fibrosis o hipertrofia. El strain circunferencial se redujo de manera apreciable en la pared inferior e inferoseptal a nivel basal y medioventricular, y en el tabique interventricular y la pared lateral a nivel apical. Estos resultados concuerdan con los de estudios publicados con anterioridad7-9. La coexistencia de segmentos de contracción normal y otros con ausencia o reducción significativa de la deformación explica la mayor desviación de los valores de strain en los pacientes de MCH respecto a los demás grupos del estudio. Dependiendo del paciente concreto de que se tratara, estas regiones sin deformación estaban situadas en cualquier lugar del VI, pero la localización más frecuente era la del tabique interventricular, mientras que en la pared lateral la deformación solía ser normal. Estos resultados concuerdan con los de Orlando et al5, en los que se puso de manifiesto que la MCH se caracterizaba por la presencia de segmentos sin deformación (detectados mediante el análisis ecográfico del strain) distribuidos de manera no uniforme en el VI.
Los segmentos sin deformación fueron detectados en todos los pacientes con MCH, la mayoría de las veces en el tabique interventricular (69%) y en los segmentos con RTG (60%), pero sin ser indicativos de fibrosis (solamente un 50% de los segmentos sin deformación mostraban RTG). De forma dual, aunque la presencia de fibrosis fue significativamente superior en los segmentos sin deformación (50%) que en los segmentos que sí mostraron deformación (8,2%), la presencia de RTG no fue un indicador preciso de la ausencia de deformación. Estos resultados indican que la ausencia de deformación no es una respuesta sistemática a la fibrosis o la hipertrofia (ni, ciertamente, la fibrosis o la hipertrofia son una respuesta a la ausencia de deformación). Así pues, la presencia de fibrosis o hipertrofia no permite identificar anomalías de la deformación.
La HVI-HT se caracteriza por un aumento de la masa del VI y el grosor relativo de la pared21. Se asocia a menudo a una hipertrofia concéntrica (simétrica) y una disminución de la función sistólica general relacionada con la sobrecarga de presión de larga evolución22. En otros estudios se ha demostrado que se produce una reducción significativa de la deformación longitudinal en la parte basal del tabique interventricular5,22. En nuestro estudio, observamos que los pacientes con HVI-HT presentaban una ligera reducción general del strain radial y circunferencial en comparación con los sujetos normales, de tal manera que la reducción más significativa fue la que se produjó en los segmentos inferoseptal y anteroseptal a nivel basal. Sin embargo, aunque hubo una disminución general de la deformación, los valores de strain no fueron nunca lo bastante bajos para mostrar ausencia de deformación, como se observaba en la MCH. Esto concuerda con lo indicado por estudios previos5. Observamos también que los pacientes con HVI-HT presentaban una dispersión del strain radial similar al de los controles, mientras que la dispersión en el strain circunferencial era mayor. Tanto para la dirección radial como para la circunferencial, la dispersión en los pacientes con HVI-HT fue sustancialmente inferior a la observada en los pacientes con MCH.
Un entrenamiento regular e intensivo da lugar a varias modificaciones morfológicas y funcionales en el corazón. La denominación de corazón de atleta hace referencia a la adaptación del VI a un entrenamiento de resistencia intensivo de larga duración, y se caracteriza por un aumento del tamaño de las cámaras, así como del espesor parietal y la masa del VI23. Sin embargo, estos cambios pueden ser también un signo temprano de enfermedades cardiacas en los individuos que presentan una predisposición hereditaria a desarrollar una miocardiopatía dilatada o hipertrófica. Así pues, resulta crucial el diagnóstico diferencial entre las respuestas patológicas y las fisiológicas (no patológicas). Peterson et al24 propusieron el uso del volumen y de índices geométricos del VI obtenidos mediante RM para diferenciar el corazón de atleta de las formas patológicas de HVI. Sin embargo, estos índices no pudieron diferenciar la MCH de la HVI-HT. Por otra parte, hay pocos estudios sobre strains miocárdicos regionales en deportitas de resistencia y a veces se han descrito resultados contradictorios. En un estudio de Richand et al25, con el empleo de speckle tracking se demostró que la hipertrofia fisiológica que se produce en los atletas de élite puede diferenciarse de la hipertrofia patológica mediante análisis de la deformación del miocardio. Esos autores observaron que los strains radial y circunferencial eran significativamente mayores en los atletas que en los controles y los pacientes con MCH. Recientemente, un estudio de Nottin et al26, con el empleo de Doppler tisular, ha indicado que los strains radiales apicales eran menores en los ciclistas que en los controles, mientras que no hubo diferencias significativas en el strain circunferencial. Los resultados de nuestro estudio indicaron que, en los atletas, el strain radial era inferior al de los controles, especialmente a nivel apical y en las paredes anterior y lateral. Observamos que el strain circunferencial fue igual o ligeramente inferior al de los controles, excepto por las regiones anterior y anterolateral a nivel medio y apical, en las que se evidenció un aumento. También presentaron resultados similares Baggish et al27. Esos autores plantearon la hipótesis de que esta conducta pudiera deberse a la adaptación simultánea del ventrículo derecho.
Por último, conviene mencionar que el uso de nuestro algoritmo de registro con aceleración a dos niveles permitió una reducción significativa del tiempo necesario para el cálculo del strain basado en el marcado de la RM, lo que hace que sea una técnica aplicable en tiempo real en la práctica clínica.
En resumen, los resultados de este estudio descriptivo indican que el uso de la distribución de strain es útil como parte de la evaluación de la HVI. Concretamente, nuestros resultados indican que: a) en pacientes con HVI, las distribuciones de strain identificaron la presencia de disfunción sistólica puesto que el strain se redujo significativamente (valor medio inferior); b) los pacientes con MCH mostraron una mayor heterogeneidad (mayor dispersión) en cuanto a la magnitud de los valores de strain y presentaron al menos un segmento sin deformación, y c) los pacientes con HVI-HT presentaron una reducción del strain circunferencial, sobre todo en la parte basal del tabique, pero ninguno de los segmentos carecía de deformación. Así pues, el uso de las distribuciones de strains es un instrumento útil para evaluar las anomalías del miocardio en los pacientes con MCH y diferenciar la MCH de otras formas de hipertrofia.
Limitaciones del estudio
Una limitación que puede influir en la estimación del strain son los artefactos de movimiento causados por el cambio de posición entre los distintos momentos de apnea durante la adquisición. Esto complica la extracción de las superficies epicárdicas y endocárdicas, que son necesarias para definir las direcciones radial y circunferencial. Un algoritmo de corrección del desplazamiento como el propuesto por Lötjönen et al28 puede ser útil para soslayar este problema. En general, sería necesario usar imágenes con un menor espaciado de las marcas y con mayor resolución o, alternativamente, las técnicas de marcado avanzadas como la CSPAMM tridimensional29 para mejorar la cuantificación del strain. Otro posible punto débil son las múltiples comparaciones, con lo que aumenta el riesgo de observar diferencias significativas cuando en realidad no las hay. Sin embargo, dado que los valores de p para los resultados principales estaban normalmente por debajo de 0,001, la probabilidad de un resultado falsamente positivo es baja.
Otras limitaciones importantes de nuestro estudio clínico son el pequeño tamaño de la muestra y la diferencia de edades entre las poblaciones sana y patológica. Aunque nuestro estudio se basó principalmente en la caracterización de la deformación de grupos de pacientes característicos, sería interesante evaluar en el futuro la deformación del miocardio en pacientes jóvenes con MCH y sin expresión fenotípica.
CONCLUSIONES
Con el empleo de RM marcada y un algoritmo de registro no rígido rápido para la cuantificación del strain, es posible elaborar con facilidad distribuciones de strain. El análisis de estas distribuciones caracteriza el patrón específico de la deformación miocárdica en pacientes con diferentes etiologías de la HVI. En MCH, el strain promediado fue significativamente inferior al de los controles, los atletas o la HVI-HT y se observaron regiones sin deformación, con lo que había una mayor heterogeneidad en los valores de strain. Estos hallazgos pueden aportar una información diagnóstica importante para establecer un diagnóstico diferencial en las enfermedades hipertróficas.
ABREVIATURAS
HVI: hipertrofia ventricular izquierda.
HVI-HT: hipertrofia ventricular izquierda hipertensiva.
MCH: miocardiopatía hipertrófica.
RM: resonancia magnética.
RTG: realce tardío con gadolinio.
VI: ventrículo izquierdo.
Full English text available from: www.revespcardiol.org
Este trabajo fue financiado en parte por el Centro para el Desarrollo Tecnológico Industrial (CDTI) en el marco del Programa CENIT (proyecto CDTEAM) y el Séptimo Programa Marco de la Comunidad Europea (FP7/2007-2013; subvención número 224495; proyecto euHeart).
G. Piella contó con el apoyo del Programa Ramón y Cajal del Ministerio de Ciencia e Innovación de España.
Correspondencia: Dra. G. Piella.
Universitat Pompeu Fabra.
Roc Boronat, 138. 08018 Barcelona. España.
Correo electrónico: gemma.piella@upf.edu
Recibido el 15 de marzo de 2009.
Aceptado para su publicación el 1 junio de 2010.