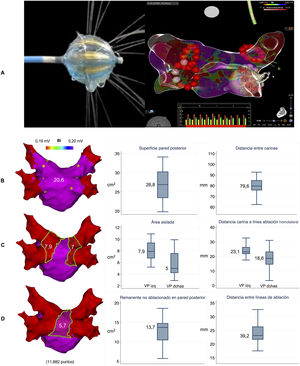
El aislamiento de venas pulmonares es el pilar fundamental del tratamiento invasivo de la fibrilación auricular. Actualmente no existe evidencia sólida sobre la repercusión de la extensión de las lesiones tras aislamiento de venas pulmonares sobre la pared posterior de la aurícula izquierda en la tasa de recurrencias en el seguimiento. Diversos estudios han analizado la extensión de las lesiones producidas por el aislamiento de venas pulmonares en la pared posterior con las distintas tecnologías disponibles, incluidos el criobalón y el balón de láser1,2. El balón de radiofrecuencia Heliostar (Biosense Webster Inc., Estados Unidos) permite el aislamiento de venas pulmonares mediante aplicaciones únicas y la visualización completa en el sistema de navegación CARTO 3 (Biosense Webster, Israel). Contiene 10 electrodos en disposición longitudinal capaces de una aplicación selectiva de la radiofrecuencia registrando en directo la temperatura y la impedancia local (figura 1A). Hasta la fecha se desconocen la extensión y las características de las lesiones producidas por el aislamiento de venas pulmonares con balón de radiofrecuencia.
A: izquierda, fotografía del balón Heliostar durante irrigación máxima; derecha, imagen de CARTO 3 que muestra visión posterior de la aurícula izquierda con balón durante la aplicación de radiofrecuencia en la vena pulmonar inferior derecha y las coronas de aplicación en el resto de venas; en la parte inferior, gráfico de barras de la impedancia, la temperatura y la potencia de cada uno de los electrodos del balón en tiempo real. B: izquierda, mapa electroanatómico previo a la ablación (aurícula izquierda, visión posterior) de uno de los casos incluidos en el estudio; se muestra con bolas amarillas los puntos que delimitan el ostium de las venas pulmonares por criterios anatómicos y eléctricos; estos encierran la superficie total de la pared posterior (en el ejemplo concreto, 20,6cm2); derecha, gráficos de caja con datos globales del total de pacientes incluidos (mediana, intervalo intercuartílico y valores extremos) de la superficie de la pared posterior y la distancia entre carinas. C: izquierda, mapa electroanatómico tras la ablación; delimitada en verde, el área aislada en la pared posterior en el antro de las venas izquierdas y derechas; derecha, gráficos de caja con datos globales del área aislada en la pared posterior y la distancia desde la carina a la línea de ablación homolateral. D: izquierda, mapa electroanatómico tras la ablación; delimitada en verde, el área remanente no ablacionada en la pared posterior; derecha, gráficos de caja con datos globales del remanente no ablacionado en la pared posterior y la distancia entre líneas de ablación medida a nivel de las carinas. Los mapas presentados incluyeron un total de 11.882 puntos.
Nuestro objetivo es caracterizar las lesiones producidas por el aislamiento de venas pulmonares con balón de radiofrecuencia Heliostar y analizar los factores que podrían influir en la extensión y la calidad de la lesión. Se trata de un estudio observacional, no aleatorizado y no comparativo con otras técnicas. El Comité de Ética Asistencial local aprobó el estudio (Ref. CI 22/548-P_NoEC). Se recogió el consentimiento informado de todos los pacientes.
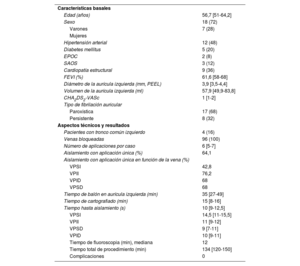
Se incluyó a 25 pacientes consecutivos con fibrilación auricular paroxística o persistente (< 1 año) que se sometieron a aislamiento de venas pulmonares con balón de radiofrecuencia mediante la metodología descrita en otros trabajos3. La tabla 1 recoge las características basales de los pacientes incluidos, los aspectos técnicos y los resultados de los procedimientos de ablación. Se realizó un mapa electroanatómico de alta densidad de la aurícula izquierda (mediana de puntos recogidos, 3.219 [intervalo intercuartílico, 2.294-4.633]) antes y después de la ablación con el sistema de navegación CARTO 3 (Biosense Webster, Israel).
Características basales, aspectos relacionados con el procedimiento y resultados
| Características basales | |
| Edad (años) | 56,7 [51-64,2] |
| Sexo | 18 (72) |
| Varones | 7 (28) |
| Mujeres | |
| Hipertensión arterial | 12 (48) |
| Diabetes mellitus | 5 (20) |
| EPOC | 2 (8) |
| SAOS | 3 (12) |
| Cardiopatía estructural | 9 (36) |
| FEVI (%) | 61,6 [58-68] |
| Diámetro de la aurícula izquierda (mm, PEEL) | 3,9 [3,5-4,4] |
| Volumen de la aurícula izquierda (ml) | 57,9 [49,9-83,8] |
| CHA2DS2-VASc | 1 [1-2] |
| Tipo de fibrilación auricular | |
| Paroxística | 17 (68) |
| Persistente | 8 (32) |
| Aspectos técnicos y resultados | |
| Pacientes con tronco común izquierdo | 4 (16) |
| Venas bloqueadas | 96 (100) |
| Número de aplicaciones por caso | 6 [5-7] |
| Aislamiento con aplicación única (%) | 64,1 |
| Aislamiento con aplicación única en función de la vena (%) | |
| VPSI | 42,8 |
| VPII | 76,2 |
| VPID | 68 |
| VPSD | 68 |
| Tiempo de balón en aurícula izquierda (min) | 35 [27-49] |
| Tiempo de cartografiado (min) | 15 [8-16] |
| Tiempo hasta aislamiento (s) | 10 [9-12,5] |
| VPSI | 14,5 [11-15,5] |
| VPII | 11 [9-12] |
| VPSD | 9 [7-11] |
| VPID | 10 [9-11] |
| Tiempo de fluoroscopia (min), mediana | 12 |
| Tiempo total de procedimiento (min) | 134 [120-150] |
| Complicaciones | 0 |
EPOC: enfermedad pulmonar obstructiva crónica; FEVI: fracción de eyección del ventrículo izquierdo; PEEL: paraesternal eje largo; SAOS: síndrome de apnea obstructiva del sueño; VPID: vena pulmonar inferior derecha; VPII: vena pulmonar inferior izquierda; VPSD: vena pulmonar superior derecha; VPSI: vena pulmonar superior izquierda.
Salvo otra indicación, los valores expresan n (%) o mediana [intervalo intercuartílico].
Para el procesamiento de los mapas, se siguió la misma metodología que la referida en otros trabajos1,2. Se definió el ostium de cada vena en el mapa previo a la ablación siguiendo criterios anatómicos y eléctricos4. Después se analizaron los mapas tras la ablación, lo que permitió definir el área aislada en la pared posterior en las venas izquierdas y derechas desde el ostium hasta la línea de ablación homolateral, fijando un límite de tejido sano> 0,2mV (figura 1B-D). El porcentaje de área aislada en la pared posterior fue una mediana del 52,2% [45%-56,6%].
Se analizaron el volumen auricular, la distancia entre carinas y la angulación de las venas con respecto al plano de la pared posterior. Ninguna de estas variables presentó asociación significativa con la superficie auricular aislada.
El porcentaje de venas aisladas con una única aplicación fue del 64,1%. El análisis univariado mediante regresión logística multinivel o de efectos mixtos mostró la caída de impedancia (por reducción de 1 Ω, odds ratio [OR]=0,1; intervalo de confianza del 95% [IC95%], 0,002-0,2; p=0,045) y el aumento de temperatura (por aumento de 1°C, OR=0,17; IC95% 0,017-0,33; p=0,03) como predictores significativos de aislamiento mediante aplicación única. El voltaje mínimo registrado por los electrodos del balón tras la aplicación mostró tendencia a predecir el aislamiento mediante aplicación única, pero no alcanzó la significación estadística (por aumento de 1mV, OR=–0,9; IC95%, –2 a 0,3; p=0,1). El modelo que mejor predijo el aislamiento con aplicación única incluyó el volumen auricular, la caída promedio de impedancia, la caída máxima de impedancia y el aumento promedio de temperatura (sensibilidad, 72%; especificidad, 68%; área bajo la curva, 0,75). El 92% de los pacientes se mantuvieron libres de recurrencias de fibrilación auricular tras una mediana de seguimiento de 12 meses (colocación del Holter-ECG a los 3, 6, 9 y 12 meses del procedimiento). Se consideró periodo de blanking los primeros 3 meses, y todos los pacientes mantuvieron tratamiento antiarrítmico hasta la primera visita.
El aislamiento de venas pulmonares con balón de radiofrecuencia produce lesiones muy antrales que logran aislar el 52% de la pared posterior. Estos datos representan mayores extensión y repercusión en la pared posterior que la crioablación1 y similares o menores que la producida por la electroporación, según los distintos trabajos2,5. Por el momento, el impacto que este hecho pueda tener en la tasa de recurrencias es desconocido. La caída de impedancia y el aumento de temperatura se mostraron predictores de aislamiento con una única aplicación, lo cual confirma los hallazgos de otros trabajos recientes6.
FINANCIACIÓNEl presente trabajo no ha recibido financiación.
CONSIDERACIONES ÉTICASEl presente trabajo ha sido aprobado por el Comité de Ética Asistencial local (Ref. CI 22/548-P_NoEC). En todos los casos incluidos se obtuvo el consentimiento informado del paciente para su estudio y publicación. En el presente trabajo se han tenido en cuenta las posibles variables de sexo y género de acuerdo con las directrices SAGER.
DECLARACIÓN SOBRE EL USO DE INTELIGENCIA ARTIFICIALEn el presente proyecto no se ha empleado inteligencia artificial.
CONTRIBUCIÓN DE LOS AUTORESE. Martínez Gómez colaboró en el diseño del protocolo, la recogida de datos, el análisis estadístico y la elaboración del manuscrito. R. Salgado Aranda, en el diseño del protocolo, el análisis estadístico y la revisión del manuscrito. D. Calvo Cuervo participó en la revisión del manuscrito. Por su parte, C. Sánchez Vallejo ayudó con la recogida de datos. D. Filgueiras-Rama participó en la revisión del manuscrito. Por último, N. Pérez-Castellano colaboró en el diseño del protocolo, análisis estadístico y revisión del manuscrito.
CONFLICTO DE INTERESESD. Filgueiras-Rama es editor asociado de Rev Esp Cardiol. Se ha seguido el procedimiento editorial establecido en la Revista para garantizar la gestión imparcial del manuscrito.
Los demás autores no presentan conflictos de intereses.