A lo largo de muchos años, los investigadores y los clínicos del campo de la cardiología pediátrica y fetal han estudiado el sistema cardiovascular durante el periodo que va de la concepción al nacimiento. Durante dicho periodo se produce el desarrollo cardiaco y vascular más rápido y crucial. En el ser humano, el corazón se forma y pasa a ser funcional a las 8 semanas de gestación. Pueden observarse malformaciones cardiacas durante la gestación en un 0,8-1% de los recién nacidos, y la alteración del desarrollo del músculo cardiaco o del tejido de conducción puede conducir a una miocardiopatía o a arritmias. Se puede determinar estas alteraciones por la interacción de trastornos genéticos o ambientales que el feto puede sufrir.
En esta revisión se abordan los antecedentes históricos que llevaron al nacimiento de la cardiología fetal y el estado actual de desarrollo de esta disciplina relativamente nueva, y se plantean hipótesis sobre lo que cabe prever en un futuro próximo.
Desarrollo históricoLas investigaciones experimentales y clínicas realizadas en la segunda mitad del siglo xx por los pioneros de la fisiología fetal y la cardiología pediátrica establecieron los conceptos fisiológicos básicos de la dinámica circulatoria fetal, como la disposición paralela de los dos ventrículos, la presencia de cortocircuitos y la resistencia vascular pulmonar elevada que contrasta con la baja resistencia placentaria1, 2, 3, 4. Se han descrito también los principales cambios circulatorios en el periodo de transición que rodea al nacimiento5. En paralelo con estas observaciones fundamentales, la tecnología ecográfica fue introduciéndose progresivamente en la práctica clínica de la cardiología pediátrica para el estudio no invasivo de los pacientes con cardiopatías adquiridas o congénitas (CC), empezando con el modo B y seguido por el modo M, la ecografía bidimensional en tiempo real y la tecnología Doppler (continuo, pulsado y en color). La aplicación de la misma tecnología a la vida prenatal se exploró tanto en el ámbito experimental como en el clínico, y rápidamente6, 7, 8 abrió el camino a la cardiología fetal tal como hoy la conocemos. Sin embargo, es preciso resaltar que la ecocardiografía es tan sólo un instrumento; ni siquiera el mejor ecografista es un cardiólogo fetal.
Cardiología fetal contemporáneaEn la actualidad, la cardiología fetal es una subespecialidad de la cardiología pediátrica. Grupos de trabajo formados en el ámbito de las sociedades médicas nacionales y supranacionales de Europa han publicado recomendaciones de formación para los futuros cardiólogos fetales9. El número creciente de asociaciones, congresos y simposios, así como el de publicaciones científicas relativas al sistema cardiocirculatorio fetal, confirma la pertinencia de esta subespecialidad y refleja la vitalidad de la investigación básica y clínica en este nuevo campo.
La cardiología fetal engloba: a) el tratamiento de fetos con CC; b) las arritmias fetales, y c) el examen de la función miocárdica y del estado cardiocirculatorio del feto en los embarazos de alto riesgo.
Tratamiento del feto con una cardiopatía congénitaDetección sistemática prenatal de las cardiopatías congénitasUn programa de detección sistemática coste-eficiente para la identificación prenatal de las CC debe cumplir un cierto número de requisitos: en primer lugar, se debe realizar a todas las mujeres embarazadas una evaluación ecográfica entre las 14 y las 20 semanas de embarazo, con objeto de detectar posibles signos de sospecha de anomalías morfológicas fetales. Sólo los casos de sospecha de CC se derivan al cardiólogo fetal. En segundo lugar, debe realizarse una evaluación cardiocirculatoria sistemática en todos los casos de malformaciones mayores o marcadores de alto riesgo. En algunos casos, sobre todo en los de lesiones estenóticas, los exámenes seriados durante el seguimiento son obligados, dado el riesgo de aumento de la significación hemodinámica de la malformación. Por ejemplo, en los casos de estenosis aórtica moderada diagnosticados precozmente en el segundo trimestre, puede haber una hipoplasia de cavidades izquierdas al final de la gestación. En una minoría de casos de CC, los que presentan un riesgo de hipoxia posnatal inmediata o colapso circulatorio, será necesario derivar el parto a un centro de tercer nivel, en el que se disponga de especialistas (cardiológicos pediátricos y cirujanos cardiacos infantiles), como ocurre en casos de obstrucción cardiaca izquierda o derecha grave o en los pacientes con una transposición completa de los grandes vasos. Tal como cabía prever, el principal impacto de este proceso de detección sistemática en cuanto a mejora de la morbilidad y la mortalidad posnatales se observa en este grupo de malformaciones.
Por último, es preciso reconocer que este enfoque de detección sistemática sólo es concebible en países que disponen de un sistema sanitario público dotado de personal experto y el apoyo económico apropiado. Es interesante señalar que se han observado diferencias notables en el grado de éxito de este programa de detección sistemática en países desarrollados, con tasas de fallos que van del 2,8 al 60% según la zona evaluada10.
Aspectos genéticosEl consejo genético es una parte importante de la cardiología fetal. En presencia de una CC en un familiar de primer grado, el riesgo de tener un hijo con CC aumenta del 0,8 al 4% y en algunos casos llega a un 8%11. Algunas CC se asocian a síndromes cromosómicos, como el canal auriculoventricular (AV) con la trisomía 21 o las anomalías conotruncales con la deleción 22q11. Por esta razón, se recomienda sistemáticamente la determinación del cariotipo fetal, incluidas las deleciones, mediante obtención de muestras de vellosidades coriónicas o amniocentesis, en la evaluación habitual de fetos con malformaciones cardiacas estructurales. Los antecedentes familiares de miocardiopatía, en especial los casos hipertróficos, pueden deberse a mutaciones génicas asociadas a proteínas sarcoméricas12 cuya transmisión hereditaria suele ser autosómica dominante (el 50% de riesgo de transmisión a partir de un progenitor heterocigoto). Debe descartarse el síndrome de Barth, una mutación ligada al cromosoma X en el gen TAZ, si hay una miocardiopatía no compactada13. La identificación prenatal de trastornos como los síndrome de Marfan y de Loeitz-Dietz ensombrece el pronóstico de la dilatación de la raíz aórtica o las anomalías valvulares asociadas halladas en el feto.
Intervención cardiaca fetalLa forma de abordar una intervención cardiaca fetal se basa en la aplicación de dos principios: a) efectos beneficiosos fetales claros a corto plazo (evitar la muerte intrauterina o posnatal inmediata) o a largo plazo (modificación de la evolución de una lesión progresiva como una estenosis causante de hipoplasia ventricular), y b) ausencia de efectos secundarios significativos para el feto o la madre embarazada. En la última década se han definido las indicaciones y los aspectos técnicos del cateterismo intervencionista en el feto14. De forma resumida, la intervención fetal cerrada, a través de una punción del abdomen materno, el útero y el ventrículo fetal empleando agujas, transductores, guías y catéteres con balón de pequeño calibre, permite la dilatación de las válvulas estenóticas. Este enfoque se ha recomendado sobre todo para la estenosis aórtica crítica. Se ha demostrado que la circulación biventricular posnatal se puede manterer en estos casos15. Los criterios para la selección de los pacientes candidatos que presentan una estenosis pulmonar crítica o una atresia pulmonar con un tabique ventricular intacto son más discutibles, aunque existen series que describen indicaciones para la selección de los fetos16. Un trastorno en el que el cateterismo intervencionista fetal tiene un máximo impacto es el síndrome de corazón izquierdo hipoplásico con un foramen oval restrictivo, una situación en la que se producen hipoxia posnatal grave y una muy mala evolución tras la cirugía neonatal (generalmente en un estadio I de Norwood). La apertura del tabique y/o la colocación de un stent reducen la presión auricular izquierda y aumentan el retorno venoso pulmonar, con lo que se evita la acidosis neonatal antes de la cirugía. Estas técnicas se realizan actualmente en unos pocos centros específicos; requieren equipos multidisciplinarios expertos y, como otras intervenciones fetales, tienen una curva de aprendizaje. Queda por demostrarse su efecto beneficioso a largo plazo.
Información a los padresSi se diagnostica una CC, la entrevista de información con los padres debe realizarse con la máxima sensibilidad. Este tal vez sea el tema menos debatido en los foros y las publicaciones científicas. Sin embargo, la entrevista con los padres sigue siendo uno de los aspectos más delicados de la práctica clínica de la cardiología fetal, y ciertamente es uno de los que tiene mayor importancia si se analizan las repercusiones finales.
El cardiólogo debe presentar el pronóstico tanto prenatal como posnatal de la enfermedad. Esta información debe ser objetiva y basada en la experiencia tanto local como de otros centros. En situaciones extremas, como los fetos con un bloqueo AV completo a las 22 semanas de gestación e hidropesía grave, es fácil predecir la muerte inminente. En cambio, tal como se ha mencionado antes respecto a la estenosis aórtica, a veces resulta difícil predecir los cuadros morfológicos y hemodinámicos finales. Siempre se debe tener en cuenta las convicciones éticas, morales y religiosas de la pareja, sobre todo de la madre, en relación con la decisión crucial de continuar o no con el embarazo, sin olvidar el cumplimiento de la legislación de los diferentes países. Si la cardiopatía se asocia a otras morbilidades, especialmente neurológicas, también se debe explicarlo con claridad. Por consiguiente, esta información crucial debe darla un cardiólogo con experiencia, en representación de un grupo multidisciplinario de cardiólogos, obstetras, genetistas, cirujanos cardiacos, neonatólogos y otros especialistas que hayan estudiado el caso desde todas sus perspectivas. Siempre se debe ofrecer a los padres una entrevista con el neonatólogo y el cirujano, y si es necesario puede intervenir también un trabajador social o un psicólogo.
Arritmias fetalesEste es uno de los campos más gratificantes de la cardiología fetal. En la inmensa mayoría de los casos, la morfología cardiaca es normal. Algunos fetos con una taquicardia sostenida (frecuencia cardiaca>180 lpm) podrían adquirir una insuficiencia cardiaca con peligro de muerte intrauterina. La conversión satisfactoria de estas taquicardias al ritmo sinusal normal actualmente es la regla, sobre todo si no hay hidropesía fetal.
Estudio diagnóstico de la arritmia fetalLa identificación de los mecanismos de la arritmia fetal se basa en la relación cronológica entre las contracciones auriculares y ventriculares. Esta identificación puede realizarse con técnicas Doppler como las técnicas de imagen tisular17 o de manera más sencilla con el registro simultáneo del Doppler pulsado en vena cava superior/aorta ascendente o arteria pulmonar/vena pulmonar18, 19. En nuestra experiencia, el método de Doppler de vena cava superior/aorta ascendente proporciona un marcador dinámico consistente de las contracciones auriculares (onda «A» venosa) y ventriculares (flujo aórtico), que permite realizar un análisis fiable del mecanismo subyacente a la arritmia. Se observan los siguientes tres tipos de arritmias18:
1.Ritmo irregular: principalmente ectopias auriculares, excepcionalmente ectopias ventriculares aisladas. Estas arritmias suelen ser autolimitadas y no requieren tratamiento alguno.
2.Bradicardia sostenida: generalmente relacionada con un bigeminismo auricular bloqueado. También se puede observar casos infrecuentes de bradicardia sinusal sostenida o bloqueo AV completo, este último en el contexto de una malformación cardiaca compleja o, con mayor frecuencia, como reacción inmunitaria debida a anticuerpos anti-RO y anti-LA en una madre con lupus.
3.Taquiarritmia (cinco tipos): tipo I, taquicardia ventriculoauricular corta debida a un fenómeno de reentrada; tipo II, taquicardia ventriculoauricular larga, causada la mayoría de las veces por una taquicardia ectópica auricular; tipo III, inicio simultáneo de contracción auricular y ventricular que se demuestra que corresponde a una taquicardia de la unión; tipo IV, aleteo auricular con bloqueo AV 2:1, y tipo V, casos muy poco frecuentes de ritmo ventricular acelerado.
Se ha obtenido amplia experiencia con el uso prenatal de digoxina, sotalol, flecainida y amiodarona. En la actualidad, suele adoptarse un enfoque más específico para la elección de los fármacos antiarrítmicos, en función de los mecanismos subyacentes20. En presencia de una taquicardia sostenida asociada a una insuficiencia cardiaca avanzada e hidropesía fetal, el tratamiento transmaterno es menos eficiente, debido al edema placentario. Si la inmadurez del feto impide un parto pretérmino, se recomienda la inyección cautelosa del fármaco antiarrítmico vía intravenosa a la madre o directamente en la vena umbilical. Debe recordarse que, en la taquicardia de reentrada ventriculoauricular corta, las contracciones auricular y ventricular se producen al mismo tiempo; las válvulas AV se cierran y las sístoles auriculares generan unas ondas venosas retrógradas gigantes y una elevación de la presión venosa central media. Esta característica dinámica específica da lugar a un edema periférico más temprano con hidropesía fetal y no necesariamente a una insuficiencia miocárdica.
Aunque el bloqueo AV completo establecido debido a la elevación de los anticuerpos RO y SSA maternos no es sensible a los corticoides, se han descrito casos aislados de bloqueo AV completo inminente (bloqueo AV de segundo grado asociado a periodos intermitentes de bloqueo AV completo) que responden al tratamiento antiinflamatorio21. El efecto beneficioso de la administración sistemática de corticoides en el bloqueo AV completo bien establecido de causa inmunitaria para reducir el proceso inflamatorio del miocardio actualmente es objeto de controversia22, 23.
Aspectos genéticosLas canalopatías, como el síndrome de QT largo, el síndrome de Brugada y otras, se asocian a mutaciones autosómicas dominantes. La identificación de estas mutaciones resulta especialmente útil para la predicción prenatal de las manifestaciones clínicas posnatales24. Recientemente se han detectado evidencias de mutaciones en el gen que codifica el canal iónico HCN4 en familias con bradicardia sinusal25. Por último, la presencia de un rabdomioma miocárdico prenatal justifica la búsqueda de mutaciones génicas asociadas a la aparición tardía de una esclerosis tuberosa cerebral.
Examen de la función miocárdica y del estado cardiocirculatorio fetal en embarazos de alto riesgoLa ecocardiografía no sólo ha sido útil para detectar las cardiopatías estructurales, sino que también ha sido un instrumento fundamental en la evaluación del bienestar fetal. La proporción cardiotorácica, la fracción de acortamiento miocárdico sistólico determinado con el modo M, así como el patrón de llenado diastólico a través de las válvulas AV se han utilizado en la evaluación funcional del corazón fetal con una reproducibilidad variable. Se obtiene una información más consistente sobre la distensibilidad ventricular derecha con el estudio de la profundidad de la onda «A» a través del conducto venoso en el registro de flujo Doppler.
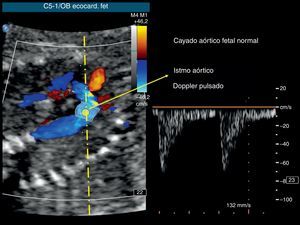
El índice de función miocárdica se ha aplicado también en la vida prenatal para una evaluación cardiaca funcional más integral26; este índice se basa en intervalos de tiempo registrados durante los ciclos cardiacos. La frecuencia cardiaca fetal rápida que da lugar a unos intervalos relativamente cortos aumenta el margen de error en el cálculo del índice de función miocárdica. Se ha propuesto una puntuación del perfil cardiovascular basada en cinco variables diferentes27. De igual modo, se ha demostrado que el Doppler pulsado del istmo aórtico (Figura) entre el origen de la arteria subclavia izquierda y el extremo aórtico del conducto arterioso proporciona una información fiable sobre la dinámica circulatoria fetal periférica, así como sobre la función sistólica relativa de cada ventrículo28. Durante la vida fetal, el istmo aórtico ocupa una posición única, en el cruce entre los dos sistemas arteriales paralelos. Representa la única comunicación entre el cayado aórtico y el arco pulmonar, así como entre las circulaciones supradiafragmática (dirigida hacia el cerebro) y la infradiafragmática (dirigida hacia la placenta). Así pues, cualquier cambio en la función ventricular individual o en las resistencias vasculares periféricas se refleja en el patrón de flujo Doppler del istmo. Este nuevo concepto fisiológico ha resultado útil en situaciones clínicas como la restricción del crecimiento intrauterino, las malformaciones cardiacas, la arritmia y la diabetes materna, entre otras29, 30. Los ecografistas obstétricos cada vez utilizan más el Doppler del istmo aórtico en la evaluación de la hemodinámica fetal31, 32, 33, 34.
Figura. Imagen de ecocardiografía fetal del cayado aórtico con Doppler color (panel izquierdo). Se resalta el istmo aórtico con localización Doppler pulsado y registro de velocidades normal (panel derecho).
El futuro de la cardiología fetalLa cardiología fetal ha pasado a ser una subespecialidad dinámica de la medicina fetal. Los futuros avances de esta disciplina se producirán, con toda probabilidad, en lo siguiente:
• Integración continua de las técnicas ecocardiográficas más modernas, que permitirán el estudio de la mecánica cardiaca fetal. Se han descrito los patrones normales en fetos de diferentes edades de gestación con el Doppler tisular35. Con la técnica de speckle tracking ecográfico, se investiga el strain longitudinal y circunferencial36, lo que abre nuevos campos para la monitorización clínica de la cardiopatía y las alteraciones hemodinámicas fetales. Indudablemente aparecerán nuevas investigaciones y publicaciones en este campo.
• Mejora de los enfoques terapéuticos prenatales para CC complejas, que probablemente serán uno de los principales avances en el futuro de la cardiología fetal. La cirugía cardiaca fetal mediante bypass cardiopulmonar o mediante técnicas de fetoscopia no ha aportado hasta el momento una viabilidad fetal postoperatoria. Una perspectiva terapéutica más prometedora puede ser la del campo de la organogénesis in vitro, a partir de células obtenidas intrauterinamente de un feto con una cardiopatía compleja, que luego recibiría un corazón normal inmunocompatible tras el parto.
• La arritmia fetal es otro campo en el que es obvia la necesidad de disponer de fármacos antiarrítmicos más específicos para la vida fetal. Es preciso abordar al menos tres limitaciones: en primer lugar, la transferencia relativamente lenta de los fármacos a través de la placenta; en segundo lugar, una adaptación farmacéutica a las características electrofisiológicas específicas del corazón inmaduro, y en tercer lugar, la ausencia completa de efectos secundarios que interfieran en el desarrollo y la maduración de otros órganos, como la glándula tiroides o el cerebro. A este respecto, en vez de basarse en los corticoides para la prevención de la reacción inflamatoria contra los anticuerpos anti-RO en la madre con lupus, la investigación inmunológica podría conducir al desarrollo de anticuerpos monoclonales específicos que bloquearan la actividad antigénica anti-RO.
• Por último, en un futuro próximo, cabe esperar que la medicina fetal, y más concretamente la cardiología fetal, traspase las fronteras nacionales para llegar a las poblaciones en que se dan las tasas más altas de mortalidad prenatal y perinatal. La necesidad de una «International Society of Fetal and Perinatal Cardiovascular Disease» es evidente. Dicha sociedad debería tener múltiples objetivos, desde la discusión del tratamiento prenatal y perinatal de los problemas cardiovasculares (y no sólo de la cardiopatía estructural) hasta la creación de un programa de formación con unas condiciones especiales para los países subdesarrollados. Dicho programa de formación debiera cubrir la fisiología y la fisiopatología prenatales y perinatales, diversos trastornos clínicos y aspectos técnicos, genéticos y psicosociales. En esta sociedad internacional deberán ser bienvenidos los «pensadores» en el campo de la ética, la filosofía y la sociología. Es ahí donde la cardiología fetal, una especialidad dependiente de una tecnología sofisticada, podría mostrar su lado más humano, atendiendo de forma compasiva tanto al paciente no nacido como a toda la familia que lo rodea.
Ninguno
Full English text available from: www.revespcardiol.org
Autor para correspondencia: Juan Esplandiu 9 portal B, 6.o B, 28007 Madrid, España. consmelu@yahoo.es