Las insuficiencias cardiacas con función sistólica conservada y con función sistólica reducida tienen en común el alto riesgo de mortalidad. Sin embargo, no se conocen bien las diferencias entre ambas por lo que respecta a la carga de reingresos hospitalarios con el correr del tiempo.
MétodosSe estudió prospectivamente a una cohorte de 2.013 pacientes consecutivos dados de alta tras una hospitalización por insuficiencia cardiaca aguda. De ellos, 1.082 (53,7%) tenían insuficiencia cardiaca con función sistólica conservada y 931 (46,2%), insuficiencia cardiaca con función sistólica reducida. Se utilizaron análisis de regresión de Cox y de regresión binomial negativa para evaluar los riesgos de muerte y rehospitalizaciones.
ResultadosTras una mediana de seguimiento de 2,36 [intervalo intercuartílico, 0,96-4,65] años, 1.018 pacientes (50,6%) habían fallecido, y se habían registrado 3.804 reingresos de 1.406 pacientes (69,8%). En general, no hubo diferencias entre la insuficiencia cardiaca con función sistólica conservada y la insuficiencia cardiaca con función sistólica reducida en cuanto a mortalidad (16,7 frente a 16,1/100 personas-año; p=0,794) o tasas de rehospitalización por cualquier causa (62,1 frente a 62,2/100 personas-año; p=0,944). Tras aplicar un ajuste multivariable, y en comparación con los pacientes con insuficiencia cardiaca y función sistólica reducida, los pacientes con insuficiencia cardiaca y función sistólica conservada mostraron una tasa de reingresos por cualquier causa similar (cociente de tasas de incidencia=1,04; intervalo de confianza del 95% (IC95%), 0,93-1,17; p=0,461). Por lo que respecta a las causas específicas, la insuficiencia cardiaca con función sistólica conservada mostró similares riesgos de rehospitalizaciones de causa cardiovascular y por descompensación de insuficiencia cardiaca (cociente de tasas de incidencia=0,93; IC95%, 0,82-1,06; p=0,304; y cociente de tasas de incidencia=0,96; IC95%, 0,83-1,13; p=0,677), pero el riesgo de reingresos de causa no cardiovascular fue superior (cociente de tasas de incidencia=1,24; IC95%, 1,04-1,47; p=0,012).
ConclusionesTras un ingreso por insuficiencia cardiaca aguda, los pacientes con insuficiencia cardiaca y función sistólica conservada presentan una carga de rehospitalizaciones similar a la de los pacientes con insuficiencia cardiaca y función sistólica reducida. Sin embargo, los pacientes con insuficiencia cardiaca y función sistólica conservada tienen mayor probabilidad de reingresos por causas no cardiovasculares.
Palabras clave
El riesgo de rehospitalización de los pacientes con insuficiencia cardiaca aguda (ICA) dados de alta recientemente continúa siendo prohibitivamente alto1–4. Los reingresos debidos al agravamiento de la insuficiencia cardiaca (IC) se asocian a un aumento del riesgo de mortalidad y generan una parte importante de los gastos de asistencia sanitaria asociados a la IC2,5; además, estas rehospitalizaciones frecuentemente tienen un origen no cardiovascular (CV), que también tiene consecuencias pronósticas negativas3,6,7. Lamentablemente, la identificación de los pacientes con IC en mayor riesgo de rehospitalizaciones es una necesidad clínica insatisfecha2,8.
Tradicionalmente, se ha utilizado el método del «tiempo hasta el primer» evento para evaluar el riesgo de eventos adversos en la IC, incluido el riesgo de rehospitalización. Desde un punto de vista metodológico, este tipo de análisis, aun estando ampliamente aceptado, no refleja con exactitud la carga de las hospitalizaciones a lo largo de la vida del paciente con IC, puesto que esta metodología no tiene en cuenta todos los episodios que se producen después del primer evento9. En los últimos años, algunos autores han defendido reemplazar los análisis del tiempo hasta el primer reingreso por análisis longitudinales que incluyan todos los eventos que tienen lugar durante el seguimiento. Este método permitiría cuantificar mejor la carga de la enfermedad y reducir los errores de tipo II10,11.
La IC con función sistólica conservada (ICFSc) hoy supone casi la mitad del total de pacientes hospitalizados por ICA12. Los pacientes con ICFSc presentan un conjunto de comorbilidades distintas y diferencias fisiopatológicas manifiestas respecto a los pacientes con función sistólica reducida (ICFSr)13–15. Sin embargo, la forma de presentación clínica y el riesgo de mortalidad son similares en las 2 entidades16–19. Sin embargo, no está claro todavía si los pacientes con ICFSc evolucionan peor, igual o mejor que los pacientes con ICFSr por lo que respecta al riesgo de rehospitalizaciones con el correr del tiempo.
El objetivo del presente estudio es caracterizar la carga de rehospitalizaciones con el paso del tiempo tras un ingreso por ICA, en función del estado de la fracción de eyección del ventrículo izquierdo (FEVI) (ICFSc frente a ICFSr).
MÉTODOSGrupo de estudio y protocoloEn el estudio se incluyó prospectivamente a una cohorte consecutiva de 2.013 pacientes dados de alta con diagnóstico de ICA tras su ingreso en el servicio de cardiología de un hospital universitario de nivel terciario (Hospital Clínico Universitario de Valencia, España) entre el 1 de enero de 2004 y el 1 de agosto de 2013. La ICA se definió según lo establecido en las guías de práctica clínica vigentes durante el estudio1. Se incluyó en el registro a los pacientes con IC de nueva aparición o descompensación aguda de una IC crónica. Según lo establecido en el diseño del estudio, no se incluyó en el análisis final a los pacientes que fallecieron durante el evento de hospitalización que los calificaba para el estudio. Durante la hospitalización de calificación para el estudio, se registraron sistemáticamente los datos relativos a características demográficas, antecedentes patológicos, constantes vitales, electrocardiograma de 12 derivaciones, parámetros analíticos y ecocardiográficos y uso de medicación mediante cuestionarios de registro preestablecidos. La FEVI se determinó mediante ecocardiografía bidimensional en todos los pacientes durante la hospitalización de calificación (96 ±24 h después del ingreso). La FEVI se calculó con el método biplanar de Simpson. Durante el estudio se utilizaron 2 sistemas comercializados, el Agilent Sonos 5500 y el ie33 (Philips; Massachusetts, Estados Unidos). La ICFSr y la ICFSc se definieron por FEVI<50% o ≥ 50% respectivamente, aplicando valores umbral establecidos con anterioridad1. El tratamiento con inhibidores de la enzima de conversión de la angiotensina (IECA), antagonistas del receptor de la angiotensina II (ARA-II), bloqueadores beta, antagonistas de aldosterona, anticoagulantes, diuréticos y otras estrategias terapéuticas se individualizó siguiendo lo indicado por las guías establecidas que estaban en vigor en el momento de incluir al paciente en el registro.
Seguimiento y objetivosLas incidencias de rehospitalización por cualquier causa, de causa CV, de causa no CV y relacionadas con la IC durante el seguimiento fueron los objetivos principales. Solamente se incluyeron los reingresos no programados. Al personal encargado de validar los episodios de los objetivos, se le ocultó el estado de la FEVI. Cada reingreso ocurrido durante el seguimiento fue clasificado de la siguiente forma: relacionado con la IC si se debía a un agravamiento de la IC; de causa CV si se debía a un agravamiento de la IC, infarto agudo de miocardio, angina inestable, ictus o accidente isquémico transitorio, arritmias cardiacas o enfermedad arterial periférica. En otro caso, se consideraba que la etiología era no CV, y ello incluía las causas oncológicas, infecciosas, gastrointestinales, renales, pulmonares, endocrinas, urológicas/ginecológicas y reumáticas. Los reingresos debidos a insuficiencia renal aguda en el contexto de un agravamiento de la IC se clasificaron como relacionados con la IC; si no, se consideraron no CV.
Consideraciones éticasEl estudio es de diseño prospectivo, se atuvo a los principios establecidos en la Declaración de Helsinki y fue aprobado por el comité de ética de investigación local del centro. Todos los pacientes dieron su consentimiento informado.
Análisis estadísticoLas variables continuas se expresan como media±desviación estándar o mediana [intervalo intercuartílico] según fuera apropiado. Las variables discretas se resumieron mediante porcentajes. Se compararon las variables continuas basales de los pacientes con FEVI<50% y FEVI ≥ 50% con la prueba de la t de Student o la prueba de suma de rangos, según fuera apropiado; las variables discretas se compararon con la prueba de la χ2. La asociación entre el estado actual de la FEVI y la mortalidad por cualquier causa o de causa CV durante el seguimiento se evaluó mediante análisis de regresión de Cox. Se realizó un análisis descriptivo de las rehospitalizaciones mediante el recuento de los ingresos ocurridos durante todo el periodo de seguimiento. Se calcularon las tasas de incidencia brutas (expresadas mediante el número de reingresos cada 100 personas-año) de cada uno de los objetivos de valoración de los reingresos (por cualquier causa, de causa CV, de causa no CV y relacionados con la IC), en las 2 categorías de FEVI consideradas. La asociación independiente entre la FEVI y las rehospitalizaciones se evaluó mediante análisis de regresión binomial negativa multivariable (NBreg), y las estimaciones del riesgo se expresaron mediante el cociente de tasas de incidencia (IRR). En el campo de la IC preocupa la censura estadística informativa. Cuando se da esta forma de censura en el análisis estadístico, un aumento del riesgo de rehospitalización puede conllevar un aumento del posterior riesgo de muerte. Se ha señalado que una forma de evitar empíricamente este sesgo sería considerar cualquier muerte ocurrida fuera de la hospitalización como un nuevo episodio (un reingreso) en el modelo de NBreg10,11 (en total, las muertes por cualquier causa, de causa CV y relacionadas con la IC que se produjeron fuera de las hospitalizaciones fueron 497, 320 y 234 respectivamente). Todas las variables incluidas en la tabla 1 fueron evaluadas respecto al posible efecto de factores de confusión. Se utilizó una selección escalonada retrógrada, utilizando el criterio de información de Akaike como criterio de detención, para elaborar modelos con un pequeño número de variables. Las covariables incluidas en los modelos clínicos multivariables para cada uno de los objetivos principales fueron: a) rehospitalizaciones por cualquier causa: edad, sexo, clase funcional de la New York Heart Association (NYHA) III o IV, ingresos previos por IC, hipertensión, diabetes, antecedentes de tabaquismo, enfermedad arterial periférica, demencia, enfermedad arterial pulmonar crónica, ictus previo, portador de desfibrilador automático implantable, infarto de miocardio previo, fibrilación auricular con interacción con la frecuencia cardiaca, nitrógeno de urea en sangre, hemoglobina, sodio, fracción aminoterminal del propéptido natriurético cerebral (NT-proBNP) y tratamiento con bloqueadores beta; b) rehospitalizaciones de causa CV: edad, sexo, ingresos previos por IC, diabetes, antecedentes de tabaquismo, demencia, ictus previo, portador de desfibrilador automático implantable, infarto de miocardio previo, fibrilación auricular con interacción con la frecuencia cardiaca, nitrógeno de urea en sangre, hemoglobina, sodio, NT-proBNP y tratamiento con bloqueadores beta; c) rehospitalizaciones de causa no CV: edad, sexo, NYHA III-IV, diabetes, antecedentes de tabaquismo, enfermedad arterial periférica, antecedentes personales de neoplasia maligna, enfermedad arterial pulmonar crónica, ictus previo, portador de desfibrilador automático implantable, infarto de miocardio previo, fibrilación auricular con interacción con la frecuencia cardiaca, nitrógeno de urea en sangre, hemoglobina y tratamiento con bloqueadores beta, y d) rehospitalizaciones relacionadas con la IC: edad, sexo, NYHA III-IV, ingresos previos por IC, diabetes, demencia, enfermedad arterial pulmonar crónica, portador de desfibrilador automático implantable, infarto de miocardio previo, presión arterial sistólica, fibrilación auricular con interacción con la frecuencia cardiaca, nitrógeno de urea en sangre, hemoglobina, sodio, NT-proBNP, tratamiento con bloqueadores beta y con IECA o ARA-II. Se investigó también el efecto del estado de la FEVI en el riesgo de rehospitalización evaluado mediante el tiempo hasta el primer evento, utilizando para ello una regresión de Cox adaptada para eventos en competencia. Se ajustaron los gráficos de incidencia acumulada respecto a la mortalidad como evento en competencia20.
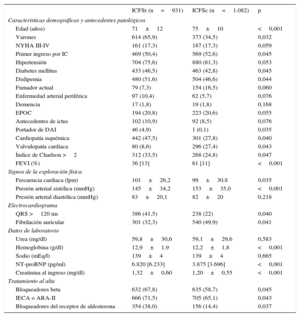
Distribución de las características basales en la insuficiencia cardiaca con función sistólica reducida en comparación con la insuficiencia cardiaca con función sistólica conservada
| ICFSr (n=931) | ICFSc (n=1.082) | p | |
|---|---|---|---|
| Características demográficas y antecedentes patológicos | |||
| Edad (años) | 71±12 | 75±10 | <0,001 |
| Varones | 614 (65,9) | 373 (34,5) | 0,032 |
| NYHA III-IV | 161 (17,3) | 187 (17,3) | 0,059 |
| Primer ingreso por IC | 469 (50,4) | 569 (52,6) | 0,045 |
| Hipertensión | 704 (75,6) | 880 (81,3) | 0,053 |
| Diabetes mellitus | 433 (46,5) | 463 (42,8) | 0,045 |
| Dislipemia | 480 (51,6) | 504 (46,6) | 0,044 |
| Fumador actual | 79 (7,3) | 154 (16,5) | 0,060 |
| Enfermedad arterial periférica | 97 (10,4) | 62 (5,7) | 0,076 |
| Demencia | 17 (1,8) | 19 (1,8) | 0,168 |
| EPOC | 194 (20,8) | 223 (20,6) | 0,055 |
| Antecedentes de ictus | 102 (10,9) | 92 (8,5) | 0,076 |
| Portador de DAI | 46 (4,9) | 1 (0,1) | 0,035 |
| Cardiopatía isquémica | 442 (47,5) | 301 (27,8) | 0,040 |
| Valvulopatía cardiaca | 80 (8,6) | 296 (27,4) | 0,043 |
| Índice de Charlson >2 | 312 (33,5) | 268 (24,8) | 0,047 |
| FEVI (%) | 36 [13] | 61 [11] | <0,001 |
| Signos de la exploración física | |||
| Frecuencia cardiaca (lpm) | 101±26,2 | 99±30,8 | 0,035 |
| Presión arterial sistólica (mmHg) | 145±34,2 | 153±35,0 | <0,001 |
| Presión arterial diastólica (mmHg) | 83±20,1 | 82±20 | 0,218 |
| Electrocardiograma | |||
| QRS >120 ms | 386 (41,5) | 238 (22) | 0,040 |
| Fibrilación auricular | 301 (32,3) | 540 (49,9) | 0,041 |
| Datos de laboratorio | |||
| Urea (mg/dl) | 59,8±30,6 | 59,1±29,6 | 0,583 |
| Hemoglobina (g/dl) | 12,9±1,9 | 12,2±1,8 | <0,001 |
| Sodio (mEq/l) | 139±4 | 139±4 | 0,665 |
| NT-proBNP (pg/ml) | 6.820 [6.233] | 3.875 [3.696] | <0,001 |
| Creatinina al ingreso (mg/dl) | 1,32±0,60 | 1,20±0,55 | <0,001 |
| Tratamiento al alta | |||
| Bloqueadores beta | 632 (67,8) | 635 (58,7) | 0,045 |
| IECA o ARA-II | 666 (71,5) | 705 (65,1) | 0,043 |
| Bloqueadores del receptor de aldosterona | 354 (38,0) | 156 (14,4) | 0,037 |
ARA-II: antagonistas del receptor de la angiotensina II; DAI: desfibrilador automático implantable; EPOC: enfermedad pulmonar obstructiva crónica; FEVI: fracción de eyección del ventrículo izquierdo; IC: insuficiencia cardiaca; ICFSc: insuficiencia cardiaca con función sistólica conservada; ICFSr: insuficiencia cardiaca con función sistólica reducida; IECA: inhibidores de la enzima de conversión de la angiotensina; NT-proBNP: fracción aminoterminal del propéptido natriurético cerebral; NYHA: clase funcional de la New York Heart Association.
Los valores expresan n (%), media±desviación estándar o mediana [intervalo intercuartílico].
En todos los análisis se consideró estadísticamente significativo un valor bilateral de p<0,05. Todos los análisis de supervivencia se llevaron a cabo con el programa Stata Statistical Software, versión 14.1 (StataCorp. 2014; College Station, Texas, Estados Unidos).
RESULTADOSCaracterísticas basales de los pacientesDe los 2.013 pacientes incluidos en este estudio, 1.082 (53,7%) y 931 (46,2%) tenían ICFSc e ICFSr. La media de edad era 72,8±11,2 años, un 51% eran mujeres, en un 36,9% la etiología era isquémica y el 48,4% tenía un ingreso previo por ICA. Las características basales de los pacientes con ICFSc e ICFSr se resumen en la tabla 1. En general, se observaron diferencias basales importantes entre los 2 grupos. Los pacientes con ICFSc eran de más edad y con mayor frecuencia mujeres y tenían mayores prevalencias de hipertensión y fibrilación auricular. En cambio, los pacientes con ICFSc tenían menores prevalencias de cardiopatía isquémica y bloqueo completo de rama del haz y una puntuación media del índice de Charlson inferior. Es de destacar que los pacientes con ICFSc tenían valores de NT-proBNP y de creatinina sérica al ingreso inferiores (tabla 1).
Riesgo de mortalidad: insuficiencia cardiaca con función sistólica conservada frente a insuficiencia cardiaca con función sistólica reducidaTras una mediana de seguimiento de 2,36 [0,96-4,65] años, 1.018 (50,6%) habían fallecido. De estas muertes, 480 (47,1%) se registraron como muertes de causa CV. Las tasas de incidencia brutas de la mortalidad por cualquier causa fueron similares en los 2 grupos: 16,2 eventos/100 personas-año en el grupo con ICFSc frente a 16,7/100 personas-año en el de ICFSr (log-rank test, p=0,794). Los pacientes con ICFSc presentaron unas tasas de muerte de causa CV inferiores. Las tasas de incidencia brutas de la mortalidad de causa CV fueron 6,7/100 personas-año en la ICFSc y 9,0/100 personas-año en la ICFSr (log-rank test, p=0,002). En la figura 1 se muestran las curvas de Kaplan-Meier de la mortalidad por cualquier causa y la mortalidad de causa CV en la ICFSc y la ICFSr. Por lo que respecta a las causas específicas de las muertes de origen CV, no se observaron diferencias entre los 2 grupos en las muertes por infarto de miocardio o las relacionadas con ictus (log-rank test, p=0,134 y p=0,452 respectivamente). En cambio, los pacientes con ICFSc mostraron tendencia a tasas de muerte súbita cardiaca más bajas (log-rank test, p=0,098) y menor incidencia de muertes relacionadas con la IC (log-rank test, p=0,015). Las tasas de incidencia brutas de las causas específicas de muerte de origen CV en los 2 grupos se presentan en la .
A: curvas de Kaplan-Meier de la mortalidad por cualquier causa para la insuficiencia cardiaca con función sistólica conservada y reducida. B: Curvas de Kaplan-Meier de la mortalidad de causa cardiovascular para la insuficiencia cardiaca con función sistólica conservada y reducida. ICFSc: insuficiencia cardiaca con función sistólica conservada; ICFSr: insuficiencia cardiaca con función sistólica reducida.
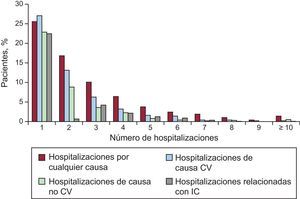
En todo el periodo de seguimiento, se registró un total acumulado de 3.804 reingresos de 1.406 pacientes (69,8%). Es de destacar que en el transcurso del estudio 552 pacientes (27,4%) tuvieron al menos 3 reingresos y 219 (10,9%), al menos 5. Por lo que respecta a las causas específicas, se registraron 2.233 reingresos de causa CV de 1.085 pacientes (53,9%), 1.571 reingresos debidos a causas no CV de 806 pacientes (40,0%) y 1.589 reingresos por IC que motivaron que 831 pacientes (41,3%) fueran rehospitalizados como consecuencia de un agravamiento de la IC al menos en una ocasión. En la figura 2 se muestra la distribución del número de hospitalizaciones por cualquier causa, de causa CV, de causa no CV y relacionadas con la IC en el conjunto de la cohorte de estudio.
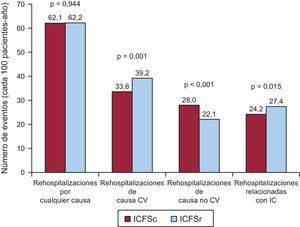
Las tasas de incidencia brutas por rehospitalizaciones cada 100 personas-año según la FEVI se presentan en la figura 3. En general, no hubo diferencias en la carga de rehospitalizaciones por cualquier causa entre la ICFSc y la ICFSr (62,1 frente a 62,2/100 personas-año; p=0,944). No obstante, los pacientes con ICFSc reingresaron con menos frecuencia por causas CV (33,6 frente a 39,2/100 personas-año; p=0,001). Concretamente, no se observaron diferencias significativas en cuanto a los reingresos por infarto agudo de miocardio (3,0 frente a 2,9/100 personas-año; p=0,788) o por ictus (2,2 frente a 1,8/100 personas-año; p=0,316). En cambio, se observaron diferencias significativas entre los reingresos relacionados con la IC (24,2 frente a 27,4; p=0,015) y los de otras causas CV (4,1 frente a 7,1/100 personas-año; p<0,001). Por otro lado, los pacientes con ICFSc presentaron mayores tasas de incidencia de rehospitalizaciones de causa no CV (28,0 frente a 22,1/100 personas-año; p<0,001).
Tasa de incidencia bruta de hospitalizaciones por cualquier causa, de causa cardiovascular, de causa no cardiovascular y relacionadas con la insuficiencia cardiaca en pacientes con función sistólica conservada o reducida. CV: cardiovascular; IC: insuficiencia cardiaca; ICFSc: insuficiencia cardiaca con función sistólica conservada; ICFSr: insuficiencia cardiaca con función sistólica reducida.
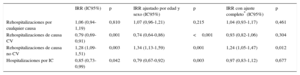
En el análisis con ajuste por edad y sexo, los pacientes con ICFSc continuaron mostrando mayor riesgo de reingreso de causa no CV, pero también un riesgo de reingresos de causa CV y relacionados con la IC ligeramente inferior (tabla 2). El efecto en el riesgo de reingreso por cualquier causa fue neutro. Tras introducir un ajuste multivariable completo, el riesgo de reingresos por cualquier causa con el paso del tiempo se mantuvo en niveles similares en los dos grupos. Así, en comparación con los pacientes con ICFSr, los que tenían ICFSc mostraron similar riesgo de reingreso por cualquier causa (IRR=1,04; intervalo de confianza del 95% [IC95%], 0,93-1,17; p=0,461). De igual modo, el riesgo ajustado de reingreso de causa CV y relacionado con la IC no mostró diferencias entre los pacientes con ICFSc y con ICFSr (IRR=0,93; IC95%, 0,82-1,06; p=0,304, e IRR=0,96; IC95%, 0,83-1,13; p=0,677). En cambio, los pacientes con ICFSc continuaron presentando un aumento significativo, de un 24%, en el riesgo de reingresos por causas no CV (IRR=1,24; IC95%, 1,05-1,47; p=0,012). En la tabla 2 se presentan las estimaciones del riesgo sin ajustar, ajustadas por edad y sexo y con ajuste completo sobre hospitalizaciones por cualquier causa, de causa CV, de causa no CV y relacionadas con la IC previamente descritas. En la , se puede consultar los modelos multivariables detallados, incluidas todas las covariables y sus estimaciones de riesgo.
Tasas de incidencia de rehospitalizaciones en la insuficiencia cardiaca con función sistólica conservada frente a la insuficiencia cardiaca con función sistólica reducida
| IRR (IC95%) | p | IRR ajustado por edad y sexo (IC95%) | p | IRR con ajuste completo* (IC95%) | p | |
|---|---|---|---|---|---|---|
| Rehospitalizaciones por cualquier causa | 1,06 (0,94-1,19) | 0,810 | 1,07 (0,96-1,21) | 0,215 | 1,04 (0,93-1,17) | 0,461 |
| Rehospitalizaciones de causa CV | 0,79 (0,69-0,91) | 0,001 | 0,74 (0,64-0,86) | <0,001 | 0,93 (0,82-1,06) | 0,304 |
| Rehospitalizaciones de causa no CV | 1,28 (1,09-1,51) | 0,003 | 1,34 (1,13-1,59) | 0,001 | 1,24 (1,05-1,47) | 0,012 |
| Hospitalizaciones por IC | 0,85 (0,73-0,99) | 0,042 | 0,79 (0,67-0,92) | 0,003 | 0,97 (0,83-1,12) | 0,677 |
CV: cardiovascular; IC: insuficiencia cardiaca; IC95%: intervalo de confianza del 95%; ICFSc: insuficiencia cardiaca con función sistólica conservada; ICFSr: insuficiencia cardiaca con función sistólica reducida; IRR: cociente de tasas de incidencia.
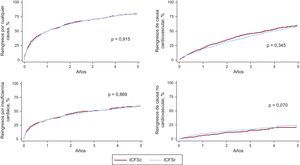
El riesgo de reingreso por cualquier causa, de causa CV y relacionado con la IC no mostró diferencias en relación con el estado de la FEVI. Por lo que respecta al reingreso de causa no CV, los pacientes con ICFSc mostraron tendencia a mayor riesgo que los pacientes con ICFSr. En la figura 4 se muestran los gráficos de incidencia acumulada.
Gráficos de incidencia acumulada del tiempo hasta el primer reingreso por cualquier causa, de causa cardiovascular, relacionado con la insuficiencia cardiaca y de causa no cardiovascular en la insuficiencia cardiaca con función sistólica conservada y la insuficiencia cardiaca con función sistólica reducida. ICFSc: insuficiencia cardiaca con función sistólica conservada; ICFSr: insuficiencia cardiaca con función sistólica reducida.
En este estudio, se observa que la carga acumulada de hospitalizaciones tras un episodio de ICA continua siendo prohibitivamente alta con independencia de la FEVI. Aunque no se apreciaron diferencias manifiestas en cuanto al riesgo de reingresos por cualquier causa, de causa CV o relacionados con la IC, los pacientes con ICFSc mostraron un aumento moderado del riesgo de rehospitalizaciones de causa no CV durante el seguimiento a largo plazo. Hasta donde nosotros sabemos, este es el primer estudio que examina la carga de reingresos de la ICFSc y la ICFSr con una metodología apropiada para el análisis de eventos repetidos. Además, tal como se ha descrito en gran parte de estudios previos16–19, el riesgo de mortalidad fue similar en los 2 grupos de pacientes.
Carga de rehospitalizaciones en la insuficiencia cardiaca: necesidad de una descripción más detalladaLa IC es un síndrome clínico caracterizado por frecuentes eventos de descompensación clínica que motivan una gran carga de hospitalizaciones2. De hecho, más del 50% de los pacientes con ICA regresan al hospital en un plazo de 6 meses tras el alta8. Una vez que el paciente ha tenido un reingreso, el riesgo de nuevas descompensaciones y de progresión de la enfermedad y el posterior riesgo de mortalidad aumentan de manera sustancial2,21.
No obstante, la mayor parte de la evidencia existente respecto al riesgo de las hospitalizaciones y sus consecuencias deletéreas en la IC procede de análisis clásicos basados en el método de «tiempo hasta el primer» evento, que no tiene en consideración gran cantidad de información relativa a los episodios posteriores al primer reingreso. Este es un aspecto muy importante, puesto que la evolución natural del paciente con IC se caracteriza por eventos de rehospitalización recurrentes. En consonancia con lo indicado por otros autores9–11, nosotros abogamos por una mejor caracterización de la carga de morbilidad existente en la IC mediante un análisis de los eventos recurrentes con el paso del tiempo, en vez de utilizar la metodología tradicional de «tiempo hasta el primer» evento22.
Hasta la fecha, la experiencia obtenida en los análisis de eventos repetidos en la IC continúa siendo escasa, pero hay cada vez más evidencia que indica su utilidad. Por ejemplo, el análisis del «tiempo hasta el primer» evento en el ensayo SHIFT no tuvo en cuenta un 44% de las hospitalizaciones por IC que se produjeron durante el periodo de seguimiento23. En una cohorte de 1.077 pacientes con IC de nuevo inicio, Dunlay et al.3 indicaron que un 83% de ellos fueron hospitalizados al menos en una ocasión, pero tiene interés señalar también que un 43% de los pacientes fueron hospitalizados al menos 4 veces en un plazo de 5 años tras el diagnóstico. En nuestro estudio, el 70% de los pacientes fueron rehospitalizados durante el seguimiento como mínimo en una ocasión, y cerca de un 30% de ellos tuvieron al menos 3 reingresos. Además, un análisis de los eventos repetidos puede aumentar la capacidad de detectar efectos del tratamiento en mayor medida que la metodología clásica de «tiempo hasta el primer» evento, como ha ocurrido en los ensayos CHARM, CORONA, SHIFT o EMPHASIS-HF10,11,23,24. Por ejemplo, en el ensayo CORONA, rosuvastatina mostró un efecto protector moderado en el tiempo hasta el primer reingreso de los pacientes con ICFSr que estaba en el límite de la significación estadística; sin embargo, en un análisis post-hoc, rosuvastatina se asoció a una reducción mayor, estadísticamente significativa, del riesgo de reingreso11. De manera análoga, en nuestro estudio, la ICFSc se asoció a una tendencia no significativa en los reingresos de causa no CV en el análisis del tiempo hasta el primer reingreso. En cambio, teniendo en cuenta la carga total de episodios de reingreso, la ICFSc mostró un riesgo de hospitalización de causa no CV un 24% superior que alcanzaba significación estadística. Actualmente, esta metodología se aplica como objetivo principal preespecificado en ensayos clínicos en la IC que están en curso, como el estudio PARAGON-HF25.
Hospitalizaciones repetidas: insuficiencia cardiaca con función sistólica conservada frente a insuficiencia cardiaca con función sistólica reducidaLa IC es un síndrome clínicamente heterogéneo con una fisiopatología compleja y multifactorial, pero la distinción más frecuente que se establece es la basada en el estado de la FEVI. La ICFSr es una entidad relativamente bien conocida, para la que hay recomendaciones terapéuticas bien establecidas1. En cambio, la ICFSc es una enfermedad compleja que está estrechamente relacionada con diferentes comorbilidades extracardiacas y para la que no hay tratamientos específicos15. A pesar de estas diferencias manifiestas entre la ICFSr y la ICFSc, el riesgo de mortalidad parece ser similar en ambos trastornos16–19. Sin embargo, los datos existentes sobre el riesgo y el patrón de las rehospitalizaciones en los 2 grupos tras el alta de una hospitalización por ICA continúan siendo escasos.
En estudios previos se ha demostrado que el riesgo de reingreso tras el alta de una hospitalización por ICA, en un análisis clásico de «tiempo hasta el primer» evento, es comparable en la ICFSc y la ICFSr, analizada tanto a corto16 como a largo plazo26. Sin embargo, el patrón de los reingresos parece ser diferente. Estudios previos han indicado que los pacientes con ICFSc tienen mayor probabilidad de reingreso por causas no CV. Hasta un 44% del total de reingresos de los pacientes incluidos en el ensayo I-PRESERVE se debieron a causas no CV27. En el programa CHARM, las tasas de rehospitalizaciones por causa no CV fueron mayores en los pacientes con FEVI ≥ 40% que en los de FEVI<40%6. Tiene interés que las hospitalizaciones de causa no CV se asociaran a un riesgo de mortalidad posterior comparable a las de causas CV6. De igual modo, en un amplio estudio de Cheng et al.18, en el que se incluyó a 40.239 pacientes con IC crónica, el riesgo de reingresos de causa no CV fue superior en los pacientes con ICFSc que en los pacientes con ICFSr. En cambio, las tasas de reingresos de causa CV o relacionados con la IC fueron mayores en los pacientes con ICFSr.
No obstante, son muy pocos los estudios que han examinado comparativamente la carga de ingresos de la ICFSc y la ICFSr teniendo en cuenta los análisis de eventos repetidos. Desai et al.6 observaron que la FEVI no es un factor independiente predictivo del total de rehospitalizaciones de los pacientes con IC de aparición reciente. Chun et al.26 realizaron un análisis de las rehospitalizaciones de 8.543 pacientes tras el alta de una hospitalización por una ICA de nueva aparición, y no observaron diferencias manifiestas entre la ICFSc y la ICFSr en cuanto al riesgo de reingreso de causa CV o relacionado con la IC. Sin embargo, los pacientes con ICFSc presentaron un moderado aumento del riesgo ajustado de reingresos de causa no CV. En ese estudio se utilizó un análisis de regresión de Cox para los análisis de eventos repetidos9 y se evaluó una cohorte de pacientes reclutados entre 1999 y 2001, de manera que tal vez no sea posible extrapolar la metodología y los resultados descritos a la época actual. En el presente estudio se avanzó un paso más, y se evaluaron los eventos repetidos en la época actual. Los datos de nuestro estudio confirman que la carga de morbilidad total, incluida la totalidad de las hospitalizaciones repetidas, es similar sea cual sea el estado de la FEVI. De igual modo, y en consonancia con lo indicado por estudios previos, se observó un aumento del riesgo de rehospitalizaciones de causa no CV en la ICFSc. En consonancia en estudios previos, y en comparación con los pacientes con ICFSr, los que tenían ICFSc han mostrado mayor probabilidad de muerte por causas no CV28. Aunque un modelo con ajuste por edad y sexo mostró que la ICFSr predice un exceso de riesgo de reingresos de causa CV y relacionados con la IC, en un modelo con ajuste completo utilizando las covariables pronósticas tradicionales, no mostró tal asociación.
Creemos que los resultados del presente estudio describen, de manera detallada, la carga de actual mortalidad excesivamente alta de la IC, con independencia de la presencia o ausencia de disfunción sistólica. Además, nuestros datos refuerzan la idea de desarrollar programas de tratamiento integrales y multidisciplinarios para la IC que vayan más allá de los tratamientos específicos cardiacos, con la finalidad de centrarse no solo en la prevención de los reingresos de causa CV o relacionados con la IC, sino también de las hospitalizaciones de causa no CV. Este enfoque parece ser especialmente importante en el caso de la ICFSc, un trastorno para el que aún se carece de tratamientos establecidos y en el que las comorbilidades y los reingresos de causa no CV desempeñan un papel tan importante29,30.
Limitaciones del estudioEste estudio tiene ciertas limitaciones. En primer lugar, se trata de un estudio observacional en un solo centro, en el cual puede haber ciertas circunstancias específicas y sesgos ocultos que influyan en el patrón de las hospitalizaciones. En segundo lugar, no se evaluó la influencia de las diferentes causas o patrones de ingreso en el riesgo de los episodios posteriores. En tercer lugar, y partiendo del supuesto de que el fenotipo asociado a la ICFSr difería del asociado a la ICFSc, se podría plantear que puede haber habido un factor de confusión residual que interviniera en la falta de significación existente en la relación entre la ICFSr y los reingresos de etiología específica. En cuarto lugar, la aplicación de la metodología de eventos repetidos en el campo de la IC es relativamente nueva y, por consiguiente, algunos aspectos continúan siendo controvertidos9. Sin embargo, parece clara la ventaja que supone el análisis de eventos repetidos sobre los objetivos tradicionales de «tiempo hasta el primer» evento tanto en potencia estadística como en una mejor evaluación de la carga asociada a la enfermedad.
CONCLUSIONESTras un ingreso por IC aguda, la tasa total de rehospitalizaciones con el paso del tiempo fue similar entre los pacientes con ICFSc y los pacientes con ICFSr. Sin embargo, los pacientes con ICFSc tuvieron mayor probabilidad de reingreso por causas no CV.
FINANCIACIÓNEste trabajo fue financiado en parte por subvenciones del Instituto de Salud Carlos III y FEDER, Red de Investigación Cardiovascular, Programa 7 (RD12/0042/0010) y PIE15/00013.
CONFLICTO DE INTERESESNinguno.
- –
El riesgo de eventos adversos para los pacientes con insuficiencia cardiaca y función sistólica conservada y con función sistólica reducida es similar.
- –
La evolución natural de la insuficiencia cardiaca se caracteriza por repetidos ingresos hospitalarios por causas tanto cardiovasculares como no cardiovasculares.
- –
Tal como señalan actualmente diferentes autores, el análisis de eventos repetidos es el método más adecuado para abordar la evaluación del riesgo de reingreso hospitalario en la insuficiencia cardiaca.
- –
Es poco lo que se sabe acerca de la carga de reingresos hospitalarios de los pacientes con insuficiencia cardiaca con el paso del tiempo evaluada mediante un análisis longitudinal de eventos repetidos.
- –
Los pacientes con insuficiencia cardiaca y función sistólica conservada presentan una gran carga de reingresos con el tiempo, de manera similar a lo que ocurre en los pacientes con insuficiencia cardiaca y función sistólica reducida.
- –
Los pacientes con insuficiencia cardiaca y función sistólica conservada tienen mayor probabilidad de reingreso por causas no cardiovasculares.