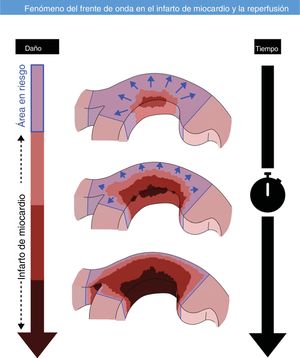
Está establecido que la necrosis secundaria a una oclusión coronaria se inicia en el subendocario y progresa hacia el subepicardio. Sin embargo, hay controversia sobre la posibilidad de que la onda de progresión del infarto sea lateral, además de transmural, y es el objetivo de este trabajo.
MétodosSe estudió la extensión del infarto en las dimensiones transmural y lateral en 220 pacientes con infarto agudo de miocardio del ensayo METOCARD-CNIC (Efecto del metoprolol en la cardioprotección durante un infarto agudo de miocardio). Los pacientes se sometieron a 2 resonancias magnéticas.
ResultadosEn la resonancia de los días 5-7 posinfarto, se encontró una fuerte correlación lineal entre las extensiones transmural y lateral del infarto (realce tardío de gadolinio) (r=-0,88; p <0,001). A los 6 meses, la extensión del realce tardío de gadolinio tanto transmural como lateral se había reducido de manera significativa, lo que indica que la reabsorción del infarto ocurre en ambas dimensiones. La progresión del infarto ocurrió en ambas dimensiones tanto en pacientes que recibieron metoprolol como en los controles, lo cual demuestra que la cardioprotección se produce limitando la necrosis tanto transmural como lateralmente.
ConclusionesNuestros hallazgos cuestionan el dogma de que la progresión del infarto solo se produce en sentido transmural. Mostramos que el infarto progresa de forma circunferencial (en sentido tanto transmural como lateral). Esto implica que las terapias cardioprotectoras pueden asociarse con miocardio salvado en los bordes laterales del infarto.
Este estudio ha sido registrado en ClinicalTrial.gov (Identificador: NCT01311700).
Palabras clave
La teoría del frente de progresión de la necrosis miocárdica (wavefront phenomenon) se describió por primera vez en 1977 en un modelo canino de infarto de miocardio1. Esta teoría, ampliamente aceptada, propone que la necrosis miocárdica durante una oclusión coronaria aguda progresa temporalmente desde el subendocardio hacia el subepicardio, sin que haya una extensión en dirección lateral2,3. No obstante, este concepto de progresión temporal exclusivamente desde el endocardio al epicardio se ha cuestionado en estudios que argumentan que los perros tienen un sistema de colaterales coronarias epicárdicas muy desarrollado, que hace que el subendocardio sea la región del miocardio más vulnerable en esa especie. Esta crítica tiene en cuenta la heterogeneidad transmural de la pared del ventrículo izquierdo (VI), con evidentes diferencias en el flujo sanguíneo miocárdico, el metabolismo, la contracción y la dinámica de relajación; en comparación con la capa subepicárdica, el subendocardio tiene una demanda de oxígeno, una presión miocárdica y una tensión de contracción superiores4. Además, Reimer y Jennings describieron que los márgenes laterales del infarto en la región subendocárdica quedan establecidos durante la primera hora de oclusión coronaria, y están claramente definidos por los límites anatómicos del lecho isquémico en riesgo5. Posteriores estudios anatómicos detallados lo respaldaron al demostrar que las anastomosis de colaterales intramurales y epicárdicas en los perros y en el ser humano tienen bucles de capilares terminales sin conexiones microvasculares entre lechos vasculares adyacentes; sin embargo, se han descrito observaciones diferentes en otras especies6. Estos resultados respaldaron la opinión general de que no había fundamento anatómico alguno para plantear una extensión lateral del borde de la zona en riesgo.
La teoría de la progresión de la necrosis exclusivamente del endocardio al epicardio motivó numerosos estudios de evaluación de tratamientos de cardioprotección7,8. La teoría estableció la idea de que hay una gran área de miocardio subepicárdico en el lecho isquémico que podría salvarse con una reperfusión temprana, pero que de otro modo moriría. Esta «teórica» área en riesgo puede incluir tanto miocardio infartado (no viable) como miocardio salvable (viable) y sienta las bases para la generalización de la revascularización temprana tras un infarto agudo de miocardio con elevación del segmento ST (IAMCEST)9. El objetivo de este planteamiento es evitar no solo los infartos grandes, sino también cicatrices transmurales, puesto que ambos factores se han asociado con mal pronóstico2,10,11.
A pesar de la abundante evidencia que respalda una progresión exclusivamente transmural de la necrosis durante un infarto, existen datos contradictorios respecto al papel que desempeñan en cada especie concreta las colaterales en la susceptibilidad del subendocardio; además, algunos estudios indican una discrepancia entre el borde lateral de los infartos subendocárdicos y el borde lateral del lecho vascular preexistente de la arteria coronaria principal ocluida12-14. Estas observaciones cuestionan la teoría previamente establecida de la progresión de la necrosis exclusivamente del endocardio al epicardio. El cambio de paradigma a considerar que abría una ola circunferencial de progresión del infarto implicaría que los tratamientos cardioprotectores también podrían salvar una proporción relevante del miocardio en los bordes laterales del infarto.
En este estudio se presenta la evaluación del infarto de miocardio en sus dimensiones transmural y lateral en una cohorte de pacientes con IAMCEST del ensayo METOCARD-CNIC (Effect of Metoprolol in Cardioprotection During an Acute Myocardial Infarction)15. Se evaluaron los datos de cardiorresonancia magnética (CRM) disponibles en una fase temprana tras el infarto (5-7 días después del IAMCEST) y en una fase tardía (6 meses después del IAMCEST). Los objetivos del presente estudio fueron los siguientes: a) describir la extensión transmural y lateral del daño miocárdico después de un infarto agudo miocardio; b) evaluar la evolución espacial del proceso de cicatrización en ambas dimensiones, y c) evaluar la extensión transmural y lateral del infarto y la evolución espacial del proceso de cicatrización en ambas dimensiones estratificando la cohorte según el grupo de asignación aleatoria (control frente a metoprolol).
MÉTODOSPoblación del estudio e intervenciónFormaron la población del estudio los pacientes incluidos en el ensayo METOCARD-CNIC (NCT01311700)15-18. En el METOCARD-CNIC se inscribió a 270 pacientes con un primer IAMCEST anterior tratados con una intervención coronaria percutánea primaria. Se aleatorizó a los pacientes a la administración intravenosa (i.v.) de metoprolol (en dosis de hasta 15mg) antes de la intervención coronaria percutánea primaria o a un tratamiento convencional (sin metoprolol i.v.). Los criterios de inclusión y exclusión se han descrito ya en otras publicaciones15,16. Todos los pacientes recibieron metoprolol oral (primera dosis a las 12-24 h de la reperfusión), con independencia del grupo de tratamiento al que hubieran sido asignados en la aleatorización. Se realizó una CRM a 220 pacientes al cabo de 1 semana (5-7 días) y a 215 de esos mismos pacientes a los 6 meses del IAMCEST. No hubo diferencias entre los grupos en cuanto a los factores demográficos, el perfil de riesgo cardiovascular o las características de la intervención15.
Adquisición de los datos de cardiorresonancia magnéticaLa descripción detallada del protocolo de CRM y de los métodos de análisis de esta puede encontrarse en publicaciones previas15,16. Los análisis de las imágenes de CRM se realizaron en el laboratorio central ubicado en el Centro Nacional de Investigaciones Cardiovasculares Carlos III (CNIC). La adquisición de los datos se realizó con escáneres de CRM de 1,5 y 3,0 T. Se utilizaron imágenes de cine funcionales de precesión libre en estado de equilibrio estable para la adquisición de las proyecciones de 2, 3 y 4 cámaras y una pila de cortes contiguos en el eje corto para cubrir la totalidad del VI. Los parámetros de adquisición de los datos fueron los siguientes: tamaño de vóxel, 1,6×2mm; grosor de corte, 8mm; brecha, 0mm; fases cardiacas, 25-30; TR, 3,5; TE, 1,7; ángulo de flip, 40; SENSE, 1,5; promedios, 1; FOV, 360×360mm. Para las imágenes de la necrosis/fibrosis miocárdica, se utilizó la adquisición de una secuencia de eco-gradiente de recuperación de inversión segmentada 10-15min después de la administración i.v. de una dosis acumulada de 0,2 mmol/kg de medio de contraste de gadolinio (Magnevist, Schering AG, Alemania).
Evaluación de los datos de cardiorresonancia magnética convencionalLos datos de CRM se analizaron con un programa informático específico para ello (QMass MR 7.5, Medis, Países Bajos), ya descrito con anterioridad19. Se utilizó el grado de realce tardío de gadolinio (RTG) como indicador indirecto del tamaño del infarto (región necrótica)20. Se calcularon las áreas con RTG positivo con el método de anchura total a la mitad de la altura máxima (full-width-half-maximum)15. Se midieron los volúmenes telediastólicos del VI.
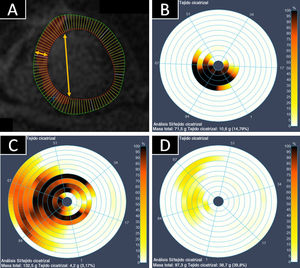
Evaluación de la extensión lateral y transmural del infarto en la cardiorresonancia magnéticaSe trazaron los contornos endocárdico y epicárdico de cada corte en el eje corto del VI, y cada contorno se dividió en 100 cuerdas radiales para una evaluación más detallada (figura 1). Cada cuerda atravesaba el miocardio e incluía, por lo tanto, subendocardio y subepicardio. Con este enfoque, se caracterizó la extensión del infarto en sus 2 dimensiones: a) lateral (porcentaje de cuerdas contiguas con miocardio con RTG positivo en cada corte), y b) transmural (porcentaje de realce dentro de cada cuerda). Para la dimensión transmural, un 10% indica la afección de solo una pequeña parte de la cuerda (el subendocardio inmediato) y un 100%, la afección de toda la cuerda. Todos los cortes (y sus porcentajes de afección transmural y lateral asociados) se ponderaron en función de su masa relativa para obtener un porcentaje medio final de extensión lateral y transmural. Evaluadores a los que se ocultó el grupo de tratamiento asignado a los pacientes evaluaron y compararon las imágenes.
Evaluación de la extensión transmural y lateral del infarto mediante cardiorresonancia magnética (CRM). A: imagen de realce tardío de gadolinio en el eje corto, que muestra la subdivisión en 100 cuerdas para el análisis posterior; la transmuralidad indica la afección del miocardio cuantificada del endocardio al epicardio (flecha horizontal); la lateralidad se midió con el número de cuerdas en el área infartada (flecha vertical); cada corte se ponderó en función de su masa. B-D: gráficos de diana de 3 infartos representativos en la CRM a los 5 días; la gama de colores del blanco al negro indica el porcentaje de necrosis transmural en cada cuerda: el color blanco indica ausencia de realce tardío de gadolinio (RTG), mientras que el negro indica RTG transmural completo. B: las cuerdas negras indican un infarto transmural; la afección de pocas cuerdas y cortes indica que el tamaño del infarto es pequeño. C: un infarto con extensión lateral y transmural. D: un infarto no transmural pequeño. Esta figura se muestra a todo color solo en la versión electrónica del artículo.
El estudio fue aprobado por los comités de ética de investigación y los comités de revisión internos pertinentes de cada centro participante. Todos los pacientes aptos para el estudio dieron su consentimiento informado por escrito. Todos los procedimientos realizados en los pacientes se atuvieron a las normas éticas del comité de investigación de cada centro, así como a lo establecido en la Declaración de Helsinki de 1964 y sus enmiendas posteriores, o a unas normas éticas comparables.
Métodos estadísticosLas características basales cualitativas se expresan en forma de frecuencia (%) y se compararon las de los 2 grupos mediante la prueba de la χ2. Las variables basales continuas se expresan en forma de media± desviación estándar y se compararon las de los 2 grupos con la prueba de la t de Student para datos no emparejados. Se representaron gráficamente los porcentajes de extensión lateral del infarto en la CRM frente a sus correspondientes porcentajes de extensión transmural del infarto, y se calculó el coeficiente de correlación de Pearson para evaluar la fuerza de su asociación. Se utilizaron pruebas de la t para datos emparejados para la evaluación longitudinal en el tiempo (CRM temprana frente a tardía) de la extensión lateral y transmural del infarto.
La repercusión del metoprolol en los tamaños lateral, transmural y total del infarto de miocardio se evaluó con modelos de regresión lineal, y se presentan las estimaciones del efecto del tratamiento junto con el intervalo de confianza del 95% (IC95%) sin ajustar. Dado el carácter conceptual del estudio, todos los análisis se realizaron según el principio de análisis por protocolo (tan solo hubo 3 casos de cambio de grupo de tratamiento en esta cohorte)15.
Las diferencias se consideraron estadísticamente significativas con un valor de p < 0,05. Todos los análisis estadísticos se realizaron con el programa STATA versión 15.1 (Stata Corp, Estados Unidos). Algunas figuras se elaboraron con el programa GraphPad Prism 6.00 (GraphPad Software, Estados Unidos).
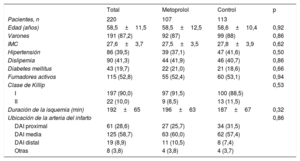
RESULTADOSPoblación en estudioEn el estudio se incluyó a un total de 220 pacientes con datos de CRM obtenidos 5-7 días después del IAMCEST (de los que 107 recibieron metoprolol y 113 fueron controles). La mayoría de los participantes en el estudio eran varones (87,2%), y se encontraron altas tasas de factores de riesgo cardiovascular: tabaquismo activo (52,8%), dislipemia (41,3%), hipertensión (39,5%) y diabetes mellitus (19,7%). No hubo diferencias significativas entre los grupos respecto a las características basales y la forma de presentación clínica (tabla 1) o la duración media de la isquemia (196±63min en el grupo de metoprolol frente a 187±67min en el grupo de control; p=0,32).
Características basales de los pacientes según el grupo de estudio
| Total | Metoprolol | Control | p | |
|---|---|---|---|---|
| Pacientes, n | 220 | 107 | 113 | |
| Edad (años) | 58,5±11,5 | 58,5±12,5 | 58,6±10,4 | 0,92 |
| Varones | 191 (87,2) | 92 (87) | 99 (88) | 0,86 |
| IMC | 27,6±3,7 | 27,5±3,5 | 27,8±3,9 | 0,62 |
| Hipertensión | 86 (39,5) | 39 (37,1) | 47 (41,6) | 0,50 |
| Dislipemia | 90 (41,3) | 44 (41,9) | 46 (40,7) | 0,86 |
| Diabetes mellitus | 43 (19,7) | 22 (21,0) | 21 (18,6) | 0,66 |
| Fumadores activos | 115 (52,8) | 55 (52,4) | 60 (53,1) | 0,94 |
| Clase de Killip | 0,53 | |||
| I | 197 (90,0) | 97 (91,5) | 100 (88,5) | |
| II | 22 (10,0) | 9 (8,5) | 13 (11,5) | |
| Duración de la isquemia (min) | 192±65 | 196±63 | 187±67 | 0,32 |
| Ubicación de la arteria del infarto | 0,86 | |||
| DAI proximal | 61 (28,6) | 27 (25,7) | 34 (31,5) | |
| DAI media | 125 (58,7) | 63 (60,0) | 62 (57,4) | |
| DAI distal | 19 (8,9) | 11 (10,5) | 8 (7,4) | |
| Otras | 8 (3,8) | 4 (3,8) | 4 (3,7) |
DAI: arteria coronaria descendente anterior izquierda; IMC: índice de masa corporal.
Análisis llevado a cabo según el principio de análisis por protocolo.
Los valores expresan n (%) o media±desviación estándar.
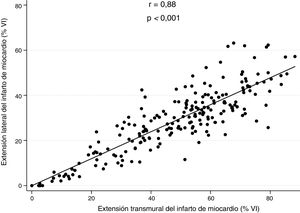
Se observó una fuerte correlación lineal entre el tamaño transmural y el tamaño lateral del infarto (r=0,88; p <0,001) (figura 2), que se mantuvo tras un ajuste por la duración de la isquemia (p <0,001). Se identificó una asociación similar en los diversos terciles de duración de la isquemia: el tercil inferior que incluía los tiempos de isquemia más breves (r=0,92; p <0,001), el tercil medio (r=0,86; p <0,001) y el tercil superior que incluía los tiempos de isquemia más largos (r=0,86; p <0,001).
Correlación entre la extensión lateral y la extensión transmural en la cardiorresonancia magnética temprana (días 5-7). Se observó una correlación lineal intensa entre el tamaño transmural y el tamaño lateral del infarto (r=0,88; p <0,001), que se mantuvo tras un ajuste respecto a la duración de la isquemia (p <0,001). VI: ventrículo izquierdo.
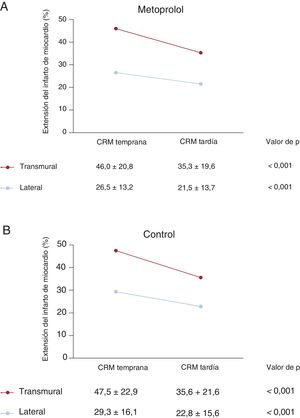
Se realizaron exploraciones de CRM 6 meses después del IAMCEST para poder analizar el proceso de cicatrización del miocardio en ambas dimensiones entre la fase temprana posinfarto (CRM inicial a los 5-7 días) y la fase tardía (CRM a los 6 meses). A los 6 meses del IAMCEST, el miocardio infartado fue menor en ambas dimensiones (figura 3). La extensión media del infarto lateral a los 5-7 días y a los 6 meses del IAMCEST fue del 27,9%±14,8% y el 22,2%±14,7% respectivamente (p <0,001). La transmuralidad se redujo también de manera significativa; el porcentaje medio de transmuralidad en los días 5-7 fue del 46,8%±21,9% y a los 6 meses, del 35,4%±20,6% (p <0,001). Estos cambios paralelos tuvieron lugar junto con un aumento del volumen telediastólico del VI, que pasó de 171,5±36,0ml a los 5-7 días del IAMCEST a 190,6±42,8ml a los 6 meses (p <0,001).
Evolución de la extensión transmural y la extensión lateral del infarto determinada mediante cardiorresonancia magnética (CRM). Se realizaron exploraciones de CRM secuenciales para analizar el proceso de cicatrización del miocardio en ambas dimensiones, entre la fase temprana posinfarto (CRM inicial a los 5-7 días) y la fase tardía (CRM a los 6 meses). A los 6 meses del IAMCEST, el miocardio infartado fue menor en ambas dimensiones.
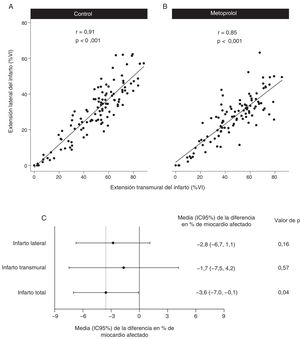
En coincidencia con resultados previos, el tamaño del infarto transmural mostró una correlación lineal directa con el tamaño del infarto lateral, tanto en el grupo de control (r=0,91; p <0,001) (figura 4A) como en el grupo de metoprolol (r=0,85; p <0,001) (figura 4B). Las menores dimensiones del infarto transmural y lateral en el grupo de metoprolol i.v. concordaban con el menor tamaño del infarto en ese grupo en general (figura 4C), si bien la potencia estadística bastó para mostrar solo la significación en el efecto observado en el tamaño total del infarto. A los 6 meses del IAMCEST, el tamaño del infarto se había reducido de manera uniforme en ambas dimensiones en los 2 grupos de tratamiento. En la figura 5 se muestran las diferencias en la progresión de la cicatriz lateral y transmural entre los 2 grupos de tratamiento.
Repercusión del metoprolol i.v. en la extensión lateral y transmural del infarto determinada mediante cardiorresonancia magnética. A y B: correlación entre la extensión lateral y la extensión transmural del infarto en el grupo de control y en el grupo de tratamiento con metoprolol i.v. C: diferencia en las dimensiones del infarto en el grupo de metoprolol i.v. respecto al grupo de control. IC95%: intervalo de confianza del 95%; VI: ventrículo izquierdo.
Nuestro estudio pone de manifiesto que la extensión transmural y lateral del infarto después de un IAMCEST tienen una estrecha correlación, lo cual indica que la progresión de la necrosis durante un infarto de miocardio tiene lugar no solo en la dirección transmural, sino también en dirección lateral. Además, los resultados de las exploraciones secuenciales de CRM tempranas y tardías revelan que la cicatrización del miocardio tiene lugar a través de reducciones del miocardio tanto en dirección transmural como en dirección lateral. Nuestros resultados señalan también a que el metoprolol i.v., un tratamiento cardioprotector con un efecto demostrado, impediría la progresión del infarto en ambas dimensiones. Estas observaciones cuestionan el concepto clásico de una progresión del infarto unidireccional del endocardio al epicardio (figura 6).
Nuestros resultados concuerdan con la teoría clásica del wavefront phenomenon, que plantea la existencia de una zona necrótica inicial en el miocardio subendocárdico que progresa en dirección transmural hacia el subepicardio, con lo que el miocardio subepicárdico queda como un lecho isquémico salvable mediante una reperfusión temprana u otras intervenciones de cardioprotección1,5. La teoría de la progesión transmural se apoya en varias observaciones: a) el ventrículo muestra una heterogeneidad transmural con diferencias sustanciales en el metabolismo y en las propiedades hemodinámicas (contractilidad, flujo sanguíneo, presión, etc.)21,22; la mayor demanda de contractilidad y la mayor necesidad de oxígeno del subendocardio hacen que esta sea la región más vulnerable a la isquemia; b) la circulación colateral coronaria se distribuye en el epicardio7,23; c) estudios anatómicos detallados en perros y en seres humanos han demostrado que las anastomosis colaterales intramurales y epicárdicas tienen bucles de capilares terminales sin conexiones microvasculares entre lechos vasculares adyacentes6. Sin embargo, aunque nuestros resultados no contradicen la teoría transmural clásica, la intensa correlación observada entre la extensión transmural y la extensión lateral del infarto en los pacientes con un IAMCEST indica la existencia de una progresión lateral simultánea, de tal manera que la extensión del infarto en una dirección indica que hay también extensión en la otra. Dada la falta de exploraciones de CRM secuenciales en la fase aguda tras la reperfusión, nuestro estudio parte del supuesto de que la extensión del RTG, que se utilizó como parámetro indicador indirecto del tamaño del infarto de miocardio, es relativamente estable la primera semana.
Está en aumento la evidencia que respalda la existencia de una progresión lateral de la necrosis durante un infarto. Por ejemplo, se ha observado que la parte media del miocardio es la región más vulnerable a la isquemia en las ovejas, que tienen un sistema de colaterales coronarias subendocárdicas preformadas limitado, que hacen que la región subendocárdica sea la más resistente21. Otros estudios han puesto en duda la presencia de unos límites laterales «fijos» en un infarto de miocardio en evolución12,13,24, y han descrito una discrepancia entre el borde lateral de los infartos subendocárdicos aparecidos tras una oclusión arterial coronaria y sus lechos vasculares preexistentes12-14; sin embargo, la mayoría de estos estudios se llevaron a cabo en modelos animales antes de que se dispusiera de las técnicas de diagnóstico por la imagen actuales o en cohortes de pacientes demasiado pequeñas para respaldar unas conclusiones sólidas. Más recientemente, van der Pals et al.25 utilizaron técnicas avanzadas de diagnóstico por la imagen en un modelo canino para mostrar que la transmuralidad del infarto en el borde del área en riesgo medida con tinción de cloruro de trifeniltetrazolio era menos intensa que la existente en la parte central. Esto indicaba un posible fenómeno de progresión lateral, y los autores afirmaron que existe un gradiente de perfusión lateral dentro del territorio de perfusión en la parte media del ventrículo correspondiente a la arteria descendente anterior izquierda ocluida. Estos autores cuantificaron con exactitud el área en riesgo mediante una secuencia MOLLI con ponderación T1, y obtuvieron una coincidencia excelente con las imágenes de perfusión con tomografía computarizada, las mediciones del flujo sanguíneo coronario y la histopatología25.
El aumento del volumen telediastólico del VI entre la CRM temprana y la tardía puede explicarse por una adaptación a la situación de carga adicional existente en el corazón infartado26-29. En paralelo con este cambio, se produjo una disminución del tamaño del infarto en ambas dimensiones en comparación con lo observado en la CRM temprana. Aunque esta observación indica que el infarto transmural se reduce significativamente en el lapso de 6 meses, los cambios en la dimensión lateral deben interpretarse con precaución, dada la dilatación general del VI. Actualmente no es posible determinar si esta dilatación se debe exclusivamente al remodelado del miocardio sano o si refleja también una contribución de la cicatrización del miocardio en su dimensión lateral.
Nuestros resultados se ven respaldados por la evaluación de la repercusión que tiene el metoprolol i.v. en la extensión lateral y transmural del infarto. El metoprolol es un tratamiento cardioprotector consolidado18,30, y el ensayo clínico METOCARD-CNIC fue el primero en comparar 2 estrategias de administración/inicio del tratamiento con un bloqueador beta en pacientes con un IAMCEST a los que se practicó una intervención coronaria percutánea primaria: metoprolol i.v. antes de la reperfusión frente a metoprolol oral después de la reperfusión15. La estrategia de administración de metoprolol i.v. antes de la reperfusión se asoció con infartos de un menor tamaño15, mejoró la fracción de eyección del VI a largo plazo, y tuvo un menor número de casos de disfunción del VI grave crónica y del consiguiente implante de un desfibrilador automático implantable19. Sin embargo, el ensayo METOCARD-CNIC tuvo una potencia estadística insuficiente para mostrar efectos en la mortalidad a 1 año o los reinfartos31. En el presente estudio, la estratificación de los datos de CRM del METOCARD-CNIC según el grupo de tratamiento puso de manifiesto que el metoprolol previno la progresión del infarto y fomentó la cicatrización tanto en la dimensión transmural como en la lateral, si bien esta observación deberá confirmarse mediante pruebas estadísticas formales utilizando términos de interacción en un estudio con la potencia estadística suficiente.
Limitaciones del estudioNuestros resultados tienen varias limitaciones. Aunque se utilizó una técnica de diagnóstico por la imagen con una alta resolución espacial, se carece de una serie cronológica de exploraciones de CRM que permita realizar una evaluación completa de la progresión del frente de onda necrótico. En el ensayo METOCARD-CNIC se utilizó el edema como posible indicador indirecto del área en riesgo; sin embargo, algunos estudios recientes han rebatido el supuesto en el que se basa esta estrategia20,32–35. Las limitaciones de realizar una CRM en un único punto temporal después de una reperfusión inmediata son que la reacción edematosa que se produce en la primera semana no es estable y sigue un patrón bimodal32-35 y que el edema se ve afectado también por los tratamientos de cardioprotección20. Por consiguiente, en este estudio no se pudo cuantificar las tendencias en la salvación de miocardio. Dado que se trata de un estudio de carácter post hoc, la potencia estadística es insuficiente para detectar diferencias entre los grupos de tratamiento en la reducción de las áreas de necrosis lateral y transmural al evaluarlas por separado. Hay que tener precaución al extrapolar nuestras observaciones a regiones del corazón distintas de la parte anterior, aunque es probable que los cambios histológicos observados se produzcan con independencia de la ubicación del IAMCEST36.
CONCLUSIONESNuestros resultados muestran una correlación estrecha entre la extensión transmural y la extensión lateral de la necrosis después de un infarto de miocardio, lo cual indica claramente que la progresión del frente de onda se produce en ambas direcciones. Además, las exploraciones secuenciales de CRM en la fase temprana y la fase tardía tras el IAMCEST revelan que la cicatrización del miocardio se produce tanto en dirección transmural como en dirección lateral. Con el análisis estratificado, la extensión del infarto en ambas direcciones parece verse limitada cuando se emplea un tratamiento antes de la reperfusión con metoprolol, un fármaco con un efecto cardioprotector establecido.
FINANCIACIÓNEl ensayo METOCARD-CNIC fue financiado en parte por el Centro Nacional de Investigaciones Cardiovasculares (CNIC), a través de la subvención traslacional del CNIC 01-2009. Otros patrocinadores fueron el Ministerio de Salud y Política Social de España (EC10-042), la Fundación Mutua Madrileña (AP8695-2011) y un Acuerdo Marco de Investigación (MRA) entre Philips Health Care y el CNIC. X. Rossello ha recibido apoyo del programa de becas de SEC-CNIC CARDIOJOVEN. R. Fernández-Jiménez ha recibido financiación del programa de investigación e innovación Horizonte 2020 de la Unión Europea dentro del acuerdo de subvención Marie Skłodowska-Curie número 707642, y ha recibido la subvención del ISCIII Fondo de Investigación Sanitaria número PI19/01704. BI ha recibido las subvenciones del ISCIII Fondo de Investigación Sanitaria y los fondos ERDF/FEDER (PI16/02110, DTS17/00136, PI13/01979, SAF2015-71613-REDI) relacionadas con este tema. El CNIC cuenta con el apoyo del Ministerio de Ciencia, Innovación y Universidades (MICINN), el Instituto de Salud Carlos III (ISCIII), y la Fundación Pro CNIC, y es un Centro de Excelencia Severo Ochoa (designación del MINECO SEV-2015-0505).
CONFLICTO DE INTERESESLos autores no tienen conflictos de intereses que declarar.
- –
La teoría de la la progresión de la necrosis exclusivamente de endocardio a epicardio (wavefront phenomenon) fue descrita por primera vez en 1977 en un modelo canino de infarto de miocardio. Esta teoría, ampliamente aceptada, propone que la necrosis del miocardio durante la oclusión coronaria aguda progresa, a medida que aumenta la duración de la isquemia, con una progresión transmural, desde el subendocardio hacia el subepicardio, sin que haya una extensión en dirección lateral.
- –
La teoría del wavefront phenomenon desencadenó una explosión de estudios de evaluación de tratamientos de cardioprotección. La teoría estableció la idea de que hay una gran área de miocardio subepicárdico en el lecho isquémico (área en riesgo) que podría salvarse con una reperfusión temprana, pero de otro modo moriría.
- –
Nuestro estudio muestra una correlación estrecha entre la extensión transmural y la extensión lateral de la necrosis después de un infarto de miocardio, lo cual indica claramente que la progresión de la necrosis durante un infarto se produce en ambas direcciones en el corazón humano. Además, las exploraciones secuenciales de CRM en la fase temprana y la fase tardía tras el IAMCEST revelan que la cicatrización del miocardio se produce tanto en dirección transmural como en dirección lateral.
- –
Nuestros resultados indican que la administración i.v. de metoprolol, que es un tratamiento cardioprotector con un efecto demostrado, impide la progresión del infarto en ambas dimensiones.
- –
Estas observaciones cuestionan el concepto clásico de una progresión de necrosis exclusivamente desde el endocardio al epicardio e implican que los tratamientos de cardioprotección podrían salvar una proporción relevante de miocardio en los bordes laterales del infarto.
Los autores dan las gracias a Carlos Galán-Arriola por su ayuda en la figura que ilustra el concepto de frente de onda multidireccional. S. Bartlett (CNIC) realizó la corrección del texto en inglés.