Las guías de la Sociedad Europea de Cardiología (ESC) están avaladas por la Sociedad Española de Cardiología (SEC) y se traducen al castellano para su publicación en Revista Española de Cardiologia. Cada nueva guía se acompaña de un artículo que la comenta siguiendo los objetivos y la metodología recomendados en el artículo del Comité de Guías de la SEC1. El Comité de Guías encargó el presente artículo, en el que se comenta la nueva guía de la ESC/EACTS 2017 sobre valvulopatías2, a un grupo de expertos. Posteriormente, las secciones de Cardiología Clínica, Imagen y Hemodinámica nombraron otros expertos, que han hecho importantes aportaciones al documento aquí presentado.
Esta guía es una actualización de las publicadas en 20123. En estos5 años ha habido avances importantes que justifican la publicación de una nueva guía, con cambios relevantes con respecto a la previa: a) hay un apartado específico sobre la fibrilación auricular en las valvulopatías, con especial énfasis en el papel de los anticoagulantes de acción directa; b) hay nueva evidencia en relación con el implante percutáneo de válvula aórtica (TAVI) para el tratamiento de la estenosis aórtica grave; c) se establecen unos criterios que pueden ser útiles en el diagnóstico de la estenosis aórtica grave con bajo gradiente, y d) se plantean nuevas indicaciones de terapia antitrombótica para pacientes con prótesis quirúrgicas y percutáneas.
La guía actual, como la anterior, adolece de falta de evidencia que sustente las recomendaciones dadas. Llama la atención el aumento tan importante de recomendaciones, pues se pasa de 70 a 159, aunque muchas de ellas son IIb C. Además, aparecen por primera vez 2 recomendaciones de nivel A: la indicación de ablación quirúrgica para pacientes con fibrilación auricular sintomática sometidos a cirugía valvular y la posibilidad de doble terapia antitrombótica en vez de triple para los pacientes con prótesis mecánicas tras un síndrome coronario agudo e implante de stent (cuyo riesgo hemorrágico pese más que el isquémico). Se debe destacar que la mayoría de las recomendaciones siguen teniendo un nivel C (123 [77%]). Se agradece la inclusión en esta guía de un apartado en el que se especifican tanto los cambios respecto a la guía previa3 como las nuevas recomendaciones. Los revisores de esta guía consideramos que es una herramienta insustituible para la valoración de los pacientes con valvulopatías, pues aporta toda la información relevante sobre la enfermedad con un planteamiento de los temas muy didáctico, especialmente los algoritmos para el manejo de las diferentes valvulopatías.
COMENTARIOS GENERALESLa guía pretende ser una directriz general para el tratamiento de los pacientes con enfermedad valvular, pero deja claro que la toma de decisiones debe individualizarse en cada caso, teniendo en cuenta los medios disponibles en cada centro, tanto diagnósticos como terapéuticos, y, por supuesto, los deseos del paciente. Se insiste en la necesidad de que las decisiones se tomen dentro del equipo multidisciplinario o heart team, sobre todo en el caso de pacientes con alto riesgo o asintomáticos.
Evaluación clínica y estratificación del riesgoLos aspectos de evaluación clínica han disminuido drásticamente en esta guía para subrayar la adecuada estratificación del riesgo quirúrgico del paciente mediante diversas escalas, básicamente las escalas EuroSCORE II y STS. La escala EuroSCORE I queda relegada, pues sobrestima el riesgo quirúrgico. Cobra importancia la evaluación de otros factores de riesgo no incluidos en estas escalas, como la fragilidad, la aorta de porcelana o la exposición previa a radiación torácica. En el caso de los pacientes ancianos, es fundamental evaluar tanto la comorbilidad como la enfermedad pulmonar, la insuficiencia renal grave (filtrado glomerular < 30ml/min) o la enfermedad cerebrovascular, que obviamente aumentan la mortalidad tanto en el tratamiento quirúrgico como en el percutáneo. Este aumento del interés en la evaluación del riesgo está motivado en parte por el crecimiento exponencial de los tratamientos percutáneos, sobre todo en la estenosis aórtica.
Se introduce como novedad el concepto de «centro de enfermedad valvular o centro de referencia en valvulopatías» como equipo multidisciplinario que debe reunirse regularmente para discutir casos complejos, seguir protocolos de actuación, recibir consultas de otros centros, disponer de todas las técnicas diagnósticas de imagen no invasivas e incluir cirugía cardiaca y cardiología intervencionista con alta experiencia que ofrezcan todas las posibilidades terapéuticas quirúrgicas o percutáneas disponibles. Se subraya la conveniencia de centralizar la realización de los tratamientos quirúrgicos o percutáneos de alta complejidad (reparaciones, implante de MitraClip, TAVI, etc.), ya que mantener la calidad requiere una curva de aprendizaje y un mínimo volumen de casos por centro. Los resultados de estos «centros de enfermedad valvular» deben ser auditados y estar disponibles para su evaluación interna y externa.
Técnicas de imagenLa ecocardiografía sigue siendo la técnica fundamental para la aproximación diagnóstica inicial, ya que permite definir los mecanismos etiológicos, la repercusión hemodinámica y en muchos casos, establecer el pronóstico. La guía constata el uso del ecocardiograma transesofágico (ETE) para evaluar los resultados de los tratamientos quirúrgicos y percutáneos. En cuanto a las indicaciones de otras técnicas de imagen, la guía es muy poco novedosa. Destaca la utilidad de la tomografía computarizada (TC) en la selección de los pacientes candidatos a TAVI y también como alternativa a la coronariografía invasiva para descartar enfermedad coronaria, aunque solo para pacientes con bajo riesgo ateroesclerótico. La resonancia magnética (RM) se considera útil cuando los estudios ecocardiográficos no sean óptimos y como técnica de referencia en la valoración de tamaño y función del ventrículo derecho.
Tratamiento de condiciones asociadasEn cuanto al tratamiento de la enfermedad coronaria asociada, se añade la recomendación, para pacientes con enfermedad coronaria de los segmentos proximales, de revascularización percutánea antes del implante de TAVI o MitraClip (IIa). Para los pacientes con fibrilación auricular, esta guía introduce la posibilidad de usar anticoagulantes de acción directa 3 meses después de la intervención para los portadores de bioprótesis y en pacientes con valvulopatías nativas, salvo la estenosis mitral moderada o grave (indicación IIa, evidencia C).
Aspectos cuestionables- •
Deberían desarrollarse herramientas más objetivas para estratificar el riesgo de los pacientes para cirugía valvular frente al tratamiento percutáneo. Asimismo se debería evitar la futilidad.
- •
Los nuevos equipos de TC, cada vez más disponibles y con mayor número de detectores, obtienen imágenes de una calidad excelente con mínimas dosis de radiación y con muy buena correlación con la coronariografía invasiva, por lo que se podría justificar realizarla a pacientes con mayor riesgo de enfermedad ateroesclerótica (al menos moderado).
- •
La RM es la técnica de referencia para la evaluación del tamaño y la función de ambos ventrículos y puede aportar variables que permitan predecir de manera más adecuada la evolución de estos pacientes.
- •
La indicación de los anticoagulantes de acción directa en los primeros 3 meses después del implante de una prótesis biológica o un TAVI no queda claramente establecida. Igualmente, su contraindicación para pacientes con estenosis mitral moderada o grave no se vincula con ningún estudio.
La guía reafirma el papel de la ecocardiografía en el estudio de las alteraciones morfológicas, valvulares, mecanismo de la insuficiencia, cuantificación de su gravedad y de la función ventricular. La información ecocardiográfica es de utilidad para determinar si es posible o no la reparación valvular. Como aspecto relevante, se expone claramente cómo deben medirse la raíz de la aorta y aorta ascendente (de borde externo a borde interno de la pared aórtica y en telediástole)4. Dependiendo del resultado de estas medidas, se clasifica la aorta ascendente en 3 fenotipos: aneurisma de la raíz de la aorta, aneurisma de la aorta ascendente (o tubular) o sin aneurisma de aorta (insuficiencia aórtica aislada). Aunque la RM es una técnica adecuada para medir la aorta ascendente, la guía recomienda la TC multidetectores (TCMD) con sincronización del ECG cuando se plantea cirugía, por su mejor resolución temporal. Se insiste en que con la TC y la RM la medición de los diámetros debe hacerse de borde interno a borde interno, en telediástole y en planos doble oblicuos, perpendiculares a la pared del vaso, en cada segmento. La aorta sinusal debe medirse de seno a seno, y no de seno a comisura opuesta.
La indicación de cirugía valvular en la insuficiencia aórtica (IAo) es la presencia de síntomas o una fracción de eyección (FE) ≤ 50% documentada (ambas, indicación I B). Se debería considerar asimismo (IIa B) para pacientes asintomáticos con FE > 50% y ventrículo izquierdo gravemente dilatado con diámetro telediastólico > 70mm o telesistólico > 50mm (> 25mm/m2) especialmente si la superficie corporal < 1,68 m2). Como novedades, se incluye la posibilidad de la reparación valvular para pacientes seleccionados, principalmente en los casos con dilatación de la raíz (mecanismo de tipo I) o prolapso de una sigmoidea (tipo II) y siempre tras la discusión del caso en el equipo multidisciplinario (clase I, evidencia C). La indicación de este tipo de cirugías conllevaría derivarlas a centros especializados en esta clase de reparaciones quirúrgicas. Se mantiene la indicación de actuar sobre la aorta de los pacientes que precisan cirugía valvular con una raíz o aorta ascendente ≥ 45mm. En el síndrome de Marfan, la cirugía está indicada con diámetros ≥ 50 o ≥ 45mm cuando haya factores de riesgo añadidos, entre ellos la hipertensión arterial o el crecimiento > 3mm anuales (en la guía previa eran 2mm, lo que rozaba la propia variabilidad de la técnica). Es importante la correcta comparación de las medidas en los estudios, utilizando iguales metodología, proyección y nivel donde se mide la aorta. Para los pacientes con mutación en TGFBR1 o TGFBR2 (incluído el síndrome de Loeys-Dietz), la cirugía está indicada con diámetros de aorta ≥ 45mm. En cuanto al tratamiento médico de la dilatación de aorta, la guía añade el losartán para los pacientes con síndrome de Marfan como alternativa a los bloqueadores beta.
Aspectos cuestionables- •
Los criterios para reparar o reemplazar la válvula aórtica están poco definidos y deberían establecerse mejor en los próximos años.
- •
La RM es una técnica con una utilidad mayor de lo que reflejan las guías. Definir la gravedad de la IAo por eco-Doppler no siempre es fácil, especialmente en presencia de chorros regurgitantes excéntricos. La fracción regurgitante medida por RM es un predictor de la aparición de síntomas y necesidad de cirugía.
- •
Iniciar el algoritmo del tratamiento de la IAo con la dilatación significativa de la aorta prescindiendo de la gravedad de la regurgitación dificulta su comprensión. Sería aconsejable que, en ausencia de IAo significativa, las indicaciones de cirugía de la dilatación de aorta ascendente se desarrollaran en la guía sobre enfermedad aórtica y así evitar superposiciones o diferencias en los criterios.
- •
La guía genera cierta confusión cuando considera que, en el caso de mujeres con superficie corporal pequeña, mutaciones en TGFBR2 o alteraciones extraaórticas (aspectos fenotípicos), puede considerarse la intervención con valores ≥ 40mm. En realidad, el estudio en el que se basa esta indicación de cirugía precoz incluye siempre la presencia de alteraciones extraaórticas importantes7.
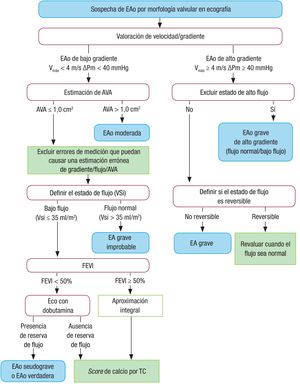
Aunque la ecocardiografía es la técnica de referencia en el diagnóstico y la cuantificación de la estenosis aórtica (EAo) y el área valvular (AVA) es el parámetro ideal para cuantificar su gravedad, hay limitaciones técnicas para su uso en la toma de decisiones clínicas. Se aconseja considerar el AVA junto con el volumen de flujo, el gradiente medio (el parámetro más robusto), la función ventricular, la hipertrofia, el grado de calcificación y la presión arterial. Se definen 4 categorías de EAo con AVA < 1 cm2: a) EAo con gradiente medio > 40mmHg, que se asume que es siempre grave; b) EAo de bajo flujo (índice de volumen-latido ≤ 35ml/m2) y gradiente < 40mmHg con FE ≤ 50%, en la que la gravedad debería definirse por ecocardiografía de estrés con dobutamina; c) EAo con gradiente medio < 40mmHg, con FE > 50% pero índice de volumen-latido ≤ 35ml/m2), en que se debe descartar sistemáticamente los errores de medición y confirmar la gravedad mediante TC u otras técnicas, y d) EAo de bajo gradiente, flujo normal y FE normal, que se consideran EAo moderadas (figura).
Aproximación integrada en la cuantificación de la estenosis aórtica considerando el área valvular, el volumen de flujo y la fracción de eyección. El estado de alto flujo puede ser reversible en situaciones como anemia, hipertiroidismo, fístulas arteriovenosas, etc. La estenosis aórtica seudograve se considera cuando se consigue aumentar el área valvular más de 1 cm2 al normalizar el flujo valvular. AVA: área valvular; EAo: estenosis aórtica; FEVI: fracción de eyección del ventrículo izquierdo; TC: tomografía computarizada; Vmáx: velocidad máxima; VSi: volumen de eyección, ΔPM: gradiente medio.
En el diagnóstico de la EAo de bajo flujo y bajo gradiente con FE conservada, se incide especialmente en la importancia de una valoración integrada de diferentes variables clínicas y métodos diagnósticos7. Así, es improbable se trate de una EAo grave cuando la puntuación de calcio sea > 1.600 UA en varones y > 800 UA en mujeres; además, en estos casos se propone un criterio de corte del AVA (≤ 0,8 cm2). Respecto al tratamiento, se realizan 18 indicaciones terapéuticas, con incremento del número de recomendaciones de clase I (55%) y una recomendación de clase III. El 78% de las recomendaciones están respaldadas por un estudio aleatorizado. En la EAo grave sintomática con bajo gradiente y bajo flujo sin reserva contráctil, se cambia el grado de recomendación, en favor de la indicación quirúrgica, de IIb a IIa para pacientes con puntuación de calcio alta (> 3.000 en varones y > 1.600 en mujeres).
En la EAo grave asintomática, se refuerza el papel del seguimiento clínico a intervalos cortos, de6 meses. Se mantienen las indicaciones de sustitución valvular basadas en estenosis muy graves o progresión hemodinámica acelerada, como la Vmáx > 5,5 m/s, la calcificación valvular grave y la progresión anual de la Vmáx ≥ 0,3 m/s/año. Se define una nueva indicación IIa C con la presencia de hipertensión pulmonar grave (presión sistólica de la arteria pulmonar > 60mmHg en reposo confirmada mediante un método invasivo) sin otra causa que pueda justificarla. También se modifica la indicación IIb C sobre las concentraciones repetida y marcadamente elevadas de péptidos natriuréticos (> 3 veces el valor normal por edad y sexo del paciente) sin otra causa que lo justifique, que pasa a ser una recomendación IIa C. Además, se eliminan 2 indicaciones previamente IIb, como eran el aumento del gradiente medio > 20mmHg con el esfuerzo y una hipertrofia ventricular izquierda excesiva en ausencia de hipertensión arterial.
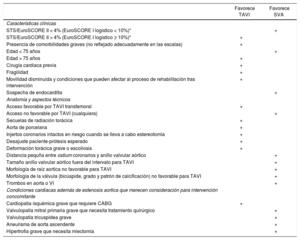
La elección de la modalidad terapéutica (abordaje percutáneo o esternotomía) aporta el mayor número de novedades, y se establecen5 recomendaciones de clase I: a) que se disponga de cirugía cardiaca y cardiología en el mismo centro; b) realizar la elección valorando individualmente los aspectos técnicos y el balance entre riesgo y beneficio con cada modalidad, teniendo en cuenta la experiencia y los resultados locales; c) se prefiere la cirugía valvular para los pacientes con bajo riesgo o sin factores adicionales no recogidos en las escalas, tales como fragilidad, aorta de porcelana y radiación previa; d) para los pacientes con riesgo quirúrgico intermedio o alto o con factores adicionales, valorar el abordaje percutáneo considerando la edad del paciente y la posibilidad del acceso femoral, y e) el TAVI está indicado para los pacientes considerados no aceptables para cirugía por el equipo multidisciplinario. En la tabla se especifican los aspectos que considerar en la indicación de TAVI. La valvuloplastia con balón se considera solo una opción puente al recambio valvular o una opción diagnóstica. Se incluye una nueva indicación IIa C de TAVI valve-in-valve para pacientes con disfunción protésica, dependiendo del riesgo quirúrgico del paciente y el tipo y el tamaño de la prótesis. Igualmente, se establece una nueva recomendación IIa C en la posibilidad de revascularización coronaria percutánea para los pacientes candidatos a TAVI con estenosis coronarias proximales > 70%. Una aportación importante de la guía es que aparecen reflejados datos de TAVI en pacientes con riesgo intermedio, basados en los resultados de los estudios PARTNER–II SURTAVI y diferentes metanálisis8,9. Esta evidencia muestra que, en pacientes ancianos con un riesgo quirúrgico intermedio, el TAVI no es inferior a la cirugía en cuanto a mortalidad, e incluso es superior cuando el acceso es transfemoral.
Aspectos que ha de considerar el equipo mulitidisciplinario en la decisión entre sustitución vavular aórtica quirúrgica o TAVI para pacientes con riesgo quirúrgico aumentado
| Favorece TAVI | Favorece SVA | |
|---|---|---|
| Características clínicas | ||
| STS/EuroSCORE II < 4% (EuroSCORE I logistico < 10%)* | + | |
| STS/EuroSCORE II > 4% (EuroSCORE I logistico ≥ 10%)* | + | |
| Presencia de comorbilidades graves (no reflejado adecuadamente en las escalas) | + | |
| Edad < 75 años | + | |
| Edad > 75 años | + | |
| Cirugía cardiaca previa | + | |
| Fragilidad | + | |
| Movilidad disminuida y condiciones que pueden afectar al proceso de rehabilitación tras intervención | + | |
| Sospecha de endocarditis | + | |
| Anatomía y aspectos técnicos | ||
| Acceso favorable por TAVI transfemoral | + | |
| Acceso no favorable por TAVI (cualquiera) | + | |
| Secuelas de radiación torácica | + | |
| Aorta de porcelana | + | |
| Injertos coronarios intactos en riesgo cuando se lleva a cabo estereotomía | + | |
| Desajuste paciente-prótesis esperado | + | |
| Deformación torácica grave o escoliosis | + | |
| Distancia pequña entre ostium coronarios y anillo valvular aórtico | + | |
| Tamaño anillo valvular aórtico fuera del intervalo para TAVI | + | |
| Morfología de raíz aortica no favorable para TAVI | + | |
| Morfología de la válvula (bicúspide, grado y patrón de calcificación) no favorable para TAVI | + | |
| Trombos en aorta o VI | + | |
| Condiciones cardiacas además de estenosis aortica que merecen consideración para intervención concomitante | ||
| Cardiopatía isquémica grave que requiere CABG | + | |
| Valvulopatía mitral primaria grave que necesita tratamiento quirúrgico | + | |
| Valvulopatía tricuspídea grave | + | |
| Aneurisma de aorta ascendente | + | |
| Hipertrofia grave que necesita miectomía | + |
EuroSCORE: European System for Cardiac Operative Risk Evaluation; STS: Society of Thoracic Surgeons; SVA: sustitución quirúrgica de válvula aórtica; TAVI: implante percutáneo de válvula aórtica; VI: ventrículo izquierdo.
* Escala STS, EuroSCORE II, EuroSCORE I logístico10 (http://www.euroscore.org/calcge.html); las escalas tienen mayores limitaciones para uso práctico cuando se utilizan en caso de escasa consideración de la gravedad de la valvulopatía y sin incluir los principales factores de riesgo, como fragilidad, la aorta de porcelana, la radiación torácica, etc.). El EuroSCORE I sobrestima marcadamente la mortalidad a 30 días y se debería sustituir por el EuroSCORE II; sin embargo, como muchos estudios/registros de TAVI lo utilizan, se ha tratado por comparación y puede ser útil para identificar subgrupos de pacientes para decidir entre las formas de intervención y predecir la mortalidad a 1 año.
- •
Las limitaciones del cálculo del AVA por ecocardiografía mediante la ecuación de continuidad son cada vez más evidentes. La guía propone la inclusión de varias variables clínicas y de imagen para establecer el diagnóstico de EAo grave. No obstante, este aspecto tan transcendente no parece cerrado.
- •
La identificación de los pacientes asintomáticos que se podrían beneficiar de un tratamiento quirúrgico más precoz está por definir.
- •
Quedan por establecer nuevas indicaciones de TAVI para pacientes menores de 75 años o con menor riesgo quirúrgico. Por otro lado, la durabilidad de las prótesis para TAVI aún no está bien establecida.
La nueva guía propone cambios sustanciales en el tratamiento de la insuficiencia mitral (IM) y mantiene recomendaciones similares en la estenosis mitral, patología de la que apenas se han presentado nuevos datos en estos últimos años. Se recomienda un seguimiento ecocardiográfico más frecuente (cada 6 meses) en casos de IM grave (antes anual), e idealmente en el contexto de un «centro de valvulopatías», o ecocardiograma cada 1–2 años para los pacientes con IM moderada (antes, cada 2 años).
La guía mantiene la indicación quirúrgica para los pacientes con IM primaria grave sintomáticos o asintomáticos con FE ≤ 60%, diámetro telesistólico ≥ 45mm, fibrilación auricular o hipertensión pulmonar sistólica ≥ 50mmHg, pero comprobada por hemodinámica. No obstante, se han introducido cambios en 2 aspectos: a) tendencia a operar antes a los pacientes asintomáticos con IM primaria grave, y b) se establecen indicaciones para el tratamiento con dispositivos percutáneos. Así, se recomienda la cirugía (recomendación IIa) para pacientes asintomáticos con IM grave aun cuando estén en ritmo sinusal y tengan una FE del ventrículo izquierdo (VI) > 60% si la probabilidad de reparación es alta, el diámetro telesistólico del VI se sitúa entre 40 y 44mm y se cumple uno de estos criterios: la aurícula izquierda está dilatada (≥ 60ml/m2) en ritmo sinusal o la causa es rotura de cuerdas tendinosas. Se elimina la indicación de cirugía en caso de hipertensión pulmonar grave con esfuerzo en el paciente con IM primaria asintomática.
En la cuantificación de la IM secundaria, habitualmente consecuencia de cardiopatía isquémica, miocardiopatías o fibrilación auricular crónica, la guía comenta que, aunque en el criterio de gravedad los valores del orificio o volumen regurgitante son inferiores que en la IM primaria, el pronóstico de estos pacientes puede estar más relacionado con la disfunción ventricular que con la gravedad de la IM. Se incorporan los dispositivos percutáneos al tratamiento de la IM secundaria grave (recomendación IIb). Para los pacientes con disfunción ventricular grave que no tienen indicada la revascularización y permanecen sintomáticos a pesar del tratamiento médico óptimo, se puede indicar la cirugía si el riesgo quirúrgico es bajo, y mediante procedimientos percutáneos si el riesgo quirúrgico no es bajo y la morfología valvular es favorable (IIb C), en particular con FEVI > 30%. La decisión de realizar cirugía o reparación percutánea dependerá del riesgo quirúrgico. Para los pacientes con FEVI < 30%, la indicación se ha de individualizar debido a que no hay evidencia de que la reducción de la IM secundaria mejore la supervivencia. Se ha retirado la indicación, presente en la guía previa3, de intervención sobre la IM moderada durante la cirugía de revascularización coronaria, aunque se mantiene si la IM es grave.
Respecto a la EM, no hay cambios sustanciales. Se debe considerar la cirugía de reemplazo valvular para el paciente asintomático, con características desfavorables para comisurotomía mitral percutánea en caso de alto riesgo de embolia o descompensación hemodinámica o si aparecen síntomas con poco ejercicio, siempre y cuando el riesgo quirúrgico sea bajo.
Aspectos cuestionables- •
A pesar de que se facilita la recomendación en el paciente con IM asintomática y aurícula significativamente dilatada, en cuanto a la indicación de cirugía sigue habiendo diferencias sustanciales con las recomendaciones estadounidenses11, donde solo se exige para la reparación que sea factible y con alta tasa de éxito y durabilidad. No se destaca la potencial utilidad de las medidas repetidas con progresiva dilatación o caída en la FEVI aunque no alcance los valores de corte descritos en las recomendaciones.
- •
En la IM grave secundaria, la presente guía se inclina por la reparación valvular con anuloplastia restrictiva como técnica de elección. Sin embargo, basándose en un reciente estudio aleatorizado12, la última actualización de la guía estadounidense recomienda cirugía de reemplazo valvular con conservación del aparato subvalvular debido a una mayor tasa de recurrencia de IM en caso de reparación.
- •
Respecto a la reparación percutánea (MitraClip) de la insuficiencia mitral secundaria, a pesar de múltiples registros y metanálisis publicados, no se ha modificado la recomendación IIb con nivel de evidencia C.
La guía no incluye cambios relevantes en relación con la enfermedad valvular tricuspídea respecto a la de 20123. Se incluye la posibilidad de reparación de tricúspide para los pacientes sometidos a cirugía valvular izquierda con insuficiencia tricuspídea moderada, si se ha documentado insuficiencia cardiaca derecha, sin necesidad de dilatación del anillo valvular o disfunción ventricular derecha13 (IIb C).
VALVULOPATÍAS COMBINADAS Y POLIVALVULOPATÍASEn caso de lesiones combinadas de una válvula, se considera que el gradiente refleja mejor la carga hemodinámica impuesta por la lesión valvular, por encima del área valvular y otras mediciones. Se considera la reparación valvular como procedimiento de elección y se ha eliminado un párrafo que favorecía el implante de 2 prótesis en caso de que una de las válvulas no fuera reparable.
PRÓTESIS VALVULARESUna de las novedades más importantes respecto a la guía previa3 es el apartado relacionado con el tratamiento antitrombótico de los pacientes portadores de prótesis. Así, se pasa de 8 a 18 recomendaciones. Entre ellas destacan la recomendación I con nivel de evidencia B de sistemas de autocontrol del INR y la recomendación IIa de doble antiagregación en los primeros 3–6 meses tras un TAVI y después un único antiagregante.
Se hace hincapié en la necesidad de informar adecuadamente a los pacientes sobre los riegos y beneficios de implantar una prótesis mecánica o biológica y la importancia de una decisión conjunta con el paciente, no considerando únicamente la edad. La guía deja muy claro que los anticoagulantes de acción directa no deben darse a pacientes con prótesis mecánicas y mantienen como objetivo la mediana del INR, y no un intervalo, para evitar que se dé por válidos unos valores extremos dentro del intervalo terapéutico. Un aspecto importante son las nuevas recomendaciones sobre la antiagregación de los pacientes con prótesis valvular mecánica tras el implante de un stent coronario14 con el uso del tratamiento antiagregante triple con antagonistas de la vitamina K (AVK), ácido acetilsalicílico (AAS) y clopidogrel, durante 1 mes, independientemente del tipo de stent y síndrome clínico que lo justifique, y prolongarla hasta 6 meses en pacientes cuyo riesgo isquémico se juzgue alto, sin alto riesgo de hemorragia. El tratamiento doble con clopidogrel y AVK se debe considerar como alternativa al tratamiento triple para los pacientes con mayor riesgo hemorrágico; transcurridos 12 meses desde el implante del stent, se puede considerar la supresión del tratamiento antiagregante. Para los pacientes portadores de prótesis mecánicas en casos de enfermedad aterotrombótica concomitante, la adición de dosis bajas de AAS al AVK pasa de ser una indicación IIa a una IIb.
En los primeros 3 meses del implante de una bioprótesis en posición mitral o tricúspide, se mantiene como indicación IIa el tratamiento con AVK y solo AAS en las aórticas. A pesar de la ausencia de estudios que lo confirmen, se considera el papel interesante de los anticoagulantes de acción directa en las prótesis biológicas, especialmente a partir del tercer mes cuando la anticoagulación esté indicada. La recomendación de implantar una prótesis mecánica en pacientes ya anticoagulados y portadores de otra prótesis mecánica pasa de indicación de clase I a IIa.
No ha habido cambios en el tratamiento de la trombosis obstructiva de las prótesis mecánicas. El reemplazo quirúrgico urgente es el tratamiento de elección cuando no haya comorbilidades importantes (indicación de clase I). Se debe considerar la fibrinolisis cuando la cirugía no esté disponible o haya un alto riesgo quirúrgico (indicación IIa). Para las trombosis protésicas no obstructivas tras un evento embólico, se indica cirugía (IIa) cuando el trombo sea ≥ 10mm.
Se recomienda la reintervención ante una dehiscencia perivalvular por endocarditis que ocasione hemolisis grave o síntomas, con la posibilidad de considerar el cierre percutáneo para los pacientes con alto riesgo quirúrgico (decisión del equipo multidisciplinario), y se propone una indicación individualizada de implante percutáneo de una nueva bioprótesis aórtica (valve-in-valve), dependiendo del riesgo y el tipo y el tamaño de la prótesis.
Aspectos cuestionables- •
En la práctica clínica hay una tendencia a que se reduzca la edad para el implante de prótesis biológicas frente a las mecánicas. Esta tendencia probablemente se deba al estilo de vida más activo de la población de mediana edad, que prefiere evitar la anticoagulación con AVK, y a la mayor durabilidad de algunas prótesis biológicas. Esta guía desaprovecha la oportunidad de hacer referencia a los tipos de prótesis mecánicas y biológicas disponibles en el mercado y sus diferencias en cuanto a la hemodinámica, el riesgo de trombosis y la durabilidad.
- •
A pesar de que hay estudios aleatorizados recientes que proponen bajar el objetivo de INR para los pacientes con prótesis mecánicas aórticas, no se han cambiados las recomendaciones. Estos datos deberán confirmarse en el futuro.
- •
Tras el implante percutáneo o quirúrgico de una prótesis biológica, la guía actual recomienda ecocardiogramas a los 30 días, al año y anualmente posteriormente (antes, para los pacientes portadores de prótesis biológica normofuncionante, solo se recomendaba ecocardiograma anual a partir del quinto año). Estas recomendaciones no se basan en ningún estudio clínico y suponen una sobrecarga importante de los laboratorios de ecocardiografía de nuestro país.
- •
El tratamiento antitrombótico los primeros 3–6 meses después del TAVI está poco definido. Se propone la posibilidad de utilizar un único antiagregante frente al tratamiento antiagregante doble y a la vez se comenta el posible beneficio de la anticoagulación inicial en caso de bajo riesgo de sangrado para evitar la trombosis subclínica15.
- •
Queda mal establecido el tratamiento de la trombosis no obstructiva de la prótesis biológica con evento embólico y trombo < 10mm. Igualmente no se especifica la actuación si persiste el trombo a pesar de una adecuada anticoagulación.
Se especifican4 situaciones en las que debería desaconsejarse el embarazo: estenosis mitral grave, estenosis aórtica grave sintomática, síndrome de Marfan con aorta > 45mm y síndrome de Turner (diámetro > 27,5mm/m2). Se emiten también recomendaciones para cesárea. No se comenta la indicación de cirugía en válvula bicúspide con dilatación aórtica.
En cuanto a la anticoagulación con prótesis mecánicas, se aconseja mantener hasta el parto la anticoagulación oral de mujeres que requieran dosis de warfarina < 5mg diarios y cambiar a heparina de bajo peso molecular monitorizando la actividad anti–Xa en los restantes casos.
Aspectos cuestionables- •
En relación con las mujeres con prótesis mecánicas que reciben anticoagulación oral durante el embarazo, debería especificarse que la anticoagulación oral debe realizarse hasta la semana 36 de gestación, momento en que debe cambiarse a heparina de bajo peso molecular.
Como consecuencia de esta guía, debería plantearse en los centros terciarios la creación de unidades multidisciplinarias de valvulopatías y fomentar los centros de referencia por comunidades. La adherencia a las guías puede requerir en algunos casos el incremento de los estándares de calidad en el tratamiento clínico, técnicas de imagen y tratamiento quirúrgico o percutáneo. La recomendación de revisiones anuales en determinados subgrupos de valvulopatías constituye una sobrecarga asistencial importante, difícilmente asumible en el entorno actual. Con herramientas como la telemedicina, debería fomentarse la colaboración clínica estrecha y fluida con los médicos de atención primaria, especialmente para los pacientes cuyo riesgo de complicaciones a medio plazo no es previsible.
IMPLICACIONES SOCIOECONÓMICAS LOCALESLos avances en el tratamiento de las valvulopatías, especialmente en el campo del tratamiento quirúrgico y percutáneo, representan un incremento significativo del gasto sanitario, ocasionalmente en un grupo de población gravemente enferma. Los profesionales de este país no podemos obviar nuestra responsabilidad en analizar e individualizar el coste/beneficio de nuestras actuaciones. Las unidades especializadas multidisciplinarias de referencia, sin duda, pueden permitir un análisis objetivo de los pacientes valvulares complejos y mejorar la eficiencia en la toma de decisiones. En cualquier caso, es importante que estas unidades, además de optimizar la atención a estos pacientes en el ámbito hospitalario, se comuniquen con hospitales comarcales y con los médicos de familia de su área de referencia.
CONCLUSIONESEsta guía es una actualización de las recomendaciones para el tratamiento del paciente con cardiopatía valvular, y son de gran utilidad en la práctica del cardiólogo clínico general. La promoción y la descripción de los requisitos de las unidades multidisciplinarias de atención al paciente valvular se hacen cada vez más obligadas, dado el continuo incremento de opciones terapéuticas para pacientes complejos, de más edad y con más comorbilidades. En este sentido, la guía incluye las aportaciones de estudios recientes con TAVI, considera la indicación para una cirugía más precoz en la IM primaria, que se puede reparar con garantías, y aborda con más profundidad el tratamiento antitrombótico para los pacientes con prótesis valvulares16.
CONFLICTO DE INTERESESNo se declara ninguno.
Grupo de Trabajo de la SEC para la guía ESC/EACTS 2017 sobre valvulopatías, revisores expertos para la guía ESC/EACTS 2017 sobre valvulopatías y Comité de Guías de la SEC*,◊.
En el anexo se relacionan los nombres de todos los autores del artículo.