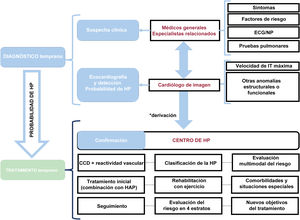
La guía de la Sociedad Europea de Cardiología (ESC)/Sociedad Respiratoria Europea (ERS) 2022 sobre el diagnóstico y tratamiento de la hipertensión pulmonar (HP)1 incluye varias novedades que se abordan en este comentario. Además, quisiéramos resaltar la necesidad de mejora tanto en el diagnóstico temprano como en el tratamiento inicial, a través del establecimiento de un enfoque organizado, colaborativo y multidimensional, desde una perspectiva local y regional. Este abordaje en equipo colaborativo involucra directamente a los médicos de primera línea, la ecocardiografía y los centros especializados en HP. Este concepto se ilustra en la figura 1.
Enfoque del equipo de colaboración para el diagnóstico y el tratamiento de los pacientes con HP. El asterisco (*) indica una probabilidad de HP intermedia/alta en presencia de factores de riesgo de HAP o antecedentes de embolia pulmonar. CCD: cateterismo cardiaco derecho; ECG: electrocardiograma; HP: hipertensión pulmonar; IT: insuficiencia tricuspídea; NP: péptidos natriuréticos.
El valor de corte de la presión arterial pulmonar media (PAPm) que define el diagnóstico de la HP se ha reducido a > 20mmHg. Este cambio se basa en los nuevos datos obtenidos mediante cateterismo cardiaco derecho (CCD), realizado en un número relativamente pequeño de individuos sanos con un amplio intervalo de edades. Sin embargo, varios estudios retrospectivos grandes han confirmado la asociación pronóstica de una PAPm > 20mmHg y ello justifica el cambio del valor umbral. Deberán evaluarse las consecuencias de esta nueva definición por lo que respecta a la derivación de pacientes a los centros especializados en HP y el uso de los recursos diagnósticos y terapéuticos en España. Además, la guía subraya la importancia de incluir la resistencia vascular pulmonar (RVP) y la presión arterial pulmonar enclavada (PAPE) en la definición de la HP precapilar. El valor de 2 unidades Woods es el límite superior de la normalidad para la RVP y el umbral de la RVP más bajo con valor pronóstico, mientras que el valor de corte de la PAPE es de 15mmHg. Con el empleo de combinaciones de los valores de corte de la PAPm, la RVP y la PAPE, se establecen varias definiciones hemodinámicas de la HP (tabla 1). Es importante subrayar la necesidad de llevar a cabo el CCD siguiendo una metodología estandarizada y precisa.
Definiciones hemodinámicas de la hipertensión pulmonar
| Definición | Características hemodinámicas |
|---|---|
| Hipertensión pulmonar | PAPm > 20 mmHg |
| Hipertensión pulmonar precapilar | PAPm > 20 mmHgPAPE ≤ 15 mmHgRVP > 2 UW |
| Hipertensión pulmonar poscapilar aislada | PAPm > 20 mmHgPAPE > 15 mmHgRVP ≤ 2 UW |
| Hipertensión pulmonar pre y poscapilar combinada | PAPm > 20 mmHgPAPE > 15 mmHgRVP > 2 UW |
| Hipertensión pulmonar en ejercicio | Pendiente de PAPm/gasto cardiaco entre reposo y ejercicio > 3 mmHg/l/min |
PAPE: presión arterial pulmonar enclavada; PAPm: presión arterial pulmonar media; RVP: resistencia vascular pulmonar.
Los principales cambios en la clasificación de la HP son la adición de los subgrupos de pacientes «sin respuesta en las pruebas de reactividad vascular» y «con respuesta aguda en las pruebas de reactividad vascular» al grupo de la hipertensión arterial pulmonar (HAP) idiopática. Sin embargo, algunos pacientes con HAP hereditaria (HAPH) o HAP relacionada con fármacos o sustancias tóxicas (PAHF) pueden incluirse también en el subgrupo de pacientes «con respuesta aguda a las pruebas de reactividad vascular». Además, el subgrupo de PAHF se ha simplificado y el consumo de metanfetaminas y dasatinib se ha asociado claramente con la HAP. El grupo de «HAP con manifestaciones de afección venosa/capilar (enfermedad venooclusiva pulmonar/hemangiomatosis capilar pulmonar [EVOP/HCP])» se ha incluido en el grupo 1 (HAP). La HAP y la EVOP/HCP tienen en común un perfil hemodinámico muy similar y parecidas forma de presentación clínica, causas y trastornos asociados, aunque algunos de ellos se asocian con más frecuencia con una afección venosa/capilar más pronunciada. Esta característica se asocia con peores pronóstico y respuesta al tratamiento de la HAP, con riesgo de edema de pulmón. En España —principalmente en el grupo étnico gitano—2 hay una incidencia elevada de EVOP hereditaria debido a mutaciones bialélicas en el gen de la cinasa 4 de factor de inicio de la traducción eucariota 2α (EIF2AK4); por consiguiente, es necesario tenerlo presente de manera específica en el diagnóstico. Por último, el nombre del grupo 3 de la HP se ha cambiado de «respiración alterada por el sueño» a «síndromes de hipoventilación», ya que en general la apnea del sueño obstructiva nocturna no es de por sí una causa de HP, pero esta es frecuente en los pacientes con síndromes de hipoventilación, que pueden cursar también con hipercapnia diurna.
ALGORITMO DE DETECCIÓN TEMPRANA DE LA HIPERTENSIÓN PULMONARSe ha diseñado un nuevo algoritmo diagnóstico destinado a obtener una detección más temprana de la HP. Se recomienda la derivación urgente de los pacientes con alto riesgo en cualquier nivel del proceso diagnóstico. Es imprescindible identificar las enfermedades subyacentes, en especial la cardiopatía izquierda y la enfermedad pulmonar, así como las comorbilidades, con objeto de asegurar una clasificación correcta y orientar el tratamiento. El algoritmo diagnóstico propuesto debe tenerse en cuenta en los pacientes con disnea inexplicada o signos y síntomas compatibles con HP e incluye 3 pasos:
- •
Paso 1. Sospecha. La evaluación inicial (generalmente llevada a cabo por médicos de atención primaria) debe incluir unos antecedentes patológicos y familiares detallados, una exploración física completa (incluida la determinación de la presión arterial, la frecuencia cardiaca y la pulsioximetría), la determinación de péptido natriurético cerebral y la fracción aminoterminal de su propéptido (BNP/NT-proBNP) y un electrocardiograma en reposo. El primer paso puede llevar a la sospecha de un trastorno cardiaco o respiratorio que cause síntomas diferentes de la HP.
- •
Paso 2. Detección. Incluye las exploraciones pulmonares y cardiacas no invasivas. La ecocardiografía es muy importante, ya que asigna un nivel de probabilidad de HP y permite identificar otros trastornos cardiacos. Si se detectan causas distintas de la HP, se debe tratar a los pacientes en consecuencia.
- •
Paso 3. Confirmación. Se debe derivar a los pacientes a un centro de HP para una evaluación más detallada cuando se detecte una probabilidad intermedia o alta de HP y en presencia de factores de riesgo de HAP o antecedentes de embolia pulmonar. Es imprescindible establecer los diagnósticos diferenciales y distinguir entre las diversas causas de HP según la clasificación clínica actual. El centro de HP se encarga de llevar a cabo una evaluación invasiva (CCD).
La presencia de cualquiera de las siguientes señales de alarma se asocia con un peor resultado y requiere una intervención inmediata: síntomas graves o en rápida evolución (clase funcional de la Organización Mundial de la Salud [CF-OMS] III/IV), signos clínicos de insuficiencia ventricular derecha, síncope, signos de bajo gasto cardiaco, arritmias mal toleradas e inestabilidad hemodinámica. Estos casos deben tratarse en régimen de hospitalización y deben derivarse de inmediato a un centro de HP.
La guía resalta también la importancia de una colaboración fluida entre la asistencia de primera línea, la medicina especializada y los centros de HP que permita un diagnóstico más temprano y, por lo tanto, un tratamiento precoz que puedan mejorar el resultado. Un enfoque propuesto para facilitar un diagnóstico más temprano incluye lo siguiente:
- •
Examen de detección sistemática de los grupos en alto riesgo asintomáticos: grupos de población con una gran prevalencia de HP, como pacientes con esclerodermia, portadores de mutaciones del gen BMPR2, familiares de primer grado de los pacientes con HAPH y pacientes a quienes se evalúa para un trasplante hepático o una derivación portosistémica transyugular. Los programas de detección sistemática deben adoptar un enfoque multimodal para aumentar la detección de la HP. Hay consenso general respecto a hacer un examen anual de detección en los grupos de población de riesgo.
- •
Detección temprana de los pacientes sintomáticos de los grupos en riesgo con trastornos como hipertensión portal, infección por el virus de la inmunodeficiencia humana y conectivopatía con esclerosis no sistémica, cuyas tasas de prevalencia no justifican la aplicación sistemática de un examen de detección a pacientes asintomáticos.
- •
Estrategias de base poblacional para el despliegue de métodos de detección temprana en el seguimiento de la embolia pulmonar y las consultas de disnea.
Entre las exploraciones que pueden servir para aumentar la detección de la HP se encuentran la ecocardiografía, la NT-proBNP, el electrocardiograma, las pruebas de función respiratoria (capacidad de difusión pulmonar del dióxido de carbono [DLCO] y cociente de capacidad vital forzada [FVC]/DLCO) y la prueba de esfuerzo cardiopulmonar (PECP). Se asigna a la ecocardiografía una recomendación de clase I B para atribuir una probabilidad ecocardiográfica de HP, que se basa en una velocidad máxima de insuficiencia tricuspídea (VIT) anormal y la presencia de otros signos que indiquen HP. Se sigue recomendando el umbral actual para la VIT (> 2,8 m/s) (clase I C) para evaluar la probabilidad ecocardiográfica de HP con la definición hemodinámica actualizada. Dependiendo de la probabilidad de HP en la ecocardiografía, deberá considerarse la posible conveniencia de hacer otras pruebas, como la PECP. La PECP puede identificar manifestaciones características de una limitación del ejercicio debida a una enfermedad venosa pulmonar o apuntar a un diagnóstico alternativo.
Las actualizaciones de mayor interés en las recomendaciones sobre el diagnóstico temprano de la HP en los grupos de población en riesgo son las siguientes:
- •
Para los pacientes asintomáticos con esclerodermia y un tiempo de evolución de la enfermedad > 3 años, FVC ≥ 40% y DLCO <60%, se recomienda emplear el algoritmo DETECT para identificar a los pacientes con HAP (clase I B)3. Para los pacientes sintomáticos, puede considerarse la posible conveniencia de utilizar la ecocardiografía en ejercicio, la PECP o la resonancia magnética cardiaca para facilitar la toma de decisiones respecto a la realización de un CCD (clase IIb C).
- •
Para los pacientes con disnea persistente o de aparición reciente o con limitación al ejercicio después de una embolia pulmonar, se recomienda una evaluación diagnóstica adicional para determinar HPTEC/enfermedad pulmonar tromboembólica crónica (clase I C). El momento óptimo para evaluar los síntomas y facilitar la detección temprana de la HPTEC puede ser de entre 3 y 6 meses después de la embolia pulmonar aguda, coincidiendo con la evaluación ordinaria del tratamiento anticoagulante. Para los pacientes sintomáticos con defectos de perfusión pulmonar desacoplados más allá de los 3 meses de anticoagulación por una embolia pulmonar aguda, se recomienda la derivación a un centro de HP/HPTEC (clase I C).
- •
Se recomienda la ecocardiografía para los pacientes con hepatopatía o hipertensión portal y signos o síntomas que indiquen HP y también como exploración de detección sistemática en los pacientes evaluados para trasplante hepático o una derivación portosistémica transyugular (clase I C).
En la nueva guía se ha resaltado el papel de las técnicas de imagen multimodales para la estratificación del riesgo de los pacientes con HP. Conjuntamente con el área de la aurícula derecha y la presencia de derrame pericárdico, el acoplamiento ventrículo derecho (VD)-arteria pulmonar (AP) estimado mediante el cociente ecocardiográfico de desplazamiento sistólico del plano del anillo tricuspídeo (TAPSE)/presión arterial pulmonar sistólica (PAPs) parece ser un nuevo parámetro útil para la evaluación del riesgo de los pacientes con HAP. Recientemente se ha demostrado que este valor tiene buena correlación con el acoplamiento VD-AP evaluado mediante bucles de presión-volumen invasivos y capacidad predictiva del resultado. Los valores de corte incorporados a la guía para diferenciar a los pacientes con riesgo bajo, intermedio y alto son > 0,32, 0,19-0,32 y < 0,19mm/mmHg respectivamente, ya que se ha demostrado su valor pronóstico independiente1. Además, se han incorporado a la estratificación del riesgo otros 3 nuevos parámetros obtenidos mediante resonancia magnética cardiaca: fracción de eyección del VD, volumen de eyección indexado (VEI) y volumen telesistólico del VD indexado (VTSVDI). La resonancia magnética cardiaca se considera el patrón de referencia en la evaluación de la estructura y la función del VD, que son los principales factores pronósticos en la HAP. Además, puede producirse un deterioro de la fracción de eyección del VD a pesar de una mejora de la hemodinámica y varios estudios han mostrado que los cambios en los parámetros de la resonancia magnética cardiaca proporcionan una información pronóstica similar o superior a la aportada por los cambios en los parámetros hemodinámicos. En consecuencia, se preveía claramente que se incorporarían estas 3 variables. Los umbrales para la fracción de eyección del VD (> 54, 37-54 y < 37%) proceden de un estudio reciente que ha indicado que estos valores de corte identifican los riesgos bajo, intermedio y alto de mortalidad a 1 año4. El motivo para establecer los umbrales de VEI (> 40, 26-40 y < 26ml/m2) está menos justificado; en este punto, la guía hace referencia a un estudio previo5 en el que un valor de corte de 38ml/m2 aportó una mejor discriminación del pronóstico y otro estudio6 que indicó una peor supervivencia de los pacientes con un VEI ≤ 25ml/m2. Por último, la incorporación del VTSVDI se basa en varios estudios que demuestran su valor pronóstico independiente, y el valor de corte de 54ml/m2 para identificar el riesgo alto se basa en un estudio que observó que este umbral se asociaba con mayor riesgo de mortalidad4.
RECOMENDACIONES SOBRE TRATAMIENTOS FARMACOLÓGICOS INICIALES —SIMPLIFICACIÓN— Y ESTRATOS DE SEGUIMIENTOPor lo que respecta al tratamiento de los pacientes con HP del grupo I, incluidas la idiopática, la heredable, la relacionada con fármacos y sustancias tóxicas o la relacionada con enfermedad del tejido conjuntivo, de las que hay más evidencia disponible, hay un algoritmo completamente nuevo para el tratamiento de la HAP, que se ha simplificado y se centra claramente en la evaluación del riesgo, las comorbilidades cardiopulmonares y los objetivos del tratamiento.
En este algoritmo, las normas de referencia actuales son el tratamiento combinado inicial y la escalada terapéutica en el seguimiento cuando sea apropiada. Además del tratamiento farmacológico dirigido, el tratamiento integral de los pacientes con HAP incluye medidas generales y un tratamiento de apoyo (p. ej., anticoagulación y diuréticos) que no han sufrido cambios significativos. Sin embargo, conviene resaltar el papel del ejercicio, ya que se ha aumentado el grado de la recomendación de un entrenamiento de ejercicio supervisado para los pacientes con HAP ya con el mejor tratamiento farmacológico (clase I A) dada la evidencia adicional que muestra la repercusión favorable del entrenamiento de ejercicio en la capacidad de ejercicio, la calidad de vida, la CF-OMS y el consumo máximo de oxígeno (VO2) en comparación con la asistencia estándar.
La decisión de tratamiento inicial debe basarse en el tipo y la gravedad de la enfermedad y también en la presencia de comorbilidades cardiopulmonares como los trastornos que se asocian con aumento del riesgo de disfunción diastólica del ventrículo izquierdo y los signos de enfermedad pulmonar parenquimatosa, que a menudo se asocian con DLCO bajo. Los pacientes con HAP que responden favorablemente a una prueba de reactividad vascular aguda pueden responder a los antagonistas del calcio. Después de una prueba de reactividad vascular positiva y mientras se trata al paciente con antagonistas del calcio, debe evaluarse la seguridad y la eficacia del tratamiento y repetirse la prueba de reactividad y el CCD después de 3 a 6 meses de tratamiento. Una prueba de reactividad crónica satisfactoria se define por una CF-OMS I-II junto con una PAPm <30mmHg y una RVP < 3 UW.
Para decidir el tratamiento inicial de los pacientes sin comorbilidades cardiopulmonares, es necesaria una reclasificación basada en el examen del riesgo del paciente mediante una puntuación de riesgo de 3 estratos. Para los pacientes en riesgo bajo o intermedio, se recomienda un tratamiento inicial combinado mediante inhibidores de la fosfodiesterasa 5 (iPDE-5) y un antagonista del receptor de la endotelina (ARE), y el grado de recomendación más alto corresponde al tadalafilo en combinación con ambrisentán o tadalafilo junto con macitentán (I B). Para los pacientes en alto riesgo, debe considerarse la posible conveniencia de añadir análogos de la prostaciclina parenterales.
Es preciso tener en cuenta que la eficacia de los fármacos para la HAP solo se ha demostrado en pacientes con PAPm ≥ 25mmHg y RVP > 3 UW, y no hay recomendaciones para la definición hemodinámica modificada (PAPm > 20mmHg, RVP > 2 UW) ni para los pacientes con HP en ejercicio. A la espera de disponer de más datos, es preciso explorar el papel de los fármacos para la HAP en estos pacientes. Los pacientes en alto riesgo de HAP, es decir, aquellos con esclerosis sistémica o los familiares de pacientes con HAPH, deben ser remitidos a un centro de HP para una toma de decisiones individualizada.
EVALUACIÓN DEL RIESGO Y OBJETIVOS DEL TRATAMIENTO EN EL SEGUIMIENTOLa aplicación de un instrumento de evaluación del riesgo con 4 estratos (4S) para el seguimiento es una de las novedades de mayor interés en la presente guía. Esto modificará la práctica clínica y el momento en que se establece la indicación del tratamiento farmacológico.
Este nuevo modelo define 2 niveles de riesgo intermedio diferentes, el bajo y el alto, lo cual permite una discriminación más precisa dentro de la categoría de riesgo intermedio, que comprende hasta un 70% del total de pacientes7. Además, los datos recientes de registros de ámbito nacional8-10 indican que el riesgo de mortalidad es superior a lo que antes se pensaba, específicamente en los grupos con riesgo intermedio a intermedio-alto. En consecuencia, se han actualizado los riesgos de mortalidad a 1 año en cada estrato de la siguiente forma: riesgo bajo, 0 a 3%; riesgo intermedio-bajo, 2-7%; riesgo intermedio-alto, 9-19%, y riesgo alto, > 20%.
Estos mismos estudios recientes de registros nacionales coinciden en que la CF-OMS, la prueba de los 6 min de marcha y la concentración de BNP/NT-proBNP, todos ellos variables no invasivas, son los factores pronósticos más potentes8-10. Esta nueva evidencia, junto con el 4S, permitirá una evaluación fácil pero precisa del riesgo de los pacientes durante el seguimiento. Deberán usarse otras variables hemodinámicas y de diagnóstico por la imagen adicionales para la estratificación del riesgo. Además, en cualquier etapa deben tenerse en cuenta otros factores no modificables, como la edad, el sexo, el tipo de enfermedad, las comorbilidades y la enfermedad renal.
Durante el seguimiento, esta guía sigue recomendando un enfoque terapéutico orientado a objetivos. A pesar de que en la mayor parte de los casos represente un verdadero reto, alcanzar un riesgo bajo debe ser el objetivo paa cada uno de los pacientes, puesto que el mejor pronóstico a largo plazo lo justifica10. La nueva guía establece las siguientes recomendaciones para las decisiones de tratamiento en el seguimiento:
- •
Para los pacientes con un riesgo intermedio-bajo a pesar del tratamiento con ARE/iPDE-5, debe considerarse la posible conveniencia de añadir selexipag como primera elección. Además, podría considerarse el cambio del iPDE-5 a riociguat para optimizar la intervención sobre la vía del óxido nítrico.
- •
Para los pacientes con un riesgo intermedio-alto o alto que toman tratamientos orales, debe considerarse la posible conveniencia de añadir epoprostenol i.v. o treprostinilo i.v./s.c. como primera elección. Al mismo tiempo, el paciente debe ser remitido a una evaluación para un posible trasplante de pulmón. Solo para los pacientes considerados no adecuados para los prostanoides parenterales en una evaluación individualizada (pacientes de edad avanzada, suma de comorbilidades, rechazo del tratamiento), se considerará la posible conveniencia de añadir selexipag como primera elección o cambiar del iPDE-5 a riociguat para optimizar el tratamiento oral.
Una decisión muy acertada del grupo de trabajo que ha elaborado la guía es resaltar el tratamiento de los pacientes con comorbilidades cardiopulmonares. Estas se observan sobre todo en los pacientes ancianos e incluyen factores de riesgo como obesidad, diabetes, enfermedad coronaria, hipertensión sistémica (fenotipo de corazón izquierdo) o antecedentes de tabaquismo crónico y DLCO baja (fenotipo cardiopulmonar). Estos pacientes responden peor a la medicación para la HAP, es menos probable que alcancen un estado de riesgo bajo, tienen un riesgo de mortalidad más alto y es más probable que interrumpan esta medicación a causa de falta de eficacia o mala tolerancia. En consecuencia, para los pacientes con HAP y riesgo de muerte intermedio o alto, la decisión de añadir una medicación para la HAP a la monoterapia inicial indicada con un iPDE-5 o un ARE debe individualizarse en cada caso sobre la base de una evidencia escasa.
Por lo que respecta a las recomendaciones de medidas generales, en esta edición se resalta la repercusión favorable del entrenamiento de ejercicio, la corrección del estado del hierro si hay anemia ferropénica y la vacunación de los pacientes contra el SARS-CoV-2, además de la vacunación contra la gripe y Streptococcus pneumoniae.
Se introducen por primera vez unas recomendaciones para el grupo de pacientes con HAP tras una cardiopatía congénita del adulto corregida, con una estrategia de tratamiento inicial y un seguimiento similares a los recomendados para los pacientes con HAP idiopática. En el síndrome de Eisenmenger, el bosentán es el tratamiento recomendado para los pacientes sintomáticos, a diferencia de lo que se indicaba en la guía de la ESC de 2020 para el tratamiento de las cardiopatías congénitas del adulto con base en una distancia recorrida en la prueba de 6 min de marcha < 450 m, que recomendaba tratamiento con un ARE (inespecífico). Si no hay respuesta al ARE inicial, se recomienda un tratamiento combinado. Por último, no hay ninguna recomendación para el tratamiento a largo plazo de los pacientes con HP y una RVP elevada que contraindique el cierre del cortocircuito.
RECOMENDACIONES SOBRE LA HIPERTENSIÓN PULMONAR DEBIDA A CARDIOPATÍA IZQUIERDALa HP y la disfunción del VD a menudo están presentes en los pacientes con cardiopatía izquierda y se asocian con mal pronóstico. La cardiopatía izquierda probablemente sea la principal causa de HP y es la causa en aproximadamente el 70% de los casos. La cardiopatía izquierda incluye a los pacientes con insuficiencia cardiaca (fracción de eyección del ventrículo izquierdo reducida, levemente reducida o conservada), valvulopatía izquierda o trastornos cardiovasculares congénitos o adquiridos que conducen a una HP poscapilar.
Además de las modificaciones de las definiciones hemodinámicas de la HP, ha dejado de utilizarse el gradiente de presión diastólica para diferenciar la HP solo poscapilar de la HP poscapilar y precapilar combinada debido a los datos contradictorios existentes sobre el pronóstico de los pacientes con cardiopatía izquierda.
Los puntos diagnósticos clave para evaluar la HP sospechada en la cardiopatía izquierda son los siguientes: a) diagnóstico y seguimiento de la cardiopatía izquierda subyacente; b) evaluación de la posible HP y determinación del fenotipo del paciente, y c) evaluación hemodinámica invasiva cuando esté indicada. La guía actual incluye una recomendación fuerte de establecer un diagnóstico exacto y optimizar el tratamiento de la cardiopatía izquierda antes de considerar la posible conveniencia de una evaluación invasiva de la HP. Además, se debe evaluar a los pacientes con cardiopatía izquierda y sospecha de HP siguiendo la estrategia diagnóstica establecida para la HP. La guía proporciona un instrumento clínico práctico para establecer el fenotipo de los pacientes y facilitar el diagnóstico y la decisión de a qué pacientes se debe examinar con un estudio diagnóstico completo para la HP.
Mientras que la evaluación invasiva de la HP no suele estar indicada para los pacientes con una probabilidad clara de cardiopatía izquierda como causa principal de la HP o una cardiopatía izquierda subyacente establecida y una HP leve, esta nueva guía introduce 2 nuevas indicaciones para el CCD: a) los pacientes con insuficiencia tricuspídea grave, con o sin cardiopatía izquierda, antes de la reparación valvular quirúrgica o percutánea, y b) sospecha de HP combinada poscapilar y precapilar con un componente precapilar grave, para lo cual una información más completa será útil en la determinación del fenotipo y la toma de decisiones sobre el tratamiento. De igual modo, las pruebas adicionales durante el CCD pueden ser útiles para detectar a los pacientes con insuficiencia cardiaca y fracción de eyección del ventrículo izquierdo conservada (IC-FEc) que tienen una PAPE en reposo normal pero una respuesta anormal al ejercicio o a la exposición a líquidos.
Los efectos de los nuevos tratamientos médicos para la insuficiencia cardiaca (antagonistas del receptor de la angiotensina y de la neprilisina o inhibidores del cotransportador 2 de sodio-glucosa) en la HP a través del remodelado inverso del ventrículo izquierdo, requieren una mayor investigación.
Por último, aunque los fármacos autorizados para la HAP no se recomiendan para pacientes con HP-cardiopatía izquierda, la guía no proporciona ninguna recomendación a favor o en contra del uso de iPDE-5 en los pacientes con IC-FEc y HP poscapilar y precapilar combinada. En cambio, hay una recomendación clara contra los iPDE-5 para pacientes con IC-FEc y HP poscapilar aislada.
ENFERMEDAD PULMONAR TROMBOEMBÓLICA CRÓNICA: NUEVO CONCEPTOEl término «enfermedad pulmonar tromboembólica crónica» (EPTEC), HP del grupo 4, se introduce como una entidad clínica diferente e incluye a pacientes con o sin HP en reposo que presentan disnea de esfuerzo, defectos de perfusión con desacoplamiento en la gammagrafía de ventilación/perfusión y coágulos fibróticos organizados crónicos que persisten después de 3 meses de anticoagulación en la angiografía pulmonar de tomografía computarizada o en la angiografía de sustracción digital11. A los pacientes con HP debida a EPTEC, se los denomina pacientes con HPTEC. Los pacientes sin HP en reposo podrían referir síntomas a causa de una HP en ejercicio o un aumento de la ventilación del espacio muerto. Para diagnosticar una EPTEC, es preciso demostrar la inducción de HP durante el ejercicio.
En el algoritmo diagnóstico para los pacientes en quienes se sospecha una EPTEC, la gammagrafía de ventilación/perfusión es el medio más eficaz para descartar la enfermedad, mientras que la angiografía pulmonar con tomografía computarizada, la angiografía de sustracción digital y segmentaria selectiva, la tomografía computarizada de haz cónico y la tomografía computarizada con detector de área se emplean para planificar y guiar la intervención.
El algoritmo de tratamiento para la HPTEC se ha modificado con la inclusión del tratamiento multimodal (cirugía, medicación para la HP, angioplastia pulmonar con balón [APB]), que pueden aplicarse de manera simultánea o secuencial. Se recomienda el empleo de dosis terapéuticas de anticoagulación durante toda la vida para todo pacientes con HPTEC y se recomiendan específicamente los antagonistas de la vitamina K para los pacientes con síndrome antifosfolipídico subyacente. Mientras que se recomienda el riociguat para los pacientes sintomáticos con una HPTEC inoperable o HP persistente/recurrente después de una endarterectomía pulmonar (EAP) (clase I B), para los pacientes sintomáticos con una HPTEC inoperable puede considerarse la posible conveniencia de administrar fármacos aprobados para la HAP fuera de las indicaciones aprobadas (clase IIb).
Para los pacientes sintomáticos seleccionados con EPTEC y sin HP puede prescribirse un tratamiento con EAP o APB, con una mejora clínica y hemodinámica tanto en reposo como en el ejercicio. Se ha asignado a la APB una recomendación de clase I B para pacientes inoperables o con HP residual después de la EAP. Estas intervenciones deben llevarse a cabo en centros de HPTEC, que se definen por un gran volumen de intervenciones: > 50 EAP/año y > 30 pacientes/año sometidos a APB o > 100 APB/año. Estos volúmenes de intervenciones se han asociado con una mejora de los resultados, pero es posible que no puedan alcanzarse de manera amplia en muchos países europeos, entre ellos España. En consecuencia, la guía reconoce la necesidad de adaptar las definiciones a cada país y resalta la necesidad de que haya centros acreditados con el máximo volumen de intervenciones y buenos resultados. La Sociedad Española de Cardiología (SEC) y la Sociedad Española de Neumología y Cirugía Torácica (SEPAR) proponen la acreditación de centros de HP con 3 niveles de complejidad: básicos, especializados y de alta complejidad12. Por último, los beneficios clínicos de la denervación de la arteria pulmonar se encuentran todavía en fase de investigación, hecho que la guía menciona como una laguna en la evidencia existente.
REPRESENTANTES DE LOS PACIENTESLa HP es una enfermedad crónica en la que las asociaciones de pacientes desempeñan un papel importante. Las asociaciones de pacientes proporcionan apoyo en formación sanitaria y emocional y pueden influir favorablemente en la autoconfianza de los pacientes, así como en sus procesos y aptitudes de afrontamiento de la enfermedad. A este respecto, la guía recomienda activamente que los centros de HP colaboren con las asociaciones de pacientes en iniciativas de empoderamiento de los pacientes y en la mejora de la experiencia de estos y sus cuidadores, atendiendo a cuestiones como el aprendizaje en salud, los estilos de vida saludables, el bienestar y la autonomía. Como novedad, a través de las Redes de Referencia Europeas (ERN) para enfermedades raras (ERN-LUNG), los representantes de los pacientes participaron activamente por primera vez en la elaboración de la actual guía sobre la HP aportando comentarios críticos y constructivos y asegurando que la voz de los pacientes estuviera representada y se tuviera en cuenta como parte del proceso de toma de decisiones.
PREGUNTAS DE POBLACIÓN, INTERVENCIÓN, COMPARADOR Y CRITERIO DE VALORACIÓN: CUESTIONES PRÁCTICAS PARA LOS MÉDICOSUna novedad importante de esta guía es el énfasis que hace en 4 cuestiones muy prácticas que tienen consecuencias directas para los médicos clínicos por lo que respecta a cada subgrupo de clasificación de la HP —preguntas: población, intervención, comparador y criterio de valoración (PICO)—.
La primera hace referencia a la estrategia de tratamiento inicial para la HP del grupo 1. Aunque los autores de la guía reconocen que la calidad de la evidencia al respecto es baja, se recomienda el tratamiento combinado doble con un ARE e iPDE-5 en vez de la monoterapia para los pacientes con HAP sintomáticos. Esta recomendación se basa en los resultados del ensayo AMBITION13, que demostró un riesgo de eventos de fallo clínico (especialmente ingresos hospitalarios) significativamente inferior con la combinación de ambrisentán y tadalafilo en comparación con cualquiera de estos fármacos utilizado en monoterapia.
La segunda cuestión PICO corresponde a iPDE-5 para pacientes con HP poscapilar y precapilar combinada relacionada con IC-FEc. Sin embargo, en este caso no pudo hacerse ninguna recomendación a favor o en contra de los iPDE-5. Esto se debe a la ausencia de ensayos clínicos aleatorizados que hayan abordado específicamente esta cuestión. En 2 ensayos clínicos aleatorizados se incluyó a pacientes con HP e IC-FEc y los resultados fueron contradictorios. En un ensayo en el que se incluyó a pacientes con un perfil de HP predominantemente solo poscapilar, se obtuvieron resultados negativos, ya que el sildenafilo no mostró efecto alguno en la hemodinámica14. El otro ensayo, en el que se incluyó a pacientes con un perfil de HP de predominio poscapilar y precapilar combinado, se presentaron resultados favorables, ya que el sildenafilo mejoró la hemodinámica, la función del VD y la vida15. En consecuencia, la guía resalta esta laguna del conocimiento en la que nuevos ensayos clínicos que incluyan a este tipo de pacientes podrían conducir a nueva evidencia que tenga repercusiones en futuras recomendaciones. En cambio, la guía establece claramente una recomendación en contra de los iPDE-5 para pacientes con IC-FEc y un perfil de HP solo poscapilar.
La tercera cuestión PICO aborda los iPDE-5 orales para pacientes con HP asociada con neumopatía intersticial (grupo 3 de HP), a los que se había asignado una recomendación de clase III en la guía de 2015. Hay una laguna importante del conocimiento a este respecto. La evidencia disponible procede de series de casos y registros, lo cual impide al grupo de trabajo llegar a ninguna conclusión definitiva (con lo cual, la recomendación es de clase II B). El documento resalta la necesidad de remitir a los pacientes a un centro especializado en HP con objeto de aplicar un enfoque terapéutico individualizado para cada paciente. Es importante señalar que no se recomiendan los fármacos para la HP para los pacientes con HP del grupo 3 no grave.
Por lo que respecta a la cuestión PICO 4, el documento presta atención al papel de los fármacos para la HP antes de la APB en los pacientes con EPTEC que no son aptos para una EAP (HP del grupo 4), sobre los que no se hacía ninguna recomendación en la guía de 2015. Este tema tiene aún más importancia como consecuencia de la nueva recomendación de clase I B de APB para los pacientes con HPTEC inoperables, que cabe suponer que aumentará el número de intervenciones. La evidencia disponible a este respecto es escasa y consiste en apenas solo 1 ensayo clínico aleatorizado y 2 estudios de observación unicéntricos. En esos estudios, los fármacos para la HP antes de la APB mostraron una mejora moderada de la hemodinámica pulmonar con un perfil de seguridad favorable. Estos resultados se han traducido en la nueva guía en una «recomendación condicional» de los fármacos para la HP antes de la APB.
CONCLUSIONESLos puntos clave de la guía ESC 2022 sobre el diagnóstico y tratamiento de la HP1 pueden resumirse de la siguiente forma:
- •
La HP se define ahora por un valor de PAPm > 20mmHg en reposo. La nueva definición de la HAP implica también una RVP > 2 unidades Wood y una PAPE ≤ 15mmHg.
- •
Se ha propuesto un algoritmo diagnóstico simplificado para la HP para respaldar la detección temprana y la derivación/tratamiento precoces, que sigue un proceso de 3 pasos y se basa en una red de colaboración:
- •
El algoritmo de tratamiento inicial para la HAP incluye una evaluación completa del riesgo, las comorbilidades cardiopulmonares y los objetivos del tratamiento.
- -
Se incluye una evaluación del riesgo mediante técnicas de imagen multimodales (ecocardiografía y resonancia magnética) en la evaluación de estratificación del riesgo en 3 estratos.
- -
Los patrones de referencia actuales son el tratamiento combinado inicial y la escalada terapéutica en el seguimiento cuando sea apropiada.
- -
Se utiliza un nuevo medio de evaluación del riesgo en 4 estratos (4S) para la toma de decisiones sobre el tratamiento orientadas a objetivos durante el seguimiento.
- -
Se recomienda el entrenamiento de ejercicio supervisado para los pacientes con una HAP estable con el mejor tratamiento farmacológico (clase I A).
- -
Deben abordarse simultáneamente las comorbilidades cardiopulmonares.
- -
- •
La HP del grupo 2 requiere la optimización del tratamiento para la cardiopatía izquierda antes de que pueda considerarse la evaluación de la HP. No se recomiendan los fármacos aprobados para la HAP y no hay consenso respecto a los iPDE-5 para los pacientes con IC-FEc y HP poscapilar y precapilar combinada.
- •
En la HP del grupo 3 se ha cambiado la denominación de «respiración alterada por el sueño» a «síndromes de hipoventilación». Se recomienda optimizar el tratamiento de la enfermedad pulmonar subyacente, con la inclusión en programas de rehabilitación pulmonar; puede considerarse la posible conveniencia de utilizar inhibidores de la PDE-5 cuando la HP grave se asocie con neumopatía intersticial.
- •
Se introduce el término EPTEC, o HP del grupo 4, como una entidad diferenciada. El diagnóstico de HPTEC debe mejorarse y basarse en una sospecha temprana en el momento en que se produce una embolia pulmonar aguda y durante el seguimiento sistemático de estos pacientes. El algoritmo de tratamiento es multimodal, con cirugía, fármacos para la HP y APB.
Ninguna.
CONFLICTO DE INTERESESLos documentos de declaración de conflictos de intereses de todos los autores se pueden consultar en el material adicional.
Grupo de Trabajo de la SEC para la guía ESC/ERS 2022 sobre el diagnóstico y tratamiento de la hipertensión pulmonar: Victoria Delgado (coordinadora), Domingo Pascual-Figal (coordinador), Esther Calero, Pilar Escribano, Ana García-Alvarez, María Lázaro, Manuel López-Meseguer, José M. Montero-Cabezas, Patricia Palau, Alejandro Recio-Mayoral, Joaquín Rueda y María Teresa Velázquez.
Comité de Guías de la SEC: Rut Andrea, Pablo Avanzas, Gemma Berga, Araceli Boraita, David Calvo, Raquel Campuzano, Victoria Delgado, Laura Dos Subirá, Juan José Gómez Doblas, Pilar Mazón, Domingo Pascual, Juan Sanchis, José M. de la Torre, David Vivas y José L. Ferreiro (presidente).
Los nombres de todos los autores del artículo se indican por orden alfabético en anexo A.
Véase contenido relacionado: https://secardiologia.es/cientifico/guias-clinicas/insuficiencia-cardiaca-y-miocardiopatia/13912-2022-esc-ers-guidelines-for-the-diagnosis-and-treatment-of-pulmonary-hypertension
*Autor para correspondencia.
Direcciones de correo electrónico: videlga@gmail.com (V. Delgado); dpascual@um.es (D. Pascual).