La experiencia con el desfibrilador automático implantable subcutáneo (DAI-SC) en pacientes pediátricos aún es reducida. El objetivo de este estudio es determinar la incidencia de complicaciones en pacientes pediátricos de nuestro centro en función del tipo de DAI y del tamaño del paciente.
MétodosSe incluyó a pacientes menores de 18 años que recibieron un DAI-SC desde 2016 y pacientes contemporáneos (desde 2014) que recibieron un DAI transvenoso (DAI-TV). El evento principal fue el combinado de complicaciones y descargas inapropiadas.
ResultadosSe implantó un DAI-SC a 26 pacientes (edad, 14 [intervalo, 5-17] años; índice de masa corporal [IMC], 20,2). De ellos, 23 (88%) fueron implantes intermusculares y el resto, en subserrato, 24 (92%) con 2 incisiones. Se programaron 2 zonas en todos los pacientes: condicional a 230 (220-230) lpm y de choque a 250 lpm. El grupo de DAI-TV incluyó a 19 pacientes (edad, 11 [5-16] años; IMC, 19,2; el 79% monocamerales). La supervivencia libre del evento principal a 5 años fue el 80% de los pacientes con DAI-SC y el 63% del grupo con DAI-TV (p=0,54); la de descargas inapropiadas fue similar (el 85 frente al 89%; p=0,86), mientras que la de complicaciones fue mayor en el grupo de DAI-SC (el 96 frente al 57%; cloglog p=0.016). En el grupo de DAI-SC no hubo fallo de la terapia ni mayores complicaciones con un IMC ≤ 20.
ConclusionesCon las técnicas de implante y programación actuales, el DAI-SC es eficaz y seguro en pacientes pediátricos, con similares descargas inapropiadas y menos complicaciones a corto y medio plazo que el DAI-TV.
Palabras clave
Los desfibriladores automáticos implantables (DAI) son el tratamiento establecido para la prevención de la muerte súbita de pacientes con cardiopatía y han mostrado sobradamente su eficacia1–3. Afortunadamente, en la población pediátrica su uso es poco frecuente, ya que la incidencia de este evento es baja. Asimismo, son dispositivos diseñados para adultos, por lo que cuando es necesario implantarlos hay dificultades técnicas por el tamaño del paciente y, además, se asocia con más complicaciones a corto y medio plazo, fundamentalmente derivadas del electrodo4. El DAI subcutáneo (DAI-SC), que se implanta en posición extratorácica, es una alternativa al DAI transvenoso (DAI-TV) tradicional para evitar estas complicaciones, así como las posibles infecciones intravasculares, por lo cual es una opción especialmente atractiva para pacientes jóvenes con larga expectativa de vida. Como contrapartida, son dispositivos de mayor tamaño, lo que limita su implante en los pacientes de menor peso, menor longevidad, con imposibilidad de realizar estimulación y mayores tasas de descargas inapropiadas5–7. Además, la experiencia en pacientes pediátricos todavía es escasa8–12. Nuestra hipótesis es que el DAI-SC es un tratamiento seguro para los pacientes pediátricos, con una tasa de complicaciones equivalente a la del DAI-TV. El objetivo general de este estudio es determinar la incidencia de complicaciones de los DAI en pacientes menores de 18 años de nuestro centro en función del tipo de dispositivo y del tamaño del paciente.
MÉTODOSDiseño del estudioSe realizó un estudio observacional, ambispectivo y unicéntrico que incluyó de manera prospectiva a pacientes menores de 18 años a los que se implantó un DAI-SC. Se empleó como grupo de comparación a los pacientes contemporáneos a los que se implantó un DAI-TV. El seguimiento se ajustó al protocolo habitual de nuestro centro, que incluye una primera visita presencial tras el alta hospitalaria (en el primer mes del implante) y después, seguimiento del dispositivo a distancia, en este caso con el sistema de transmisión Latitude (Boston Scientific, Estados Unidos). En caso de que no hubiera transmisiones, se contactó con el paciente por teléfono para evaluar su situación clínica y solucionar los problemas de transmisión si los hubiera. Se hicieron revisiones presenciales en función de la cardiopatía de base.
La inclusión de pacientes con DAI-TV fue prospectiva desde 2016 y retrospectiva hasta 2014. Se analizó en ambos grupos a 2 pacientes a los que se cambió de DAI-TV a DAI-SC, considerando el tiempo que pertenecieron a cada uno de ellos. El protocolo de seguimiento es el mismo que el descrito para el DAI-SC.
Implante y programaciónEl abordaje estándar empleado en nuestro centro para el implante de DAI-SC es alojar el generador entre el dorsal ancho y el serrato con la técnica de 2 incisiones, en la que puede haber modificaciones en función de las características del paciente. La posición del electrodo fue paraesternal izquierda o derecha según el resultado del cribado. Se empleó escopia antes del implante en todos los casos para confirmar una adecuada posición del dispositivo y marcar la piel, mientras que su uso durante el procedimiento quedó a criterio del operador. El DAI-TV se implanta siguiendo la técnica habitual, dejando bucle en el electrodo en previsión del crecimiento del paciente. Todos los implantes se realizaron con profilaxis antibiótica.
El modo de programación habitual del DAI-SC fue de 2 ventanas, la de choque a 250 lpm y la condicional a partir de 220 lpm, con el filtro SMART PASS activado (si está disponible) y con estimulación posterior al choque. Del mismo modo, en los DAI-TV se emplea una ventana de fibrilación ventricular (FV) a partir de 220 lpm y una zona de monitor o una segunda zona de terapia a criterio del operador.
EventosEl evento principal del estudio fue un combinado de complicaciones y descargas inapropiadas. Como eventos secundarios, se consideraron ambos por separado, la eficacia de las terapias, las descargas apropiadas y la necesidad de recambio del dispositivo y sus motivos. Se evaluaron los eventos específicamente en el subgrupo de pacientes con índice de masa corporal (IMC) ≤ 20, ya que este dato se ha asociado con mayores complicaciones en estudios previos12.
Las complicaciones se dividieron en agudas (durante el procedimiento) y posteriores al implante. Se analizaron todas las complicaciones potencialmente relacionadas con la intervención, el generador o el electrodo: neumotórax, derrame pericárdico o taponamiento, infección de la herida quirúrgica, infección del dispositivo, disfunción del dispositivo o necesidad de recambio no electivo del dispositivo, hematoma que precisa reintervención, desplazamiento del electrodo que precisa reintervención, fracaso de la terapia o ausencia de detección de arritmias ventriculares, así como las complicaciones que requirieron reintervención quirúrgica o recambio del dispositivo no planeados inicialmente.
Recogida de datosSe recogieron datos demográficos y clínicos relevantes de los pacientes, así como los eventos durante el seguimiento. Todos los datos se recogieron mediante un formulario de RedCap (Research Electronic Data Capture)13,14.
Análisis estadísticoLos datos cualitativos se presentan como frecuencias y porcentaje y los cuantitativos, como mediana [intervalo intercuartílico]. Se compararon mediante la prueba de la χ2 y el test de la suma de rangos de Wilcoxon respectivamente. Para las variables dependientes del tiempo, se llevó a cabo un análisis de supervivencia basado en el tiempo hasta el evento, se obtuvieron curvas de Kaplan-Meier de supervivencia y las diferencias se analizaron con el log-ranktest. Para la comparación de supervivencia en un momento concreto (p. ej., a los 5 años), se empleó el test basado en la transformación cloglog de los estimadores de Kaplan-Meier15. No se calculó la razón de riesgos (hazard ratio) del evento principal y los eventos secundarios, ya que la variable de estudio («tipo de DAI») violaba la asunción de riesgos proporcionales del modelo de regresión de Cox. Para el análisis de los datos se emplearon el programa R16, versión 4.2.3 y los paquetes Hmisc (5.0.1), survival (3.5.3) y ComparisonSurv (1.1.1), gtsummary (1.7.0) para las tablas, y ggplot2 (3.4.1) y survminer (0.4.9) para los gráficos17–22.
Consideraciones éticasEl estudio cumplió con los principios de la declaración de Helsinki y antes de comenzar fue aprobado por el Comité Ético de Investigación (CEIm) del centro. Los pacientes incluidos de manera prospectiva firmaron el correspondiente consentimiento informado; el CEIm eximió la recogida de los incluidos retrospectivamente. La imagen que incluye a un paciente se publica con el consentimiento firmado por sus padres.
RESULTADOSCohorte de pacientesDesde enero de 2016, se implantó un DAI-SC a 26 pacientes con edades entre 5 y 17 años, peso mínimo de 20 kg; de ellos, 12 (46%) tenían un IMC ≤ 20. En 2 pacientes, el DAI-SC se implantó por complicaciones previas de un DAI-TV. El cribado fue favorable en al menos 2 vectores en uno de los lados en todos los pacientes menos 3, que solo tenían 1 vector válido en cada lado. Asimismo, desde 2014 se implantó un DAI-TV a 19 pacientes (edades entre 5 y 16 años, peso mínimo de 24 kg, 11 [58%] con IMC ≤ 20). Desde 2016, el motivo de implantar un DAI-TV fue la necesidad de estimulación o no tener un cribado favorable para DAI-SC.
Las características basales de ambos grupos se presentan en la tabla 1 y la figura 1 del material adicional. Los pacientes con DAI-TV tenían un peso significativamente menor (59 frente a 45 kg; p=0,027), aunque sin diferencias en el IMC (20,2 frente a 19,2; p=0,32). En conjunto, las cardiopatías de base predominantes en la cohorte fueron la miocardiopatía hipertrófica (51%), la arritmogénica (16%), las cardiopatías congénitas (13%) y las canalopatías (11%).
Características basales
| Variable | Subcutáneo (n=26) | Transvenoso (n=19) | Total (n=45) | p |
|---|---|---|---|---|
| Edad al implante (años) | 14,5 [11,0-16,4] | 11,5 [10,1-14,2] | 13,6 [10,3-16,1] | 0,075 |
| Varones | 17 (65) | 14 (74) | 31 (69) | 0,55 |
| Estatura (cm) | 164 [146-172] | 147 [136-165] | 160 [138-170] | 0,079 |
| Peso (kg) | 59 [39-67] | 45 [33-53] | 50 [38-60] | 0,027 |
| IMC | 20,2 [17,3-24,9] | 19,2 [16,8-21,7] | 20,0 [17,1-23,0] | 0,32 |
| IMC ≤ 20 | 12 (46) | 11 (58) | 23 (51) | |
| Cardiopatía | 0,37 | |||
| Miocardiopatía hipertrófica | 15 (58) | 8 (42) | 23 (51) | |
| Miocardiopatía arritmogénica | 4 (15) | 3 (16) | 7 (16) | |
| Miocardiopatía dilatada | 0 | 3 (16) | 3 (6,7) | |
| Síndrome de Brugada | 1 (3,8) | 0 (0) | 1 (2,2) | |
| Síndrome de QT largo | 1 (3,8) | 1 (5,3) | 2 (4,4) | |
| FV idiopática | 1 (3,8) | 0 (0) | 1 (2,2) | |
| TV catecolaminérgica | 1 (3,8) | 0 (0) | 1 (2,2) | |
| Cardiopatía congénita | 3 (12) | 3 (16) | 6 (13) | |
| Miocardiopatía no compactada | 0 (0) | 1 (5,3) | 1 (2,2) | |
| FEVI o FE del ventrículo sistémico (%) | 60 [56-67] | 62 [53-76] | 61 [56-70] | 0,45 |
| Antecedente de insuficiencia cardiaca | 3 (12) | 3 (16) | 6 (13) | 0,69 |
| NYHA | 0,63 | |||
| I | 22 (85) | 14 (74) | 36 (80) | |
| II | 1 (3,8) | 2 (11) | 3 (6,7) | |
| III | 3 (12) | 3 (16) | 6 (13) | |
| Diabetes | 1 (3,8) | 0 | 1 (2,2) | >0,99 |
| QRS | 0,61 | |||
| Estrecho | 21 (81) | 14 (74) | 35 (78) | |
| BCRI | 1 (3,8) | 2 (11) | 3 (6,7) | |
| BCRD | 4 (15) | 2 (11) | 6 (13) | |
| TCIV | 0 | 1 (5,3) | 1 (2,2) | |
| QRS estimulado | 0 | 0 | 0 | |
| Frecuencia cardiaca (lpm) | 75 [66-78] | 76 [72-85] | 75 [68-80] | 0,25 |
| Dispositivo previo | >0,99 | |||
| No | 24 (92) | 18 (95) | 42 (93) | |
| DAI | 2 (7,7) | 1 (5,3) | 3 (6,7) | |
| Otros | 0 | 0 | 0 | |
| Antiarrítmicos | 1 (3,8) | 2 (11) | 3 (6,7) | 0,56 |
| Bloqueadores beta | 12 (46) | 8 (42) | 20 (44) | 0,79 |
BCRD: bloqueo completo de rama derecha; BCRI: bloqueo completo de rama izquierda; DAI: desfibrilador automático implantable; FE: fracción de eyección; FEVI: fracción de eyección del ventrículo izquierdo; FV: fibrilación ventricular; M: miocardiopatía; NYHA: clase funcional de la New York Heart Association; TCIV: trastorno de conducción intraventricular; TV: taquicardia ventricular.
Los valores expresan n (%) o mediana [intervalo intercuartílico].
Los datos del implante y la programación al alta de ambos grupos se describen en la tabla 1 del material adicional y la tabla 2 y la tabla 3. En total, 41 implantes (91%) se realizaron en la sala de electrofisiología, 42 (93%) con anestesia general.
Datos del desfibrilador automático implantable subcutáneo
| Pacientes, n | 26 |
| Cribado izquierdo (vectores válidos) | |
| 1 | 7 (27) |
| 2 | 7 (27) |
| 3 | 12 (46) |
| Cribado derecho (vectores válidos)* | |
| 1 | 3 (14) |
| 2 | 9 (43) |
| 3 | 9 (43) |
| N.ode incisiones | |
| 2 | 24 (92) |
| 3 | 2 (8) |
| Bolsillo | |
| Intermuscular (entre serrato y dorsal) | 23 (88) |
| Submuscular (subserrato) | 3 (12) |
| Posición del electrodo | |
| Paraesternal izquierdo | 22 (85) |
| Paraesternal derecho | 4 (15) |
| Test de desfibrilación | |
| No realizado | 1 (4) |
| Exitoso<65 J | 24 (92) |
| FV no inducible | 1 (4) |
| Impedancia de descarga (Ω) | 54 [48-68] |
| Tiempo a terapia (s) | 14,50 [13,35-15,95] |
| Ventana de choque a 250 lpm | 26 (100) |
| Zona condicional | 26 (100) |
| Ventana condicional (lpm) | 230 [220-230] |
| Vector de sensado | |
| Primario | 7 (27) |
| Secundario | 12 (46) |
| Alternativo | 7 (27) |
| Smart Pass | 25 (96) |
| Estimulación tras terapia | 26 (100) |
FV: fibrilación ventricular.
Datos del desfibrilador automático implantable transvenoso
| Pacientes, n | 19 |
| Tipo de DAI | |
| Monocameral | 15 (79) |
| Bicameral | 4 (21) |
| Resincronizador | 0 |
| Ventana de FV (lpm) | 220 [220-226] |
| Zona TV-2 | 4 (21) |
| Ventana de TV-2 (lpm) | 190 [178-200] |
| Zona TV-1 | 0 |
| Zona monitor | 13 (68) |
| Ventana de monitor (lpm) | 180 [170-200] |
DAI: desfibrilador automático implantable; FV: fibrilación ventricular; TV: taquicardia ventricular.
Los valores expresan n (%) o mediana [intervalo intercuartílico].
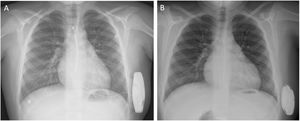
Para el implante del DAI-SC se utilizó mayoritariamente la técnica de 2 incisiones (n=24 [92%]), la colocación del dispositivo fue intermuscular en 23 (88%) y subserrato en 3 (12%) pacientes con peso<30 kg (figura 1); se empleó escopia durante el implante en 17 casos (65%) para garantizar una correcta posición del electrodo. Se implantó el modelo A219 en todos salvo el primer paciente de la serie, que recibió el modelo A209. A criterio del operador, no se hizo el test de desfibrilación en 1 paciente, dada su situación clínica, mientras que en otro no se consiguió inducir la FV.
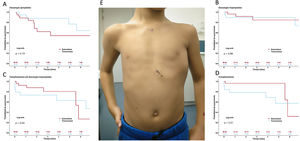
Figura central. El DAI-SC es eficaz y seguro en niños, sin mayores complicaciones o descargas inapropiadas que el desfibrilador automático implantable transvenoso. A-D: curvas de Kaplan-Meier de la supervivencia libre de descargas apropiadas (A), inapropiadas (B), complicaciones o descargas inapropiadas (C) y complicaciones (D). E: resultado del implante de un DAI-SC subserrato en el paciente más pequeño de la serie (5 años, 112 cm y 20 kg). DAI-SC: desfibrilador automático implantable subcutáneo.
De los pacientes con DAI-TV, 15 (79%) recibieron un dispositivo monocameral. El tiempo de escopia (4,1 [3,0-8,9] frente a 0,3 [0,2-0,5] min; p<0,001) y la duración del procedimiento (90 [71-112] frente a 71 [54-75] min; p=0,012) fueron más largos que en el grupo de DAI-SC. No se hizo ningún test de desfibrilación.
En todos los pacientes con DAI-SC se programaron 2 zonas, con la ventana de choque a partir de 250 lpm y la ventana condicional a 230 (220-230) lpm, mientras que en los DAI-TV se programó una zona de FV a partir de 220 (220-226) lpm, en 13 (68%) pacientes se programó una zona de monitor a 180 (170-200) lpm y en 4 (21%) se dejó una segunda zona de terapias a 190 (178-200) lpm.
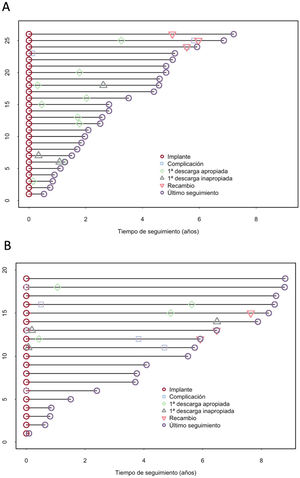
Seguimiento y complicacionesLa mediana de seguimiento fue 3,71 [1,51-5,73] años: 2,70 [1,56-4,77] en el grupo de DAI-SC y 5,50 [1,96-8,07] en el de DAI-TV (p=0,091). Los eventos se describen y detallan en la tabla 4, las tablas 2-4 del material adicional y la figura 1 y la figura 2. Al cierre del estudio todos los pacientes estaban vivos, y se había trasplantado a 3 (6,7%) de ellos.
Eventos y complicaciones en el seguimiento
| Variable | Subcutáneo (n=26) | Transvenoso (n=19) | Total (n=45) | p |
|---|---|---|---|---|
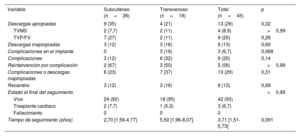
| Descargas apropiadas | 9 (35) | 4 (21) | 13 (29) | 0,32 |
| TVMS | 2 (7,7) | 2 (11) | 4 (8,9) | >0,99 |
| TVP/FV | 7 (27) | 2 (11) | 9 (20) | 0,26 |
| Descargas inapropiadas | 3 (12) | 3 (16) | 6 (13) | 0,69 |
| Complicaciones en el implante | 0 | 3 (16) | 3 (6,7) | 0,068 |
| Complicaciones | 3 (12) | 6 (32) | 9 (20) | 0,14 |
| Reintervención por complicación | 2 (67) | 3 (50) | 5 (56) | >0,99 |
| Complicaciones o descargas inapropiadas | 6 (23) | 7 (37) | 13 (29) | 0,31 |
| Recambio | 3 (12) | 3 (16) | 6 (13) | 0,69 |
| Estado al final del seguimiento | >0,99 | |||
| Vivo | 24 (92) | 18 (95) | 42 (93) | |
| Trasplante cardiaco | 2 (7,7) | 1 (5,3) | 3 (6,7) | |
| Fallecimiento | 0 | 0 | 0 | |
| Tiempo de seguimiento (años) | 2,70 [1,56-4,77] | 5,50 [1,96-8,07] | 3,71 [1,51-5,73] | 0,091 |
FV: fibrilación ventricular; TVMS: taquicardia ventricular monomórfica sostenida; TVP: taquicardia ventricular polimórfica.
Los valores expresan n (%) o mediana [intervalo intercuartílico].
En los pacientes con DAI-SC, las supervivencias libres de descargas apropiadas a 1 y 5 años fueron del 88 y el 54% respectivamente (tabla 2 del material adicional). En los 9 pacientes (35%) que recibieron descargas apropiadas, la cardioversión fue exitosa con el primer choque (eficacia del 100%); la mayoría (78%) de ellas fueron por taquicardia ventricular (TV) polimórfica. En ningún paciente fue preciso cambiar a DAI-TV por necesidad de estimulación, ya fuese para resincronización, terapia antitaquicardia o por bradiarritmias.
Las supervivencias libres de descargas inapropiadas a 1 y 5 años fueron del 96 y el 85%. Hubo 3 pacientes (12%) que recibieron descargas inapropiadas debidas a sobresensados de onda T (n=2), ambos corregidos con optimización del sensado en ejercicio, y de miopotenciales (n=1).
Las supervivencias libres de complicaciones a 1 y 5 años fueron del 96%. No hubo complicaciones en el implante (tabla 3 del material adicional) y en el seguimiento hubo 5 eventos en 3 pacientes (12%) (tabla 4 del material adicional): 2 tuvieron infección de la herida quirúrgica (1 tuvo infección de ambas heridas) que se resolvieron con antibióticos sin necesidad de reintervención, mientras que otro paciente precisó limpieza quirúrgica de la herida, pero sin necesidad de explantar el dispositivo, y 2 pacientes precisaron recambio de generador debido al agotamiento prematuro de la batería (ambos afectados por la alerta 92400926D-FA). En total, 2 pacientes tuvieron los eventos a partir del quinto año del implante. No se observó mayor incidencia de complicaciones en los pacientes con IMC ≤ 20 (figura 2 del material adicional).
En el grupo de DAI-TV, 4 pacientes (21%) presentaron descargas apropiadas, todas ellas eficaces con la primera descarga (eficacia del 100%); en 2 de ellos la causa fue taquicardia ventricular (TV) monomórfica sostenida. En estos pacientes, además, se asociaron episodios yugulados con estimulación antitaquicardia. Hubo 7 complicaciones en 6 pacientes (32%) (supervivencias libres de complicaciones a 1 y 5 años del 79 y el 57%). En el implante (tabla 3 del material adicional) hubo 1 neumotórax y 1 derrame pericárdico que se pudo tratar de manera conservadora y 1 sangrado que requirió reintervención, mientras que en el seguimiento (tabla 4 del material adicional) 1 paciente tuvo una TV no detectada, por debajo de la ventana y 3 tuvieron impedancias de descarga fuera de rango debidos a estiramiento del electrodo por el crecimiento. Asimismo, hubo 3 pacientes (16%) con terapias inapropiadas debidas a sobresensado de onda T (n=1), taquicardia sinusal (n=1) y flutter auricular (n=1). En el grupo de DAI-SC no se observaron alteraciones del sensado de la señal con el crecimiento y la consiguiente modificación de la posición del electrodo en el tórax (figura 3), ni siquiera en los 3 pacientes que tuvieron un incremento de talla>10 cm.
En conjunto, no hubo diferencias estadísticamente significativas en el evento principal del estudio, y las supervivencias libres del evento a 1 y 5 años fueron del 92 y el 80% en el grupo de DAI-SC y del 73 y el 63% en el grupo de DAI-TV (figura 1 y tabla 2 del material adicional). A los 5 años de seguimiento, la supervivencia libre de complicaciones sí fue superior en el grupo de DAI-SC que en el de DAI-TV (el 96 frente al 57%; cloglog p=0,016), aunque la aparición de eventos más tardía en el grupo de DAI-SC hizo que ambas se igualasen al final del seguimiento (figura 1D). Estas diferencias en las complicaciones también se observaron en el subgrupo de pacientes con IMC<20 (supervivencia libre de complicaciones a 5 años del 100 frente al 48%; p=0,037) (figura 3). Las tasas de descargas inapropiadas fueron similares en ambos grupos (figura 1 y tabla 2 del material adicional).
DISCUSIÓNSe presenta la primera serie que analiza y compara los resultados del DAI-SC en pacientes exclusivamente pediátricos (edad<18 años) con técnicas de implante fundamentalmente intermuscular o subserrato y 2 incisiones, con programación de las zonas de terapia a frecuencias altas, frente al DAI-TV. Además, es la primera experiencia en España sobre el uso de esta tecnología en este grupo de pacientes. Los principales resultados son: a) el DAI-SC es eficaz para el tratamiento de las arritmias ventriculares; b) no hubo complicaciones relacionadas con el implante ni disfunciones del electrodo; c) la tasa de descargas inapropiadas fue similar a la del DAI-TV; d) no se observaron mayores complicaciones en los pacientes con IMC ≤ 20, y e) las complicaciones fueron menores que con el DAI-TV a corto y medio plazo. No obstante, a partir del quinto año de seguimiento hubo que sustituir el generador por agotamiento prematuro de la batería en 2 pacientes con DAI-SC, lo que hizo que, en conjunto, aunque numéricamente hubo menos eventos que entre los pacientes con DAI-TV, estas diferencias no fueran estadísticamente significativas en las curvas globales de supervivencia. Estos resultados indican que el DAI-SC probablemente deba considerarse como primera opción para pacientes pediátricos siempre y cuando sean candidatos al implante.
El DAI-TV es una terapia eficaz y ampliamente probada para la prevención de la muerte súbita y es con mucho el dispositivo más empleado en nuestro medio23. Sin embargo, no es una terapia exenta de riesgos y tiene algunas complicaciones relevantes, tanto en el momento del implante (neumotórax, perforación, etc.), como a largo plazo, fundamentalmente derivadas de su parte más frágil, el electrodo, y de su carácter intravascular, que se debe tener en cuenta. Las disfunciones del electrodo en seguimientos largos son altas (15-40%)24,25, sobre todo en pacientes pediátricos debido a su crecimiento durante el desarrollo4, por lo que son esperables en estos pacientes que, además, tienen una larga expectativa de vida. Asimismo, la infección del dispositivo es una complicación grave con importante impacto en la morbimortalidad y en costes relacionados con las hospitalizaciones y reintervenciones26–29. Por otro lado, los dispositivos epicárdicos no son una alternativa óptima, ya que presentan incluso más complicaciones que los DAI-TV30.
Para evitar estos problemas, en los últimos años han surgido los DAI-SC, que son dispositivos completamente extravasculares. Estudios previos ya han confirmado su eficacia y su seguridad5, así como la reducción de problemas derivados del electrodo en comparación con el DAI-TV, aunque con una mayor tasa de descargas inapropiadas6. En el único ensayo clínico aleatorizado realizado hasta la fecha, el DAI-SC no fue inferior al DAI-TV en pacientes que no precisan estimulación7. Sin embargo, la experiencia en pacientes pediátricos publicada todavía es escasa8–12.
En algunas series pediátricas iniciales se confirmó la eficacia del DAI-SC, aunque también se destacaron las complicaciones relacionadas con el dispositivo, mayores en pacientes con bajo IMC y asociadas con las técnicas de implante iniciales (3 incisiones, implante más superficial)8–12. Recientemente se han publicado 2 estudios multicéntricos10,12, aunque con diferencias respecto a la serie actual (tabla 5 del material adicional). En el primero, en centros de Estados Unidos, Canadá y China, se incluyó a 115 pacientes, aunque no solo pediátricos, sino también adultos con cardiopatías congénitas (mediana de edad, 17 años; peso, 71 kg). El 47% empleó la técnica de 2 incisiones y solo en un 18% el implante fue intermuscular10. El segundo es el estudio SIDECAR, de diferentes centros europeos, que incluyó a 81 pacientes con edades comprendidas entre 8 y 17 años12. En ambos, la incidencia acumulada de complicaciones quirúrgicas fue del 4-11% y la de descargas inapropiadas, del 19-21% a 3 años de seguimiento, y en general fueron mayores en los pacientes con bajo IMC (< 20).
Es destacable que en nuestro estudio, pese a haber incluido a pacientes con menos edad y peso que en estudios previos de DAI-SC, la incidencia de complicaciones es menor (tabla 5 del material adicional). Los motivos probablemente sean multifactoriales. Por un lado, la técnica de implante ha sido, salvo excepciones, la de 2 incisiones y alojando el dispositivo a nivel profundo (intermuscular o incluso subserrato en los pacientes más pequeños). La introducción del DAI-SC a escala nacional fue tardía en comparación con otros países de nuestro entorno; esto ha hecho que nos hayamos beneficiado de la experiencia previa de otros grupos y, desde el principio, hayamos incorporado las mejoras que se han ido produciendo en la técnica. Tampoco se han observado complicaciones derivadas del crecimiento de los pacientes durante el desarrollo, a pesar de que algunos tuvieron incrementos de talla notables.
Por otro lado, no hubo más descargas inapropiadas que en los pacientes con DAI-TV. La programación se llevó a cabo empleando altas ventanas de detección (zona de FV>250 lpm y zona condicional ≥ 220 lpm) y el filtro SMART-PASS para minimizar estos eventos. No obstante, en los pacientes con DAI-TV las frecuencias de corte de la zona de FV (mediana, 220 lpm) y de la zona de TV (mediana, 190 lpm) en quienes la tenían activada no fueron tan altas como en los pacientes con DAI-SC, lo que pudo influir en la incidencia de descargas inapropiadas en este subgrupo.
Como se ha puesto de manifiesto en este trabajo, una de las principales ventajas del DAI-SC (a diferencia del DAI-TV) es que las infecciones se pueden tratar, al menos inicialmente, con antibióticos y, en muchas ocasiones, no precisa extracción del dispositivo, que es un procedimiento con importantes morbimortalidad para el paciente y coste para el sistema sanitario. También es preciso mencionar que no hubo problemas derivados del electrodo a pesar del crecimiento, a diferencia de lo que ocurrió en algunos pacientes con DAI-TV.
Por último, mejoras en la tecnología, como un menor tamaño del dispositivo y una mayor longevidad de la batería —que son las principales limitaciones del DAI-SC que pueden afectar a pacientes pediátricos—, son esperables y podrían contribuir a reducir los eventos a largo plazo.
LimitacionesExisten algunas limitaciones inherentes al tipo de estudio que es preciso mencionar. Primero, se trata de un registro unicéntrico de un centro terciario con experiencia en implante de dispositivos en edad pediátrica y un reducido número operadores realizaron los implantes, por lo que es posible que estos resultados no sean generalizables. Segundo, el pequeño tamaño muestral y el sesgo de selección existente (en cuanto al tipo de dispositivo) hacen que las conclusiones que se puedan extraer de las comparaciones estadísticas sean muy limitadas. Sería aconsejable realizar estudios multicéntricos y, quizás, plantear la inclusión de los dispositivos implantados en pacientes pediátricos en el Registro Nacional de DAI23 que publica la Asociación del Ritmo Cardiaco de la Sociedad Española de Cardiología, para recopilar la experiencia en otros centros del país. Tercero, el tiempo de seguimiento, aunque superior al de otras series, puede ser insuficiente para detectar algunas complicaciones a más largo plazo, sobre todo la longevidad de la batería de los dispositivos y las complicaciones posiblemente relacionadas con el electrodo. Por último, aspectos que podrían ser relevantes para decidir qué tipo de dispositivo se implanta, si hay opción, como son los relativos a la calidad de vida u otros como el coste-efectividad, no se han valorado en este estudio.
CONCLUSIONESEl DAI-SC implantado a nivel intermuscular (o subserrato en pacientes con muy bajo peso) con 2 incisiones y ventanas de detección a altas frecuencias es una opción con buen perfil de seguridad y eficacia para la prevención de la muerte súbita de pacientes pediátricos, y evita las potenciales complicaciones derivadas del electrodo intravascular de los DAI-TV tradicionales. En niños, incluso con IMC<20, y adolescentes podría ser el dispositivo de elección, aunque se precisa más experiencia para confirmar estos resultados tanto a medio como a largo plazo.
- –
El implante de DAI en pacientes pediátricos es un procedimiento complejo, asociado con mayores tasas de complicaciones que en la población adulta.
- –
Son pacientes que, además, están expuestos mucho más tiempo a las potenciales complicaciones a largo plazo de estos dispositivos, fundamentalmente las derivadas de la presencia del electrodo intravascular.
- –
Series previas de pacientes jóvenes, no exclusivamente pediátricos, han mostrado buenos resultados del DAI-SC en términos de eficacia y seguridad, aunque con mayores tasas de complicaciones, especialmente en pacientes con IMC ≤ 20.
- –
No existen comparaciones previas frente a DAI transvenosos en pacientes pediátricos.
- –
El DAI-SC implantado a nivel intermuscular o subserrato, preferiblemente con técnica de 2 incisiones y programando 2 zonas a altas frecuencias, es una buena alternativa al DAI-TV en pacientes pediátricos, con menos complicaciones a corto y medio plazo y similares descargas inapropiadas.
- –
No hubo complicaciones asociadas con el crecimiento de los pacientes durante el seguimiento.
- –
A diferencia de estudios previos, con las técnicas de implante actuales no se observaron mayores complicaciones con el DAI-SC en los pacientes con IMC ≤ 20 (frente a IMC>20). Además, en este subgrupo hubo significativamente menos complicaciones que con el DAI-TV.
Este estudio se ha llevado a cabo a iniciativa de los investigadores y no ha recibido financiación.
CONTRIBUCIÓN DE LOS AUTORESConcepción y diseño del estudio: M. Centeno, R. Álvarez García-Rovés y P. Ávila. Inclusión de pacientes y recopilación de datos: todos los autores. Supervisión del proyecto y revisión del original: A. Arenal, F. Fernández-Avilés y C. Medrano. Análisis estadístico: P. Ávila. Preparación del borrador y contribuciones relevantes: todos los autores. Todos los autores han expresado su acuerdo con el contenido de la versión final del manuscrito. M. Centeno y R. Álvarez son primeras coautoras.
CONFLICTO DE INTERESESP. Ávila ha recibido honorarios por consultaría y docencia de Boston Scientific y Metronic. Á. Arenal ha recibido honorarios por consultoría de Boston Scientific y Metronic. F. Atienza y A. Carta han recibido honorarios por consultoría de Medtronic. El resto de los autores no tienen conflictos de intereses.
Se puede consultar material adicional a este artículo en su versión electrónica disponible en https://doi.org/10.1016/j.recesp.2023.08.006.