El uso de dispositivos de asistencia circulatoria mecánica de corta duración como puente a trasplante es frecuente en España. Se desconocen la epidemiología y la repercusión de las complicaciones infecciosas en estos pacientes.
MétodosDescripción sistemática de la epidemiología y análisis de la repercusión pronóstica de las complicaciones infecciosas en un registro multicéntrico retrospectivo de pacientes tratados con dispositivos de asistencia circulatoria mecánica de corta duración como puente a trasplante cardiaco urgente entre 2010 y 2015 en 16 hospitales españoles.
ResultadosSe estudió a 249 pacientes; 87 (34,9%) de ellos tuvieron un total de 102 infecciones. La vía respiratoria fue la localización más frecuente (n=47; 46,1%). En 78 casos (76,5%) se obtuvo confirmación microbiológica; se aislaron en total 100 gérmenes causales, con predominio de bacterias gramnegativas (n=58, 58%). Los pacientes con complicaciones infecciosas presentaron mayor mortalidad durante el periodo de asistencia circulatoria mecánica (el 25,3 frente al 12,3%; p=0,009) y menor probabilidad de recibir un trasplante (el 73,6 frente al 85,2%; p=0,025) que los pacientes sin infección. La mortalidad posoperatoria tras el trasplante fue similar en ambos grupos (con infección, el 28,3%; sin infección, el 23,4%; p=0,471).
ConclusionesLos pacientes tratados con dispositivos de asistencia circulatoria mecánica de corta duración como puente al trasplante cardiaco están expuestos a un alto riesgo de complicaciones infecciosas, las cuales se asocian con una mayor mortalidad en espera del órgano.
Palabras clave
En los últimos años hemos asistido a un incremento progresivo del número de candidatos a trasplante cardiaco (TxC) que requieren asistencia circulatoria mecánica (ACM). En España predomina el empleo de dispositivos de ACM de corta duración, en cierta medida como consecuencia de las peculiaridades de nuestro sistema nacional de distribución de órganos, que confiere el nivel de máxima prioridad en la lista de espera (urgencia grado 0) a estos candidatos1.
La alta incidencia de eventos clínicos adversos —tromboembolias, hemorragias, infecciones— es el principal inconveniente de los dispositivos de ACM. En la literatura hay extensa información referente a las complicaciones asociadas con los dispositivos de ACM de larga duración2, procedente de ensayos clínicos y registros multicéntricos. Sin embargo, muy pocas han abordado de manera sistemática la incidencia y la repercusión clínica de las complicaciones asociadas con los dispositivos de ACM de corta duración.
Las complicaciones infecciosas podrían llegar a afectar a algo más de la mitad de los pacientes tratados con oxigenador extracorpóreo de membrana (ECMO)3 y dispositivos de asistencia ventricular (DAV) de corta duración4. No obstante, la información publicada sobre el tema procede en su mayor parte de pequeños estudios unicéntricos, condicionados por prácticas locales y entornos epidemiológicos concretos. Hasta el momento, no se ha analizado de manera sistemática la potencial repercusión de las complicaciones infecciosas en el caso concreto de los pacientes que reciben ACM de corta duración como puente directo al TxC.
En vista de esta laguna en el conocimiento, nos propusimos realizar un análisis sistemático de los agentes causales, los factores de riesgo y las implicaciones pronósticas de las complicaciones infecciosas asociadas con los dispositivos de ACM de corta duración en los candidatos a TxC urgente en España. Para ello se empleó la información clínica recogida en un registro multicéntrico.
MÉTODOSDescripción del estudioEl estudio ASIS-TC (Empleo de los dispositivos de asistencia circulatoria mecánica de corta duración como puente a trasplante cardiaco urgente en España) es un registro retrospectivo en el que se incluyó a los pacientes consecutivos en la lista de espera urgente de la Organización Nacional de Trasplantes (urgencia grado 0) para un primer TxC no multiorgánico y asistidos con dispositivos de ACM de corta duración entre el 1 de enero de 2010 y el 31 de diciembre de 20151. Se consideraron dispositivos de ACM de corta duración el ECMO venoarterial y los DAV de corta duración de inserción quirúrgica o percutánea. Los 16 centros trasplantadores de España participaron en el registro. El protocolo fue aprobado por el Comité de Ética en la Investigación Clínica de la comunidad autónoma de Galicia.
En el presente artículo se describe un subanálisis de la información recogida en el estudio ASIS-TC que se centra en la incidencia y la repercusión pronóstica de las complicaciones infecciosas en pacientes tratados con ACM de corta duración como puente a TxC. Se trata, por lo tanto, de un análisis retrospectivo de una base de datos preexistente que no fue diseñada específicamente para esta finalidad.
Se excluyó a los pacientes del registro que habían recibido asistencia con más de un dispositivo de ACM o habían sufrido alguna infección tratada con antibioterapia durante el periodo de ingreso hospitalario que precedió al implante del dispositivo de ACM.
Definición de complicaciones infecciosasLa variable de resultado principal del estudio fue la infección que se presenta durante la asistencia con dispositivos de ACM de corta duración, definida como cualquier episodio de infección probada por cultivos y diagnosticada después de la inserción del dispositivo y antes de su explante o antes de la cirugía del TxC, independientemente de la terapia empleada. Los episodios de sospecha de infección diagnosticados por hallazgos clínicos, analíticos y de imagen típicos, pero sin confirmación microbiológica de un germen causal, también se consideraron eventos infecciosos, pero únicamente en el caso de que los pacientes hubiesen recibido tratamiento antibiótico endovenoso empírico. Las infecciones registradas se clasificaron a posteriori en específicas, relacionadas o no relacionadas con el ACM según la nomenclatura de la International Society for Heart and Lung Transplantation5.
La asignación de episodios de infección, focos y gérmenes causales fue responsabilidad del equipo investigador local y se realizó con base en la información contenida en la historia clínica de los pacientes, dada la naturaleza retrospectiva del registro.
Análisis estadísticoLas variables cuantitativas se presentan como media±desviación estándar y las cualitativas, mediante proporciones. Para el análisis de diferencias entre grupos, se empleó la prueba de la t de Student para el caso de las primeras y el test de la χ2 para las segundas. Dada su asimetría, se presenta también la mediana [intervalo intercuartílico] de la duración de la ACM.
Se estimó la tasa de incidencia de infección (episodios/1.000 pacientes-día) durante el periodo de ACM, tanto en la cohorte total como en los subgrupos de pacientes tratados con cada tipo de dispositivo. La probabilidad acumulada de infección según la duración de la ACM se estimó mediante el método de Kaplan-Meier.
Se utilizó un modelo multivariable de regresión logística por pasos hacia atrás con un criterio de salida de p <0,05 para identificar los factores clínicos asociados de modo independiente con el riesgo de infección durante la ACM. En el primer paso de dicho modelo se introdujeron las variables que mostraban una asociación univariante estadísticamente significativa (p <0,05) con el evento en estudio.
La regresión logística se empleó también para ajustar el efecto de la infección asociada con la ACM en la mortalidad durante el propio periodo de asistencia. En este caso, se hizo un ajuste dirigido forzando la inclusión como covariables de varios factores clínicos que se consideraron potenciales factores de confusión según el razonamiento clínico (edad, sexo, tipo de cardiopatía subyacente, perfil INTERMACS y tipo de dispositivo de ACM).
El análisis estadístico se realizó con SPSS 20 y Epidat 4.1. Se consideró un nivel de significación p <0,05 para todos los contrastes.
RESULTADOSIncidencia de infecciónEn el registro ASIS-TC se incluyó a 291 pacientes procedentes de 16 centros hospitalarios españoles. Se excluyó del presente análisis a 21 pacientes que habían recibido asistencia con más de 1 dispositivo y otros 21 pacientes que habían sufrido alguna complicación infecciosa durante la estancia hospitalaria previa al implante. Por este motivo, la muestra analizada finalmente estaba formada por 249 sujetos. De ellos, se asistió a 151 (60,6%) con ECMO venoarterial (146 con canulación periférica y 5 con canulación central), a 11 (4,4%) con DAV percutáneos (todos Impella Recover implantados mediante acceso femoral) y a 87 (34,9%) con DAV de inserción quirúrgica (67 Levitronix Centrimag, 17 Abiomed BVS 5000, 1 Abiomed AB5000, 1 Sorin Revolution y 1 Maquet Rotaflow).
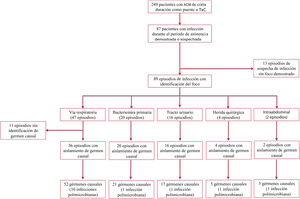
La duración media de la ACM fue de 12,1±11,3 días, con una mediana de 9 [4-17] días. En este periodo, 87 pacientes (34,9%) tuvieron un total de 102 episodios de infección; se registraron 3 episodios de infección en 2 pacientes, 2 en 11 pacientes y 1 en 74 pacientes. La figura 1 muestra un diagrama de flujo en el que se detalla la distribución de los episodios de infección nosocomial diagnosticados en los pacientes del estudio.
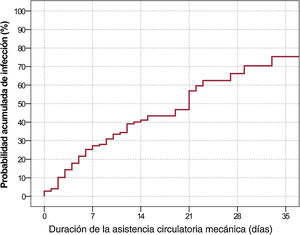
Se estimó una tasa de incidencia total de infección nosocomial de 33,8 (intervalo de confiaza del 95% [IC95%], 27,6-41,1) episodios/1.000 pacientes-día de asistencia. La figura 2 representa la probabilidad acumulada de infección en relación con la duración de la ACM, estimada mediante el método de Kaplan-Meier.
Focos de infección y gérmenes causalesSe obtuvo confirmación microbiológica mediante cultivo en 78 (76,5%) de los 102 episodios de infección nosocomial; en 14 (17,9%) de ellos, la etiología fue polimicrobiana. Entre los 24 casos de infección sospechada sin confirmación microbiológica, en 11 se atribuyó a un probable foco respiratorio según los datos clínicos (figura 1).
En total, se identificaron 100 gérmenes causales: 58 casos (58%) de bacterias gramnegativas, 28 (28%) de bacterias grampositivas, 11 (11%) de hongos y 3 (3%) de virus. La relación de gérmenes causales aislados se detalla en la tabla 1.
Focos de infección y gérmenes aislados en los cultivos. N representa el número de episodios de infección registrados para cada uno de los focos
| na | |
|---|---|
| Infección respiratoria | 47 |
| Acinetobacter spp. | 1 |
| Candida spp. | 8 |
| Enterococcus spp. | 1 |
| Enterobacter spp. | 8 |
| Escherichia coli | 2 |
| Haemophilus spp. | 4 |
| Klebsiella spp. | 5 |
| Moraxella spp. | 1 |
| Proteus spp. | 1 |
| Pseudomonas spp. | 5 |
| Serratia spp. | 2 |
| Staphylococcus aureus | 4 |
| Staphylococcus coagulasa negativo | 2 |
| Streptococcus spp. | 3 |
| Adenovirus | 1 |
| Rhinovirus | 1 |
| Virus respiratorio sincitial | 1 |
| Delftia acidovorans | 1 |
| Bacilo gramnegativo no identificado | 1 |
| Germen no identificado | 11 |
| Infección urinaria | 16 |
| Candida spp. | 2 |
| Enterococcus spp. | 4 |
| Escherichia coli | 4 |
| Klebsiella spp. | 3 |
| Proteus spp. | 2 |
| Pseudomonas spp. | 1 |
| Saccharomyces spp. | 1 |
| Bacteriemiab | 20 |
| Acinetobacter spp. | 1 |
| Enterobacter spp. | 1 |
| Enterococcus spp. | 2 |
| Escherichia coli | 3 |
| Klebsiella spp. | 2 |
| Propinibacterium spp. | 1 |
| Pseudomononas spp. | 4 |
| Staphylococcus aureus | 2 |
| Staphylococcus coagulasa negativo | 5 |
| Infección de herida quirúrgica | 4 |
| Acinetobacter spp. | 1 |
| Enterococcus spp. | 1 |
| Pseudomonas spp. | 1 |
| Staphylococcus aureus | 1 |
| Staphylococcus coagulasa negativo | 1 |
| Infección intraabdominal | 2 |
| Clostridium difficile | 1 |
| Escherichia coli | 1 |
| Enterococcus spp. | 1 |
| Morganella spp. | 1 |
| Pseudomonas spp. | 1 |
| Sospecha de infección de foco desconocido | 13 |
El tracto respiratorio (n=47; 46,1%) y el tracto urinario (n=16; 15,6%) fueron las localizaciones de infección más frecuentes. Se documentaron 20 episodios de bacteriemia: 11 en relación con infección de catéteres centrales, 3 en relación con infección del dispositivo de ACM y 6 bacteriemias primarias o de origen desconocido. Además, otros 5 pacientes presentaron diseminación hematógena desde un foco infeccioso primario. Cuatro pacientes presentaron infecciones superficiales de la herida quirúrgica: 3 con ECMO veno-arterial con canulación periférica y 1 con DAV implantado mediante esternotomía.
De los 89 episodios de infección registrados en los que fue posible identificar un foco, 3 (3,4%) cumplían los criterios definidos para ser clasificadas como infecciones específicas de la ACM, 21 (23,6%) como infecciones relacionadas con la ACM y 65 (73%) como infecciones no relacionadas con la ACM, de acuerdo con la nomenclatura recomendada por la International Society for Heart and Lung Transplantation5.
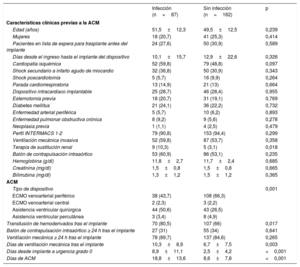
Características clínicas de los pacientes con y sin infección nosocomialLa tabla 2 muestra las características clínicas de los pacientes que sufrieron una infección durante el periodo de ACM y de los que no. En el grupo de pacientes que sufrieron una infección, se observó una mayor frecuencia de DAV quirúrgicos y una menor frecuencia de ECMO, una mayor necesidad de terapia de sustitución renal previa al implante del dispositivo, una mayor necesidad de transfusión de hemoderivados periintervención y una mayor duración de la ventilación mecánica tras el implante del dispositivo.
Comparación de las características clínicas de los pacientes del estudio en función de la presencia o ausencia de infecciones asociadas con la asistencia circulatoria mecánica
| Infección (n=87) | Sin infección (n=162) | p | |
|---|---|---|---|
| Características clínicas previas a la ACM | |||
| Edad (años) | 51,5±12,3 | 49,5±12,5 | 0,239 |
| Mujeres | 18 (20,7) | 41 (25,3) | 0,414 |
| Pacientes en lista de espera para trasplante antes del implante | 24 (27,6) | 50 (30,9) | 0,589 |
| Días desde el ingreso hasta el implante del dispositivo | 10,1±15,7 | 12,9±22,6 | 0,326 |
| Cardiopatía isquémica | 52 (59,8) | 79 (48,8) | 0,097 |
| Shock secundario a infarto agudo de miocardio | 32 (36,8) | 50 (30,9) | 0,343 |
| Shock poscardiotomía | 5 (5,7) | 16 (9,9) | 0,264 |
| Parada cardiorrespiratoria | 13 (14,9) | 21 (13) | 0,664 |
| Dispositivo intracardiaco implantable | 25 (28,7) | 46 (28,4) | 0,955 |
| Esternotomía previa | 18 (20,7) | 31 (19,1) | 0,769 |
| Diabetes mellitus | 21 (24,1) | 36 (22,2) | 0,732 |
| Enfermedad arterial periférica | 5 (5,7) | 10 (6,2) | 0,893 |
| Enfermedad pulmonar obstructiva crónica | 8 (9,2) | 9 (5,6) | 0,278 |
| Neoplasia previa | 1 (1,1) | 4 (2,5) | 0,479 |
| Perfil INTERMACS 1-2 | 79 (90,8) | 153 (94,4) | 0,299 |
| Ventilación mecánica invasiva | 52 (59,8) | 87 (53,7) | 0,358 |
| Terapia de sustitución renal | 9 (10,3) | 5 (3,1) | 0,018 |
| Balón de contrapulsación intraaórtico | 53 (60,9) | 86 (53,1) | 0,235 |
| Hemoglobina (g/dl) | 11,8±2,7 | 11,7±2,4 | 0,685 |
| Creatinina (mg/dl) | 1,5±0,8 | 1,5±0,8 | 0,665 |
| Bilirrubina (mg/dl) | 1,3±1,2 | 1,5±1,2 | 0,365 |
| ACM | |||
| Tipo de dispositivo | 0,001 | ||
| ECMO venoarterial periférico | 38 (43,7) | 108 (66,3) | |
| ECMO venoarterial central | 2 (2,3) | 3 (2,2) | |
| Asistencia ventricular quirúrgica | 44 (50,6) | 43 (26,5) | |
| Asistencia ventricular percutánea | 3 (3,4) | 8 (4,9) | |
| Transfusión de hemoderivados tras el implante | 70 (80,5) | 107 (66) | 0,017 |
| Balón de contrapulsación intraaórtico ≥ 24 h tras el implante | 27 (31) | 55 (34) | 0,641 |
| Ventilación mecánica ≥ 24 h tras el implante | 78 (89,7) | 137 (84,6) | 0,265 |
| Días de ventilación mecánica tras el implante | 10,3±8,9 | 6,7±7,5 | 0,003 |
| Días desde implante a urgencia grado 0 | 8,9±11,1 | 2,5±4,2 | <0,001 |
| Días de ACM | 18,8±13,6 | 8,6±7,8 | <0,001 |
ACM: asistencia circulatoria mecánica; ECMO: oxigenador extracorpóreo de membrana; INTERMACS: Interagency Registry for Mechanically Assisted Circulatory Support.
Los valores expresan n (%) o media±desviación estándar.
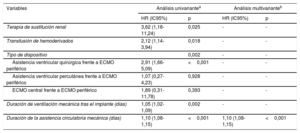
En el análisis multivariante de regresión logística (tabla 3), la única variable estudiada que mostró una asociación estadística significativa e independiente con el riesgo de infección durante la ACM fue la duración de la asistencia (por cada día de asistencia, odds ratio=1,11; IC95%, 1,08-1,15; p <0,001).
Factores de riesgo de infección asociada con la asistencia circulatoria mecánica de corta duración: análisis de regresión logística
| Variables | Análisis univariantea | Análisis multivarianteb | ||
|---|---|---|---|---|
| HR (IC95%) | p | HR (IC95%) | p | |
| Terapia de sustitución renal | 3,62 (1,18-11,24) | 0,025 | - | - |
| Transfusión de hemoderivados | 2,12 (1,14-3,94) | 0,018 | - | - |
| Tipo de dispositivo | 0,002 | - | - | |
| Asistencia ventricular quirúrgica frente a ECMO periférico | 2,91 (1,66-5,09) | <0,001 | - | - |
| Asistencia ventricular percutánea frente a ECMO periférico | 1,07 (0,27-4,23) | 0,928 | - | - |
| ECMO central frente a ECMO periférico | 1,89 (0,31-11,78) | 0,393 | - | - |
| Duración de ventilación mecánica tras el implante (días) | 1,05 (1,02-1,09) | 0,002 | - | - |
| Duración de la asistencia circulatoria mecánica (días) | 1,10 (1,08-1,15) | <0,001 | 1,10 (1,08-1,15) | <0,001 |
ECMO: oxigenador extracorpóreo de membrana, HR: hazard ratio; IC95%: intervalo de confianza del 95%.
Las incidencias acumuladas de infección durante el periodo de ACM en pacientes con DAV quirúrgicos, DAV percutáneos, ECMO central y ECMO periférico fueron del 50,6, el 27,3, el 40 y el 26% respectivamente (p=0,002). La mayor incidencia acumulada de infección observada en los pacientes tratados con DAV quirúrgicos se debió, fundamentalmente, a un mayor número de infecciones respiratorias (tabla 4).
Incidencia acumulada y tasa de incidencia de los principales focos de infección en función del tipo de dispositivo de asistencia circulatoria mecánica
| DAV quirúrgico (n=87) | DAV percutáneo (n=11) | ECMO central (n=5) | ECMO periférico (n=146) | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Episodios de infección | Pacientes con infección | TI (IC95%) | Episodios de infección | Pacientes con infección | TI (IC95%) | Episodios de infección | Pacientes con infección | TI (IC95%) | Episodios de infección | Pacientes con infección | TI (IC95%) | |
| Infección respiratoria | 28 | 28 (32,2%) | 18,3 (11,5-25,1) | 0 | 0 | 0 | 1 | 1 (20%) | 22,2 (0,6-123,8) | 18 | 18 (12,3%) | 13 (7,7-20,5) |
| Infección urinaria | 9 | 9 (10,3%) | 5,9 (2-9,7) | 2 | 2 (18,2%) | 28,9 (3,5-104,2) | 0 | 0 | 0 | 5 | 5 (3,4%) | 3,6 (1,2-8,4) |
| Bacteriemia* | 6 | 6 (6,9%) | 3,9 (0,8-7,1) | 0 | 0 | 0 | 0 | 0 | 0 | 14 | 14 (9,6%) | 10,1 (5,5-16,9) |
| Otras infecciones | 8 | 8 (9,2%) | 5,2 (1,6-8,8) | 1 | 1 (9,1%) | 14,4 (0,4-80,4) | 1 | 1 (20%) | 22,2 (0,6-123,8) | 9 | 9 (5,5%) | 6,5 (3-12,3) |
| Total | 51 | 44 (50,6%) | 33,3 (24,2-42,4) | 3 | 3 (27,3%) | 43,3 (8,9-126,5) | 2 | 2 (40%) | 44,4 (5,4-160,5) | 46 | 38 (26%) | 33,2 (24,3-44,2) |
DAV: dispositivo de asistencia ventricular; ECMO: oxigenador extracorpóreo de membrana; IC95%: intervalo de confianza del 95%; TI: tasa de incidencia (episodios/1.000 pacientes-día).
La duración media de la ACM fue significativamente mayor en los pacientes con DAV quirúrgicos (17,6±14,5 días) que en los pacientes con ECMO periférico (9,5±7,8 días), ECMO central (9±7,5 días) o DAV percutáneos (6,3±5,8 días) (p <0,001). Como resultado, la tasa de incidencia de infección durante la ACM fue similar en los 4 grupos de pacientes, tal y como se refleja en la tabla 4 (DAV quirúrgicos, 33,3 episodios/1.000 pacientes-día; DAV percutáneos, 43,3/1.000 pacientes-día; ECMO central, 44,4/1.000 pacientes-día; ECMO periférico, 33,2/1.000 pacientes-día; p >0,05 para todas las comparaciones entre grupos).
Repercusión clínica de la infecciónDurante el periodo de ACM, se trasplantó a 202 pacientes (81,1%), mientras que 42 (16,9%) fallecieron sin TxC. Además, a 2 pacientes (0,8%) se les implantó un dispositivo de ACM de larga duración, mientras que a 3 (1,2%) se les pudo retirar la ACM por mejoría y siguieron con solo tratamiento farmacológico.
Los pacientes que sufrieron complicaciones infecciosas mostraron una mayor mortalidad durante el periodo de ACM (el 25,3 frente al 12,3%; p=0,009) y una menor probabilidad de someterse a TxC (el 73,6 frente al 85,2%; p=0,025). La infección se consideró, según el criterio del investigador, como la causa principal de muerte en 6 casos. Las tasas de mortalidad durante el periodo de ACM fueron del 27,7, el 25, el 30 y el 26,3% de los pacientes que sufrieron infecciones respiratorias, infecciones urinarias, bacteriemias y otros cuadros infecciosos respectivamente.
Tras el ajuste multivariable por edad, sexo, perfil clínico INTERMACS, tipo de dispositivo de ACM y tipo de cardiopatía subyacente, se observó una asociación independiente de las complicaciones infecciosas con la mortalidad durante el periodo de ACM (odds ratio=2,47; IC95%, 1,21-5,05; p=0,013).
Los pacientes que presentaron infecciones durante el periodo de ACM también tuvieron una mayor incidencia acumulada de insuficiencia renal que requirió terapia de sustitución renal (el 24,1 frente al 14,2%; p=0,05) y una mayor incidencia acumulada de complicaciones tromboembólicas (el 17,6 frente al 6,1%; p=0,025). La incidencia acumulada de complicaciones hemorrágicas fue numéricamente mayor en los pacientes con infección, pero la diferencia no alcanzó la significación estadística (el 46 frente al 34,6%; p=0,078).
Trasplante cardiacoEn total, 202 pacientes (81,1%) recibieron un TxC tras una espera media de 7,2±7,2 días. De ellos, 64 (31,7%) habían tenido complicaciones infecciosas durante el periodo de ACM.
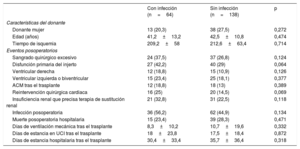
No se observaron diferencias estadísticamente significativas en cuanto a la mortalidad posoperatoria hospitalaria tras el TxC entre los pacientes con y sin antecedente de complicaciones infecciosas durante el periodo de ACM (con infección, el 23,4%; sin infección, el 28,3%; p=0,471) (tabla 5). Tampoco se observaron diferencias estadísticamente significativas entre ambos grupos de pacientes con respecto a la incidencia de otros eventos clínicos adversos durante el posoperatorio hospitalario tras el TxC.
Características de los donantes y desenlaces clínicos adversos durante el periodo posoperatorio hospitalario en los 202 pacientes del estudio trasplantados según la presencia o ausencia de infección asociada con la asistencia circulatoria mecánica
| Con infección (n=64) | Sin infección (n=138) | p | |
|---|---|---|---|
| Características del donante | |||
| Donante mujer | 13 (20,3) | 38 (27,5) | 0,272 |
| Edad (años) | 41,2±13,2 | 42,5±10,8 | 0,474 |
| Tiempo de isquemia | 209,2±58 | 212,6±63,4 | 0,714 |
| Eventos posoperatorios | |||
| Sangrado quirúrgico excesivo | 24 (37,5) | 37 (26,8) | 0,124 |
| Disfunción primaria del injerto | 27 (42,2) | 40 (29) | 0,064 |
| Ventricular derecha | 12 (18,8) | 15 (10,9) | 0,126 |
| Ventricular izquierda o biventricular | 15 (23,4) | 25 (18,1) | 0,377 |
| ACM tras el trasplante | 12 (18,8) | 18 (13) | 0,389 |
| Reintervención quirúrgica cardiaca | 16 (25) | 20 (14,5) | 0,069 |
| Insuficiencia renal que precisa terapia de sustitución renal | 21 (32,8) | 31 (22,5) | 0,118 |
| Infección posoperatoria | 36 (56,2) | 62 (44,9) | 0,134 |
| Muerte posoperatoria hospitalaria | 15 (23,4) | 39 (28,3) | 0,471 |
| Días de ventilación mecánica tras el trasplante | 8,3±10,2 | 10,7±19,6 | 0,332 |
| Días de estancia en UCI tras el trasplante | 18±23,8 | 17,5±18,4 | 0,872 |
| Días de estancia hospitalaria tras el trasplante | 30,4±33,4 | 35,7±36,4 | 0,318 |
ACM: asistencia circulatoria mecánica; UCI: unidad de cuidados intensivos.
Los valores expresan n (%) o media ± desviación estándar.
En este artículo se presenta una descripción sistemática de las complicaciones infecciosas asociadas con los dispositivos de ACM de corta duración tomando como base un registro multicéntrico español de pacientes candidatos a TxC urgente. En nuestra cohorte, un 34,9% de los pacientes presentaron complicaciones infecciosas durante una media de asistencia de 12 días, lo que resultó en una tasa de incidencia de infección de 33,8 casos cada 1.000 pacientes-día de asistencia.
Existen pocos datos en la literatura previa en relación con la incidencia de infecciones nosocomiales en pacientes que requieren ACM de corta duración; además, la mayor parte de la información disponible procede de estudios que han tenido en cuenta un único tipo de dispositivo. Así, se ha descrito una incidencia acumulada de infección nosocomial que oscila entre el 9 y el 65% de los pacientes tratados con ECMO3,6–12, del 24-59%4,13 de los tratados con DAV quirúrgicos y del 12,9-35,3% de los tratados con DAV percutáneos14,15. Esta variabilidad de resultados se justifica por una significativa heterogeneidad de los trabajos referidos en cuanto a sus criterios de definición de las infecciones y el rigor al registrarlas, así como por diferentes características clínicas y niveles de gravedad de los pacientes tratados y diferentes duraciones de las asistencias. No obstante, y con las debidas reservas, se puede concluir que la incidencia de infecciones observada en nuestra serie se encontraría, en general, dentro de los límites esperables.
Tipo de dispositivoEn nuestro trabajo no se ha constatado un impacto significativo del tipo de dispositivo de ACM de corta duración empleado (ECMO central, ECMO periférico, DAV percutáneo o DAV quirúrgico) en el riesgo de infección nosocomial. La mayor incidencia acumulada de infecciones observada en el subgrupo de pacientes tratados con DAV quirúrgico resulta, de hecho, únicamente atribuible a una mayor duración de la asistencia en estos candidatos, como indica la ausencia de diferencias significativas entre las tasas de incidencia de infección en función del tipo de dispositivo de ACM empleado. Además, el tipo de dispositivo de ACM tampoco resultó predictor independiente del riesgo de infección en el modelo de regresión logística multivariante; en dicho análisis, únicamente la duración de la ACM retuvo una asociación estadísticamente significativa con el riesgo de infección.
Otros trabajos previos han constatado, al igual que el nuestro, que la duración de la asistencia probablemente sea el principal determinante del riesgo de infección8,15–17 en pacientes tratados con ACM de corta duración. A diferencia de otros eventos clínicos adversos, como el accidente cerebrovascular o la reintervención por hemorragia, que tienden a presentarse en los primeros días tras el implante del dispositivo, la instauración temporal de los episodios de infección nosocomial es más paulatina y presenta una meseta tardía, y se distribuye gradualmente a lo largo de todo el periodo de asistencia4.
EpidemiologíaLa epidemiología de las complicaciones infecciosas descrita en nuestra cohorte concuerda con la patología infecciosa nosocomial habitual del paciente crítico que requiere un alto grado de instrumentación y medidas de soporte vital18. Al igual que en otras series4,12, la mayoría de las infecciones se atribuyeron a focos de origen respiratorio, lo que resulta congruente con una elevada frecuencia de empleo de la ventilación mecánica invasiva y la dificultad para el destete que presentan muchos de estos pacientes.
El perfil microbiológico de los agentes causales de infección asociada con los dispositivos de ACM en nuestra cohorte es el esperable para cuadros de adquisición nosocomial en pacientes con estancias prolongadas, cuya etiología está condicionada por la flora hospitalaria19. Entre los agentes bacterianos, se observa un predominio de bacterias gramnegativas con independencia del foco considerado, de manera que este grupo microbiológico estaba presente en más de la mitad de los aislamientos, de modo similar a lo observado por otros autores12,16. Se observó también una frecuencia relevante de bacterias grampositivas, fundamentalmente Staphylococcus spp., sobre todo en los aislamientos de pacientes con bacteriemia o infecciones respiratorias. En torno a 1 de cada 10 aislamientos correspondieron a Candida spp., también con predominio en la vía respiratoria. Si bien la atribución de causalidad a este germen puede resultar difícil, otros autores también han descrito una significativa incidencia de infecciones por Candida spp. en pacientes tratados con ECMO9.
Repercusión pronóstica de la infecciónUn resultado relevante de nuestro trabajo, también comunicado con anterioridad12, es la elevada mortalidad observada en pacientes que sufrieron infecciones nosocomiales asociadas con la ACM. Este incremento del riesgo de muerte se observó independientemente de las características clínicas basales, el tipo de dispositivo y el perfil del paciente definido según la escala INTERMACS. Cabe destacar, además, que los episodios infecciosos tendieron a ocurrir en pacientes que también presentaron una mayor incidencia de otras complicaciones asociadas, como eventos tromboembólicos o insuficiencia renal. El diseño de nuestro trabajo no permite establecer una asociación temporal entre los diferentes episodios clínicos adversos; no obstante, otros autores han observado una agregación similar de complicaciones en estos pacientes, e incluso se han presentado modelos jerárquicos que permiten comprender mejor las complejas relaciones de causalidad existentes entre ellos20.
Una característica diferencial de nuestro estudio es que, por protocolo, incluyó exclusivamente a candidatos a TxC urgente. Por este motivo, una consecuencia adicional de la aparición de complicaciones infecciosas fue perder la oportunidad de recibir un órgano. La infección activa es una contraindicación absoluta para el TxC21, al menos hasta que se haya controlado; por este motivo, es frecuente que estos pacientes sean excluidos transitoriamente de la lista de espera urgente y pierdan su prioridad. Un estudio multicéntrico francés reveló que, en pacientes con un perfil similar a los de nuestra serie, la propia realización del TxC es la variable que tiene un mayor impacto en su posibilidad de supervivencia22, ya que la posibilidad de destete de la ACM por recuperación es excepcional en esta situación.
Por último, cabe destacar que el antecedente de infección nosocomial no conllevó un incremento significativo de la mortalidad o la incidencia de complicaciones posoperatorias tras el TxC en los pacientes que efectivamente recibieron el órgano. En nuestra opinión, esta observación probablemente se justifique por un sesgo de selección; es razonable suponer que, en su mayor parte, los pacientes finalmente sometidos a TxC ya habían superado con éxito la fase de actividad de la complicación infecciosa.
Implicaciones para la práctica clínicaLos resultados de nuestro estudio son relevantes para la práctica clínica habitual, y ponen de manifiesto la importancia de extremar los protocolos de prevención, vigilancia y tratamiento precoz de las complicaciones infecciosas en los pacientes tratados con dispositivos de ACM de corta duración. No obstante, consideramos que en los próximos años los equipos trasplantadores han de enfrentarse a una reflexión más profunda. Es previsible que el creciente incremento de los tiempos de espera al TxC conlleve tiempos de asistencia cada vez más largos y, consecuentemente, un mayor riesgo de complicaciones de la ACM y la estancia prolongada en unidades de críticos. En este sentido, el implante precoz de un DAV de larga duración como puente al TxC surge como opción atractiva que permitiría la estabilización de algunos candidatos y su paso a un régimen de espera ambulatorio.
LimitacionesEste estudio tiene algunas limitaciones. En primer lugar, se trata de un análisis de datos secundarios recogidos en un registro multicéntrico cuyo objetivo principal no era el planteado en este artículo. La asignación de los episodios infecciosos fue responsabilidad de los investigadores locales, de acuerdo con unos criterios predefinidos, pero sin confirmación por un comité independiente. Es posible, asimismo, que diferencias locales en cuanto a los protocolos de manejo de los dispositivos de ACM, incluidos los relativos al diagnóstico y el tratamiento de las complicaciones infecciosas, así como en cuanto a los criterios de selección de receptores de TxC urgente, puedan condicionar cierta heterogeneidad en los resultados. La falta de información sobre el tipo y la duración de la profilaxis antibiótica empleada durante el periodo periimplante es una limitación relevante que dificulta la interpretación epidemiológica de los hallazgos microbiológicos. Por último, la exclusión de los pacientes que precisaron múltiples dispositivos mecánicos diferentes puede haber introducido un sesgo de selección que llevaría a subestimar la incidencia de infección asociada a la ACM, al tratarse de una subpoblación en especial riesgo.
CONCLUSIONESLos pacientes tratados con dispositivos de ACM de corta duración como puente al TxC están expuestos a un alto riesgo de complicaciones infecciosas propias del paciente crítico, tales como infecciones respiratorias, infecciones urinarias y bacteriemias. Este tipo de complicaciones disminuyen la probabilidad de que el paciente reciba el trasplante y se asocian con un incremento de mortalidad en espera del órgano. Los resultados de nuestro estudio ponen de manifiesto la necesidad de extremar las medidas de prevención, vigilancia y tratamiento precoz de las infecciones en los candidatos a TxC urgente.
FINANCIACIÓNEl presente estudio se ha realizado gracias a una Ayuda de Investigación en Salud de la Fundación Mutua Madrileña, XI Convocatoria, Madrid, 2014.
CONFLICTO DE INTERESESE. Barge-Caballero ha recibido una beca académica de Abbot Vascular para cursar el Postgraduate Course in Heart Failure (Universidad de Zúrich) en el periodo 2016-2017.
- –
Hay abundante literatura previa sobre la epidemiología de las infecciones asociadas con los dispositivos de asistencia circulatoria mecánica de larga duración; no obstante, la información sobre infecciones asociadas con los dispositivos de corta duración es escasa.
- –
Se desconocen las implicaciones de las infecciones asociadas con la asistencia circulatoria mecánica de corta duración en candidatos a trasplante cardiaco urgente.
- –
El estudio aporta descripción detallada sobre la epidemiología y los agentes causales de las complicaciones infecciosas en pacientes tratados con dispositivos de asistencia circulatoria mecánica de corta duración.
- –
El trabajo pone de manifiesto la repercusión pronóstica negativa de las complicaciones infecciosas asociadas con la asistencia circulatoria mecánica en candidatos a trasplante cardiaco urgente.