En las últimas décadas, a través de la experimentación animal se han descubierto numerosos beneficios cardiovasculares para la hormona relaxina, tradicionalmente conocida por sus efectos durante la gestación1. La relaxina reduce las resistencias vasculares periféricas, disminuye la congestión pulmonar, mejora el gasto cardiaco y aumenta el flujo renal. A través del incremento de óxido nítrico, produce efectos vasodilatadores, antiinflamatorios, antiagregantes y antioxidantes. Además, se ha descrito la existencia de receptores cardiacos y su liberación en aurículas y ventrículos2. La serelaxina, forma recombinante de la hormona endógena relaxina, ha surgido como opción terapéutica en la insuficiencia cardiaca aguda (ICA) y muestra resultados prometedores en el ensayo RELAX-AHF3. Sin embargo, el papel de relaxina en la fisiopatología de la ICA no está establecido y los trabajos clínicos publicados son escasos4–6. Hasta ahora no se ha logrado demostrar que la producción endógena de relaxina tenga importancia como mecanismo compensador, utilidad como biomarcador o valor pronóstico en el paciente con ICA.
El objetivo de este trabajo es estudiar si la relaxina desempeña un papel como mediador neurohormonal en el paciente con ICA. Para ello, se seleccionó a 43 pacientes consecutivos (edad, 69,8 ± 9,4 años; varones, el 63%) hospitalizados con diagnóstico de ICA. Se determinaron las concentraciones de relaxina en plasma a su llegada a urgencias y a los 30 días tras el alta y en situación estable. Para medirla se usó un test por inmunoadsorción ligado a enzimas (Immunodiagnostik; Bensheim, Alemania), previamente validado2,4–6. Se recogieron retrospectivamente variables clínicas, analíticas y ecocardiográficas a partir de la historia clínica de los pacientes.
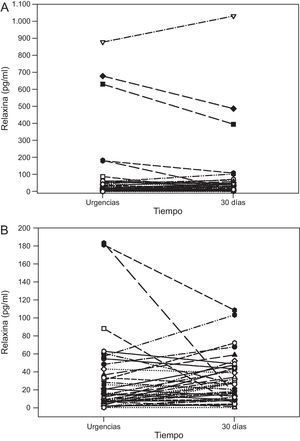
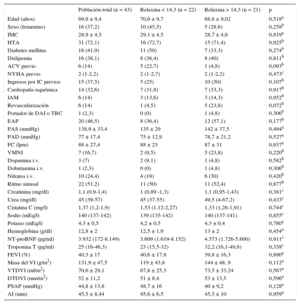
A su llegada a urgencias, la relaxina era indetectable en 3 pacientes (7%); en el resto de la población, la mediana fue de 14,3 [intervalo intercuartílico, 5,8-48,0] (intervalo, 1,5-878) pg/ml. La tabla muestra las características de la población total y según la mediana de concentración. No se encontró ninguna asociación significativa con variables clínicas, incluidas la edad, el sexo, la fracción de eyección del ventrículo izquierdo, la fracción aminoterminal del propéptido natriurético cerebral, variables ecocardiográficas y clase funcional de la New York Heart Association. Sobre el comportamiento de las concentraciones hormonales tras el evento agudo, la concentración de relaxina a los 30 días tuvo una mediana de 26,5 [11,4-47,3] (0,85-1.031) pg/ml y se correlacionó con la concentración al ingreso de manera significativa (rs = 0,536; p < 0,001). El análisis de muestras repetidas no mostró un cambio significativo entre urgencias y a los 30 días (p = 0,204, test de Wilcoxon), ni tampoco un patrón uniforme de comportamiento (figura). Durante el seguimiento —mediana, 654 [332-932] días, 8 de 21 pacientes por encima y 8 de 22 por debajo de la mediana de relaxina fallecieron o reingresaron por insuficiencia cardiaca (p = 0,91).
Características de la población total y según las concentraciones de relaxina a la llegada a urgencias estuvieran por debajo o por encima de la mediana
| Población total (n = 43) | Relaxina < 14,3 (n = 22) | Relaxina > 14,3 (n = 21) | p | |
|---|---|---|---|---|
| Edad (años) | 69,8 ± 9,4 | 70,6 ± 9,7 | 68,8 ± 9,02 | 0,518a |
| Sexo (femenino) | 16 (37,2) | 10 (45,5) | 5 (28,6) | 0,258b |
| IMC | 28,9 ± 4,5 | 29,1 ± 4,5 | 28,7 ± 4,6 | 0,819a |
| HTA | 31 (72,1) | 16 (72,7) | 15 (71,4) | 0,925b |
| Diabetes mellitus | 18 (41,9) | 11 (50) | 7 (33,3) | 0,274b |
| Dislipemia | 16 (38,1) | 8 (36,4) | 8 (40) | 0,811b |
| ACV previo | 6 (14) | 5 (22,7) | 1 (4,8) | 0,093b |
| NYHA previo | 2 (1-2,2) | 2 (1-2,7) | 2 (1-2,2) | 0,473c |
| Ingresos por IC previos | 15 (37,5) | 5 (25) | 10 (50) | 0,107b |
| Cardiopatía isquémica | 14 (32,6) | 7 (31,8) | 7 (33,3) | 0,917b |
| IAM | 6 (14) | 3 (13,6) | 3 (14,3) | 0,952b |
| Revascularización | 6 (14) | 1 (4,5) | 5 (23,8) | 0,072b |
| Portador de DAI o TRC | 1 (2,3) | 0 (0) | 1 (4,8) | 0,306b |
| EAP | 20 (46,5) | 8 (36,4) | 12 (57,1) | 0,177b |
| PAS (mmHg) | 138,9 ± 33,4 | 135 ± 29 | 142 ± 37,5 | 0,494a |
| PAD (mmHg) | 77 ± 17,4 | 75 ± 12,9 | 78,7 ± 21,2 | 0,527a |
| FC (lpm) | 88 ± 27,4 | 88 ± 23 | 87 ± 31 | 0,937a |
| VMNI | 7 (16,7) | 2 (9,5) | 5 (23,8) | 0,220b |
| Dopamina i.v. | 3 (7) | 2 (9,1) | 1 (4,8) | 0,582b |
| Dobutamina i.v. | 1 (2,3) | 0 (0) | 1 (4,8) | 0,306b |
| Nitratos i.v. | 10 (24,4) | 4 (19) | 6 (30) | 0,420b |
| Ritmo sinusal | 22 (51,2) | 11 (50) | 11 (52,4) | 0,877b |
| Creatinina (mg/dl) | 1,1 (0,9-1,4) | 1 (0,89 -1,3) | 1,1 (0,95-1,43) | 0,381c |
| Urea (mg/dl) | 45 (39-57) | 45 (37-55) | 49,5 (4-67,2) | 0,433c |
| Cistatina C (mg/l) | 1,37 (1,2-1,9) | 1,53 (1,12-2,27) | 1,33 (1,26-1,91) | 0,744c |
| Sodio (mEq/l) | 140 (137-142) | 139 (135-142) | 140 (137-141) | 0,855c |
| Potasio (mEq/l) | 4,3 ± 0,5 | 4,2 ± 0,5 | 4,3 ± 0,4 | 0,780a |
| Hemoglobina (g/dl) | 12,8 ± 2 | 12,5 ± 1,9 | 13 ± 2 | 0,454a |
| NT-proBNP (pg/ml) | 3.932 (172-8.149) | 3.609 (1.619-8.152) | 4.573 (1.726-5.600) | 0,911c |
| Troponina T (pg/ml) | 25 (16-46,3) | 23 (15,5-32) | 32,2 (16,1-49,8) | 0,338c |
| FEVI (%) | 40,3 ± 17 | 40,6 ± 17,9 | 39,8 ± 16,3 | 0,890a |
| Masa del VI (g/m2) | 131,9 ± 47,5 | 119 ± 43,8 | 144 ± 48, 9 | 0,112a |
| VTDVI (ml/m2) | 70,6 ± 29,1 | 67,8 ± 25,3 | 73,5 ± 33,24 | 0,567a |
| DTDVI (mm/m2) | 52 ± 11,2 | 51 ± 8,4 | 53 ± 13,5 | 0,596a |
| PSAP (mmHg) | 44,8 ± 13,8 | 48,7 ± 16 | 40 ± 9,2 | 0,128a |
| AI (mm) | 45,5 ± 8,44 | 45,6 ± 6,5 | 45,5 ± 10 | 0,959a |
ACV: accidente cerebrovascular; AI: diámetro anteroposterior de la aurícula izquierda; DAI: desfibrilador automático implantable; DTDVI: diámetro telediastólico del ventrículo izquierdo; EAP: edema agudo de pulmón; FC: frecuencia cardiaca; FEVI: fracción de eyección del ventrículo izquierdo; HTA: hipertensión arterial; IAM: infarto agudo de miocardio; IC: insuficiencia cardiaca; IMC: índice de masa corporal; i.v.: intravenoso; NT-proBNP: fracción aminoterminal del propéptido natriurético cerebral; NYHA: clase funcional de la New York Heart Association; PAD: presión arterial diastólica; PAS: presión arterial sistólica; PSAP: presión sistólica de la arteria pulmonar; TRC: terapia de resincronización cardiaca; VI: ventrículo izquierdo; VMNI: ventilación mecánica no invasiva; VTDVI: volumen telediastólico del ventrículo izquierdo.
Nuestro estudio es el primero que investiga la cinética de relaxina en pacientes con ICA y su relación con una amplia serie de variables relacionadas con la enfermedad. Las concentraciones de relaxina presentaron una importante variabilidad, al igual que han mostrado los escasos estudios publicados, con variaciones entre 600 y 900 pg/ml4–6, similares a las de nuestra población (878-1.031 pg/ml). Estos estudios incluyeron a pacientes con insuficiencia cardiaca crónica, con fracción de eyección del ventrículo izquierdo deprimida5,6 y preservada6, y tras el alta de un episodio de ICA4. La falta de asociación con variables clínicas, junto a que las concentraciones hormonales no dependieran del momento, urgencias con ICA o estabilizado a los 30 días, indica que la relaxina, como hormona endógena, no participa activamente en la fisiopatología de la ICA. La obtención de las muestras en la llegada a urgencias, a distintas horas, no debió influir, dada la correlación con los valores a 30 días (en ayunas) y la ausencia de ritmo circadiano de relaxina en estudios previos. Los resultados de este estudio concuerdan con los de otros que encontraron concentraciones similares de relaxina en pacientes con insuficiencia cardiaca crónica y controles sanos5,6 y ausencia de relación con la fracción aminoterminal del propéptido natriurético cerebral y el pronóstico al alta tras un episodio de ICA4. Solo un trabajo indica esta relación, pues encontró que las concentraciones se correlacionaban con las presiones de llenado ventricular y el índice cardiaco, y descendían tras 48 h de nitroprusiato endovenoso en 14 pacientes con ICA y fracción de eyección del ventrículo izquierdo deprimida2; sin embargo, este descenso no ocurrió en 13 pacientes con insuficiencia cardiaca moderada. Esta discordancia de hallazgos no parece explicada por datos objetivos, como el tipo de pacientes o el escenario clínico.
En conclusión, este estudio muestra que la relaxina es detectable en sangre periférica de pacientes con ICA a su llegada a urgencias, pero sus concentraciones fueron muy variables, no se correlacionaron con variables clínicas y no mostraron un cambio significativo tras la mejoría clínica (30 días). Estos datos, junto con otras publicaciones, indican que la relaxina, como hormona de producción endógena, no tiene un papel compensador en la fisiopatología de la ICA. Sin embargo, los escasos trabajos publicados y el pequeño número de pacientes hacen necesarios nuevos estudios que confirmen el papel de la relaxina como biomarcador en insuficiencia cardiaca.
FINANCIACIÓNEste trabajo ha sido financiado por la red nacional de investigación cardiovascular «RIC», Ministerio de Sanidad y Consumo, Madrid, España [RD12/0042/0049].