En los últimos años han surgido evidencias crecientes que respaldan la existencia de un comportamiento biológico diferenciado de los pacientes con insuficiencia cardiaca (IC) que se encuentran en la parte alta del intervalo de valores de fracción de eyección del ventrículo izquierdo (FEVI). De hecho, en los pacientes con IC y fracción de eyección conservada (ICFEc), a aquellos que presentan valores más altos de FEVI se les ha designado como pacientes con una fracción de eyección «supranormal» (ICFEsn)1–3.
Existen diferencias notorias entre los pacientes con fracción de eyección reducida, intermedia y conservada1,3. Sin embargo, continúan sin conocerse bien los factores asociados a los pacientes con una función sistólica más elevada. En este sentido, el aumento de la actividad inflamatoria ha surgido como mecanismo fisiopatológico fundamental y posible diana terapéutica en la ICFEc4. Por ejemplo, en un ensayo en curso se está evaluando la eficacia del ziltivekimab frente a placebo en pacientes con IC ambulatorios, con una FEVI >40% y una proteína C reactiva de alta sensibilidad (PCRas) >2mg/l (NCT05636176). No hay estudios previos en que se haya evaluado el perfil inflamatorio en todo el espectro de valores de la FEVI y, en especial, cuando hay una FEVI ≥50%. El objetivo de este estudio fue examinar si el valor de la PCRas circulante en el momento de la presentación inicial difiere a lo largo del espectro continuo de valores de la FEVI en pacientes con IC aguda (ICA) y una FEVI ≥ 50%.
Se llevó a cabo un estudio retrospectivo de un registro multicéntrico en curso de pacientes ingresados por ICA entre enero de 2010 y enero de 2021, con la inclusión de 5.246 pacientes. Se excluyó de este análisis a los pacientes con evidencia de una FEVI <50% durante la hospitalización (n=2.433), evidencia de una infección en el momento del ingreso (n=113), valores de PCRas no disponibles (n=312) o muerte temprana sin determinación de la FEVI (n=38). Ninguno de los pacientes estaba siendo tratado con fármacos inotrópicos en el momento de la presentación clínica inicial. La muestra final del estudio la formaron 2.350 pacientes. Se evaluaron las características clínicas y los parámetros bioquímicos, como la PCRas, en el momento de la presentación clínica inicial. Se realizaron evaluaciones ecocardiográficas, incluida la determinación de la FEVI, durante la hospitalización (72±24horas después del ingreso). La FEVI se determinó mediante ecocardiografía bidimensional utilizando el método de Simpson. La asociación entre la PCRas y la FEVI se evaluó a lo largo de todo el espectro continuo de valores de la FEVI o con una dicotomización (< 65% frente a ≥65%). Las variables continuas se presentan en forma de media±desviación estándar o de mediana (del percentil 25% al percentil 75%), y se analizaron sus diferencias en los diversos cuartiles de la FEVI con el empleo de pruebas de ANOVA o de Kruskal-Wallis. Las variables discretas se presentan en forma de número (porcentaje) y las diferencias se examinaron con la prueba de la χ2. La relación multivariable con los valores de la PCRas en todo el espectro continuo de valores de la FEVI o con la dicotomización de <65% frente a ≥ 65% se examinó mediante un análisis multivariante de regresión lineal o de regresión logística, respectivamente. Las covariables candidatas que se incluyeron en los modelos multivariantes se basaron en la plausibilidad biológica. Se evaluó de forma simultánea el supuesto de linealidad para todas las variables continuas y, si procedía, se transformaron las variables con polinomios fraccionales. La contribución de las covariables a la variabilidad del modelo de regresión lineal se evaluó mediante R2 y la capacidad de discriminación del modelo multivariante, mediante el área bajo la curva de características operativas del receptor. Los modelos finales incluyeron las covariables edad, sexo, primer ingreso, clase previa de la New York Heart Association (NYHA), cardiopatía isquémica, índice de comorbilidad de Charlson, presión arterial sistólica y diastólica, frecuencia cardiaca, fibrilación auricular, creatinina, fracción aminoterminal del propéptido natriurético cerebral (NT-proBNP), diámetro auricular izquierdo, diámetro telediastólico ventricular izquierdo y desplazamiento sistólico del plano del anillo tricuspídeo (DSPAT).
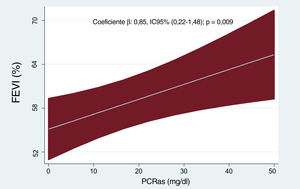
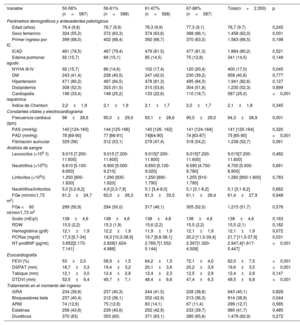
La media de edad fue 76,7±9,7 años y 1.458 de los pacientes (62%) eran mujeres. La proporción de pacientes con cardiopatía isquémica fue del 25%. La media de la FEVI fue de 62±7%, y 876 (37,3%) presentaron una FEVI ≥ 65%. La mediana de la PCRas en el momento del ingreso fue 19,7mg/dl (10,5-37,9). Las características iniciales de los pacientes en los diversos cuartiles de la FEVI se muestran en la tabla 1. En los pacientes de los cuartiles superiores de la FEVI había mayor frecuencia de mujeres y era menos probable la existencia de antecedentes de cardiopatía isquémica. También presentaban valores más bajos de frecuencia cardiaca, presión arterial diastólica, NT-proBNP y de los diámetros telediastólicos ventriculares izquierdos. En cambio, en estos pacientes había mayor proporción de casos con una clase III/IV de la NYHA antes del ingreso, un valor superior del DSPAT y cifras más altas de PCRas. El análisis de regresión lineal multivariante inferencial confirmó la asociación positiva significativa entre los valores superiores de la PCRas y la FEVI. Esta relación era lineal (figura 1). El análisis de regresión logística multivariante confirmó también que los valores más altos de PCRas predecían la FEVI ≥ 65%. De hecho, por cada 1mg/dl de aumento de la PCRas, la probabilidad aumentaba en un 22% (odds ratio [OR], 1,22; intervalo de confianza del 95% [IC95%], 1,01-1,48; p=0,046). El valor de R2 (regresión lineal) y el del área bajo la curva de características operativas del receptor (regresión logística) fueron 0,33 y 0,706, respectivamente.
Características iniciales en los cuartiles de FEVI
| Variable | 50-56%(n=587) | 56-61%(n=588) | 61-67%(n=588) | 67-88%(n=587) | Total(n=2.350) | p |
|---|---|---|---|---|---|---|
| Parámetros demográficos y antecedentes patológicos | ||||||
| Edad (años) | 76,4 (9,8) | 76,7 (9,9) | 76,3 (9,9) | 77,3 (9,1) | 76,7 (9,7) | 0,245 |
| Sexo femenino | 324 (55,2) | 372 (63,3) | 374 (63,6) | 388 (66,1) | 1.458 (62,0) | 0,001 |
| Primer ingreso por IC | 399 (68,0) | 402 (68,4) | 392 (66,7) | 370 (63,0) | 1.563 (66,5) | 0,198 |
| ICAD | 461 (78,5) | 467 (79,4) | 479 (81,5) | 477 (81,3) | 1.884 (80,2) | 0,521 |
| Edema pulmonar agudo | 92 (15,7) | 89 (15,1) | 85 (14,5) | 75 (12,8) | 341 (14,5) | 0,149 |
| NYHA III-IV | 92 (15,7) | 86 (14,6) | 102 (17,4) | 120 (20,4) | 400 (17,0) | 0,045 |
| DM | 243 (41,4) | 238 (40,5) | 247 (42,0) | 230 (39,2) | 958 (40,8) | 0,777 |
| Hipertensión | 471 (80,2) | 497 (84,5) | 478 (81,3) | 495 (84,3) | 1.941 (82,6) | 0,127 |
| Dislipidemia | 308 (52,5) | 303 (51,5) | 315 (53,6) | 304 (51,8) | 1.230 (52,3) | 0,899 |
| Cardiopatía isquémica | 196 (33,4) | 148 (25,2) | 133 (22,6) | 110 (18,7) | 587 (25,0) | <0,001 |
| Índice de Charlson | 2,2±1,9 | 2,1±1,9 | 2,1±1,7 | 2,0±1,7 | 2,1±1,8 | 0,345 |
| Constantes vitales y electrocardiograma | ||||||
| Frecuencia cardiaca (lpm) | 98±28,6 | 95,0±29,0 | 93,1±28,6 | 90,5±29,0 | 94,3±28,9 | 0,001 |
| PAS (mmHg) | 140 [124-160] | 144 [125-166] | 140 [126- 162] | 141 [124-164] | 141 [125-164] | 0,320 |
| PAD (mmHg) | 78 [69-90] | 77 [66-91] | 74[64-90] | 74 [63-87] | 75 [65-90] | <0,001 |
| Fibrilación auricular | 329 (56) | 312 (53,1) | 279 (47,4) | 318 (54,2) | 1.238 (52,7) | 0,061 |
| Análisis de sangre | ||||||
| Leucocitos (×109 /l) | 9.015 [7.200-11.600] | 9.015 [7.200-11.600] | 9.015[7.200-11.600] | 9.015[7.200-11.600] | 9.015[7.200- 11.600] | 0,482 |
| Neutrófilos (×109/l) | 6.610 [5.100-8.650] | 6.900 [5.000-9.210] | 6.650 [5.100-9.020] | 6.590 [4.750-8.780] | 6.700 [5.000-8.900] | 0,661 |
| Linfocitos (×109/l) | 1.250 [900-1.830] | 1.290 [935-1.820] | 1.250 [890-1.790] | 1.255 [910-1.780] | 1.260 [900-1.800] | 0,783 |
| Neutrófilos/linfocitos | 5,0 [3,2-8,2] | 4,9 [3,3-7,9] | 5,1 [3,4-8,0] | 5,1 [3,1-8,2] | 5,1 [3,1-8,2] | 0,662 |
| FGe (ml/min/1,73 m2) | 61,3±24,7 | 62,0±26,3 | 61,3±33,5 | 61,1±26,4 | 61,4±27,9 | 0,948 |
| FGe <60 ml/min/1,73 m2 | 299 (50,9) | 294 (50,0) | 317 (46,1) | 305 (52,0) | 1.215 (51,7) | 0,576 |
| Sodio (mEq/l) | 138±4,6 | 138±4,6 | 138±4,6 | 138±4,6 | 138±4,6 | 0,163 |
| RDW | 15,5 (2,2) | 15,3 (1,9) | 15,6 (2,2) | 15,5 (2,2) | 15,5 (2,1) | 0,182 |
| Hemoglobina (g/dl) | 12,1±1,9 | 12,2±1,9 | 11,9±1,9 | 12,1±1,9 | 12,1±1,9 | 0,072 |
| PCRas (mg/dl) | 17,3 [9,7-34] | 18,3 [10,3-38,9] | 19,7 [9,8-38,1] | 20,2 [11,0-39,4] | 21,7 [11,5-37,9] | 0,031 |
| NT-proBNP (pg/ml) | 3.852[2.173-7.141] | 2.826[1.624-4.988] | 2.769,7[1.552-5.144] | 2.397[1.320-4.508] | 2.947,4[1.617-5.447] | <0,001 |
| Ecocardiografía | ||||||
| FEVI (%) | 53±2,0 | 58,9±1,5 | 64,2±1,5 | 72,1±4,0 | 62,0±7,5 | <0,001 |
| DSPAT (mm) | 18,7±3,3 | 19,4±3,2 | 20,1±3,6 | 20,2±3,9 | 19,6±3,5 | <0,001 |
| Tabique (mm) | 12,1±3,0 | 12,4±2,8 | 12,4±2,3 | 12,5±2,9 | 12,4±2,8 | 0,147 |
| DTDVI (mm) | 52,5±6,4 | 49,7±7,1 | 48,4±6,6 | 47,4±6,3 | 49,5±6,8 | <0,001 |
| Tratamiento en el momento del ingreso | ||||||
| iSRA | 234 (39,9) | 237 (40,3) | 244 (41,5) | 228 (38,8) | 943 (40,1) | 0,828 |
| Bloqueadores beta | 237 (40,4) | 212 (36,1) | 252 (42,9) | 213 (36,3) | 914 (38,9) | 0,044 |
| ARM | 74 (12,6) | 75 (12,8) | 83 (14,1) | 67 (11,4) | 299 (12,7) | 0,585 |
| Estatinas | 256 (43,6) | 239 (40,6) | 252 (42,9) | 233 (39,7) | 980 (41,7) | 0,485 |
| Diuréticos | 370 (63) | 353 (60) | 371 (63,1) | 385 (65,6) | 1.479 (62,9) | 0,272 |
ARM, antagonista de receptores de mineralocorticoides DM, diabetes mellitus; DSPAT, desplazamiento sistólico del plano del anillo tricuspídeo; DTDVI, diámetro telediastólico del ventrículo izquierdo; FEVI, fracción de eyección del ventrículo izquierdo; FGe, filtrado glomerular estimado; IC, insuficiencia cardiaca; ICAD, insuficiencia cardiaca aguda descompensada; ISRA, inhibidores del sistema renina-angiotensina; NT-proBNP, fracción aminoterminal del propéptido natriurético cerebral; NYHA, New York Heart Association; PAD, presión arterial diastólica; PAS, presión arterial sistólica; PCRas, proteína C reactiva de alta sensibilidad; RDW, amplitud de distribución eritrocitaria (red cell distribution width).
Los datos se presentan en forma de porcentaje (%), media±desviación estándar o mediana [Q1-Q3].
En la línea del paradigma de comorbilidad-inflamación de la ICFEc, el presente trabajo muestra una asociación significativa entre los valores superiores de FEVI y las cifras más altas de PCRas en la ICA. Este paradigma propone que una mayor carga de comorbilidad inducirá una inflamación vascular sistémica que dará lugar a disfunción endotelial, fibrosis miocárdica, rigidez diastólica elevada e IC clínica4. Se propone que la mayor carga de comorbilidad y la activación inmunoinflamatoria aumentan la demanda de oxígeno y que el corazón lo compensará inicialmente con un aumento de la función sistólica. A medida que avanza esta situación, la cual comporta un aumento de la fibrosis miocárdica, este mecanismo de compensación acaba resultando insuficiente y ello conduce a una progresión de la IC.
Este estudio tiene varias limitaciones. En primer lugar, se trata de un estudio retrospectivo y de un solo centro, por lo que la extrapolación de estos resultados a otras situaciones requerirá confirmación. En segundo lugar, no se exploró la asociación entre los valores más altos de ICFEsn y de PCRas, y los resultados adversos clínicos. En tercer lugar, aunque se excluyó a los pacientes con infecciones en el momento del ingreso, no puede descartarse la existencia de una infección subclínica o de otros factores de confusión proinflamatorios. En cuarto lugar, no se dispuso de datos sobre peso, altura, citocinas, otros reactivos de fase aguda, función renal, coagulación o troponina de ninguno de los pacientes. Por último, con los datos actuales no se puede inferir una causalidad ni revelar los mecanismos biológicos subyacentes.
FINANCIACIÓNTrabajo parcialmente financiado por subvenciones del Centro de Investigación Biomédica en Red de Enfermedades Cardiovasculares (CIBERCV) (subvenciones número 16/11/00420 y 16/11/00403).
CONSIDERACIONES ÉTICASEl estudio se atuvo a los principios indicados en la Declaración de Helsinki y fue aprobado por el comité ético local (Hospital Clínico Universitario de Valencia). Todos los pacientes otorgaron previamente el consentimiento informado. Se han tenido en cuenta las directrices SAGER.
DECLARACIÓN SOBRE EL USO DE INTELIGENCIA ARTIFICIALNo se ha utilizado ninguna herramienta de inteligencia artificial en la preparación de este trabajo.
CONTRIBUCIÓN DE LOS AUTORESLos autores no tienen ninguna otra financiación, relaciones económicas ni conflictos de intereses que declarar en relación con este trabajo.
CONFLICTO DE INTERESESNinguno.