En el año 2016, la Sociedad Europea de Cardiología (ESC) publicó la última versión de su guía para el tratamiento de la insuficiencia cardiaca (IC), y no está prevista una nueva actualización y publicación de la siguiente hasta 2021. Ante la constante investigación y generación de nueva evidencia en el campo de la IC con fracción de eyección (FE) reducida (IC-FEr), un grupo de expertos de distintas especialidades relacionadas con el diagnóstico y el tratamiento de los pacientes con IC (cardiología, medicina interna, atención primaria, enfermería cardiovascular) convino en la necesidad de desarrollar un trabajo de revisión y actualización de la nueva evidencia científica aparecida en el área, acompañada de una serie de recomendaciones prácticas basadas principalmente en la experiencia y el conocimiento de los autores sobre la patología y el tratamiento clínico en las distintas situaciones que se plantean en el documento, todo con el claro objetivo de ayudar a los profesionales sanitarios que desarrollan su labor en esta patología a mejorar el cuidado de estos pacientes.
En este documento se tratan 15 aspectos del tratamiento de la IC que abarcan todo el espectro de esta enfermedad, tanto desde el punto de vista organizativo como de detección, diagnóstico y tratamiento. En algunos de ellos ya existe nueva evidencia, que probablemente se verá reflejada en la guía de práctica clínica de IC de 2021, pero en otros temas es difícil disponer de evidencia clara, y va a seguir siéndolo. Sin embargo, la falta de evidencia no debe ser un impedimento para dar respuesta a nuestros pacientes en sus distintos problemas clínicos, y a ello va dirigido este documento de consenso. La estructura de cada tema es similar, con una introducción inicial sobre la relevancia del problema, seguida de una revisión de la evidencia disponible y las fuentes de las que procede, para finalizar con unas recomendaciones prácticas realizadas por los expertos.
A continuación, y a modo de guía orientativa, se detallan los 15 puntos tratados con un breve resumen de cada uno de ellos.
- 1.
¿Cómo se debe actuar ante la sospecha clínica de IC en atención primaria? En este capítulo se pone de manifiesto el papel fundamental de la atención primaria (AP) tanto en el diagnóstico como en el tratamiento de los pacientes con IC, especialmente los ancianos y los pacientes con comorbilidades y polifarmacia, así como la importancia de que exista una buena colaboración/comunicación entre los servicios de cardiología y las unidades de AP.
- 2.
Formación del paciente con IC. Incluye recomendaciones sobre actividad/ejercicio físico, su duración y su frecuencia semanal, tipo de ejercicio particular, nutrición y autocuidado, con una referencia especial a la corresponsabilidad de todos los profesionales de la salud en la formación y el cuidado de los pacientes con esta afección.
- 3.
Rutas de IC (atención multidisciplinar del paciente con IC). Muchos pacientes con IC son atendidos por diferentes profesionales de la salud y en distintos niveles asistenciales. En este capítulo se establece una serie de puntos y recomendaciones sobre una atención multidisciplinar, con objetivos compartidos y claras responsabilidades asignadas a cada uno de los agentes implicados.
- 4.
IC y adherencia: medidas para incrementarla. Al igual que en otras enfermedades crónicas, la mala adherencia al tratamiento en la IC es un problema muy relevante. En este capítulo se realiza una revisión sistemática de la evidencia y una descripción de una serie de estrategias generales para promover y mejorar esta falta de adherencia, muy especialmente en tratamientos crónicos.
- 5.
IC, monitorización clínica y pruebas complementarias. Incluye la monitorización clínica, analítica simple, péptidos natriuréticos, CA125, ultrasonido pulmonar y de vena cava inferior (VCI), FE, biomarcadores y otras exploraciones y pruebas complementarias que considerar en la evaluación y el seguimiento de los pacientes con esta enfermedad.
- 6.
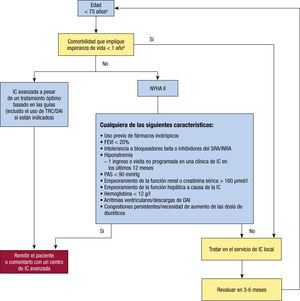
IC avanzada. Incluye una revisión y recomendaciones sobre distintas opciones terapéuticas, bombas elastoméricas para infusión subcutánea de diuréticos en la IC descompensada, el tratamiento ambulatorio con inotropos, el tratamiento de la IC crónica refractaria y resistencia a los diuréticos.
- 7.
Transición al alta hospitalaria. Se describen criterios de alta hospitalaria, datos básicos en informe de alta, plazo máximo de demora hasta la primera revisión clínica y otras recomendaciones para conseguir un buen seguimiento del paciente una vez se le da el alta del hospital y afronta un periodo crítico en su proceso de recuperación.
- 8.
IC de novo. Incluye pasos para el tratamiento farmacológico o con dispositivos, el tiempo de respuesta (titulación) de la enfermedad para la toma de decisiones, con una revisión en profundidad de la evidencia científica, y se subraya la importancia de prescribir pronto los tratamientos más eficaces y seguros.
- 9.
IC en el paciente estable. En este capítulo los autores señalan que el término «estable» aplicado a la IC debería dejar de emplearse, a favor de IC «optimizada frente a no optimizada» para mantener a los clínicos alerta de que la optimización del tratamiento recomendado por las guías es la única manera para enlentecer o detener la progresión de la enfermedad.
- 10.
Sacubitrilo/valsartán en la IC-FEr. Se realiza una revisión sistemática de la evidencia científica sobre sacubitrilo/valsartán en el tratamiento de la IC-FEr, en diferentes perfiles de pacientes (de novo, naïve, hospitalizado).
- 11.
IC y enfermedad renal crónica. Incluye el tratamiento y la toma de decisiones, así como el tratamiento y las limitaciones al tratamiento del paciente con IC e insuficiencia renal avanzada.
- 12.
IC y diabetes mellitus. Existe una estrecha relación entre la diabetes mellitus y la IC, y en este capítulo se revisan la evidencia y el impacto metabólico de los tratamientos activos para la IC en la glucemia, con consejos y recomendaciones prácticas de abordaje y tratamiento de estos pacientes.
- 13.
IC y fibrilación auricular (FA). La FA es la arritmia más prevalente en la IC, y aunque hay alguna evidencia sobre su tratamiento, aún existen muchas situaciones clínicas sin claras recomendaciones en las guías, que se revisan en este apartado.
- 14.
IC y cáncer. En el paciente con IC y cáncer, resulta fundamental realizar una correcta y exhaustiva valoración de su estado antes de iniciar el tratamiento oncológico, durante y después de los ciclos de quimioterapia, dado el riesgo que existe de empeorar la función cardiaca.
- 15.
IC y paciente anciano. Se realiza una revisión de los estudios y la evidencia más reciente publicada para el tratamiento y el seguimiento del paciente anciano (frágil) con IC, y se pone de manifiesto la importancia de desarrollar y reforzar un abordaje holístico y multidisciplinar.
Está bien documentado el papel fundamental de AP tanto en el diagnóstico como en el tratamiento de los pacientes con IC, especialmente los ancianos y los pacientes con comorbilidades y polifarmacia1-3.
Por otro lado, según las distintas sociedades científicas4,5, para el diagnóstico de IC debe haber, además de los signos y síntomas característicos, una evidencia objetiva de disfunción cardiaca6. Sin embargo, los síntomas y signos son muchas veces inespecíficos o difíciles de interpretar7-9, y no siempre se dispone de acceso a estudios fundamentales como el de péptidos natriuréticos (PN).
En este sentido, distintas publicaciones que han analizado los casos de IC registrados en las bases de datos de AP han mostrado que se pudo confirmar como IC según los criterios actualmente aceptados un 35-85% de los casos8-11. En un estudio realizado en 2 centros de AP en España, además se mostró que algunos factores se asocian de manera estadísticamente significativa con mayor probabilidad de confirmación diagnóstica de IC. Estos fueron la edad, el seguimiento por cardiología, el antecedente de enfermedad cardiaca isquémica, la presencia de fibrilación auricular y la prescripción de diuréticos de asa8.
Por todo ello, el diagnóstico de IC en AP continúa siendo un reto.
EvidenciaEl proceso de la IC comienza con la sospecha clínica de IC basada en los síntomas y signos de la enfermedad. La disnea es el único síntoma que tiene una especificidad elevada, del 87% aproximadamente, pero esta especificidad no es lo bastante alta para descartar una IC en su ausencia (sensibilidad del 50%)7. Además, en algunos pacientes la disnea es difícil de interpretar, especialmente los ancianos, los obesos y las mujeres8,9.
Entre los estudios complementarios, los PN también tienen una gran sensibilidad (de hasta un 94-96%), pero una especificidad moderada7,12-14. De hecho, hay situaciones clínicas que pueden cursar con incrementos de los PN, como la hipertensión pulmonar, el síndrome coronario agudo, la FA, la insuficiencia renal o la enfermedad pulmonar obstructiva crónica con cor pulmonale, y otras con bajas concentraciones, como la obesidad15. También es importante indicar que los valores de los PN se incrementan con la edad16,17. En un paciente que no recibe tratamiento, unos valores de PN normales prácticamente excluyen la IC (alto valor predictivo negativo).
El ECG también presenta unos valores de sensibilidad elevados, pero baja especificidad7,18,19. Además, estos valores se pueden ver alterados por la formación de la persona que interpreta el resultado del ECG7.
Se ha publicado una revisión sistemática y metanálisis de excelente calidad. Presenta la limitación de su fecha de publicación (2009), pero es muy exhaustiva, por lo que algunos de los datos que describimos (no exentos de limitaciones y sesgos propios de estos estudios sobre reglas de predicción diagnóstica) pueden ser de interés7. Esta publicación incluyó 34 estudios (individualmente de calidad baja o moderada, realizados en AP o servicios de urgencias) y evaluó, entre otras cuestiones, el rendimiento diagnóstico de IC (diagnosticada clínicamente) de distintos factores (tabla 1). Los datos comparativos entre los factores fueron: péptido natriurético cerebral (BNP) frente a la fracción aminoterminal del propéptido natriurético cerebral (NT-proBNP) (6 estudios; p = 0,077) y BNP frente a ECG (4 estudios; odds ratio [OR] para el diagnóstico, superior para el BNP: OR = 0,34, p = 0,03).
Rendimiento de los factores individuales para el diagnóstico de insuficiencia cardiaca
| Factor | N.o de estudios | Sensibilidad, % | Especificidad, % | VPP | VPN |
|---|---|---|---|---|---|
| Antecedente de IAM | 10 | 26 | 89 | 2,37 | 0,82 |
| Ortopnea | 6 | 44 | 89 | 3,91 | 0,63 |
| Disnea paroxística nocturna | 3 | Resultados similares a la ortopnea | |||
| Edema | 12 | 53 | 72 | 1,89 | 0,75 |
| Taquicardia | 3 | 23-36 | 40-92 | - | - |
| Presión venosa yugular elevada | 7 | 52 | 70 | 1,73 | 0,68 |
| Cardiomegalia | 6 | 27 | 85 | 31 | 82 |
| S3 o ritmo de galope | 6 | 11 | 99 | 12,1 | 0,99 |
| Estertores crepitantes pulmonares | 11 | 51 | 81 | 2,64 | 0,61 |
| Hepatomegalia | 1 | 17 | 97 | - | - |
| ECG | 11 | 89 (médico AP 53 frente a médico hospital 95) | 56 (médico AP 63 -médico hospital 47) | 4,07 | 0,38 |
| Radiografía simple tórax (cualquier signo de IC) | 5 | 68 | 83 | 4,07 | 0,38 |
| Radiografía simple de tórax (índice cardiotorácico elevado) | 6 | 67 | 76 | 2,73 | 0,44 |
| BNP | 20 | 93 | 74 | 3,57 | 0,09 |
| NT-proBNP | 16 | 93 | 65 | 2,70 | 0,11 |
AP: Atención Primaria; BNP: péptido natriurético cerebral; IAM: infarto agudo de miocardio; IC: insuficiencia cardiaca; NT-proBNP: fracción aminoterminal del propéptido natriurético cerebral. Tabla elaborada con datos de Mant et al7.
En 2019 se publicó una revisión sistemática de excelente calidad (sigue las recomendaciones PRISMA20), que recogió y evaluó distintas reglas de predicción diagnóstica de IC en AP (utiliza el CHARMS para evaluar la calidad y exige que al menos presente un modelo multivariable). Además, con aquellos en que era posible, trataron de validarlos en una cohorte de pacientes referidos desde AP por sospecha de IC que acuden a una unidad hospitalaria específica de IC para confirmarla (validación externa)21.
Se incluyeron 9 estudios (la mayoría publicados entre 2010 y 2016), de los que posteriormente se validaron 4 (validación externa). Las variables candidatas incluidas en el diseño de cada regla variaron de 5 a 32, y las variables predictivas finalmente incluidas variaron de 5 a 11. Entre estas, se encuentran por ejemplo la edad, el sexo, la presencia de disnea/ortopnea/disnea paroxística nocturna, el antecedente de infarto agudo de miocardio, la presencia de cardiopatía isquémica, el tratamiento del paciente, los valores de BNP/NT-proBNP, el ECG alterado, el murmullo cardiaco, los crepitantes pulmonares, la frecuencia cardiaca basal o la pérdida de apetito. Cuatro reglas de predicción diagnóstica utilizaron síntomas; 8, datos de la exploración física; 5, el ECG y 5, los BNP/NT-proBNP. Cuatro de las reglas ya tienen una validación externa y otra está en proceso de evaluación de su impacto clínico. La mayoría de los modelos utilizan reglas ya validadas como el MICE (male, infarction, crepitations, edema) o MIJO (male, infarction, elevated jugular pressure, orthopnea), y algunas las amplían incorporando el ECG o la determinación de BNP.
Por otro lado, 6 modelos predictivos evaluaron la IC y la IC con FE preservada (FEp), y 3 solo el diagnóstico de IC en general. Asimismo los 9 modelos incluyeron la derivación al especialista, de los que 2 solo incluyeron la derivación; 2, la derivación y la validez interna y 4, la derivación y la validez externa. Ninguno realizó un análisis de impacto clínico.
En cuanto a las poblaciones incluidas, estas fueron muy heterogéneas; por ejemplo, las edades variaron de los 65 a los 82 años; los hombres incluidos, del 35,4 al 55,1%, y 5 de los estudios analizaron a pacientes referidos específicamente de AP.
La cohorte con que se realizó la validación externa incluyó a 733 pacientes, el 39% con IC; la media de edad fue 77 años, el 44% eran varones, y la mayoría tenía varias comorbilidades.
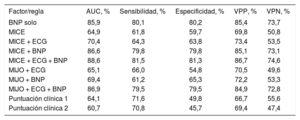
En la tabla 2 se describen los resultados en términos de rendimiento diagnóstico de distintas reglas de predicción en su cohorte (validación externa). Los resultados obtenidos en esta cohorte fueron similares a los obtenidos en las originales. Sin embargo, en esta cohorte el rendimiento de las reglas de precisión fue muy similar al del BNP individual. Según esto, la utilidad de los PN es clave en el diagnóstico de IC por AP. En pacientes sin tratamiento médico y con ECG normal que consultan por disnea, si los PN son normales, se debería excluir IC y no se debería remitirlos a cardiología.
Validación externa de las reglas de predicción diagnóstica
| Factor/regla | AUC, % | Sensibilidad, % | Especificidad, % | VPP, % | VPN, % |
|---|---|---|---|---|---|
| BNP solo | 85,9 | 80,1 | 80,2 | 85,4 | 73,7 |
| MICE | 64,9 | 61,8 | 59,7 | 69,8 | 50,8 |
| MICE + ECG | 70,4 | 64,3 | 63,8 | 73,4 | 53,5 |
| MICE + BNP | 86,6 | 79,8 | 79,8 | 85,1 | 73,1 |
| MICE + ECG + BNP | 88,6 | 81,5 | 81,3 | 86,7 | 74,6 |
| MIJO + ECG | 65,1 | 66,0 | 54,8 | 70,5 | 49,6 |
| MIJO + BNP | 69,4 | 61,2 | 65,3 | 72,2 | 53,3 |
| MIJO + ECG + BNP | 86,9 | 79,5 | 79,5 | 84,9 | 72,8 |
| Puntuación clínica 1 | 64,1 | 71,6 | 49,8 | 66,7 | 55,6 |
| Puntuación clínica 2 | 60,7 | 70,8 | 45,7 | 69,4 | 47,4 |
AUC: área bajo la curva; BNP: péptido natriurético cerebral; MICE: male, infarction, crepitations, edema; MIJO: male, infarction, elevated jugular pressure, orthopnea; NT-proBNP: fracción aminoterminal del propéptido natriurético cerebral; VPN: valor predictivo negativo; VVP: valor predictivo positivo. Tabla elaborada con datos de Gallagher et al21.
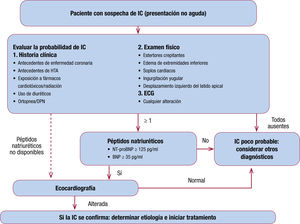
La ESC5, en su última actualización de 2016, incorpora un algoritmo para el diagnóstico de la IC de instauración no aguda. Ante la sospecha de IC, dirige al clínico a una evaluación de síntomas y signos y la realización de un ECG. A continuación, plantea 2 situaciones en función de la disponibilidad (accesibilidad) de la determinación de PN. En ambos casos el último paso es la realización de una ecocardiografía.
Por otro lado, la Sociedad Española de Cardiología (SEC), en colaboración con médicos de AP, publicó en 2017 un informe en el que propone un algoritmo para el diagnóstico de IC similar al comentado por la ESC4. Además, también se hace hincapié en este documento en que los pacientes con infarto agudo de miocardio (IAM) previo y sospecha de IC deben ser derivados inmediatamente (< 2 semanas) para su evaluación por un cardiólogo y exploración por ecocardiografía, idóneamente una consulta de alta resolución. También que se debe garantizar un plazo inferior a las 4 semanas para la evaluación por un cardiólogo de los pacientes referidos desde AP con sospecha de IC y que es recomendable la determinación previa de PN en AP.
Puntos que considerar y recomendacionesEl infradiagnóstico de la IC es importante, por lo que se hace necesaria la búsqueda activa en pacientes con factores de riesgo y factores precipitantes de disfunción cardiaca en el contexto de la AP.
El diagnóstico de sospecha se establece ante la identificación de síntomas y signos no siempre fáciles de interpretar; la anamnesis adecuada, la exploración y el ECG, junto con una analítica básica, permiten realizar dicho diagnóstico.
Dada la utilidad del BNP y la NT-proBNP, es necesario garantizar a los centros de AP su disponibilidad, especialmente para el diagnóstico pero también en las descompensaciones. Los PN también presentan una elevada sensibilidad (de hasta un 94-96%)7,12-14. Por ello, y a pesar de su relevancia, los PN no bastan para hacer el diagnóstico, y deben formar parte de un contexto clínico adecuado.
Además, hay que tener en cuenta que el beneficio de utilizar los PN en pacientes mayores de 75 años es incierto16, así que debe tenerse precaución en su interpretación.
La colaboración entre el servicio de cardiología y los equipos de AP debe ser fluida y facilitar la participación de todos los agentes implicados, para así disminuir las cifras de infradiagnóstico ya descritas. Además, con el mismo fin, se debe fortalecer la colaboración entre niveles asistenciales para que este sea un proceso bidireccional.
Para terminar, podría contribuir muy positivamente en este contexto el establecimiento de procesos asistenciales integrados con flujos y plazos de atención definidos. Su aplicación en la práctica diaria permitiría completar el diagnóstico y la clasificación de la IC.
ResumenSe muestra, a continuación, un resumen de los puntos más destacados de lo expuesto anteriormente4,22-24:
- 1.
Establecimiento de la sospecha clínica de IC basada en síntomas y signos de la enfermedad (incluye también la historia clínica previa del paciente y la valoración de factores de riesgo de cardiopatía) y en el ECG.
- 2.
De los pacientes con sospecha clínica, hay que solicitar y valorar los PN (cuyo resultado debería estar disponible en menos de 1 semana).
- 3.
Si los PN son positivos (NT-proBNP ≥ 125 pg/ml; BNP ≥ 35 pg/ml), valorando posibles falsos positivos, solicitar/realizar una prueba de imagen (ecocardiograma en un plazo inferior a 1-2 semanas) y remitir a cardiología para completar su estudio.
- 4.
Si los síntomas/signos/ECG o los PN son negativos, hay que valorar otros diagnósticos.
- 5.
Individualizar en cada caso otras exploraciones, como radiografía de tórax, que se solicitará en caso de que se precise para diagnosticar alguna enfermedad concreta (no como prueba sistemática en el proceso), o analítica en búsqueda de causas reversibles o potencialmente tratables de disnea y enfermedades asociadas que pueden modificar el pronóstico o el tratamiento.
- 6.
Tras el diagnóstico sindrómico, es necesario un diagnóstico etiológico, de las comorbilidades y los factores precipitantes.
- 7.
Es preciso clasificar la IC según su grado funcional y su FE porque esto será relevante a la hora de instaurar el tratamiento y el seguimiento.
La enfermedad crónica lleva implícita la adaptación de la persona y su entorno a un nuevo estilo de vida, de ahí la necesidad de un aprendizaje para un cuidado autónomo y la prevención de sus complicaciones.
La educación terapéutica (ET) comprende un conjunto de actividades formativas realizadas por los profesionales de la salud que son esenciales para la gestión de las enfermedades crónicas y cuyo objetivo es ayudar al paciente o grupos de pacientes y familiares a realizar su tratamiento y prevenir las complicaciones evitables, con el fin de mejorar la adherencia al plan terapéutico y el autocuidado, y así mantener o mejorar la calidad de vida.
Los profesionales de enfermería son los responsables de trasladar todas estas habilidades al paciente, así como de realizar un seguimiento activo de las personas con IC, acción que, junto con la formación para la salud, es lo que presenta un mayor grado de evidencia científica en el terreno de la prevención de las reagudizaciones de la enfermedad5,25-27.
La intervención ideal en IC incluiría el seguimiento conjunto de los pacientes tanto en AP como en atención especializada, con programas de formación continua centrados en fomentar el autocuidado de estos pacientes y mejorar la capacidad de reconocer y responder a los signos de descompensación5,28.
EvidenciaFormación en general (responsable, contenidos, actuaciones)Se ha descrito la eficacia de distintos programas educacionales, la mayoría impartidos por enfermería (a menudo definida como especializada o con entrenamiento específico), aunque también impartidos por equipos multidisciplinares, tanto en el ámbito ambulatorio como en el hospitalario, con contenidos y actuaciones variados en número y características20,25,29-31.
Una revisión sistemática de la literatura de buena calidad (sigue las recomendaciones de la Cochrane Collaboration) comparó la formación dada por enfermeras con el cuidado habitual de adultos con IC en un ámbito ambulatorio25. Analizó 7 ensayos clínicos aleatorizados de calidad moderada-buena (evaluada mediante el Appraisal Skills Programme tool para este tipo de diseño), que incluyeron a más de 3.500 pacientes con medias de edad entre los 59 y los 75 años, muchos de ellos con IC-FEr. Destaca que el seguimiento de estos estudios varió desde las 6/12 semanas hasta los 4 años. Además, en uno de los estudios incluidos, la formación del paciente de IC se realizaba en la consulta ambulatoria, 5 incluían llamadas telefónicas, 3 hacían visitas a domicilio y 1 se servía de la telemedicina. Por otro lado, los contenidos de los programas y las actuaciones de la enfermera fueron muy diversos e incluyeron aspectos como el conocimiento de la enfermedad y sus tratamientos, el autocuidado y el afrontamiento de la enfermedad, la adherencia y las estrategias para evaluarla y fomentarla, o la promoción de un estilo de vida saludable (dieta, ejercicio, etc.). Además de un contacto verbal (en todos), mayormente presencial, se utilizan otros materiales escritos o vídeos.
En cuanto a los resultados, la formación brindada por enfermería, en comparación con el cuidado habitual, se asoció con una reducción de la tasa de reingresos hospitalarios en hasta un 50% (datos brutos no ajustados, dependiendo del estudio y el momento en que se evaluó la variable de desenlace). Lo mismo se observó en la tasa de hospitalizaciones (p. ej., uno de los estudios incluidos mostró que ingresan en el hospital en los 3 años posteriores el 28,5% de los pacientes con la intervención de enfermería y el 35,1% del grupo de control). También, al menos en el corto plazo (12 semanas), la mejora en calidad de vida fue significativamente mayor con la intervención (datos no ajustados)25.
Existen también varias publicaciones sobre la eficacia de los programas formativos impartidos a los familiares y cuidadores de pacientes con IC. Destaca una revisión sistemática de la literatura de buena calidad (sigue las recomendaciones PRISMA20, e incluyó 9 artículos sobre 6 ensayos clínicos de calidad buena-moderada −1 era de baja calidad — según la escala de PEDro32, y también un ensayo clínico de buena calidad publicado posteriormente29). Los programas formativos de estos estudios fueron muy variados (en formatos, contenidos, responsable, contexto, etc.) y, al igual que en el caso comentado anteriormente, incluyen aspectos como el conocimiento de la enfermedad y sus tratamientos, el autocuidado, la adherencia y las estrategias para evaluarla y fomentarla, o la promoción de un estilo de vida saludable (dieta, ejercicio, etc.). Todos compararon su eficacia con el cuidado habitual, y el seguimiento varió entre las 5 y las 24 semanas. Sin embargo, los resultados mostrados son contradictorios, por lo que se precisan más estudios para determinar la eficacia de estos programas tanto para los pacientes como para sus familiares/cuidadores.
EjercicioDistintos estudios individuales y metanálisis han puesto de manifiesto la eficacia del ejercicio físico aeróbico regular para los pacientes con IC en general y aquellos con IC-FEr en particular33.
Una revisión sistemática y metanálisis de gran calidad publicada en 2019 por la Cochrane Collaboration analizó la eficacia de la rehabilitación cardiaca basada en el ejercicio físico en 44 ensayos clínicos aleatorizados de calidad variable (la mayoría buenos según la escala de evaluación de sesgos de la Cochrane), con diversos comparadores (activos y no activos) y casi 6.000 pacientes con IC (la mayoría IC-FEr). El metanálisis mostró que la rehabilitación cardiaca no influye en la mortalidad por cualquier causa a corto plazo, pero sí puede mejorar la mortalidad por cualquier causa a largo plazo (seguimiento > 12 meses), con un riesgo relativo (RR) = 0,88 (intervalo de confianza del 95% [IC95%], 0,75-1,02)33. También se asocia con una reducción de los ingresos hospitalarios por cualquier causa a corto plazo (RR = 0,70; IC95%, 0,60-0,83) y una reducción del riesgo de hospitalización por IC (RR = 0,59; IC95%, 0,42-0,84). Finalmente, la rehabilitación cardiaca también mostró una mejoría clínica significativa en la calidad de vida de los pacientes con IC a corto plazo (medida mediante el Minnesota Living With Heart Failure questionnaire)33. En los análisis ajustados, estos efectos se mantuvieron independientemente de algunos aspectos relacionados con el ejercicio, como si se realiza en casa o en otro lugar, si forma parte de un programa de ejercicios estructurado o el tipo de ejercicio (aeróbico o aeróbico con resistencia). Esta revisión, sin embargo, debido a la gran variedad de tipos de ejercicio incluidos, no pudo demostrar que un tipo de ejercicio, formato o contexto donde realizarlo sea claramente superior a otro.
NutriciónUna de las recomendaciones incluidas en las guías de práctica clínica y los consensos hace referencia a una serie de actuaciones que incluyen comer saludablemente y evitar una ingesta excesiva de líquidos y sal (> 6 g/día)5.
En cuanto a la restricción de sal en la dieta, siempre ha habido cierta controversia sobre su eficacia en los pacientes con IC34,35. Recientemente se ha publicado una revisión sistemática de la literatura de calidad (registrada en PROSPERO)36, que analizó 9 ensayos clínicos de calidad poco clara (establecida mediante la herramienta Cochrane de evaluación del riesgo de sesgos), de 7 días a 6 meses de duración. Incluyeron a 479 pacientes con IC (ingresados y ambulatorios), con medias de edad entre los 54 y los 75 años, con diferentes características clínicas en cuanto a la FE o la clase funcional de la New York Heart Association (NYHA). Sin embargo, aunque se encontró una tendencia a la mejoría de los síntomas y signos de la IC, no se pudo obtener datos para emitir conclusiones robustas en relación con la eficacia de la restricción de sal en la mortalidad cardiovascular, la mortalidad por cualquier causa, las hospitalizaciones y la duración de la estancia hospitalaria.
Por otro lado, en relación con la dieta, una revisión sistemática y metanálisis de calidad (sigue las recomendaciones PRISMA) publicada en 2018 analizó el efecto de distintas dietas en pacientes adultos con IC37. Finalmente se incluyeron 4 ensayos clínicos aleatorizados, 5 estudios observacionales de cohortes y 3 estudios transversales de calidad moderada-buena (la calidad se analizó mediante un sistema de evaluación de sesgos en función del tipo de diseño). Analizó un total de 4.201 pacientes que seguían alguna (o varias) de las siguientes dietas: dieta DASH (Dietary Approaches to Stop Hypertension), dieta mediterránea, dieta baja en carbohidratos y dieta hiperproteica. Las poblaciones de los estudios fueron muy diversas y heterogéneas, lo que hace que los resultados deban contextualizarse. Hay estudios que específicamente incluyen a pacientes con IC y otros incluyeron diversos perfiles de pacientes. En cuanto a los comparadores (en aquellos que presentan un brazo comparador), estos son la dieta habitual u otra dieta concreta de las ya mencionadas. Muchos incluyen algún tipo de estrategia para fomentar y analizar la adherencia a las dietas, y el seguimiento de los pacientes varió entre 21 días y 4,6 años.
En relación con la dieta DASH, uno de los artículos incluidos es un estudio de cohortes prospectivo de buena calidad que incluyó a más de 3.000 mujeres posmenopáusicas con IC tras una mediana de seguimiento de 4,6 años; en el análisis multivariado, estimó una reducción estadísticamente significativa de la mortalidad por cualquier causa del 16% (hazard ratio [HR] = 0,84; IC95%, 0,70-1,00; p = 0,010). Por otro lado, en cuanto a la dieta mediterránea, en esta misma cohorte se estimó una reducción de la mortalidad por cualquier causa del 16% (HR = 0,85; IC95%, 0,70-1,02; p = 0,08), pero no fue estadísticamente significativa. Los datos relacionados con las dietas hiperproteica o baja en carbohidratos son muy preliminares y precisan de estudios de calidad metodológica para evaluar su eficacia en la IC.
AutocuidadoVarias revisiones sistemáticas de la literatura y metanálisis han puesto de manifiesto la eficacia de distintas estrategias de autocuidado en la IC38-41.
Una revisión sistemática y metanálisis reciente, de buena calidad, analizó la eficacia de las intervenciones dirigidas al autocuidado, comparadas con el cuidado habitual, en 20 ensayos clínicos aleatorizados que incluyeron en total a 5.624 pacientes con IC41. Cerca del 60% de los pacientes eran varones, con una media de edad próxima a los 70 años y una media de FE del 39,2%.
En cuanto a las intervenciones, la mayoría las impartían individualmente enfermeras especializadas, 2 de ellas lo hacían en grupo y 2 consistían en la gestión telefónica de casos. La duración de las intervenciones varió de las 2 semanas a los 18 meses. En cuanto a los programas dados en estas estrategias, se incluía (dependiendo del estudio) la monitorización de síntomas y signos de la IC, la mejora de la capacidad para resolver problemas, la adherencia al tratamiento, la actividad física, la dieta o el cese del hábito tabáquico. Dos de los ensayos incluían además estrategias de refuerzo formativo.
El metanálisis mostró que la implementación de estrategias de autocuidado, en comparación con el cuidado habitual, reduce el tiempo hasta una variable compuesta de hospitalizaciones por IC o muerte por cualquier causa (HR = 0,80; IC95%, 0,71-0,89) y el tiempo hasta una hospitalización por IC (HR = 0,80; IC95%, 0,69-0,92) y mejora la calidad de vida a los 12 meses (diferencia media estandarizada, 0,15; IC95%, 0,00-0,30).
Este mismo grupo analizó en otra publicación si alguna característica concreta de los programas de estas estrategias de autocuidado se asociaba con mejores resultados. Sin embargo, ninguna característica concreta se asoció con mejores resultados de una manera constante, salvo una mayor duración de la intervención, que disminuyó de manera significativa la mortalidad, la hospitalización por cualquier causa a los 6 meses y la hospitalización por IC.
Puntos que considerar y recomendacionesEl papel de enfermería en la atención a los pacientes con IC se centra en:
- 1.
La información y la formación sanitaria orientada al autocuidado.
- 2.
La detección precoz de signos de descompensación y su abordaje.
- 3.
La promoción de hábitos de vida adecuados (alimentación equilibrada, restricción salina e intervención antitabaco si procede).
- 4.
La elaboración de planes de cuidados según las necesidades de cada individuo.
- 5.
El asesoramiento ante dudas y dificultades del paciente y su familia.
- 6.
El apoyo emocional para el mejor afrontamiento de la enfermedad y la posible pérdida de funcionalidad.
Con la información y la formación sanitaria, el paciente y la familia aprenderán que el control de la enfermedad incluye cambios que se refieren al tratamiento farmacológico, los hábitos y el estilo de vida, la alimentación y el ejercicio físico.
Otra función importante es la detección precoz de los síntomas y signos de descompensación de la IC, que se describe en la tabla 3.
Síntomas y signos que evaluar para la detección precoz de una descompensación
| 1 | Ganancia de peso rápida: 2 kg/3 días o 3 kg/semana |
| 2 | Edemas de pies, tobillo o piernas |
| 3 | Disminución de la cantidad de orina |
| 4 | Disnea con menor esfuerzo o en reposo |
| 5 | Ortopnea o necesidad de aumentar el número de almohadas para dormir |
| 6 | Tos irritativa y persistente (sobre todo acostado) |
| 7 | Dolor en el pecho, palpitaciones |
| 8 | Cansancio intenso |
| 9 | Mareos, pérdida de conocimiento |
En cuanto a la promoción de hábitos y estilos de vida saludables, un tema importante que tratar es la dieta. En este sentido recomendamos una serie de pautas que se han demostrado beneficiosas para los pacientes con IC (tabla 4)34,35,37.
Recomendaciones sobre la dieta
| 1 | Seguir una dieta equilibrada y mantener un peso saludable |
| 2 | Promover la modificación de hábitos dietéticos que favorezcan el incremento de la ingesta de frutas, verduras, cereales, legumbres y pescado azul reduciendo el consumo de grasas saturadas y alimentos con alto contenido en colesterol |
| 3 | La restricción de sodio puede ayudar a controlar los síntomas y signos de congestión en pacientes con IC sintomática en NYHA III-IV |
| 4 | Evitar el consumo excesivo de líquidos; para aliviar los síntomas y la congestión, se puede considerar la restricción de líquidos a 1,5-2 l/día a los pacientes con IC grave |
| 4 | Consumo moderado de alcohol: se recomienda la abstinencia a los pacientes con miocardiopatía inducida por el alcohol |
| 5 | Promover el abandono del tabaco |
IC: insuficiencia cardiaca; NYHA: clase funcional de la New York Heart Association.
La actividad física es una parte importante del plan terapéutico de los pacientes con IC; se debe adaptar en todo momento en función de la capacidad de la persona y su situación clínica. En la tabla 5 se propone una serie de recomendaciones33.
Recomendaciones sobre el ejercicio
| 1 | El ejercicio físico moderado (caminar o montar en bicicleta, subir escaleras, nadar en agua templada) hará que se encuentre mejor y pueda hacer una vida con menos limitaciones |
| 2 | En general se desaconseja el reposo absoluto o dejar cualquier actividad física |
| 3 | Caminar a buen ritmo es un excelente entrenamiento. Empiece lento y aumente progresivamente la distancia y la intensidad. Puede ir aumentando de manera progresiva y en función de sus capacidades hasta conseguir andar 30-40 min al menos 5 veces por semana |
| 4 | Existen actividades de fuerza que se pueden realizar con brazos o piernas y, si se realizan con regularidad, mejoran la capacidad funcional y aumentan la fuerza muscular y la tolerancia al ejercicio y favorecen la realización de tareas cotidianas. Entre estas actividades se encuentran los ejercicios con bandas elásticas o pesas/lastres |
| 5 | Tras el ejercicio, realización de estiramientos suaves de cada uno de los principales grupos musculares implicados en el ejercicio |
| 6 | Evitar temperaturas extremas (calor o frío intensos) |
Por otro lado, recomendamos la elaboración de planes de cuidados según las necesidades del paciente. Estos tienen como objetivo ayudar al individuo a llevar a cabo y mantener, por sí solo, acciones de autocuidado para conservar la salud y la vida, recuperarse de la enfermedad y afrontar las consecuencias de esta38-41.
En la formación del paciente, el asesoramiento ante posibles dudas del paciente y su familia es fundamental29,32. La ET del paciente con IC debe abordarse desde consultas programadas del profesional de enfermería de referencia. El acceso a los profesionales, tanto telefónico como en el centro de salud, facilitará este aspecto. Una herramienta que puede ser de utilidad para explorar conocimientos y dificultades en la gestión de la salud es la escala europea de autocuidado en IC (European Heart Failure Self-care Behaviour scale)42.
Asimismo hablar con enfermería puede dar al paciente información sobre apoyo emocional y social para mejorar el afrontamiento de la enfermedad y la posible pérdida de funcionalidad.
ResumenSe muestra, a continuación, un resumen de los puntos más destacados de lo expuesto anteriormente20,25,29-32:
- 1.
La responsabilidad de la formación de los pacientes recae en todos los profesionales de la salud implicados en su cuidado, pero especialmente en enfermería.
- 2.
La formación del paciente con IC incluye información sobre la enfermedad y su tratamiento, la dieta, el ejercicio, el autocuidado, el afrontamiento de la enfermedad, la adherencia y estrategias para evaluarla y fomentarla o la promoción de un estilo de vida saludable (dieta, ejercicio, etc.).
- 3.
Se debe establecer programas formativos desde el diagnóstico de la IC y durante el curso de la enfermedad, adaptados a las características y las necesidades del paciente y su entorno (incluidos los familiares/cuidadores).
- 4.
Emplear instrumentos que puedan facilitar la formación, como la entrevista motivacional, y considerar los recursos disponibles en cada centro.
Muchos pacientes con IC son atendidos por diferentes profesionales de la salud y en distintos niveles asistenciales. Entre ellos pueden encontrarse los cardiólogos, médicos internistas, geriatras, enfermeras, médicos de atención primaria, rehabilitadores, psicólogos, etc. Sin embargo, la fragmentación en la atención de los pacientes por una misma enfermedad puede dificultar una visión y una planificación correctas, sobre todo a largo plazo, lo que a su vez puede afectar al pronóstico y la calidad de vida del paciente, así como a los resultados del propio sistema sanitario. Esto puede llevar, por ejemplo, a duplicidades en la solicitud de pruebas diagnósticas o a tratamientos que no se pauten desde un punto de vista holístico del paciente, lo que pone en riesgo la seguridad del mismo5,28,43.
La guía para el tratamiento de la IC de 2016 y un reciente documento de consenso de la ESC5,28 establecen que el objetivo en el tratamiento del paciente con IC es proporcionar una atención sanitaria «perfecta» que englobe la atención hospitalaria y ambulatoria a través de la denominada ruta asistencial de la IC. Para ello se recomienda que la atención al paciente con IC se organice a través de programas multidisciplinares. Estos se han demostrado muy eficaces a la hora de disminuir la mortalidad y la hospitalización por IC26,27,44,45. Los programas multidisciplinares, a su vez, se basan en la coordinación asistencial, la transferencia de información y la integración de servicios (médicos y no médicos) y de niveles asistenciales.
Como también se refleja en las guías, son igualmente muy relevantes los aspectos locales y organizativos de cada sistema sanitario, que también se deberán tener en cuenta en esta atención multidisciplinar al paciente con IC.
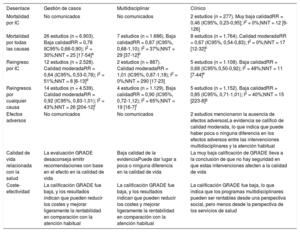
EvidenciaCardiología-AP-atención especializadaEn 2016 se publicó una propuesta conjunta de la SEC y la Sociedad Española de Medicina Interna (SEMI) para la organización compartida de nuevos modelos de atención al paciente con IC, que incluye las unidades de IC y las denominadas UMIPIC (Unidad de Manejo Integral del Paciente con Insuficiencia Cardiaca). Los equipos multidisciplinares deben estar formados al menos por los especialistas que se detallan en la tabla 646. Este documento igualmente reconoce el papel fundamental de enfermería y la coordinación funcional con AP.
Profesionales implicados en los equipos multidisciplinares
| Cardiólogo con formación avanzada en IC |
| Internista con formación avanzada en IC |
| Representante de los médicos de atención primaria del ámbito de influencia del hospital |
| Enfermera con experiencia en IC |
| Psicólogo clínico |
| Especialista en endocrinología y nutrición |
| Médico experto en cuidados paliativos |
| Farmacólogo clínico (se recomienda) |
IC: insuficiencia cardiaca. Tabla elaborada con datos de la Propuesta conjunta SEC-SEMI para la organización compartida de nuevos modelos de atención al paciente con insuficiencia cardiaca46.
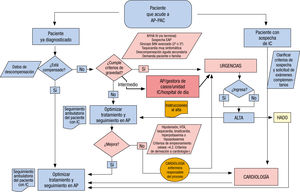
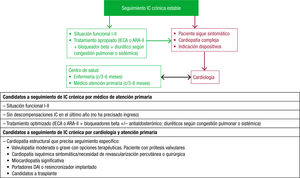
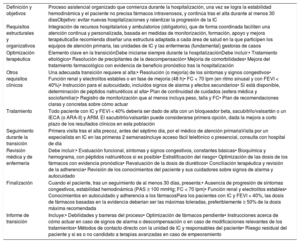
Por otro lado, también en 2017 se publicó un documento colaborativo entre la SEC y AP sobre el proceso de la IC47. Este parte desde la sospecha diagnóstica, donde ya se establece el primer circuito asistencial multidisciplinar (figura 1 y figura 2). Además de este primer contexto, se propone otro para el seguimiento (figura 3), en el que la atención multidisciplinar dependerá de las características del paciente, la IC, los recursos y los aspectos organizativos locales, etc.
Algoritmo de sospecha diagnóstica de IC según la Sociedad Española de Cardiología en colaboración con atención primaria (2017) (adaptado de SEC-Primaria4). BNP: péptido natriurético cerebral; HTA: hipertensión arterial; IC: insuficiencia cardiaca; NT-proBNP: fracción aminoterminal del propéptido natriurético cerebral.
Algoritmo de actuación con los pacientes con sospecha de IC47. AP: atención primaria; EAP: enfermedad arterial periférica; FA: fibrilación auricular; HADO: ; HTA: hipertensión arterial; IC: insuficiencia cardiaca; NYHA: clase funcional de la New York Heart Association.
Atención multidisciplinar del paciente con IC crónica estable47. ARA-II: antagonistas del receptor de la angiotensina II; DAI: desfibrilador automático implantable; IC: insuficiencia cardiaca; IECA: inhibidores de la enzima de conversión de la angiotensina.
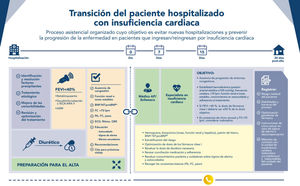
Otra situación clínica muy relevante, y en la que la atención multidisciplinar es fundamental, es la transición tras el alta hospitalaria (véase la sección 7 «Transición al alta hospitalaria»)48.
Por otro lado, estos documentos también señalan el establecimiento de flujos de pacientes entre cardiología y AP y de responsabilidades en su tratamiento, que dependerán de distintos aspectos de la enfermedad y de las características del paciente (tabla 7)47.
Responsables y actuaciones en el seguimiento de la insuficiencia cardiaca
| Procedimiento | ¿Quién? | Comentarios |
|---|---|---|
| IC de novo: diagnóstico, etiología y pronóstico | Cardiología | Al menos una vez evaluado por cardiología |
| Formación | Cardiología/atención primaria | Compartir materiales educativosReforzar mensajes uniformes |
| Ajustar tratamiento | Cardiología/atención primaria | Protocolos de ajuste de dosisConsulta no presencial |
| Seguimiento crónicoCrónico estableCrónico complejoAjuste de tratamiento | Atención primariaAtención primaria + cardiologíaAtención primaria/cardiología | Cada 3-6 meses (antes si hay inestabilidad clínica) |
| Posterior ingreso-urgencias | Atención primaria < 10 díasCardiología < 30 días | Conciliación de la medicaciónComorbilidad |
IC: insuficiencia cardiaca. Tabla elaborada con datos de la comunicación/relación entre Atención Primaria y Cardiología47.
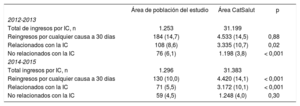
Una revisión Cochrane de 2019 (calidad alta, pero basada en estudios de calidad moderada-baja, I B) comparó los efectos de distintas intervenciones en IC con la atención habitual en términos de mortalidad, reingresos hospitalarios, calidad de vida y coste-efectividad45 y actualiza una revisión de 2012 (47 estudios y 10.869 pacientes).
Las intervenciones descritas en los artículos podrían clasificarse como:
- •
Variaciones del modelo de gestión de casos (28 estudios).
- •
Modelos multidisciplinares (9 estudios, con 1 en un hospital geriátrico de día).
- •
Modelos de intervención basados en la clínica (7 estudios).
- •
Difíciles de clasificar: un hospital de día con un programa de tratamiento de la IC, una intervención de apoyo educativo y psicológico y una intervención de apoyo al autocuidado.
En cuanto a la persona clave que realizó la intervención, esta fue una enfermera especializada en 19 de los estudios, un farmacéutico en 3 estudios y una enfermera no especializada o de AP en 11. En 13 de los estudios, parece que realizaron la intervención 2 o más profesionales, aunque no eran modelos estrictamente multidisciplinares. En un caso la intervención fue por un cardiólogo y otro describe al coordinador de la investigación como responsable de la entrega de la intervención.
En cuanto a los componentes de las intervenciones:
- •
Seguimiento telefónico (n = 40).
- •
Formación de los participantes y, en algunos casos, los cuidadores (n = 31) sobre el diagnóstico, los síntomas y el tratamiento de la IC y cuándo solicitar ayuda experta.
- •
Autocuidados (n = 33), incluidos diarios o cuadernos de IC.
- •
Control de peso (n = 30), sobre todo mediante gráficos o diarios.
- •
Restricción de sodio, consejos dietéticos o ambos (n = 31), a menudo a cargo de una enfermera a domicilio.
- •
Recomendación de ejercicios (n = 23).
- •
Revisión de medicamentos (n = 25).
- •
Apoyo social y psicológico (n = 10).
La evidencia se muestra por desenlace y modelo de atención en la tabla 8.
Resultados del metanálisis sobre distintos modelos de cuidados
| Desenlace | Gestión de casos | Multidisciplinar | Clínico |
|---|---|---|---|
| Mortalidad por IC | No comunicados | No comunicados | 2 estudios (n = 277). Muy baja calidadRR = 0,46 (IC95%, 0,23-0,95]; I2 = 0%;NNT = 12 [9-126] |
| Mortalidad por todas las causas | 26 estudios (n = 6.903). Baja calidadRR = 0,78 IIC95% 0,68-0,90); I2 = 30%;NNT = 25 [17-54]a | 7 estudios (n = 1.686). Baja calidadRR = 0,87 (IC95%, 0,68-1,10); I2 = 37%;NNT = 29 [37-12]b | 8 estudios (n = 1.764). Calidad moderadaRR = 0,67 (IC95%, 0,54-0,83); I2 = 0%;NNT = 17 [12-32]c |
| Reingreso por IC | 12 estudios (n = 2.528). Calidad moderadaRR = 0,64 (IC95%, 0,53-0,78); I2 = 51%;NNT = 8 [6-13]d | 2 estudios (n = 887). Calidad moderadaRR = 1,01 (IC95%, 0,87-1,18); I2 = 0%;NNT = 290 [17-23] | 5 estudios (n = 1.108). Baja calidadRR = 0,68 (IC95% 0,50-0,92); I2 = 48%;NNT = 11 [7-44]e |
| Reingresos por cualquier causa | 14 estudios (n = 4.539). Calidad moderadaRR = 0,92 (IC95%, 0,83-1,01); I2 = 43%;NNT = 26 [204-12]f | 4 estudios (n = 1.129). Baja calidadRR = 0,90 (IC95%, 0,72-1,12); I2 = 65%;NNT = 19 [16-7]f | 5 estudios (n = 1.152). Baja calidadRR = 0,85 (IC95%, 0,71-1,01); I2 = 40%;NNT = 15 [223-8]g |
| Efectos adversos | No comunicados | No comunicados | 2 estudios mencionaron la ausencia de efectos adversosLa evidencia se calificó de calidad moderada, lo que indica que puede haber poca o ninguna diferencia en los efectos adversos entre las intervenciones multidisciplinares y la atención habitual |
| Calidad de vida relacionada con la salud | La evaluación GRADE desaconseja emitir recomendaciones con base en el efecto en la calidad de vida | Baja calidad de la evidenciaPuede dar lugar a poca o ninguna diferencia en la calidad de vida | La muy baja calificación de GRADE lleva a la conclusión de que no hay seguridad en que estas intervenciones afecten a la calidad de vida |
| Coste-efectividad | La calificación GRADE fue baja, y los resultados indican que pueden reducir los costes y mejorar ligeramente la rentabilidad en comparación con la atención habitual | La calificación GRADE fue baja, y los resultados indican que pueden reducir los costes y mejorar ligeramente la rentabilidad en comparación con la atención habitual | La calificación GRADE fue baja, lo que indica que los programas multidisciplinares pueden ser rentables desde una perspectiva social, pero menos desde la perspectiva de los servicios de salud |
NNT: número de pacientes necesario que tratar para evitar un episodio.
hNo hubo diferencias por duración del seguimiento (p = 0,98). No se pudo hacer análisis de sensibilidad (solo 1 estudio con bajo sesgo).
No hubo diferencias entre subgrupos en la duración del seguimiento y la persona que realizó la intervención; en una análisis de sensibilidad con los estudios de mejor calidad, el efecto es mayor. La metarregresión indicó que ninguna intervención individual se asocia particularmente con el éxito. Podría existir algún sesgo de publicación, por lo que se redujo la calidad de la evidencia.
Sin diferencias por duración del seguimiento (p = 0,38) o por la persona que realiza la intervención (p = 0,17). El análisis de sensibilidad limitado a estudios con bajo riesgo de sesgo dio un resultado diferente (RR = 0,65; IC95%, 0,23-1,88; n = 296; I2 = 82%).
No hubo heterogeneidad ni diferencias por duración del seguimiento. El análisis de sensibilidad con estudios con bajo riesgo de sesgo dio resultados no concluyentes (RR = 0,65; IC95%, 0,34-1,25; n = 342; en 2 estudios = 2; I2 = 0%).
El análisis por duración del seguimiento no indicó diferencias (p = 0,33), pero la persona que realizó la intervención sí (p = 0,002), a favor de la gestión de casos por una enfermera especializada (RR = 0,58; IC95%, 0,47-0,70) o por un cardiólogo. El análisis de sensibilidad en estudios con bajo riesgo de sesgo tuvo un efecto similar al del análisis principal (RR = 0,62; IC95%, 0,50-0,77). Podría existir algún sesgo de publicación. En la metarregresión se observa que el componente educativo se asocia con no reingreso.
Sin diferencias por seguimiento (p = 0,13). No se pudo realizar un análisis de sensibilidad (solo 1 con bajo riesgo de sesgo).
No hubo diferencias por tiempo de seguimiento (p = 0,19), pero sí según quién realizó la intervención (p = 0,09). Si se trataba de una enfermera especializada, el RR = 0,85 (IC95%, 0,73-0,99) y en 1 estudio en el que fue un farmacéutico, RR = 0,68 (IC95%, 0,45-1,03). El análisis de sensibilidad restringido a estudios con bajo riesgo de sesgo fue similar (RR = 0,87; IC95%, 0,74-1,02). La metarregresión indicó que el único componente que mostró alguna repercusión particular en el riesgo relativo fue el tratamiento del peso, en el que fue mayor (RR = 1,32; IC95%, 1,09-1,60; p = 0,008). No se indica sesgo de publicación.
Los principales especialistas en la atención multidisciplinar del paciente con IC deben ser de cardiología, medicina interna, AP y urgencias, todos ellos trabajando junto con enfermería. En algunos casos, podrán apoyar el tratamiento de estos pacientes especialidades como geriatría o nefrología. Por último, será de gran importancia contar con los especialistas de urgencias hospitalarias, que deben estar informados de la existencia de la unidad y conocer los criterios de ingreso hospitalario o derivación a la consulta para evitar ingresos hospitalarios. Para actuar de nexo entre las especialidades médicas y los pacientes, será de gran importancia la existencia de un o una responsable de enfermería que centralice la asistencia y pueda dar respuesta rápida a los problemas de estos pacientes.
Implicados y responsablesEn la mayor parte de las circunstancias asistenciales, la unidad debe ser coordinada por cardiología, trabajando de manera cercana y coordinada con urgencias, medicina interna y AP. La enfermera que trabaje en la unidad deberá ser el nexo entre especialidades (incluida la AP) y la persona de contacto para los pacientes. También será parte esencial en la formación sanitaria del paciente y sus cuidadores. Deberá estar disponible para solventar dudas sobre la enfermedad o los distintos tratamientos de los pacientes.
Es importante que se defina a qué pacientes se atenderá fundamentalmente en cardiología y en medicina interna. En términos generales, en cardiología se debe llevar la iniciativa en el diagnóstico y el abordaje inicial. Tras este y una vez se descarte la necesidad de procedimientos invasivos, se definirá, con base en las características del paciente y los recursos disponibles, a qué pacientes se podrá seguir en otros servicios como medicina interna o incluso geriatría.
En la atención ambulatoria, será crucial la ayuda del médico de AP ya que, a través de la coordinación de la enfermera de la unidad, si el paciente necesita una valoración médica ambulatoria, será el médico de AP quien la lleve a cabo y proceda a ajustar tratamientos y participar en la formación sanitaria del paciente y sus cuidadores.
El servicio de nefrología apoyará a la unidad tratando el deterioro de la función renal de estos pacientes y planteando técnicas de filtrado para los casos en que sea conveniente.
La implicación del servicio de urgencias será de gran importancia para evitar ingresos innecesarios. Desde el propio servicio de urgencias se deberá tener protocolos de actuación para el tratamiento agudo de los pacientes conocidos y diagnosticados, encaminados a evitar el ingreso.
Por último, el servicio de análisis clínico es parte importante en el diagnóstico, especialmente por el papel de los PN. En este sentido, será de gran importancia en el diagnóstico del paciente ambulatorio que consulta por disnea.
ObjetivosEn la tabla 9 se muestran los objetivos de las unidades de IC.
Objetivos de las unidades de insuficiencia cardiaca
| 1 | General: mejorar la atención integral de los pacientes con insuficiencia cardiaca |
| 2 | Específicos: |
| • Disminución de la morbimortalidad | |
| • Disminución de la tasa de reingresos | |
| • Disminución de la variabilidad asistencial | |
| • Mejorar el tratamiento de los pacientes impulsando la adecuación a las guías de práctica clínica | |
| • Evitar la duplicidad de consultas y pruebas complementarias | |
| • Optimizar el uso de recursos y mejorar la continuidad asistencial y la coordinación multidisciplinar |
- 1.
Se precisa de coordinación, comunicación entre especialidades y niveles asistenciales. Para ello la enfermera coordinadora de la unidad será de gran importancia.
- 2.
Se precisa el compromiso de todas las partes implicadas.
- 3.
El seguimiento de los pacientes ingresados debe comenzar con el alta hospitalaria. Siguiendo las recomendaciones del Decálogo sobre la transición del paciente hospitalizado con IC48 (véase «Transición al alta hospitalaria»).
- 4.
Protocolizar flujos y criterios.
Se puede definir una serie de criterios de entrada y salida de la unidad de IC, así como criterios de tratamiento prioritario por medicina interna (tabla 10).
Criterios de entrada y salida de las unidades de insuficiencia cardiaca y de tratamiento prioritario por medicina interna
| Criterios de entrada |
| Pacientes con insuficiencia cardiaca de reciente diagnóstico |
| • Si en su seguimiento habitual no se va a poder optimizar adecuadamente el tratamiento |
| • Presencia de comorbilidades que puedan dificultar el tratamiento del paciente (insuficiencia renal, etc.) |
| Pacientes con insuficiencia cardiaca ya conocida |
| • Dos o más ingresos en el último año |
| • Resistencia a diuréticos |
| • Progresión de clase funcional |
| • Pacientes sintomáticos pese al tratamiento |
| • Otras dificultades en el seguimiento como, por ejemplo, necesidad de tratamiento intravenoso ocasional |
| Criterios de salida |
| Muerte |
| Ausencia ingresos hospitalarios durante 2 años y posibilidad de seguimiento en atención primaria |
| Traslado a otra área sanitaria |
| Decisión del paciente o, si este no fuese capaz, de sus familiares de no seguir el tratamiento y los controles |
| Criterios de tratamiento prioritario por medicina interna |
| Comorbilidad que dificulta el tratamiento óptimo y la estabilización del paciente (puntuación en la escala de Charlson modificada ≥ 4 y sin tener en cuenta el diagnóstico de insuficiencia cardiaca como criterio) |
| Ausencia de seguimiento estrecho en cardiología y de necesidad de procedimientos diagnósticos o terapéuticos en cardiología |
Estos deben individualizarse en función de las características del paciente, la estratificación del riesgo y la gravedad de la IC (leve, grave, terminal) y de la adaptación a la organización local.
ResumenSe muestra, a continuación, un resumen de los puntos más destacados de lo expuesto anteriormente5,28,43,46,47:
- 1.
La atención multidisciplinar es fundamental en el tratamiento del paciente con IC.
- 2.
Establecimiento de objetivos, implicados, sus responsabilidades y flujos de pacientes (dependiendo de sus características y la organización local).
- 3.
Coordinación por cardiología con los servicios de urgencias, medicina interna, AP, etc.
- 4.
Participación de distintos profesionales de la salud, entre ellos médicos especialistas, de AP, enfermeros, psicólogos, etc.
Al igual que en otras enfermedades crónicas, la mala adherencia al tratamiento en la IC es un problema muy relevante. La tasa de falta de adherencia es variable, pero se ha descrito que puede ser incluso > 50% de los pacientes, y afecta a todas las medicaciones para la IC49-52.
Una deficiente adhesión al tratamiento es un problema que limita la eficacia terapéutica, conlleva un empeoramiento de los síntomas y, a menudo, la necesidad de hospitalización. Además, se ha asociado con mayor riesgo de mortalidad por cualquier causa50. Por ello es necesario que los profesionales sanitarios estén sensibilizados acerca de la necesidad de controlar el grado de cumplimiento de los regímenes terapéuticos de sus pacientes. Así, en cada visita de seguimiento enfermería debe valorar la adherencia de todos los pacientes.
Las causas más reconocidas del incumplimiento farmacológico son: el olvido involuntario, la falta de conocimientos, la aparición de efectos adversos y la escasez de apoyo social. Y siempre que un paciente no responda a un tratamiento correctamente prescrito se debe valorar también la posibilidad de un mal cumplimiento terapéutico.
La falta de adherencia no solo se refiere al tratamiento en general, sino en mayor medida a la modificación de estilos de vida y hábitos saludables, que suelen tener peor cumplimiento.
EvidenciaFactores asociados con la mala adherencia al tratamiento y el ejercicio: barreras y facilitadoresSon múltiples los factores asociados con la mala adherencia al tratamiento de los pacientes con IC. En la tabla 11 se resumen los resultados de una revisión sistemática de la literatura (algunos contradictorios) sobre los análisis multivariados de los 15 estudios incluidos53, así como de otros estudios individuales52,54.
Factores asociados con la falta de adherencia en la insuficiencia cardiaca
| Relacionados con: | Asociados con peor adherencia | Asociados con mejor adherencia |
|---|---|---|
| El paciente | MujeresHombresRaza: minorías, no blancos, afroamericanosFalta de atenciónSomnolencia diurna excesiva (con o sin deterioro cognitivo leve)Visión negativa de la medicaciónPoca implicación en las decisiones terapéuticas | Mayores de 65 añosMujeresMayor nivel educativoPacientes motivados |
| La IC u otras afecciones | Mayor gravedad de la ICMayor frecuencia cardiacaMayor número de comorbilidadesDepresiónPeor función renal o diálisisTabaquismoHospitalización previa por cualquier causa en los 6 meses tras el alta de la hospitalización por IC | Hospitalización previa por IC |
| La medicación | Mayor frecuencia de tomas (al menos 2 veces al día)Mayor número de medicamentos (> 5)Uso de fármacos antiarrítmicosCambios en la rutina diaria del paciente para acomodar el esquema de tratamiento | Toma previa del mismo tipo de medicaciónToma concurrente de medicaciones cardiacasToma concurrente de otras medicacionesMayor conocimiento del paciente sobre la correcta dosificación de los tratamientosMenor número de eventos adversos |
| Factores socioeconómicos | Vivir soloBajo nivel de ingresosBajo apoyo socialSin seguro médico | Con formación/conocimientos sobre la enfermedadSaber leerCasados |
| Sistema sanitario | Mayor copago sanitario |
Tabla elaborada con datos de Davis et al53.
Una revisión sistemática de la literatura y metanálisis de gran calidad, publicada en 2016, analizó la eficacia de distintas intervenciones encaminadas a mejorar la adherencia al tratamiento en la IC en cuanto a mejora en la mortalidad y los reingresos hospitalarios55. También se ha publicado otra revisión sistemática de la literatura y metanálisis (en este caso de la Cochrane Collaboration) de excelente calidad sobre las intervenciones dirigidas a incrementar el uso (comienzo, adherencia y cumplimiento) de la rehabilitación cardiaca56. Ambas incluyen muchas intervenciones distintas, por lo que, aunque se resumen sus características, se recomienda acudir a los artículos originales para consultar detalles en profundidad.
En la primera revisión sistemática (que siguió las recomendaciones PRISMA), se analizó un total de 57 ensayos clínicos de calidad moderada-buena en general (definida mediante la evaluación del riesgo de sesgos)55.
Los estudios incluidos fueron muy variables en cuanto a diseño, tipo, contenido y duración de la intervención, el profesional que intervino, el contexto en el que se implementó, la población a la que se dirigía o el modo de evaluar y medir la adherencia. En la mayoría de ellos se comparaba una intervención específica con el cuidado habitual del paciente con IC.
En cuanto a la población, la media de edad era 70 (44-80) años. La proporción de mujeres varió del 1 al 100%. En cuanto al tipo de IC, en muchos casos no se describe, pero cuando sí lo está, la mayoría de los pacientes presentaban IC-FEr.
El tipo y el contenido de la intervención en general estaban bien descritos, no así su duración. La inmensa mayoría de los estudios incluían información sobre la medicación (n = 50) y formación sobre la enfermedad (n = 48). Otras 11 intervenciones también trataron de incorporar de alguna manera estrategias para mejorar el autocuidado. Por otro lado, al menos 8 estudios incluían estrategias relacionadas con la monitorización de la adherencia al tratamiento, por ejemplo, mediante diarios. Finalmente, todos los estudios, a excepción de 4, utilizaban varias estrategias para incrementar la adherencia.
Las intervenciones se llevaron a cabo por distintos profesionales de la salud, sobre todo enfermeras, aunque también farmacéuticos, equipos mixtos de enfermeras y médicos o enfermeras con farmacéuticos, y educadores de salud. Sin embargo, en algunos estudios no se especificaba quién era el responsable de realizarla. La mayoría incluía a más de un profesional, y solo en 4 estudios el médico habitual del paciente practicó la intervención. Por otro lado, en cuanto al momento o contexto, estas intervenciones se realizaron durante la hospitalización del paciente, tras el alta hospitalaria o en el contexto ambulatorio.
Al menos 52 de las intervenciones incluían una parte presencial con el responsable de realizar la intervención. Solo 28 estudios describieron en detalle el número de sesiones que incluía la intervención (de 1 a 52) y 6, la duración de cada sesión (de 10 min a 2 h). En cuanto a su duración, esta varió desde intervenciones de un único día a otras de hasta 901 días. Casi todas las intervenciones incorporaban algún tipo de interacción verbal con el responsable, y 38 de ellas se realizaron al menos parcialmente por teléfono; otros utilizaron la telemedicina, el envío de mensajes por teléfono, formatos electrónicos diversos, vídeos o el correo postal.
Los resultados de los metanálisis muestran que, en pacientes con IC, las intervenciones encaminadas a mejorar la adherencia al tratamiento en general, comparadas con el cuidado habitual, disminuyen el riesgo de mortalidad en un 10,6% (RR = 0,89; IC95%, 0,81-99). La heterogeneidad de este análisis fue moderada y estadísticamente significativa, así que se realizó un análisis de sensibilidad en el que se eliminaron 2 estudios de baja calidad con mucho efecto residual. Tras ello, la heterogeneidad prácticamente desapareció y se mantuvo la eficacia de la intervención.
Se observó un resultado muy similar en relación con el riesgo de nuevas hospitalizaciones (OR = 0,79; IC95%, 0,71-0,89). De nuevo, la heterogeneidad fue moderada, pero con el análisis de sensibilidad, al igual que en el caso anterior, prácticamente desapareció sin que se viese afectado el efecto de la intervención.
Al analizar los componentes de las distintas intervenciones, solo encontraron diferencias en la inclusión de la automonitorización, que se asoció con un menor riesgo de reingreso en comparación con las intervenciones que no lo incluían (OR = 0,76 frente a OR = 1,03; p = 0,016).
En relación con la revisión sistemática de la literatura y metanálisis publicada en 2019 sobre intervenciones para promocionar el uso de la rehabilitación cardiaca56, se analizaron 26 ensayos clínicos aleatorizados (de calidad variable según una evaluación del riesgo de sesgos) que incluyeron a 5.299 pacientes con distintas enfermedades cardiacas, incluida la IC. Muchos de los estudios incluían, por lo tanto, a poblaciones de pacientes mixtas, y no siempre fue posible saber cuántos tenían IC. Esto hace que se deba utilizar con cautela los resultados que se exponen pues, aunque los autores realizan múltiples análisis en los que la presencia o ausencia de IC no parece que influya, no se puede descartar un efecto real.
Las intervenciones analizadas se dirigen a incrementar la participación, la adherencia al programa de rehabilitación cardiaca y su cumplimiento en su totalidad. Los programas de rehabilitación cardiaca en general están bien descritos. En estos estudios las distintas intervenciones se comparan sobre todo con el cuidado habitual del paciente, aunque hay algún estudio que compara 2 o hasta 3 intervenciones distintas.
Muchas de ellas se basaron en el contacto de un profesional sanitario con el paciente durante, o poco tiempo después de un ingreso hospitalario. Por ejemplo, mediante llamadas telefónicas estructuradas, visitas domiciliarias, intervenciones mixtas que incluían llamadas y entrevistas presenciales, etc. Es decir, mediante un contacto verbal presencial o telefónico. También se incluyeron estudios en los que la intervención se desarrolla durante la rehabilitación cardiaca, por ejemplo, mediante llamadas telefónicas para conocer la adherencia, proporcionar recordatorios, etc. Aunque en la mayoría de estudios las intervenciones estaban realizadas por enfermeras, también las realizaron otros profesionales sanitarios como médicos o terapeutas ocupacionales.
En 15 de estos estudios, las intervenciones estaban basadas en teorías encaminadas al cambio del comportamiento (entrevista motivacional, etc.) o en la teoría cognitivo-social. En 8 estudios la intervención se ofrecía para una rehabilitación cardiaca sin supervisión (p. ej., a distancia). También muchos estudios incorporaban estrategias relacionadas con la formación del paciente (sobre los beneficios de la intervención y sobre la enfermedad de base). En general, estas intervenciones para incrementar el uso de la rehabilitación cardiaca consistieron en una media de 14 a 32 contactos diferentes. Estaban dirigidas a pacientes con una enfermedad cardiaca (la mayoría), aunque en algún estudio concreto se aplicaron a familiares o grupos de pacientes, y en la mitad de los estudios se implementaron antes de la rehabilitación cardiaca.
Destaca el resultado en cuanto a la finalización de los programas de rehabilitación cardiaca de forma completa. En base a una calidad de la evidencia moderada, se encontró que las intervenciones incluidas en el estudio también tenían un efecto positivo en comparación con el cuidado habitual del paciente con enfermedad cardiaca (RR = 1,13; IC95%, 1,02-1,25). La heterogeneidad fue moderada y en el análisis de subgrupos solo las intervenciones realizadas en un único sitio, frente a las realizadas en varios a la vez, resultaron más eficaces a la hora de conseguir que se finalicen los programas de rehabilitación cardiaca.
Puntos que considerar y recomendacionesUn primer paso es detectar un caso de posible mala adherencia. Para evaluarla existen métodos directos e indirectos. Un ejemplo de método directo es la medición de la concentración del fármaco, aunque en general es caro y no se suele recomendar. En cuanto a los métodos indirectos, estos incluyen cuestionarios al paciente (test de Haynes57, cuestionario de Morisky-Green58), recuentos de comprimidos, los diarios de medicación o la monitorización electrónica.
Por otro lado, no hay ninguna intervención que haya demostrado una evidencia concluyente para mejorar la adherencia al plan terapéutico, aunque sí parece confirmarse que lo más efectivo es la combinación de varias estrategias y la individualización de cada paciente55,56.
En la tabla 12 se describe una serie de estrategias generales para promover la adherencia.
Estrategias para mejorar la adherencia
| No culpabilizar al paciente y evitar la intimidación |
| Indagar creencias y expectativas |
| Establecer buena relación profesional-paciente |
| Modelo de atención centrado en el paciente |
| Aceptar que el paciente es quien decide |
| Implicar al paciente en la toma de decisiones |
| Lograr apoyo familiar/social |
| Adaptar el tratamiento a sus rutinas |
| Reducción de la complejidad del tratamiento (frecuencia, número de fármacos) |
| Recordatorios de los horarios (teléfono, mensajes, alarmas, pastilleros), ligar la toma a una actividad |
| Dar información verbal y escrita sobre los tratamientos y otras recomendaciones |
Se muestra, a continuación, un resumen de los puntos más destacados de lo expuesto anteriormente49-52,55-58:
- 1.
La mala adherencia al plan terapéutico es frecuente en los pacientes con IC.
- 2.
Evaluar la posibilidad de una mala adherencia al tratamiento y sus causas.
- 3.
Implementar estrategias para fomentar la adherencia, adaptadas a las características del paciente y los recursos disponibles.
La monitorización clínica de los pacientes con IC resulta fundamental para garantizar una titulación óptima de los fármacos empleados para tratarla, facilitar una detección precoz de eventos adversos relacionados con ellos y detectar posibles complicaciones (como una FA) u otras comorbilidades. La monitorización engloba una serie de actuaciones en la práctica diaria, como una anamnesis y una exploración dirigidas, la evaluación de parámetros analíticos como biomarcadores, ECG, radiografía de tórax, pruebas de imagen (básicamente, ecocardiograma Doppler) y, según el paciente, otros procedimientos o pruebas complementarias5.
Por lo descrito, las guías de las principales sociedades científicas, tanto nacionales como internacionales, han emitido una serie de recomendaciones generales sobre la monitorización4,5,16,59. Sin embargo, teniendo en cuenta la gran variedad de perfiles clínicos y actuaciones, se precisa un mayor grado de detalle sobre qué pruebas hay que solicitar en cada caso, la cadencia precisa de las mismas, el responsable/coordinador de la monitorización, etc., para que se pueda proceder correctamente en la práctica clínica diaria.
Es fundamental, más allá de proponer o recomendar cuál debe ser la secuencia y la cronología para cada prueba individual, integrar el conjunto de pruebas en una cadencia lógica de visitas de seguimiento.
EvidenciaPéptidos natriuréticosDesde un punto de vista pronóstico, el uso de los PN como factor predictor se analizó en una revisión sistemática de la literatura con metanálisis y metarregresión de calidad60, que incluyó 19 ensayos clínicos de calidad variable (según el Detsky Quality Score). Se analizó en total a 12.891 pacientes con IC crónica (intervalo de edades, 38-76 años; un 60-92% varones). Tras un seguimiento de entre 1 y 36 meses, la metarregresión mostró que los cambios en las cifras de PN (respecto a las basales) se asociaban de manera significativa con el riesgo de hospitalización por empeoramiento de la IC (a menores concentraciones, menor el riesgo; coeficiente de regresión = 0,036; IC95%, 0,015-0,056; heterogeneidad moderada).
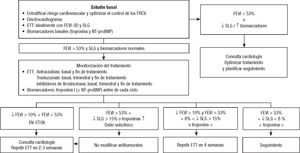
Por otro lado, en cuanto a la monitorización del tratamiento según la concentración de PN, una revisión sistemática de la literatura y metanálisis de buena calidad (sigue las recomendaciones PRISMA) y publicada en 201861 analizó si la monitorización según la concentración de PN, en comparación con el denominado guideline-directed medical therapy (GDMT), mejora los resultados clínicos de los pacientes con IC-FEr o IC-FEp. Como medidas de resultado, se utilizaron la mortalidad y la hospitalización de causa cardiovascular y por cualquier causa, el cambio en la FEVI, el cambio en la clase funcional de la NYHA, la hipotensión sintomática y la insuficiencia renal. Se analizaron subgrupos por biomarcador, tipo de IC, edad, tiempo de seguimiento y FE basal.
Se incluyeron en total 18 ensayos clínicos aleatorizados de calidad variable, con un total de 5.116 pacientes; 5 estudios incluyeron a pacientes con IC-FEp e IC-FEr y el resto, solo IC-FEr. En total se incluyó a 1.257 pacientes con IC aguda y 3.859 con IC crónica. La media de tiempo de seguimiento fue 16 meses. El metanálisis demostró que, en comparación con el GDMT, el tratamiento basado en las cifras de PN no tiene efecto adicional en la mortalidad (RR = 0,91; IC95%, 0,81-1,03) o la hospitalización por IC (RR = 0,81; IC95%, 0,65-1,01) o por cualquier causa (RR = 0,93; IC95%, 0,86-1,01). Los resultados concordaron por tipo de biomarcador (NT-proBNP o BNP) y por el tipo de IC. El análisis de subgrupo indicó que el tratamiento según las cifras de PN disminuye las hospitalizaciones por cualquier causa de los menores de 72 años.
ST2La determinación de la proteína ST2 circulante se puede obtener mediante análisis centralizados o point-of-care de alta sensibilidad. La ST2 soluble aporta información triple del estado del paciente con IC. Por un lado, es un marcador de estrés del cardiomiocito; es también un marcador de inflamación (pues pertenece a la superfamilia de la interleucina 1) y aporta información del grado de remodelado de la matriz extracelular y la fibrosis intersticial. A diferencia de los PN, la ST2 aporta, como aspectos beneficiosos para monitorizar al paciente con IC, que no se modifica sustancialmente en los ancianos, con insuficiencia renal o con obesidad. Dos metanálisis muestran la validez de la ST2 para monitorizar al paciente con IC tanto en la fase aguda como en la fase crónica62,63. Estudios multicéntricos también han demostrado el valor pronóstico de la ST2 independiente de los PN y las troponinas64.
Otros biomarcadoresLa evidencia sobre el valor de las troponinas en la monitorización es muy escasa y se basa en lo descrito en algunos estudios observacionales sobre su posible significación pronóstica65,66. La evidencia es mucho más escasa y preliminar sobre la proteína C reactiva, la galec-tina-3, el GDF-15 y la hormona de crecimiento67,68.
En cuanto a los nuevos biomarcadores, hay varios estudios sobre diferentes tipos de micro-ARN. En el contexto de un ensayo clínico aleatorizado a doble ciego y controlado por placebo69, se analizó la relación entre la concentración de micro-ARN-132 y los desenlaces de muerte u hospitalización de causa cardiovascular y mortalidad por todas las causas en una muestra de 953 pacientes con IC crónica y estable. Los resultados demostraron una asociación independiente entre los valores basales de micro-ARN-132 y la mortalidad cardiovascular (HR = 0,87; IC95%, 0-76-0,99) y hospitalización por IC (HR = 0,80; IC95%, 0,66-0,96), pero no con la mortalidad por cualquier causa (HR = 0,95; IC95%, 0,85-1,07). Tras un ajuste adicional por las concentraciones basales de NT-proBNP, solo la hospitalización por IC permaneció estadísticamente significativa (HR = 0,79; IC95%, 0,66-0,95). Los valores de micro-ARN-132 también mejoraron la predicción del riesgo de ingreso por IC con el continuous net reclassification index (cNRI = 0,205; p = 0,001).
Bayés-Genis et al.70 analizaron el valor predictivo de 12 micro-ARN sobre la morbimortalidad por IC en 2 cohortes. La primera de ellas estaba formada por 834 pacientes de IC-FEr (82%), el 71% varones con una media de edad de 68 años y una media de FE del 35%. Durante un seguimiento de 3,8 años, se produjeron 183 hospitalizaciones por IC (22%) y 344 fallecimientos (41%). La segunda cohorte estaba formada por 1.369 pacientes con IC-FEr (59%) e IC-FEp (41%), más frecuentemente varones (58%) y con una media de edad de 69 años. Durante un seguimiento de 1,9 años, se produjeron 450 hospitalizaciones por IC (33%) y 222 fallecimientos (16%). Los resultados demostraron una asociación significativa entre 2 micro-ARN circulantes (miR-1254 y miR-1306-5p) y la mortalidad por cualquier causa y la hospitalización por IC (HR entre 1,11 y 1,21; p < 0,005). No obstante, la adición de estos micro-ARN a los predictores conocidos no incrementó la capacidad discriminativa de los modelos, evaluada mediante el estadístico C, que alcanzó valores de 0,69 en la cohorte I y 0,70 en la cohorte II.
CA125Múltiples estudios observacionales han analizado el CA125 como marcador pronóstico. La mayoría en la IC aguda pero también en la IC crónica (incluida la avanzada)71-73. En una cohorte de 286 pacientes con IC crónica (media de edad, 69 años; el 43% varones; FE, 27-32%), tras un seguimiento medio de 6 meses se observó que la concentración de CA125 se asoció con el objetivo combinado de hospitalización por IC o la mortalidad a los 6 meses72.
Por otro lado, en un estudio observacional que incluyó a 946 pacientes ingresados por el primer episodio de IC aguda (media de edad, 71 años; el 52,7% varones; el 51% con FE < 50%), se analizó la trayectoria longitudinal de mediciones repetidas del CA125. Tras una mediana de seguimiento de más de 2 años, el CA125 predijo de manera independiente el riesgo de mortalidad (HR = 1,05; IC95%, 1,01-1,09).
Un ensayo clínico aleatorizado evaluó el efecto de la monitorización del tratamiento por el CA125 o siguiendo las guías de práctica clínica en 380 pacientes hospitalizados por descompensación de su IC74. La medida de resultado principal fue muerte o reingreso por IC aguda al año. En el momento de la inclusión, los pacientes habían sufrido ya al menos 1 episodio de IC aguda en los últimos 180 días, estaban en NYHA ≥ II y tenían el CA125 > 35 U/ml, evidencia ecocardiográfica de alteración estructural o funcional acorde con el diagnóstico de IC o elevación del NT-proBNP > 1.000 pg/ml o del BNP > 100 pg/ml. En el grupo del CA125 se realizaron más visitas que en el del criterio estándar (5,97 frente a 5,23 visitas/pacientes-años; IRR = 1,14; p = 0,003); también fueron más frecuentes la administración intravenosa de furosemida (el 21 frente al 11%; p = 0,008) y la prescripción de estatinas (el 78 frente al 41%; p < 0,001). En cuanto a la medida de resultado principal, la estrategia con CA125 produjo una reducción significativa del número de eventos (muerte o reingreso por IC aguda), tanto como primer evento (55 frente a 84; p = 0,017) como en los sucesivos (85 frente a 165; IRR = 0,49; IC95%, 0,28-0,82; p = 0,008), a expensas fundamentalmente de la disminución de los reingresos.
Otro estudio observacional prospectivo evaluó el valor pronóstico del CA125 y el NT-proBNP en la mortalidad por cualquier causa tras un episodio de descompensación aguda de la IC75. Se incluyó a 946 pacientes (el 52,7% varones, con una media de edad de 71 años y una mediana del NT-proBNP y CA125 basales de 1.874 pg/ml y 64,7 U/ml respectivamente). Tras una mediana de seguimiento de 2,64 años, se produjeron 498 muertes (52,6%). En el análisis multivariado se observó una asociación significativa de la mortalidad con el cambio absoluto en las cifras de CA125 (HR = 1,05; IC95%, 1,01-1,09) y NT-proBNP (HR = 1,04; IC95%, 1,02-1,06; p < 0,001). La utilización de ambos marcadores en categorías por encima de los puntos de corte ≥ 1.000 pg/ml para el NT-proBNP y > 35 U/ml para el CA125 demostró que el riesgo de muerte es mayor cuando están elevados ambos marcadores, intermedio cuando solo lo está 1 de los 2 y mínimo cuando ambos están bajos.
Evaluación concomitante de varios biomarcadores o con pruebas de imagenEs posible (según las datos disponibles actualmente) que las estrategias que combinan múltiples biomarcadores y las técnicas de imagen puedan ser útiles en la monitorización de los pacientes con IC, pero todavía se precisan estudios con mayor rigor metodológico para evaluar esta cuestión67,68,75,76.
Ecocardiografía transtorácica y de la vena cava inferiorEn un estudio observacional prospectivo77 en pacientes ambulatorios con IC (con IC-FEr y también con FE entre el 40 y el 49%), los autores realizaron ecografías seriadas: basal, al año y posteriormente cada 2 años hasta un periodo de seguimiento máximo de 15 años. La media de ecocardiografías por paciente fue de 3,6 ± 1,7. En los pacientes con IC-FEr se observó un llamativo incremento de la FE en el primer año (del 9 ± 12%), para luego presentar una tendencia muy leve a la mejoría durante el seguimiento (aproximadamente durante 10 años) y después disminuir lentamente. La evolución de estos pacientes también mostró que el 56% de ellos no se movieron de la categoría de IC-FEr, mientras que el 21 y el 23% se movieron a IC con FE en rango medio (IC-FEm) e IC-FEp respectivamente. Para terminar, los pacientes que fallecieron presentaban una FE inferior que los supervivientes y una peor dinámica de la FEVI en el periodo inmediatamente anterior (cambios entre las 2 evaluaciones previas de la FEVI) durante la mayor parte del seguimiento.
Por otro lado, en los últimos años han seguido apareciendo publicaciones sobre el valor del strain longitudinal global (GLS) en distintas fases de la IC, incluida la monitorización de estos pacientes78. Desde un punto de vista de la predicción, se publicó un estudio observacional longitudinal de buena calidad que incluyó la valoración del GLS en 4.172 pacientes consecutivos con IC aguda (media de edad, 70 años; el 53% varones; el 93% en NYHA III-IV). Se clasificó a los pacientes en un strain poco reducido (GLS > 12,6%), moderadamente reducido (GLS de < 12,5 hasta el 8%) o gravemente reducido (GLS del 8%). El GLS medio fue del 10,8% y la media de FEVI, del 40%. A los 5 años, 1.740 pacientes (40,4%) habían fallecido. En los análisis multivariados se observó que cada incremento en el GLS del 1% se asociaba con un descenso de la mortalidad del 5% (p < 0,001). Además, los pacientes con una reducción de GLS moderada (HR = 1,31; IC95%, 1,13-1-53) o grave (HR = 1,61; IC95%, 1,36-1,91) mostraron mayor riesgo de mortalidad por cualquier causa. Sin embargo, en este estudio la FEVI no se asoció con la mortalidad. En comparación con la FEVI, el GLS mostró una mayor área bajo la curva para determinar la mortalidad a los 5 años, con un c-index (un estadístico utilizado para medir la capacidad predictiva) del 59 frente al 51% (p < 0,001). Otros documentos apuntan en este sentido.
Otros parámetros clínicosTambién se recomienda monitorizar otros parámetros clínicos (no se describe su cadencia) como el peso, la presión arterial o la frecuencia cardiaca4,5,16,59.
Visitas clínicasNo se dispone de una guía clara sobre cómo realizarlas y su cadencia.
Puntos que considerar y recomendacionesFrecuencia de seguimiento de los pacientes con ICNo hay evidencia clara, basada en resultados de estudios y ensayos clínicos, sobre cuál debe ser la frecuencia de las visitas de seguimiento de los pacientes con IC, que en último extremo debe individualizarse de acuerdo con las características del paciente, el tipo y la gravedad de la IC, el modo local de organización y gestión del proceso de IC, los recursos disponibles y el momento evolutivo de la enfermedad. Pueden hacerse unas recomendaciones generales lógicas basadas en la experiencia clínica y en las recomendaciones generales de las guías de práctica clínica4,5,16,59. También debe establecerse el ámbito de las visitas de seguimiento en cada fase de la IC (unidad especializada de IC, consultas especializadas de enfermería, consultas generales de cardiología o medicina interna, AP).
Posiblemente, la mejor forma de acercarse a este importante aspecto del tratamiento de la IC sea establecer unas recomendaciones de seguimiento en función del riesgo del paciente (bajo, intermedio o alto).
- 1.
Pacientes de bajo riesgo. Este grupo incluiría a los pacientes con NYHA I-II sin ingresos por descompensaciones en los 12 meses previos, que tengan un tratamiento farmacológico y no farmacológico (dispositivos) óptimo y no hayan sufrido cambios recientes en el tratamiento farmacológico4,5,16,59. A estos pacientes se los puede revisar cada 6-12 meses.
- 2.
Pacientes de alto riesgo. Serían los pacientes en NYHA III o IV, con ingresos recientes por descompensación de la IC u otros eventos cardiovasculares, comorbilidades graves (anemia, EPOC, insuficiencia renal, etc.), gran fragilidad, descargas frecuentes o recientes del DAI, IC de reciente comienzo, durante la titulación del tratamiento, complicaciones del tratamiento o necesidad de reducir dosis o suspender los fármacos4,5,16,59. Se debe revisar a estos pacientes cada 1-4 semanas como mínimo.
- 3.
Pacientes de riesgo intermedio. Son los pacientes no claramente clasificables, a juicio del médico, como en alto o bajo riesgo. Se deberían evaluar cada 1-6 meses.
En cuanto al ámbito de las visitas de seguimiento, se debe revisar a los pacientes de alto riesgo en unidades especializadas de IC (consultas médicas y de enfermería); los pacientes de riesgo intermedio, en consultas especializadas de IC y en consultas generales de cardiología y medicina interna (según las características de los pacientes y los recursos y el modo de gestión del proceso de IC en cada centro), y los pacientes de bajo riesgo, en consultas generales de cardiología y medicina interna o en consultas de AP. En general, puede ser recomendable para los pacientes de bajo riesgo una revisión al año en la consulta de la unidad de IC o en las consultas generales de cardiología o medicina interna.
Algunos pacientes de muy bajo riesgo y muy estables pueden no requerir revisiones en las unidades especializadas de IC16. Las guías canadienses16 admiten el alta de este tipo de seguimiento cuando se cumplen al menos 2 de las siguientes características: NYHA I o II en los últimos 6-12 meses, ausencia de ingresos por descompensación de la IC en los últimos 12 meses, tratamiento óptimo, FEVI > 35% en al menos 2 determinaciones recientes consecutivas, causa reversible para la IC totalmente controlada, médico de AP con experiencia en IC, adherencia al tratamiento y adecuado acceso desde AP a la unidad de IC.
En cada visita de seguimiento debe realizarse una anamnesis dirigida a las circunstancias del paciente y la historia y la clínica de la IC, y una exploración física que incluya presión arterial, ritmo y frecuencia cardiaca, peso, índice de masa corporal (IMC) y auscultación cardiaca y pulmonar.
Cadencia de realización de exploraciones complementariasAnalítica simpleSegún las distintas guías4,5,16,59, la monitorización general del paciente incluye una analítica simple, que al menos incluya un hemograma completo y bioquímica con electrolitos séricos (Na+ y K+), incluidos calcio y magnesio, urea, creatinina, filtrado glomerular, glucosa, perfil lipídico y pruebas de función hepática. Debe añadirse un estudio de función tiroidea (tirotropina), ferropenia (hierro sérico, ferritina y saturación de transferrina) y hemoglobina A1C (pacientes diabéticos). Dependiendo del paciente o la circunstancia, se solicitará otro tipo de parámetros analíticos o de orina. En el paciente estable de bajo riesgo, parece razonable realizar este estudio analítico en la revisión anual. En el paciente de alto riesgo o cuando se inicia la administración de un fármaco que pueda alterar la función renal y los iones, así como cuando se modifican sus dosis en el proceso de titulación, se debe realizar una determinación de iones y marcadores de la función renal en cada visita.
BiomarcadoresEn opinión de este grupo de expertos:
- 1.
El PN recomendado, dado que cada vez es más habitual el empleo del sacubitrilo/valsartán, basado en la evidencia, debe ser el NT-proBNP.
- 2.
Tras la determinación inicial del NT-proBNP en la evaluación clínica basal o durante el episodio de descompensación de la IC, se debe realizar una determinación de control al alta y tras la optimización del tratamiento, con el objetivo de identificar a los pacientes con mayor riesgo que necesitan mayor frecuencia de seguimiento o una intensificación del tratamiento. En el paciente ambulatorio, un aumento ≥ 30% sobre los valores previos y en el paciente ingresado una reducción antes del alta < 30% sobre los valores obtenidos al ingreso indican un peor pronóstico. En estos pacientes parece recomendable determinar la NT-proBNP cada 1-3 meses hasta que se consiga esa reducción del 30%.
- 3.
En el paciente estable con bajo riesgo y tratamiento optimizado y en los que se demostró esa reducción de las cifras de PN > 30%, no parece necesario realizar determinaciones seriadas de NT-proBNP, salvo que se produzcan cambios clínicos en el curso de la enfermedad. No obstante, podría ser razonable una determinación cada 12 meses en el contexto de la visita de monitorización anual.
Actualmente no hay evidencia que justifique el control sistemático del tratamiento guiado por las concentraciones de péptidos, salvo en los casos descritos en el apartado 2.
La evidencia sobre la utilidad de otros biomarcadores, fundamentalmente troponinas y ST2, como métodos de monitorización es escasa65-68, y creemos que su utilización en la práctica clínica habitual debe considerarse en el contexto de vías clínicas bien establecidas y consensuadas. En cuanto al CA125, varios estudios observacionales han analizado esta sustancia como marcador pronóstico, y 2 estudios prospectivos, 1 aleatorizado74 y otro observacional72, han señalado que el tratamiento guiado por los valores de CA125 puede reducir los reingresos por IC74 y tener un valor adicional al de la NT-proBNP en la predicción de la mortalidad72. El CA125, como biomarcador de congestión, debería incorporarse a la práctica clínica habitual para el paciente con IC aguda y durante la fase de transición.
ECGSegún las distintas guías4,5,16,59, esta es una prueba que se debe realizar durante el seguimiento, pero no son posibles las recomendaciones basadas en evidencia sobre con qué cadencia solicitarla. Al igual que las baterías analíticas, pensamos que se debe realizar sistemáticamente en la visita anual, en casos de descompensaciones y cuando haya datos en la historia clínica (palpitaciones, mareos…), la exploración física (alteraciones del ritmo, nuevos soplos) o los análisis (alteraciones hidroelectrolíticas) que lo hagan necesario.
Radiografía de tóraxLas guías recomiendan solicitar una radiografía de tórax en algunos contextos concretos, como los pacientes con una IC aguda descompensada, o para detectar enfermedades cardiacas, pulmonares y de otro tipo. No hay razones para indicar sistemáticamente su realización seriada.
Ecocardiografía DopplerMás allá del diagnóstico (y las evaluaciones iniciales) y tras establecer y optimizar el tratamiento, las guías recomiendan realizar eco-cardiogramas durante el seguimiento de pacientes con IC-FEr solo en casos de empeoramiento o cambios terapéuticos y para pacientes expuestos a fármacos cardiotóxicos4,5,16,59. Las guías canadienses16 son algo más concretas y dan unas recomendaciones en 4 situaciones clínicas:
- 1.
En el paciente con IC de novo, de inmediato o en las primeras 2 semanas tras la evaluación.
- 2.
A los 3 meses de completar la titulación y alcanzar el tratamiento farmacológico óptimo.
- 3.
Antes de indicar un dispositivo de resincronización o DAI.
- 4.
En los 30 días siguientes a un episodio de descompensación con ingreso hospitalario (aunque no es necesario tras ingresos repetidos).
Para el paciente con IC estable, bajo riesgo y tratamiento optimizado, las guías canadienses proponen la determinación de la FEVI «aproximadamente cada 1-3 años» (y posiblemente con menor frecuencia incluso si dicha FEVI es persistentemente > 40%). Sin embargo, un reciente estudio español77 en pacientes ambulatorios con IC-FEr e IC-FEm, puede ser razonable realizar una determinación anual de FEVI, habitualmente mediante ecocardiografía.
Otras pruebasActualmente no hay evidencia ni razones para recomendar la realización sistemática de otras pruebas, como cardiorresonancia magnética, ergoespirometría u otras técnicas de imagen, que deben reservarse para pacientes concretos que las tengan indicadas. En los últimos años se han publicado estudios sobre el valor del strain longitudinal global en las distintas fases de la IC, incluida la monitorización de estos pacien-tes78, pero su utilidad en el seguimiento debe confirmarse.
ResumenSe muestra, a continuación, un resumen de los puntos más destacados de lo expuesto anteriormente4,5,16,59,60:
- 1.
Individualizar la frecuencia de las visitas de seguimiento de los pacientes con IC en función de sus características, el tipo y la gravedad de la IC, el modo local de organización y gestión del proceso de IC, los recursos disponibles y el momento evolutivo de la enfermedad.
- 2.
Establecer el ámbito de las visitas de seguimiento en cada fase de la IC (unidad especializada de IC, consultas especializadas de enfermería, consultas generales de cardiología o medicina interna, AP).
- 3.
Estimar el riesgo del paciente (bajo, intermedio o alto).
- 4.
Las pruebas complementarias que solicitar para los pacientes con IC incluyen una serie de parámetros básicos para todos ellos y pueden solicitarse otros adicionales dependiendo de las características de cada paciente.
La Heart Failure Association (HFA) europea definió en 2007 la IC avanzada como una etapa de la enfermedad en que los tratamientos convencionales, es decir, fármacos, dispositivos o cirugía utilizados según las guías de práctica clínica79, resultan insuficientes para controlar los síntomas del paciente. En estos casos es necesario otro tipo de tratamientos, como el trasplante cardiaco, la asistencia circulatoria mecánica o el tratamiento sintomático especializado (infusiones de inotrópicos, ultrafiltración o diálisis peritoneal), para controlar la congestión, mejorar la calidad de vida o aportar cuidados paliativos al final de la vida.
En 2018, un grupo de expertos de la HFA actualizó el conocimiento sobre la IC avanzada en un Position Statement de lectura recomendada para los interesados en el tema80. La IC avanzada supone entre el 1 y el 10% del total de pacientes con IC81-83, y su prevalencia está aumentado debido al incremento del número de pacientes con IC y la prolongación de su supervivencia. Aunque la atención a la IC avanzada ha mejorado sustancialmente84, estos pacientes requieren múltiples ingresos hospitalarios y visitas a los servicios de urgencias y presentan una elevada tasa de muerte hospitalaria85,86. Por todo ello, la IC avanzada sigue siendo un reto clínico de gran magnitud.
Principios del tratamiento de pacientes con IC avanzada: unidades de ICLa IC avanzada implica el fracaso de los tratamientos con eficacia probada en fases previas de la enfermedad, y por ello su tratamiento implica estrategias que están «más allá de las guías», con evidencia científica escasa o inexistente. El objetivo para estos pacientes ya no es prolongar su supervivencia, sino disminuir el número de ingresos y la estancia hospitalaria, así como mejorar su calidad de vida. Ello requiere a la vez un alto grado de experiencia en la gestión de estas situaciones y el dominio de ciertas modalidades de tratamiento no habituales en ámbitos menos especializados.
El medio habitual en que se dan estas condiciones y, por lo tanto, el lugar donde se debe tratar a estos pacientes, son las unidades de IC87. Estas unidades se organizan en forma de red (figura 4), con 3 niveles que permiten la atención adecuada a todos los pacientes con IC avanzada:
- •
Las unidades de IC comunitarias: para atención de pacientes susceptibles de tratamiento ambulatorio en hospitales de cualquier nivel: disponen de técnicas diagnósticas y terapéuticas básicas y pueden proporcionar tratamiento paliativo.
- •
Las unidades de IC especializadas: en hospitales de mayor nivel de complejidad, con unidades de hemodinámica, electrofisiología y cirugía capaces de implantar dispositivos de estimulación eléctrica o asistencia circulatoria de corta duración.
- •
Las unidades de IC avanzada añaden a lo anterior la posibilidad de realizar trasplante cardiaco y proporcionar asistencia ventricular de larga duración. Son el nódulo central de una red formada por los hospitales de menor nivel en su área de influencia.
Esquema hub and spoke (eje y radios) para relación y referencia de pacientes con IC entre unidades de los distintos niveles. Adaptado de Crespo-Leiro et al.80.
La mayoría de los pacientes comienzan su atención en unidades de IC comunitarias, donde el trato cercano es suficiente para atender las necesidades de la mayoría de ellos. En casos determinados es necesario remitir a los pacientes a unidades de nivel superior. La figura 5 muestra los criterios propuestos por la HFA para consultar o referir a estos pacientes.
Criterios de referencia para remisión de pacientes a unidades de IC superiores propuestos en la Position Statement sobre IC avanzada de la HFA80.
DAI: desfibrilador automático implantable; IC: insuficiencia cardiaca; INRA: inhibidor del receptor de la angiotensina; NYHA: clase funcional de la New York Heart Association; PAS: Presión arterial sistólica; SRA: sistema renina-angiotensina; TRC: terapia de resincronización cardiaca.
a Edad > 75 años si el estado funcional es bueno, aparte de la IC (enfermedad de un solo órgano).
b Por ejemplo, cáncer no tratable, demencia, enfermedad pulmonar obstructiva crónica grave.
Se han publicado varios ensayos clínicos sobre la furosemida subcutánea para pacientes con IC avanzada88,89 y existen pequeñas experiencias observacionales90,91.
Un primer ensayo clínico aleatorizado y cruzado (de calidad moderada, Jadad 2) analizó la farmacocinética y la farmacodinámica de la administración subcutánea de furosemida mediante una bomba de infusión externa bifásica. Se aleatorizó a los pacientes a furosemida oral (80 mg) o furosemida subcutánea con una infusión de 30 mg en 1 h, seguida de una infusión del fármaco a 12,5 mg/h durante 4 h. El cruce se realizó a los 14 días. Incluyó a 10 pacientes con IC (media de edad, 69 años; el 80% varones; el 100% en NYHA II y la mayoría, con alguna comorbilidad importante). El segundo fue un ensayo clínico fundamental cruzado (de calidad moderada, Jadad 2), diseñado para estudiar la farmacocinética y la biodisponibilidad de la preparación; aleatorizó a 17 pacientes con IC avanzada y congestiva (media de edad, 68 años; el 88% varones; el 76,5% en NYHA II y el 23,5% en NYHA III) a 80 mg de furosemida intravenosa (40 mg en 2 min, seguida de una segunda dosis de 40 mg en 2 h) u 80 mg (8 mg/ml en 10 ml) de una nueva solución de furosemida administrada por vía subcutánea con una bomba de infusión externa que usa un patrón bifásico (30 mg en los primeros 60 min, seguidos de 12,5 mg/h durante 4 h). El cruce se realizó a los 7 días.
En cuanto a los resultados de los estudios, por una parte, el preparado subcutáneo alcanzó una biodisponibilidad completa (99,6%) y, comparado con la administración intravenosa, se alcanzaron grados de diuresis similares (no se dan datos sobre la significación estadística). La tolerancia en ambos estudios fue buena y no se registraron eventos adversos graves.
Otro ensayo clínico en fase II (calidad moderada, Jadad 2-3), incluyó a 41 pacientes con IC descompensada y necesidad de tratamiento diurético intravenoso (media de edad, 57 años; el 45% varones; el 70% en NYHA III-IV, la mayoría con comorbilidades importantes). Se los aleatorizó a furosemida intravenosa (dosis media, 123 mg) o furosemida subcutánea (dosis fija de 80 mg durante 5 h) con la misma bomba que los ensayos clínicos anteriores. En cuanto a los resultados, la mediana de diuresis a las 6 h fue similar entre los 2 grupos: 1.425 ml con la furosemida intravenosa frente a 1.350 ml con la furosemida subcutánea (p = 0,84); la pérdida de peso fue similar también (p = 0,095), pero la natriuresis fue significativamente mayor en el grupo de la furosemida subcutánea (p = 0,050). No hubo deterioro de la función renal, ototoxicidad o irritaciones de la piel en ningún grupo.
Tratamiento vasoactivo intravenosoDistintos estudios observacionales no han mostrado un claro beneficio clínico de los vasopresores (dopamina, dobutamina, norepi-nefrina, epinefrina) en pacientes con IC avanzada. Un análisis post hoc del registro ALARM-HF (pacientes ingresados por descompensación de la IC) encontró una asociación estadísticamente significativa entre los vasopresores y una mayor mortalidad hospitalaria: dopamina (HR = 1,62; IC95%, 1,30-2,02), dobutamina (HR = 2,15; IC95%, 1,76-2,61), epinefrina (HR = 2,73; IC95%, 2,04-3,65) y norepinefrina (HR = 1,74; IC95%, 1,31-2,29)92. Además, los estudio ROSE y DAD-HF II, ensayos clínicos aleatorizados y controlados con placebo en pacientes ingresados por descompensación de la IC, no encontraron diferencias estadísticamente significativas entre la dopamina en dosis bajas y el placebo en variables relacionadas con la congestión cardiaca, la mejoría de los síntomas o la mortalidad por cualquier causa a las 72 h93,94. El estudio FIRST95, ensayo clínico de calidad, aleatorizado y controlado con placebo, incluyó a 471 pacientes (media de edad, 64 años; el 76% varones) con IC avanzada, y mostró una mayor mortalidad entre los pacientes tratados con dobutamina en infusión intravenosa continua, en comparación con el placebo (el 70,5 frente al 37,1%; p = 0,001), confirmada en los análisis de regresión multivariados.
Por otro lado, la administración intermitente de vasodilatadores para la mejoría sintomática ha ido aumentando, sobre todo del levo-simendán, cuyo efecto hemodinámico puede durar más de 7 días después de una infusión de 12-24 h96. Los estudios REVIVE I y II son 2 ensayos clínicos controlados con placebo secuenciales que analizaron el efecto del levosimendán en algo más de 600 pacientes con IC avanzada a corto plazo (5 días)97. Observaron que, en comparación con el placebo, había menos pacientes con levosimendán que empeoraron clínicamente (p = 0,015), aunque la hipotensión y las arritmias cardiacas fueron más frecuentes con este fármaco. Por otro lado, el estudio LION-HEART aleatorizó a 69 pacientes con IC avanzada a recibir placebo o levosimendán 0,2 µg/kg/min durante 6 h cada 2 semanas durante 12 semanas98. La variable principal fue la NT-proBNP, que fue significativamente menor en el grupo con levosimendán que en el grupo de placebo (p = 0,003). El levosimendán también se asoció con menor riesgo de hospitalización por IC (HR = 0,25; IC95%, 0,11-0,56) y del objetivo compuesto de hospitalización por IC o muerte por cualquier causa (HR = 0,33; IC95%, 0,16-0,70) o de empeoramiento de la calidad de vida (el 21 frente al 3%; p = 0,022) en comparación con el placebo. No hubo diferencias en la mortalidad por cualquier causa, y los eventos adversos fueron similares en ambos grupos.
Por otro lado, un metanálisis de 7 ensayos clínicos de pequeño tamaño y calidad variable en 437 pacientes con IC avanzada encontró una asociación estadísticamente significativa entre la administración repetitiva o intermitente de levosimendán y la reducción de la morta-lidad99 y el número de hospitalizaciones100, dato este último que se ha confirmado en otro metanálisis de características similares realizado por el mismo grupo.
En cuanto a la milrinona, en el estudio OPTIME-CHF101-105, un ensayo clínico de calidad controlado con placebo, se analizaron los resultados de este fármaco (infusión intravenosa de 48-72 h) en 951 pacientes con IC avanzada y descompensada (media de edad, 65 años; el 65% varones; el 95% en NYHA III-IV; FE media, 23%). La milrinona, en comparación con el placebo, se asoció con más eventos hipotensi-vos que requirieron intervención (el 10,7 frente al 3,2%; p < 0,001) y arritmias auriculares de novo (el 4,6 frente al 1,5%; p = 0,004) y con mayores tasas de mortalidad entre los pacientes con cardiomiopatía isquémica. No hubo diferencias en relación con la mortalidad hospitalaria (el 3,8 frente al 2,3%; p = 0,19), la mortalidad a los 60 días (el 10,3 frente al 8,9%; p = 0,41) o la tasa del objetivo compuesto de muerte o reingreso (el 35 frente al 35,3%; p = 0,92).
Desfibrilador automático implantable (DAI)Un ensayo clínico aleatorizado que incluyó a más de 1.000 pacientes con IC sintomática no causada por enfermedad coronaria (media de edad, 64 años; el 72% varones; FE media, 25%) comparó el efecto del DAI y el tratamiento habitual. Tras una mediana de seguimiento de 67,6 meses, se observó que la mortalidad por cualquier causa fue del 21,6% en el grupo con DAI y el 23,4% en el grupo de tratamiento habitual (HR = 0,87; IC95%, 0,68-1,12). La muerte súbita cardiaca afectó al 4,3% de los pacientes con DAI y el 8,2% del grupo de control (HR = 0,50; IC95%, 0,31-0,82). No hubo diferencias estadísticamente significativas entre los grupos en cuanto a otras muertes cardiovasculares, muerte no cardiovascular o parada cardiaca.
Por otro lado, un estudio observacional retrospectivo multicéntrico, de 3 años de duración106, analizó a 1.089 pacientes consecutivos con IC avanzada en lista de espera para trasplante cardiaco (media de edad, 53 años; el 84% varones; FE media, 20%). El 51% tenía un DAI en prevención tanto primaria como secundaria, y la mediana de tiempo en lista de espera era de 8 meses. El DAI se asoció de manera significativa con menor mortalidad por cualquier causa (HR = 0,4; IC95%, 0,19-0,85).
Tratamiento de la IC congestiva refractaria con resistencia a los diuréticosEl curso clínico de los pacientes con IC avanzada se caracteriza a menudo por una disfunción renal (síndrome cardiorrenal) y por la resistencia a los diuréticos.
Las guías de la ESC no recomiendan la ultrafiltración sistemática para pacientes con IC avanzada y la reservan para los casos de IC congestiva sintomática refractarios a todas las estrategias con diuréticos (orales, intravenosos, aumentos de dosis, combinaciones, etc.)5.
El estudio UNLOAD107 es un ensayo clínico con 200 pacientes con IC descompensada y congestiva (media de edad, 63 años; el 69% varones; el 71% con FE ≤ 40%) aleatorizados a ultrafiltración o tratamiento diurético intravenoso. A las 48 h, la pérdida de peso (5 frente a 3,1 kg; p = 0,001) y de líquido (4,6 frente a 3,3 l; p = 0,001) fueron mayores en el grupo de ultrafiltración, aunque no hubo diferencias significativas en los cambios en la disnea. A los 90 días, hubo menos hospitalizaciones por IC en el grupo de ultrafiltración (el 18 frente al 32%; p = 0,037), rehospitalizaciones por IC (0,22 frente a 0,46; p = 0,022), días de reingreso por paciente (1,4 frente a 3,8; p = 0,022) y visitas no programadas (el 21 frente al 44%; p = 0,009). Sin embargo, no hubo diferencias estadísticamente significativas entre los grupos en las concentraciones séricas de creatinina. Finalmente, hubo 9 muertos en el grupo de ultrafiltración contra 11 en el de diuréticos.
Posteriormente, en el estudio AVOID-HF108, se analizaron la eficacia y la seguridad de la ultrafiltración ajustable en los 224 pacientes hospitalizados con IC congestiva descompensada y mal pronóstico incluidos hasta que el financiador suspendió el estudio unilateralmente (media de edad, 67 años; el 71% varones, el 27,5% de la muestra total estimada). Los días estimados hasta el primer evento de IC en los grupos de ultrafiltración y de diuréticos fueron 62 y 34 días (p = 0,106) respectivamente. A los 30 días del alta hospitalaria, en comparación con los diuréticos, la ultrafiltración registró menor número de eventos cardiovasculares y por IC (dependiendo de la variable, las diferencias fueron estadísticamente significativas o no). Los cambios en la función renal fueron similares entre grupos. Por otro lado, los pacientes del grupo de ultrafiltración tuvieron más eventos adversos considerados de especial interés (p = 0,018) y eventos adversos graves relacionados con ella (p = 0,026). Para acabar, la mortalidad a los 90 días fue similar (el 15 frente al 13%; p = 0,837).
El estudio PURE-HF, que hace poco ha finalizado el reclutamiento, evaluará si la combinación de ultrafiltración periférica con diuréticos intravenosos en dosis bajas reduce los eventos por IC o muerte cardiovascular a los 90 días, en comparación con el tratamiento dirigido por guías, incluyendo diuréticos intravenosos para pacientes con IC hospitalizados por congestión.
La diálisis peritoneal es una modalidad terapéutica que se puede hacer en domicilio y ser útil para pacientes con IC refractaria, síndrome cardiorrenal y sobrecarga de líquidos. Los estudios de diálisis peritoneal en pacientes con IC, insuficiencia renal crónica y sobrecarga de líquido refractaria a tratamiento han demostrado que esta modalidad se asocia con pérdida de peso, mejora de la calidad de vida, reducción de las hospitalizaciones por IC y aumento de la FE109-112. Sin embargo, estos estudios carecen de un grupo de control, tienen un seguimiento corto y una potencia estadística insuficiente para detectar un efecto en la mortalidad.
ResumenSe muestra, a continuación, un resumen de los puntos más destacados de lo expuesto anteriormente88,89,92,99,113:
- 1.
El tratamiento de la congestión refractaria en pacientes con IC debe realizarse en unidades de IC organizadas en red.
- 2.
La infusión subcutánea de furosemida es un procedimiento eficaz y seguro de administración parenteral del fármaco, con eficacia comparable a la de la administración intravenosa.
- 3.
La ultrafiltración y la diálisis peritoneal para el tratamiento de la congestión refractaria a diuréticos solo deben emplearse en pacientes seleccionados tras el fracaso de otras medidas.
- 4.
Los fármacos vasoactivos intravenosos no aportan beneficios a los pacientes con IC crónica avanzada. Únicamente la administración intermitente de levosimendán ha mostrado efectos beneficiosos en eventos clínicos a medio plazo.
Se define la transición tras el alta hospitalaria como un proceso asistencial organizado y coordinado, basado en la atención individualizada y la optimización terapéutica, cuyo objetivo es evitar nuevas hospitalizaciones y, con ello, mejorar el pronóstico de la IC.
En los pacientes con IC crónica, el periodo inmediatamente posterior al alta hospitalaria representa un tiempo de gran vulnerabilidad, en el que existe un riesgo importante de deterioro clínico30. Las tasas de reingreso en los 30 días posteriores al alta hospitalaria varían del 25 al 42%, dependiendo del estudio114-116. También se ha estimado que aproximadamente el 30% de los reingresos hospitalarios ocurren en la primera semana tras el alta, y el 60% en las primeras 2 semanas117. La mayoría de las hospitalizaciones se deben a descompensaciones agudas de la IC118, aunque se han descrito otras causas de reingreso, como alteraciones en la función renal, neumonías o arritmias119. Así, se ha descrito que la mortalidad en el primer mes tras el alta hospitalaria es de hasta el 20%120.
Por otro lado, hasta el 40% de los reingresos precoces podrían estar relacionados con una asistencia subóptima durante el periodo de transición tras el alta hospitalaria121,122. Por ello se han desarrollado distintos programas específicos de transición tras el alta hospitalaria, de los que se ha demostrado que disminuyen significativamente la mortalidad por cualquier causa y el riesgo de reingreso por IC27,30,123.
EvidenciaCriterios de alta hospitalariaTeniendo en cuenta la importancia de todo lo referente a la transición tras el alta hospitalaria, distintas sociedades científicas tanto nacionales como internacionales han desarrollado distintos documentos en este sentido, que a continuación se amplían5,48,118,124.
Entre ellas se encuentra el Decálogo de la SEC, con su infografía, las consideraciones previas al alta de la SEMI, incluidas en el protocolo de tratamiento de la IC aguda publicado en forma de documento de bolsillo, o el documento de SEC-Primaria Proceso de IC, elaborado por la SEC con colaboración de médicos de AP.
Uno de los elementos sobre los que se ha trabajado es los criterios de alta hospitalaria. Aunque puede haber algunos pequeños matices dependiendo del documento, los principales criterios médicos para el alta hospitalaria son que los pacientes deben estar hemodinámicamente estables y euvolémicos, recibir medicación oral y tener una función renal estable al menos las 24 h previas al alta5,48,118,124. Además, los pacientes deben haber recibido formación personalizada, estar inscritos en un programa de tratamiento de la enfermedad y ser evaluados por su médico de AP en el plazo de 1 semana tras el alta y por el equipo de cardiología en el plazo de 2 semanas tras el alta (siempre que sea posible)5,48,118,124.
Como ya se ha comentado, algunos de estos documentos incluyen una serie de recomendaciones o actuaciones que seguir antes del alta y en los 30 días posteriores. En la tabla 13 se muestran las indicadas por la SEC48. Además, para facilitar la implementación de estos documentos, se han desarrollado materiales adicionales de bolsillo, como los mostrados en la figura 6 (infografía del Decálogo de la SEC) y la figura 7 (lista de comprobación de tareas de la SEMI).
Decálogo de la SEC sobre la transición del paciente hospitalizado con insuficiencia cardiaca. Resumen de las características y recomendaciones sobre la transición de un paciente hospitalizado por insuficiencia cardiaca descompensada
| Definición y objetivos | Proceso asistencial organizado que comienza durante la hospitalización, una vez se logra la estabilidad hemodinámica y el paciente no precisa fármacos intravenosos, y continúa tras el alta durante al menos 30 díasObjetivo: evitar nuevas hospitalizaciones y ralentizar la progresión de la IC |
| Requisitos estructurales y organizativos | Integración de recursos hospitalarios y ambulatorios (obligatorio), que de forma coordinada faciliten una atención continua y personalizada, basada en medidas de monitorización, formación, apoyo y mejora terapéuticaSe recomienda diseñar una estructura adaptada a cada área de salud en la que participen los equipos de atención primaria, las unidades de IC y las enfermeras (fundamental) gestoras de casos |
| Optimización terapéutica | Elemento clave en la transiciónDebe iniciarse siempre durante la hospitalizaciónDebe incluir:• Tratamiento etiológico• Resolución de precipitantes de la descompensación• Mejoría de comorbilidades• Mejora del tratamiento farmacológico con evidencia de beneficio pronóstico tras la hospitalización |
| Otros requisitos clínicos | Una adecuada transición requiere al alta:• Resolución (o mejoría) de los síntomas y signos congestivos• Función renal y electrolitos estables o en fase de mejoría (48 h)• FC < 70 lpm (en ritmo sinusal y con FEVI < 40%)• Instrucción para el autocuidado, incluidos signos de alarma y efectos secundarios• Si está disponible, determinación de péptidos natriuréticos al alta• Plan de continuidad de cuidados (esfera médica y sociofamiliar)• Registro de monitorización que al menos incluya peso, talla y FC• Plan de recomendaciones claras y concretas sobre cómo actuar |
| Tratamiento | Todo paciente con IC y FEVI < 40% debería ser dado de alta con un bloqueador beta, sacubitrilo/valsartán o un IECA (o ARA-II) y ARM. El sacubitrilo/valsartán puede considerarse primera opción, dada la mejora a corto plazo de los resultados clínicos en esta población |
| Seguimiento durante la transición | Primera visita tras el alta precoz, antes del séptimo día, por el médico de atención primariaVisita por un especialista en IC en las primeras 2 semanasIncluye acceso fácil telefónico o presencial, consulta con hospital de día |
| Revisión médica y de enfermería | Debe incluir:• Evaluación funcional, síntomas y signos congestivos, constantes básicas• Bioquímica y hemograma, con péptidos natriuréticos si es posible• Estratificación del riesgo• Optimización de las dosis de los fármacos con evidencia pronóstica• Revaluación de la dosis de diuréticos• Conciliación terapéutica y revisión de la adherencia• Revisión de los conocimientos del paciente y sus cuidadores sobre signos de alarma y autocuidado |
| Finalización | Cuando el paciente, tras un seguimiento de al menos 30 días, presenta:• Ausencia de progresión de síntomas congestivos, estabilidad hemodinámica (PAS ≥ 100 mmHg; FC < 70 lpm)• Función renal y electrolitos estables• Conocimientos en autocuidado y adherencia a los fármacosPara los pacientes con IC y FEVI < 40%, las dosis de fármacos basadas en la evidencia deberían ser las máximas toleradas, preferiblemente ≥ 50% de la dosis máxima recomendada |
| Informe de transición | Incluye:• Debilidades y barreras del proceso• Optimización de fármacos pendiente• Instrucciones acerca de cómo actuar en caso de signos de alarma o descompensación o en caso de modificaciones relevantes de los tratamientos• Métodos de contacto directo con la unidad de IC y responsables del paciente• Riesgo residual del paciente y si es o no candidato a terapias avanzadas en caso de empeoramiento |
ARA-II: antagonistas del receptor de la angiotensina II; ARM: antagonistas de los receptores mineralocorticoides; FC: frecuencia cardiaca; FEVI: fracción de eyección del ventrículo izquierdo; IC: insuficiencia cardiaca; IECA: inhibidores de la enzima de conversión de la angiotensina; PAS: presión arterial sistólica; SEC: Sociedad Española de Cardiología. Tabla elaborada con datos del Decálogo de transiciones al alta hospitalaria tras ingreso por insuficiencia cardicada 201948.
Decálogo de la Sociedad Española de Cardiología sobre la transición del paciente con IC hospitalizado48. AP: atención primaria; ARAII: antagonistas del receptor de la angiotensina II; ARM: antagonistas del receptor de mineralocorticoides; BNP: péptido natriurético cerebral; DAI: desfibrilador automático implantable; FC: frecuencia cardiaca; FEVI: fracción de eyección del ventrículo izquierdo; HTA: hipertensión arterial; IC: insuficiencia cardiaca; IECA: inhibidores de la enzima de conversión de la angiotensina; NT-proBNP: fracción aminoterminal del propéptido natriurético cerebral; PA: presión arterial.
* Si está disponible en el centro.
Consideraciones antes del alta del paciente con IC hospitalizado, según la Sociedad Española de Medicina Interna124. ARAII: antagonistas del receptor de la angiotensina II; ARM: antagonistas de los receptores mineralocorticoides; BB: bloqueadores beta; FC: frecuencia cardiaca; FEVI: fracción de eyección del ventrículo izquierdo; IC: insuficiencia cardiaca; IECA: inhibidores de la enzima de conversión de la angiotensina; PAS: presión arterial sistólica.
Al igual que en el apartado anterior, algunas sociedades científicas han desarrollado unas plantillas específicas con los elementos que los informes de alta deben contener.
En la tabla 14 se muestran las variables mínimas que hay que incluir según se describe en el documento colaborativo desarrollado entre la SEC y AP4.
Elementos mínimos que incluir en el alta hospitalaria del paciente ingresado por IC según la Sociedad Española de Cardiología
| Tema | Subespecificaciones |
|---|---|
| Datos de filiación | Nombre y apellidos del paciente, fecha de nacimiento, número de historia, teléfono y correo electrónico de contacto |
| Motivo del ingreso y fecha | |
| Antecedentes personales | Alergias medicamentosas, FRCV, antecedentes medico-quirúrgicos (fecha diagnóstico), ingresos previos (fecha) |
| Situación basal | Clase funcional NYHA previa al ingreso 0075Actividades básicas de la vida diaria, vive solo o acompañado |
| Procedimientos realizados durante el ingreso | Datos más relevantes de la exploración: peso (ingreso y alta), talla, presión arterial, etc. 0080Análisis: analítica general, ferritina, tirotropina, péptidos natriuréticos, etc. 0085Técnicas diagnósticas: ECG, ecocardiograma, radiografía de tórax |
| Diagnóstico principal | |
| Diagnósticos secundarios | FEVI, clase funcional de la NYHA al alta, complicaciones durante el ingreso, comorbilidades relevantes, etc. |
| Tratamientos del paciente | Deben figurar todos los fármacos que tome el paciente. Fármacos para la IC: referencia a la titulación de dosis hasta la dosis objetivo, ajuste de dosis según situación clínica, cuándo realizar el control analítico de la función renal, control de la FC |
| Establecer objetivos terapéuticos específicos | Ejercicio físico, dieta baja en sal, abstención del tabaco, evitar el consumo de alcohol, vacunaciones, PA < 140/90 mmHg, FC < 70 lpm (< 80 lpm en caso de FA), objetivo de control del cLDL según el riesgo cardiovascular, HbA1c < 7,0% |
| Programa de rehabilitación cardiaca | Ejercicio en grupo supervisado, con instrucción y apoyo psicológico |
| Calendario de visitas | Antes de 24 h tras el alta, contacto telefónico con una enfermera 0090En menos de 10 días, visita al centro de salud 0095En menos de 30 días, consulta de cardiología 0100Visita de control cada 6 meses, con revisión de la medicación y de la función renal 0105Programa de seguimiento estructurado de los pacientes en riesgo o frágiles para la detección precoz de descompensaciones y la optimización terapéutica, basado en la medida de lo posible en la intervención domiciliaria (gestoras de casos) |
| Páginas web donde encontrar más información | www.mimocardio.org 0110www.fundaciondelcorazon.com |
cLDL: colesterol unido a lipoproteínas de baja densidad; FA: fibrilación auricular; FC: frecuencia cardiaca; FEVI: fracción de eyección del ventrículo izquierdo; FRCV: factores de riesgo cardiovascular; HbA1C: glucohemoglobina; IC: insuficiencia cardiaca; NYHA: clase funcional de la New York Heart Association; PA: presión arterial. Tabla elaborada con datos de SEC-PRIMARIA. Proceso Insuficiencia Cardiaca. 20174.
La máxima demora hasta la primera visita puede variar de una guía a otra, aunque en general la primera visita se establece en un plazo máximo de 7 días4,5,118,124. Estos plazos se basan principalmente en datos observacionales provenientes de los programas de intervención tras el alta hospitalaria descritos en la literatura.
Puntos que considerar y recomendacionesEn cuanto al esquema temporal, la atención del periodo de transición al alta se debe iniciar durante la hospitalización una vez se alcanza la estabilidad hemodinámica y no se precisa medicación intravenosa. Continuará tras el alta, un mínimo de 30 días48.
En cuanto a la estructura, hay que tener presente una serie de cuestiones que se muestran en la tabla 15.
Cuestiones relacionadas con la estructura
| Debe adaptarse a cada área de salud |
| Coordinación: equipo de insuficiencia cardiaca |
| Establecer una buena relación profesional-paciente |
| Integración de la atención hospitalaria y la atención primaria. Papel fundamental de las enfermeras gestoras de casos/enfermeras de enlace hospitalarias y de atención primaria para asegurar el seguimiento |
| Monitorización de constantes básicas: presión arterial, frecuencia cardiaca y peso |
| Conocimiento de la fracción de eyección del ventrículo izquierdo |
| Formación: conocimiento de la enfermedad, medidas higiénico-dietéticas, incremento de la adherencia al tratamiento y fomento del autocuidado (identificación de signos de alarma y autocontrol de constantes) |
| Apoyo social: identificación del cuidador principal y de los problemas de índole social que afecten a la adherencia. Necesidad de incorporar a los equipos de trabajo social en los programas transicionales |
En caso de IC de novo con FEVI reducida, hay que asegurar que el paciente recibe al alta dosis iniciales de todos los grupos farmacológicos de demostrada eficacia en la mejora del pronóstico, adaptándolos a las circunstancias individuales de cada paciente. Se puede considerar la ivabradina para los pacientes en ritmo sinusal y la máxima dosis tolerada de bloqueadores beta para un adecuado control de la FC al alta (< 70 lpm). Consulte la sección 8 sobre la IC de novo para más información.
En caso de IC crónica con descompensación aguda y FEVI reducida, hay que asegurar que el paciente recibe al alta las dosis adecuadas de todos los grupos farmacológicos de demostrada eficacia en la mejora del pronóstico, bloqueadores beta, sacubitrilo/valsartán (o IECA/ARA-II) y antagonistas de los receptores mineralocorticoides (ARM). Adaptándolos a las circunstancias individuales según las condiciones hemodinámicas (presión arterial y FC), la función hepática y renal, los iones y las comorbilidades.
Por otro lado, para la optimización terapéutica al alta, es tan importante identificar, tratar y controlar los precipitantes como el tratamiento adecuado y optimizado de las comorbilidades.
A continuación se describen los criterios de alta hospitalaria5,28,48,124:
- 1.
Estabilidad hemodinámica (presión arterial y FC).
- 2.
Euvolemia (debe registrarse el peso al alta).
- 3.
Concentraciones de péptidos natriuréticos al alta (si se dispone de esa determinación en el centro).
- 4.
Resolución (o mejoría) de los síntomas y signos congestivos.
- 5.
Asegurar una cita de revisión en AP antes de los 7 días y en atención especializada antes de los 14 días tras el alta.
En la tabla 16 se muestran los datos mínimos que se debe incluir en el informe de alta4.
Elementos mínimos que incluir en el informe de alta
| Fracción de eyección del ventrículo izquierdo y etiología de la insuficiencia cardiaca |
| Constantes: presión arterial, frecuencia cardiaca y peso |
| Última analítica básica |
| Fármacos y dosificación. Fase de titulación/optimización farmacológica en que se encuentra el paciente |
| Instrucciones sobre cómo actuar en caso de descompensación (signos de alarma) o necesidad de modificar el tratamiento (realización de pruebas diagnósticas, tratamiento quirúrgico de otras dolencias, etc.) |
| Cómo contactar con el equipo de insuficiencia cardiaca e identificación de personal sanitario referente |
| Riesgo del paciente y considerar la posibilidad de futuros tratamientos avanzados si se precisaran |
En cuanto al seguimiento, la primera toma de contacto con el equipo hospitalario encargado del tratamiento de la IC durante la hospitalización debe ser, preferentemente, con una enfermera especializada en IC. La primera visita del equipo de AP se realizará antes del séptimo día tras el alta, y la primera al equipo de IC, antes de los 14 días tras el alta. Es importante asegurar al paciente y el equipo de AP un acceso fácil telefónico/presencial al equipo de IC, en consulta o a través del Hospital de Día. Las revisiones deberán incluir una serie de actuaciones, que se enumeran en la tabla 17. Por último, tras el primer mes después del alta y una vez cumplidos los siguientes criterios, se puede considerar que han finalizado los cuidados transicionales (tabla 18).
Actuaciones durante el seguimiento
| Evaluación funcional, signos y síntomas, peso, presión arterial y frecuencia cardiaca |
| Bioquímica básica (función renal, iones) y hemograma; también péptidos natriuréticos si están disponibles |
| Estratificación de riesgo (uso de escalas de riesgo) |
| Optimización y titulación de fármacos |
| Evaluación de dosis o necesidad de diuréticos. Objetivo: utilizarlos solo en caso de congestión persistente, descompensación aguda o posible precipitante (procesos infecciosos intercurrentes, previsión de ingesta excesiva de sal, etc.) |
| Conciliación terapéutica y revisión de la adherencia |
| Formación sobre signos de alarma, consejos higiénico-dietéticos y fomento del autocuidado |
Criterios de finalización de los cuidados transicionales
| Tratamiento optimizado o en fase de optimización en caso de FEVI < 40% (dosis máxima tolerada y preferiblemente > 50% de la dosis máxima recomendada) |
| Ausencia de progresión de congestión |
| Estabilidad hemodinámica (PA > 100 mmHg y FC < 70 lpm) |
| Función renal y electrolitos estables |
| Conocimiento sobre autocuidados, signos de alarma y adherencia terapéutica |
| Control de la comorbilidad (especialmente ferropenia) |
FC: frecuencia cardiaca; FEVI: fracción de eyección del ventrículo izquierdo; PA: presión arterial.
Se muestra, a continuación, un resumen de los puntos más destacados de lo expuesto anteriormente4,5,48,124:
- 1.
La transición al alta hospitalaria se debe iniciar durante la hospitalización, una vez se alcanza la estabilidad hemodinámica y no se precisa medicación intravenosa. Continuará tras el alta, un mínimo de 30 días.
- 2.
La optimización terapéutica es un elemento clave en la transición. Debe iniciarse siempre durante la hospitalización.
- 3.
La primera visita del equipo de AP se realizará antes del séptimo día tras el alta, y la primera del equipo de IC, antes de los 14 días tras el alta.
- 4.
Hay una serie de actuaciones específicas que llevar a cabo durante este periodo de seguimiento (tabla 17).
Los pacientes con IC de nueva aparición (de novo) son los que presentan síntomas de IC por primera vez. Estos pacientes constituyen una porción significativa y muy variable (entre el 12 y el 63%) de todos los pacientes con episodios de IC aguda125. De ellos, se estima que un 30-58% pueden presentarse con IC-FEr126-129.
Distintos estudios observacionales han analizado los factores de riesgo de aparición de la IC-FEr de novo. Aunque también variables, se han descrito la diabetes mellitus, los antecedentes de valvulopatía, el sexo masculino, el colesterol total, la FC, la hipertensión, los antecedentes de enfermedad cardiovascular isquémica, la hipertrofia del VI, el bloqueo de la rama izquierda del haz de His y una peor clase funcional de la NYHA126,127,130,131.
En cuanto al pronóstico de la IC-FEr de novo, el registro español RICA observó, en 279 pacientes, una mortalidad total del 6% a los 3 meses del diagnóstico y del 18% al año, mientras que en pacientes con IC crónica descompensada fueron del 11 y el 27% respectivamente. En cuanto a los reingresos hospitalarios, fueron del 13% a los 3 meses y el 30% al año en la IC-FEr de novo frente al 23 y el 45% de los pacientes con IC crónica descompensada126. Otro estudio observacional con más de 1.600 pacientes con IC-FEr de novo estimó una mortalidad hospitalaria del 4,7%, una tasa de ingresos en la UCI del 55,1% y una tasa de mortalidad total al año del 26,9%128.
La evidencia sobre la eficacia del tratamiento en estos pacientes es todavía escasa. La guía de la ESC para el tratamiento de la IC no desarrolla un capítulo específico sobre la IC-FEr de novo, pero en una de sus recomendaciones sí que indica de manera explícita que en estos pacientes se deben instaurar los tratamientos con demostrada eficacia en la IC tan pronto como sea posible5.
Los autores de un subestudio del ensayo SHIFT132, que es el primero que analiza el impacto de la duración de la IC en el pronóstico de la enfermedad, concluyen que la duración de la IC predice de manera independiente (sin relación con comorbilidades o indicadores de riesgo) un pobre resultado en pacientes con IC crónica de larga duración, y argumentan que puede estar relacionado con la larga duración del remodelado y la menor capacidad de recuperación y de remodelado inverso del miocardio enfermo. Se produce una reducción del potencial de recuperación de la IC a medida que la enfermedad avanza, pese a instaurarse tratamientos basados en la evidencia, lo que indica que los pacientes con IC de novo son los que más se beneficiarían de un inicio precoz de estos tratamientos.
EvidenciaSacubitrilo/valsartánEn el ensayo clínico PIONEER-HF133, realizado en pacientes hospitalizados por una descompensación aguda de la IC-FEr una vez lograda la estabilidad hemodinámica, se incluyó a 881 pacientes, de los que 303 (34,4%) presentaban IC-FEr de novo133. En el Congreso Europeo de IC se presentó el análisis de este subgrupo, en el que se observó que en los pacientes con IC de novo frente a aquellos con descompensación de la IC había mayor reducción de NT-proBNP y menos eventos clínicos134. Comparando sacubitrilo/valsartán con enalapril, se obtenían mejorías significativas en todos los grupos: reducción de NT-proBNP en la IC de novo y en la IC descompensada, menos mortalidad cardiovascular y rehospitalizaciones por IC en la IC de novo y descompensada, sin diferencias en el perfil de tolerabilidad y seguridad, por lo que los autores concluyeron que el sacubitrilo/valsartán es recomendable independientemente de la condición clínica en ese momento y el tiempo desde el diagnóstico (IC de novo frente a IC descompensada).
En el estudio TRANSITION, se aleatorizó a 1.002 pacientes ingresados por descompensación aguda de la IC-FEr, una vez estabilizados hemodinámicamente, a iniciar sacubitrilo/valsartán mientras estaban hospitalizados (al menos 12 h antes del alta) o tras el alta (días 1 a 14 posteriores)135. En cada grupo se incluyó una representación proporcional de pacientes con IC de novo. En el Congreso Europeo de IC136,137 se presentaron los resultados específicos del subanálisis en los 286 pacientes de novo (28,8%), que mostró que el porcentaje de pacientes que alcanzaron la dosis objetivo de sacubitrilo/valsartán fue significativamente superior en el grupo de pacientes con IC de novo (56,0%) que en el de los que ya tenían el diagnóstico de IC (44,8%) (RR = 1,30; IC95%, 1,12-1,52) y que el 90% de los pacientes con IC-FEr de novo lograron mantener la dosis (cualquiera que fuera) de sacubitrilo/valsartán. Respecto a la seguridad, el perfil y la incidencia de eventos adversos fueron similares a lo encontrado en estudios previos con sacubitrilo/valsartán133,138, y concretamente la tasa de interrupción permanente del sacubitrilo/valsartán por eventos adversos fue muy baja, tanto en el grupo de novo como en el de IC descompensada y menor en el grupo con IC de novo que en el grupo con IC ya diagnosticada (el 3,2 frente al 7,3%).
Un análisis multivariado de los datos constató que la IC-FEr de novo se asociaba de manera significativa e independiente con la probabilidad de alcanzar la dosis objetivo del tratamiento con sacubitrilo/valsartán en la semana 10, en comparación con la IC-FEr diagnosticada previamente (HR = 1,56; IC95%, 1,11-2,18)137.
En relación con los biomarcadores, los pacientes con IC de novo mostraron una mayor reducción de la Troponina T de alta sensibilidad (TnT-hs) y la NT-proBNP, lo que confirma una mayor reversibilidad de la enfermedad y una mejor respuesta al sacubitrilo/valsartán en este estadio inicial137.
En cuanto al remodelado cardiaco inverso, recientemente se han publicado datos del estudio PROVE-HF139. En el subgrupo preespecificado de pacientes con IC de novo o naïve a IECA/ARA-II, a los 12 meses de tratamiento se observaron resultados numéricos incluso mejores que en la población general del estudio en todos los parámetros ecocardiográficos: la mejoría media en la FEVI fue del 12,8% (IC95%, 11,05%-14,5%; p < 0,001); en el volumen telediastólico indexado del VI, de –13,81 ml/m2 (IC95%, –15,78 a –11,83; p < 0,001), y en el volumen telesistólico indexado del VI, de –17,88 ml/m2(IC95%, −20,07 a −15,68; p < 0,001). Asimismo se observó una reducción en el volumen indexado de la aurícula izquierda, de −8,44 ml/m2 (IC95%, −9,73 a −7,15; p < 0,001) y del índice E/e’, de −2,60 (IC95%, −3,83 a −1,37; p < 0,001).
Bloqueadores beta, IECA, ARA-II y antagonistas del receptor de mineralocorticoidesNo existen estudios clínicos aleatorizados y controlados en pacientes con IC-FEr de novo que demuestren la eficacia de los bloqueadores beta, los IECA/ARA-II o los antagonistas del receptor de mineralocorticoides en este contexto. Un estudio observacional de calidad moderada-baja, que analizó los resultados del registro Gulf CARE (registro prospectivo multicéntrico de pacientes hospitalizados con IC aguda, llevado a cabo en 7 países de Oriente Medio)140, incluyó a 260 pacientes con IC-FEr de novo. El 100% de estos pacientes ya estaban en tratamiento con bloqueadores beta, tenían una media de edad de 59 años y el 68,1% eran varones. Durante el ingreso, un grupo de los pacientes continuó con bloqueadores beta y otro los suspendió (se desconoce el motivo).
Se observó que mantener los bloqueadores beta durante el episodio de descompensación aguda redujo el riesgo de mortalidad hospitalaria de estos pacientes (OR = 0,05; IC95%, 0,022-0,112). Sin embargo, comparados con los pacientes que los suspendieron, no hubo diferencias estadísticamente significativas entre los grupos en la mortalidad a los 12 meses (el 15,3 frente al 24,4%; p = 0,10), las rehospitalizaciones por IC a los 3 meses (el 24,9 frente al 36,6%; p = 0,09) y los 12 meses (el 44,7 frente al 50,0%; p = 0,54) o la estancia hospitalaria a los 3 meses (8,1 frente a 7,7 semanas; p = 0,86) y a los 12 meses (9,6 frente a 10,9 semanas; p = 0,73)140.
Otro estudio realizado en Corea129 analizó a 5.625 pacientes consecutivos hospitalizados por IC descompensada en el registro prospectivo KorAHF. En él se muestra un subanálisis específico de los pacientes con IC-FEr de novo y ecografía (n = 1.509). Tras realizar el análisis ajustando por las distintas covariables de interés, el grupo tratado con bloqueadores beta tuvo una mejor supervivencia (HR = 0,73; 1C95%, 0,54-1,00)129. Sin embargo, esta mejora significativa en la supervivencia no se pudo demostrar con los IECA, los ARA-II y los ARM (no se muestra el resultado numérico).
Otro registro coreano141, de calidad moderada-baja, evaluó la relación entre el cumplimiento del tratamiento que se ha demostrado eficaz y los resultados clínicos a los 60 días en pacientes ingresados por descompensación aguda de la IC-FEr. En los pacientes con IC de novo (n = 1.417; el 61,6% varones; media de edad, 63,9 años), el 13,3% de los pacientes tenían prescritos bloqueadores beta en el momento del ingreso; el 26,1%, IECA; el 17,0%, ARA-II y el 7,8%, los ARM. Los resultados de los análisis multivariantes a los 60 días mostraron que los IECA o ARA-II se asociaron con menor riesgo de rehospitalización (HR = 0,57; IC95%, 0,34-0,95) y mortalidad (HR = 0,41; IC95%, 0,24-0,69); los bloqueadores beta solo se asociaron con menor riesgo de rehospitalización (HR = 0,62; IC95%, 0,41-0,95), y los los ARM no se asociaron de manera estadísticamente significativa con menor mortalidad ni con menos rehospitalizaciones.
IvabradinaUn subanálisis del estudio SHIFT132, ensayo clínico aleatorizado y a doble ciego, controlado con placebo y multicéntrico, de moderada calidad y 3 años de duración en 6.505 pacientes con IC-FEr en ritmo sinusal, analizó a 2.875 pacientes que presentaban IC de 4 semanas a 1,5 años de duración (media, 0,6 años, IC de inicio reciente según los autores; media de edad, 58 años; el 77% varones; FE media, 29,1%). Se aleatorizó a los pacientes a recibir ivabradina o placebo y se permitían otras medicaciones para la IC. La variable principal del estudio fue una medida compuesta de muerte de causa cardiovascular y/u hospitalización por empeoramiento de la IC. A los 3 años, se observó disminución de la variable principal (HR = 0,83; IC95%, 0,70-0,97), la mortalidad cardiovascular (HR = 0,89; IC95%, 0,72-1,12), las hospitalizaciones por descompensación de la IC (HR = 0,73; IC95%, 0,60-0,90) y la mortalidad por cualquier causa (HR = 0,88; IC95%, 0,55-1,40). Sin embargo, los autores señalan que estos datos no pueden extrapolarse a pacientes con IC de novo o diagnosticados muy recientemente.
Desfibrilador automático implantableNo se ha encontrado evidencia directa sobre los DAI o dispositivos de resincronización cardiaca en pacientes con IC-FEr de novo. Sí se encontró una extensa revisión de la literatura142, donde los expertos proponían distintos modelos de acción.
En los pacientes con IC-FEr que aparecen fuera del contexto de un IAM, suele aceptarse un «periodo de espera» crítico de al menos 3 meses antes de volver a evaluar la FEVI y considerar el tratamiento con un DAI. Se supone que este intervalo de tiempo permite la optimización del tratamiento médico, la recuperación del miocardio y la mejora de la FEVI, de manera que ya no esté indicado el DAI142. Es probable que en los pacientes con IC-FEr de novo haya que prolongar este periodo. Respaldan esta prolongación del plazo tanto el riesgo de muerte súbita cardiaca (tasas muy bajas en estos pacientes), la reciente ampliación del arsenal terapéutico, especialmente después de los resultados de remodelado cardiaco inverso con sacubitrilo/valsartán en el estudio PROVE-HF139, y un mayor foco en una toma de decisiones compartida. Según estos autores, en la ampliación de este intervalo hay que considerar el inicio gradual del tratamiento farmacológico con 3 o más fármacos, la monitorización ambulatoria de parámetros analíticos, hemodinámicos y sintomáticos y el hecho de que muchos tratamientos precisan de 1 a 3 cambios posológicos antes de lograr las dosis objetivo, con intervalos entre dichos cambios de dosis de 2 a 8 semanas142.
Por lo tanto, los pacientes con IC-FEr de novo representan un momento de oportunidad terapéutica, en los que la optimización farmacológica puede determinar una mejor respuesta clínica y una mayor reversibilidad. En este contexto, según el conocimiento actual, debe considerarse un tratamiento completo incluyendo un inhibidor de la neprilisina y del receptor de la angiotensina (INRA), un bloqueador beta y un antagonista del receptor de mineralocorticoides en primera línea, tal y como ha planteado recientemente la ESC28 en el consenso de expertos, en el que se recomienda que inicien el sacubitrilo/valsartán los pacientes hospitalizados con IC de novo (o IC descompensada) para reducir el riesgo a corto plazo de eventos adversos y simplificar el tratamiento evitando la necesidad de titular los IECA primero y después cambiar a sacubitrilo/valsartán.
Puntos que considerar y recomendaciones- 1.
El paciente que presenta IC y recibe el diagnóstico por primera vez (de novo) requiere un abordaje diagnóstico y etiológico intensivo buscando identificar y corregir sus causas y factores agravantes o precipitantes.
- 2.
El paciente con IC de novo se encuentra en la fase inicial de la enfermedad, que es más susceptible de mejoría y respuesta favorable a los tratamientos modificadores de la enfermedad. Por ello, resulta imprescindible realizar un esfuerzo terapéutico basado en los fármacos con beneficio pronóstico demostrado:
- •
Además del control de los síntomas y signos congestivos, es necesario tratar las 4 dianas terapéuticas: inhibición del sistema nervioso simpático, angiotensina y aldosterona, incluyendo la potenciación de los PN mediante la inhibición de la neprilisina.
- •
De manera individualizada, deben introducirse los diferentes fármacos modificadores de la enfermedad a través de dichas dianas terapéuticas. Por la rapidez y la precocidad de sus beneficios clínicos, demostrada en ensayos clínicos fundamentales, los bloqueadores beta y el sacubitrilo/valsartán deberían priorizarse.
- •
El tratamiento se debe monitorizar y revisar frecuentemente, hasta conseguir su optimización, en la cual debe incluirse alcanzar la dosis objetivo o la máxima tolerada en las 4 dianas terapéuticas. Además, deben implementarse las medidas de formación y autocuidado del paciente y sus familiares.
- •
Dicha optimización inicial debe incluir la revaluación a la baja hasta la menor dosis posible de diuréticos para evitar los síntomas y signos congestivos, y una FC < 70 lpm en pacientes con ritmo sinusal.
- •
Este esfuerzo terapéutico debe realizarse tanto en pacientes que son diagnosticados de IC en un ingreso hospitalario como aquellos que son diagnosticados en el medio ambulatorio. En el paciente hospitalario debe adaptarse el modelo de atención tanto dentro del hospital como tras el alta para conseguir la optimización terapéutica tan pronto como sea posible, dado el riesgo de eventos adversos a corto plazo.
- •
- 3.
¿Se debe considerar el sacubitrilo/valsartán frente a los IECA/ARA-II como primera línea de tratamiento?
- •
Considerando la precocidad de sus beneficios clínicos y el alto riesgo de eventos adversos en esta población, en particular los pacientes hospitalizados, debe considerarse como primera línea de tratamiento133.
- •
Respaldan esta recomendación el documento de actualización de las guías europeas28, la experiencia acumulada en práctica clínica y todos los resultados provenientes de estudios aleatorizados, que demuestran la adecuada tolerabilidad, su mejor seguridad renal y su superioridad clínica en todos los escenarios, tanto en el contexto ambulatorio como en el hospitalario.
- •
Se muestra, a continuación, un resumen de los puntos más destacados de lo expuesto anteriormente28,132,133,135,137,142:
- 1.
En el paciente con IC de novo, el abordaje diagnóstico y etiológico debe ser intensivo buscando identificar y corregir sus causas y factores agravantes o precipitantes.
- 2.
Hay que basar el tratamiento en los fármacos con beneficio pronóstico demostrado.
- 3.
Se debe considerar el sacubitrilo/valsartán como primera línea de tratamiento.
La ESC define la IC crónica «estable» como aquella cuyos síntomas y signos en general no han cambiado en el último mes5.
Según esta definición, para establecer que un paciente tiene una IC estable, se le podría preguntar: «¿Cómo se encuentra?», y la respuesta del paciente sería «Bien, sigo igual desde la última visita»143. Esto, sin embargo, se debe evaluar con mucha precaución, porque se ha observado, entre otras cuestiones, que la concordancia entre el paciente y la clasificación funcional de la NYHA según el médico está por debajo del 50% y es menor cuanto peor es la clase funcional del paciente144. Además, en un estudio transversal de base poblacional, se comunicó que los pacientes con IC sintomática en cualquier momento (estadio C según la clasificación del ACC/AHA), pero sin síntomas ni signos en el momento de la revisión médica, tenían un riesgo de muerte significativo (mortalidad del 22% a los 5 años)145.
Asimismo, con los tratamientos que se han demostrado eficaces para la IC junto con diuréticos, y atendiendo a la definición de la ESC, un grupo importante de pacientes atendidos en la práctica diaria tendrían una IC estable. En este contexto, un estudio observacional, que incluyó a 400 pacientes con IC-FEr, halló que la dosis de furosemida identificó en el seguimiento una mayor mortalidad de los pacientes sin congestión y clasificados como clínicamente estables146. En otro estudio similar, en pacientes aparentemente estables, la dosis de furosemida se asoció de manera independiente con un mayor riesgo de mortalidad, sobre todo de pacientes con tratamiento optimizado y en mejor clase funcional147. Por lo tanto, hay que tener en cuenta estos datos y considerar la «estabilidad» de un paciente con IC que está en tratamiento con diuréticos más bien como una falsa estabilidad en la que los diuréticos actuarían como marcador de alto riesgo147,148.
Por otro lado, es importante destacar que, a pesar de que algunos pacientes con IC crónica no presenten cambios en sus síntomas y signos, sí tienen cambios clínicos debidos al continuo efecto deletéreo de la activación compensatoria del sistema renina-angiotensina-aldosterona (SRAA) y del sistema nervioso simpático149. Así, esto indica que no existe una IC «estable» como tal, ya que la IC sería por definición una enfermedad progresiva. Varios subanálisis del estudio Val-HeFT, que incluyó a pacientes con IC-FEr «estables» y optimizados, mostraron que en ellos se producen incrementos de la TnT-hs y los PN con el tiempo y que estos aumentos, incluso leves, se asociaron con un mayor riesgo de muerte150,151. Es posible, según algunos autores, que pequeños cambios en las concentraciones de biomarcadores (incluso en pacientes «estables») estén reflejando un daño/estrés miocárdico progresivo, con lo que podrían utilizarse en la monitorización de la IC150,151. En este sentido, los resultados del estudio SHIFT indican que la duración de la IC es un factor independiente predictor de muerte cardiovascular y hospitalización por IC, probablemente debido a un remodelado cardiaco que a largo plazo tiene menor capacidad de recuperación132. Además, en el estudio PARADIGM-HF, en pacientes con IC-FEr crónica (el 75% en NYHA I-II), se observó una tasa de muerte súbita del 6,67%152.
En base a lo expuesto, algunos autores indican que el término «estable» aplicado a la IC debería dejar de emplearse, a favor de «IC optimizada o no optimizada» para mantener a los clínicos alerta de que la optimización del tratamiento recomendado por las guías es la única manera de enlentecer o detener la progresión de la enfermedad143. Este punto puede ser muy relevante si se tiene en cuenta que diversos estudios han mostrado que el porcentaje de pacientes con tratamiento optimizado es subóptimo. Datos del registro CHAMP-HF, con más de 3.500 pacientes con IC-FEr muestran que el 27% de los pacientes candidatos a INRA, IECA o ARA-II no los tenían prescritos, el 33% estaba con bloqueadores beta y el 67%, con ARM153. Pero además, muchos pacientes no alcanzaban las dosis objetivo. Solo las alcanzaron el 14% de los pacientes que estaban en tratamiento con INRA, el 17% con IECA/ARA-II y el 28% con bloqueadores beta, mejor en el caso de los pacientes con ARM (77%). En la práctica diaria, la aparición de eventos adversos con estos tratamientos (muchos, dependientes de la dosis), las comorbilidades o la polimedicación podrían explicar, al menos en parte, estos datos. Sin embargo, también hay estudios que muestran que la mayoría de los pacientes cuya atención (lo que incluye el ajuste de dosis) está estandarizada alcanzan las dosis objetivo, po r lo que es probable que también haya un componente de inercia del médico154.
Actualmente se han identificado 4 dianas terapéuticas fundamentales en el tratamiento de la IC: PN, angiotensina II, norepinefrina y aldosterona. Los grupos farmacológicos dirigidos a potenciar la primera diana (sacubitrilo/valsartán, que también bloquea la segunda diana) y a bloquear las 3 siguientes: IECA o ARA-II, bloqueadores beta y ARM han demostrado ser eficaces en la reducción de la morbimortalidad en la IC-FEr155. La evidencia actual indica que es mejor abordar la 4 dianas terapéuticas, aunque sea a dosis bajas, que alcanzar dosis altas de un grupo farmacológico dejando otro sin iniciar155.
En el documento de Consenso de la ESC-HFA de 201928 sobre el tratamiento de los pacientes con IC, se describe un metanálisis en red que analizó la eficacia de la combinación de tratamientos modificadores de la IC a través de 58 estudios156. Las combinaciones más efectivas fueron: a) sacubitrilo/valsartán + bloqueador beta + ARM y b) IECA + bloqueador beta + ARM + ivabradina, que redujeron la mortalidad por cualquier causa respecto al placebo en un 62 y un 59%, respectivamente, y las hospitalizaciones por cualquier causa en un 42% en ambas combinaciones. Sin embargo, a pesar de estos datos, en ese mismo documento señalan que en la práctica diaria estos tratamientos se prescriben poco y que muchos pacientes no alcanzan las dosis objetivo28.
En ese mismo consenso28 se recomienda el cambio de los IECA/ARA-II por el sacubitrilo/valsartán en los pacientes con IC-FEr ambulatorios que siguen sintomáticos a pesar de un tratamiento médico óptimo con un IECA, un bloqueador beta y un ARM, para reducir el riesgo de hospitalización y muerte.
En el documento de consenso de expertos norteamericanos de 2017, en pacientes con IC-FEr crónica y sintomática (NYHA II-III) que pueden tolerar IECA/ARA-II, se recomienda cambiar a sacubitrilo/valsartán para alcanzar una mayor reducción de la morbimortalidad de estos pacientes (clase de recomendación I, nivel de evidencia B-R)68. También indica que, una vez se ha realizado el diagnóstico de IC, se debe iniciar la denominada guideline-directed medical therapy, y los tratamientos se deben titular para alcanzar la dosis objetivo (o la máxima dosis tolerada) con una frecuencia que no supere las 2 semanas. Los clínicos deben alcanzar este objetivo a los 3-6 meses68.
Por lo tanto, la IC-FEr es una enfermedad siempre progresiva, incluso en ausencia de síntomas o signos congestivos o una situación sin aparentes cambios clínicos. Una actitud activa y continua hacia la optimización de los tratamientos que modifican la evolución de la enfermedad es clave. Para ello, el bloqueo neurohormonal completo junto con el efecto beneficioso de la inhibición de neprilisina (IRNA + bloqueador beta + ARM) es hoy el tratamiento más efectivo.
Puntos que considerar y recomendaciones- 1.
La IC es una enfermedad progresiva, por lo que la estabilidad es solo aparente. Una vez diagnosticada, incluso en estadios asintomáticos y a pesar de la ausencia de ingresos recientes, la mortalidad es alta a medio plazo, en particular por muerte súbita. La disfunción ventricular, los biomarcadores por encima de los valores normales o la necesidad de diuréticos para evitar los síntomas o signos son marcadores de progresión, que en muchas ocasiones pasan inadvertidos. La enfermedad subyacente no se cura, solo se intenta controlarla y enlentecer la progresión.
- 2.
El término «estable» no debería emplearse, pues puede condicionar un infratratamiento. En su lugar, debería considerarse el término «optimizado» o «no optimizado» en referencia al uso de los tratamientos modificadores de la progresión de la enfermedad y que han demostrado igual beneficio en todas las fases de la enfermedad.
- 3.
En pacientes cuyo tratamiento optimizado lleva a una mejoría significativa de la función ventricular y los síntomas, incluso a la normalización, no se debe disminuir o suspender los fármacos modificadores de la enfermedad. Se ha demostrado que el hacerlo supone un riesgo de empeoramiento, incluso con una función ventricular recuperada.
Se muestra, a continuación, un resumen de los puntos más destacados de lo expuesto anteriormente28,145,154,155:
- 1.
El término «estable» no debería emplearse en la IC; es preferible el término «optimizado».
- 2.
El tratamiento debe basarse en los fármacos con beneficio pronóstico demostrado.
- 3.
El bloqueo neurohormonal completo, junto con el efecto beneficioso de la inhibición de neprilisina (INRA + bloqueador beta + ARM), es actualmente el tratamiento más efectivo.
El sacubitrilo/valsartán está aprobado para el tratamiento de la IC-FEr sintomática en adultos157. La aprobación se apoyó principalmente en el estudio fundamental PARAD1GM-HF, que comparó el sacubitrilo/valsartán con el enalapril.
El estudio PARAD1GM-HF138 (n = 8.442; media de edad, 64 años; el 79% hombres; FE media, 29,5%) comparó el sacubitrilo/valsartán con el enalapril en pacientes ambulatorios sintomáticos (NYHA II-IV) en tratamiento óptimo para la IC (bloqueadores beta, ARM). El estudio terminó prematuramente por el beneficio estadísticamente significativo de los pacientes que tomaban el sacubitrilo/valsartán: reducción del 20% en la variable principal compuesta de mortalidad cardiovascular o primera hospitalización por IC (HR = 0,80; IC95%, 0,73-0,87). El sacubitrilo/valsartán también fue superior a sus componentes individuales: reducción del 20% de muerte cardiovascular (HR = 0,80; IC95%, 0,71-0,89) y reducción del 21% en la primera hospitalización por IC (HR = 0,79; IC95%, 0,71-0,89) respecto al enalapril138. En cuanto a la seguridad, el sacubitrilo/valsartán tiene mejor seguridad renal158. En el grupo del sacubitrilo/valsartán, hubo menos pacientes que interrumpieron el tratamiento por eventos adversos (el 10,7 frente al 12,3%; p = 0,03) o por insuficiencia renal (el 0,7 frente al 1,4%; p = 0,002). Se observó un mayor número de eventos de hipotensión sintomática comparado con el enalapril (el 14,0 frente al 9,2%; p < 0,001) que no se correlacionó con hipotensiones graves, de manera que la tasa de interrupción de tratamientos por esta causa fue similar con el sacubitrilo/valsartán y con enalapril (el 0,9 frente al 0,7%; p = 0,38).
Otros beneficios observados con el sacubitrilo/valsartán frente al enalapril en el paciente ambulatorio fueron: reducción del 16% de muerte por cualquier causa (HR = 0,84; IC95%, 0,76-0,93; p < 0,001)138, reducción del 20% de muerte cardiovascular (HR = 0,80; IC95%, 0,72-0,89; p < 0,001), reducción del 20% de muerte súbita cardiaca. (HR = 0,80; IC95%, 0,68-0,94; p = 0,008]), reducción del 21% de muerte por empeoramiento de la IC (HR = 0,79; IC95%, 0,64-0,98; p = 0,034)152, reducción del 29% de la probabilidad de reingresar de forma repetida por IC (p = 0,001)159 y reducción del 30% de las visitas a urgencias por IC (HR = 0,70; IC95%, 0,52-0,94; p = 0,017)159.
En conjunto, el sacubitrilo/valsartán frente a enalapril redujo significativamente tanto el riesgo de muerte (total y cardiovascular, súbita o por empeoramiento de la IC) como el riesgo de progresión o empeoramiento, cuyo mayor exponente son las hospitalizaciones, y que también se refleja en la mejora de síntomas y calidad de vida, necesidad de diuréticos y hospitalizaciones graves. Estos beneficios clínicos tienen su reflejo fisiopatológico en la mejora de la geometría y la función cardiacas (remodelado inverso), así como en los biomarcadores de necrosis y estrés miocárdico139.
Evidencia, puntos que considerar y recomendacionesSacubitrilo/valsartán en pacientes que no han llegado a dosis plenas de IECA/ARA-IIEn el estudio TITRATION se evaluó la tolerabilidad de 2 regímenes diferentes de ajuste de dosis de sacubitrilo/valsartán en pacientes con IC-FEr. Tras un periodo inicial abierto de 5 días con sacubitrilo/valsartán 50 mg/12 h (24 mg/26 mg), se aleatorizó a los pacientes a seguir un régimen «condensado», o rápido 100 mg/12 h (49 mg/51 mg) durante 2 semanas seguidos de 200 mg/12 h (97 mg/103 mg) durante 9 semanas más, o uno «conservador», o lento (50 mg/12 h durante 2 semanas, 100 mg/12 h durante 3 semanas y finalmente 200 mg/12 h durante 6 semanas más)160. También se estratificó a los pacientes en función de la dosis previa de IECA/ARA-II (dosis altas o bajas).
Los autores concluyen que ambos regímenes presentan un perfil de tolerabilidad similar al de otros tratamientos aprobados para la IC. Destacan que en ambos casos se llega a cifras altas de éxito en alcanzar la dosis óptima en una amplia franja de pacientes (ambulatorios y hospitalizados) y también en aquellos con dosis previas de IECA/ARA-II bajas. Añaden que, en este último grupo, una titulación más gradual puede aumentar la probabilidad de alcanzar y mantener la dosis objetivo.
Sacubitrilo/valsartán en pacientes naiveEl Consenso de la ESC-HFA apunta que el sacubitrilo/valsartán es seguro y eficaz para un amplio espectro de pacientes con IC-FEr. Dado que su seguridad es similar en pacientes naïve para IECA/ARA-II, se puede considerar el inicio de sacubitrilo/valsartán también en estos pacientes28.
El estudio TRANSITION135,137 incluyó a 326 pacientes naïve para IECA/ARA-II (el 32,9% de la muestra total) que iniciaron la toma de sacubitrilo/valsartán. No se encontraron diferencias entre los pacientes naïve y los que ya habían recibido IECA/ARA-II en cuanto al objetivo primario: alcanzar la dosis objetivo de 97 mg/103 mg/12 h (o 200 mg/12 h) a las 10 semanas de tratamiento. Tras un análisis multivariante, el hecho de ser naïve o no para IECA/ARA-II no fue un factor predictivo del éxito en el ajuste de dosis del sacubitrilo/valsartán (OR = 1,04; IC95%, 0,75-1,45).
Tampoco se encontraron diferencias estadísticamente significativas entre grupos (naïve o no) en las variables secundarias, como el mantenimiento de las dosis de 49 mg/51 mg o 97 mg/103 mg 2 veces al día durante al menos 2 semanas hasta llegar a la semana 10 o la interrupción definitiva del fármaco por eventos adversos (el 5,8 frente al 6,2%; RR = 0,94; IC95%, 0,55-1,59)161.
La disminución de NT-proBNP y de TnT-hs a las 10 semanas fue significativamente mayor en el grupo de pacientes naïve que en el grupo de pacientes naïve frente a no naïve (p < 0,001) y se observaba ya desde la semana 4161.
Para terminar, en la seguridad solo hubo diferencias estadísticamente significativas en el porcentaje de pacientes con hiperpotasemia, que fue significativamente inferior en el grupo naïve que en el no naïve (el 7,1 frente al 12,9%; p = 0,005)161.
En el estudio P1ONEER-HF (véase el apartado de hospitalización)162, el uso de sacubitrilo/valsartán en la hospitalización, comparado con enalapril, se asoció a mayores reducciones de la NT-proBNP a las 8 semanas, tanto en los pacientes naïve (−61,9 frente a −47,5; p < 0,001) como en los no naïve (−46,8 frente a −24,2; p < 0,001), y de TnT-hs (naïve, RR = 0,87; IC95%, 0,77-0,99; no naïve, RR = 0,84; IC95%, 0,72-0,97). Se generó un objetivo compuesto sobre eventos clínicos relevantes que incluía la muerte, el reingreso por IC, el implante de DAI y el trasplante cardiaco. Comparado con el enalapril, el sacubitrilo/valsartán redujo significativamente el riesgo de alcanzar este desenlace en el grupo de pacientes naïve (RR = 0,52; IC95%, 0,29-0,95) y en el de los no naïve (RR = 0,56; IC95%, 0,34-0,93). En cuanto a la seguridad, no hubo diferencias estadísticamente significativas entre el sacubitrilo/valsartán y el enalapril en deterioro de la función renal, hipotensión sintomática o hiperpotasemia, tanto en los pacientes naïve como en los no naïve162.
En cuanto a remodelado cardiaco inverso, recientemente se han publicado datos del estudio PROVE-HF139, un estudio abierto de fase IV que incluyó a 794 pacientes (media de edad, 65 años; FEVI media, 28,2%), cuyo objetivo era determinar en pacientes con IC-FEr que inician sacubitrilo/valsartán si los cambios en la NT-proBNP se correlacionan con cambios en las medidas de volumen y función cardiacas (remodelado cardiaco inverso). En el subgrupo preespecificado de pacientes con IC de novo o naïve a IECA/ARA-II, a los 12 meses de tratamiento se observaron resultados numéricos incluso mejores que en la población general del estudio en todos los parámetros ecocardiográficos: la mejoría media en la FEVI fue del 12,8% (IC95%, 11,05%-14,5%; p < 0,001); en el volumen telediastólico indexado del VI, −13,81 ml/m2; IC95%, −15,78 a −11,83; p < 0,001), y en el volumen telesistólico indexado del VI, −17,88 ml/m2; IC95%, −20,07 a −15,68). También se objetivó una reducción del volumen indexado de la aurícula izquierda de −8,44 ml/m2; IC95%, −9,73 a −7,15; p < 0,001) y del índice E/e’ de −2,60; IC95%, −3,83 a −1,37; p < 0,001).
Por lo tanto, los pacientes naïve para IECA/ARA-II tienen una tolerancia similar y se benefician de iniciar sacubitrilo/valsartán en igual o mayor medida que los pacientes con tratamiento previo con IECA/ARA II.
Sacubitrilo/valsartán durante la hospitalizaciónEl Documento de Consenso de la ESC-HFA, basado en la evidencia que se expone a continuación, concluye que el sacubitrilo/valsartán se puede prescribir a los pacientes hospitalizados con IC de novo o descompensada para reducir el riesgo a corto plazo de eventos adversos y simplificar el tratamiento (evitando la necesidad de titular primero los IECA y después cambiar al sacubitrilo/valsartán)28. También indica que, dado que estos pacientes ya tienen alto riesgo de eventos, no es necesario comprobar las concentraciones plasmáticas de los PN antes de iniciar el sacubitrilo/valsartán.
El estudio PIONEER-HF133 incluyó a 881 pacientes hospitalizados por una descompensación aguda de la IC-FEr. Una vez alcanzada la estabilidad hemodinámica, se aleatorizó a los pacientes al sacubitrilo/valsartán (dosis objetivo, 97 mg/103 mg/12 h) o enalapril (dosis objetivo, 10 mg/12 h) durante 8 semanas. Posteriormente, hubo una extensión abierta del estudio en la que todos los pacientes recibían sacubitrilo/valsartán durante 4 semanas más, también los inicialmente aleatorizados al enalapril.
Respecto al objetivo principal del estudio, el sacubitrilo/valsartán redujo significativamente y de manera precoz la concentración promediada en el tiempo (entre 4 y 8 semanas comparado con la basal) de NT-proBNP frente a enalapril (el −46,7 frente al −25,3%; índice de cambio, 0,71; IC95%, 0,63-0,81; p < 0,001). La reducción fue significativa ya desde la semana 1 (índice de cambio, 0,76; IC95%, 0,69-0,85). El tratamiento con sacubitrilo/valsartán también se asoció con una disminución del 44% del riesgo de rehospitalización comparado con el enalapril (HR = 0,56; IC95%, 0,37-0,84) y del 46% del objetivo compuesto de eventos clínicos relevantes (muerte, rehospitalización por IC, implante de un dispositivo de asistencia ventricular izquierda e inclusión en la lista de trasplante cardiaco) (HR = 0,54; IC95%, 0,370,79). No hubo diferencias estadísticamente significativas entre el sacubitrilo/valsartán y el enalapril en deterioro de la función renal, hiperpotasemia, hipotensión sintomática o angioedema, así como en el porcentaje de interrupción permanente de la medicación. El 55,2% de los pacientes lograron alcanzar la dosis objetivo de sacubitrilo/valsartán y el 60,8%, la de enalapril.
Sobre los biomarcadores, el sacubitrilo/valsartán redujo significativa y precozmente los valores medios de TnT-hs (p < 0,001) y de ST2 soluble (p = 0,035) comparado con el enalapril, efecto que se mantuvo a las 8 semanas y fue paralelo a la reducción de NT-proBNP163.
También se evaluó el efecto del inicio hospitalario de sacubitrilo/valsartán en las rehospitalizaciones por IC a los 30 días y a las 8 semanas164. A los 30 días hubo una disminución no significativa del riesgo de rehospitalización con el sacubitrilo/valsartán respecto al enalapril, que fue significativa a las 8 semanas (OR = 0,61; IC95%, 0,39-0,95). También el tiempo hasta el primer reingreso por IC fue significativamente menor con el sacubitrilo/valsartán que con el enalapril (HR = 0,55; IC95%, 0,35-0,88).
Por último, en la fase de extensión abierta del estudio PIONEER-HF (de las semanas 8 a 12)165, los pacientes que habían iniciado la toma de enalapril cambiaron al sacubitrilo/valsartán, así todos los pacientes estuvieron en tratamiento con sacubitrilo/valsartán durante 4 semanas más. La reducción de NT-proBNP de las semanas 8 a 12 fue del 35,8% en los pacientes que habían cambiado de enalapril a sacubitrilo/valsartán (IC95%, −30,6 a −40,7) y del 18,5% en los pacientes que estuvieron desde el principio del estudio con sacubitrilo/valsartán (IC95%, −11,8 a −24,7). Por otro lado, el riesgo de muerte, reingreso por IC o implante de un dispositivo de asistencia ventricular izquierda en este periodo de extensión fue significativamente menor en los pacientes que continuaban con sacubitrilo/valsartán que en los que inicialmente recibían enalapril y habían cambiado a sacubitrilo/valsartán (HR = 0,67; IC95%, 0,48-0,94). En cuanto a seguridad, no hubo diferencias entre estos 2 grupos en deterioro de la función renal, hiperpotasemia, hipotensión sintomática o angioedema.
En el estudio TRANSITION, ensayo clínico aleatorizado y abierto, se incluyó a 1.002 pacientes ingresados por IC-FEr aguda135,161. Una vez en estabilidad hemodinámica, se los aleatorizó a sacubitrilo/valsartán en el hospital (al menos 12 h antes del alta) o una vez dados de alta (días 1 a 14 posteriores). Las dosis de inicio y las dosis objetivo fueron similares a las de los demás estudios con este fármaco. La titulación del fármaco era cada 2-4 semanas según el criterio del clínico. El objetivo principal era el porcentaje de pacientes que habían alcanzado la dosis objetivo de sacubitrilo/valsartán (97 mg/103 mg/12 h) a las 10 semanas. No hubo diferencias significativas entre ambos grupos por iniciar el fármaco antes o después del alta hospitalaria, en los eventos adversos o en la interrupción definitiva del fármaco por eventos adversos (RR = 1,49; IC95%, 0,90-2,46).
Por último, en los análisis multivariados para analizar los predictores de éxito en la titulación, no se encontró que iniciar el sacubitrilo/valsartán en el hospital o tras el alta hospitalaria fuera un factor predictivo (OR = 1,21; IC95%, 0,93-1,59)137, por lo que los autores concluyen que el inicio precoz de sacubitrilo/valsartán durante la hospitalización por IC descompensada es factible.
Sacubitrilo/valsartán en la IC de novoConsiderando la precocidad de los beneficios clínicos y el gran riesgo de eventos adversos en esta población, en particular en los pacientes hospitalizados, el sacubitrilo/valsartán debe considerarse como primera línea de tratamiento133 (consulte la sección 8 sobre IC de novo para ampliar información).
A esta recomendación da apoyo el documento de actualización de las guías europeas28, así como la experiencia acumulada en práctica clínica, y todos los resultados provenientes de estudios aleatorizados, que demuestran la adecuada tolerabilidad, la mayor seguridad renal y su superioridad clínica en todos los escenarios, tanto en el contexto ambulatorio como en el hospitalario.
Sacubitrilo/valsartán y remodelado cardiaco inverso izquierdo completoEl remodelado cardiaco se define como el conjunto de cambios moleculares, celulares e intersticiales que se manifiesta clínicamente como cambios en el tamaño, la masa, la geometría y la función del corazón después de una lesión. La disfunción cardiaca es la principal consecuencia del remodelado cardiaco, que resulta en una pérdida progresiva de la función ventricular, inicialmente asintomática, que evoluciona a signos y síntomas de IC166. El aumento de tan solo 10 ml en los volúmenes del VI (telesistólico y telediastólico) se asocia con un aumento significativo de muerte u hospitalización por IC167. La disminución de tan solo el 10% de la FEVI se asocia con un aumento significativo de muerte u hospitalización por IC168. El remodelado inverso (disminución de volúmenes del VI, aumento de la FEVI) conduce a una disminución de la mortalidad169.
Según los resultados de los estudios mecanísticos EVALUATE-HF (frente a enalapril, 3 meses)170, PROVE-HF (sin enmascaramiento, 12 meses)139 y PRIME (frente a valsartán, 3 meses)171, el sacubitrilo/valsartán se asocia a un remodelado cardiaco inverso izquierdo completo (disminución de volúmenes del VI, del volumen de la aurícula izquierda, de la insuficiencia mitral funcional y aumento de la FEVI) que es precoz y progresivo.
El estudio PROVE-HF, en el que los ecocardiogramas se analizaron en un Core Lab a ciegas en cuanto a temporalidad y situación clínica una vez finalizado el estudio, mostró que la mejoría de la FEVI era significativa ya a los 6 meses, con un aumento medio del 5,2%, que a los 12 meses llegaba al 9,4%, y que en el 25% de los pacientes era > 13,4%. En relación a los tres subgrupos preespecificados (pacientes con niveles basales de PN inferiores a los requeridos para la inclusión en el estudio PARADIGM-HF, pacientes que no alcanzaron dosis máximas de sacubitrilo/valsartán, pacientes que presentaban IC de novo o eran naïve para IECA/ARA II), los resultados fueron similares a la población general del estudio, siendo el aumento medio de la FEVI en el grupo de IC de novo o sin tratamiento previo para IECA/ARA II incluso mejor (+12,8%).
ResumenSe muestra, a continuación, un resumen de los puntos más destacados de lo expuesto anteriormente133,135,137,139,161:
- 1.
Sacubitrilo/valsartán ha demostrado buena tolerabilidad (similar a la de IECA/ARA II) en todos los escenarios de la IC con FEr, y mejor seguridad renal que IECA/ARA II, a la vez que un beneficio clínico precoz y superior a IECA/ARA II en términos tanto de mortalidad (total, cardiovascular, muerte súbita, por empeoramiento de la IC) como de progresión de la enfermedad y hospitalizaciones, con evidencia de remodelado cardiaco inverso izquierdo completo.
- 2.
Por ello, sacubitrilo/valsartán debe considerarse como la primera opción terapéutica, en vez de IECA/ARA II, en ausencia de contraindicaciones, en todos los escenarios clínicos de la IC-FEr.
La insuficiencia renal (IR) es muy frecuente en pacientes con IC y empeora el pronóstico. La prevalencia puede alcanzar el 30% de los pacientes con IC y alrededor de un 25% puede sufrir un deterioro de la función renal durante una hospitalización por IC descompensada172, que puede ser casi el doble en presencia de diabetes mellitus tipo 2 (DM2)173.
El tratamiento farmacológico de la IC en pacientes con IR tiene aspectos de especial interés. La evidencia científica es escasa, ya que la IR grave es un criterio de exclusión habitual en los ensayos clínicos. Los inhibidores del SRAA (iSRAA), fármacos clave en el tratamiento de la IC-FEr, pueden causar disfunción renal o hiperpotasemia, en especial en el inicio o la titulación del tratamiento, con enfermedades intercurrentes o tratamientos concomitantes (p. ej., con antiinflamatorios no esteroideos [AINE]) y en el empeoramiento de la IC. Sin embargo, reducciones leves de la función renal durante el tratamiento con iSRAA no reducen su beneficio pronóstico174.
La disfunción renal en la IC hay que entenderla como un proceso dinámico, ya que la función renal durante el tratamiento de la IC experimenta cambios de origen multifactorial, como por congestión o bajo gasto, activación neurohormonal, aumento de la presión intraabdominal y el tratamiento con diuréticos, iSRAA o inotrópicos. De ahí que la monitorización estrecha de la función renal y el potasio (K+) sérico sea clave para guiar el tratamiento. Sin embargo, las interacciones entre los iSRAA y la función renal pueden no ser bien entendidas y existe el riesgo de una preocupación «excesiva»; por ejemplo, que por un aumento leve de la creatinina o una reducción de la tasa de filtrado glomerular estimada (TFGe) se prescriban menos los fármacos que mejoran la supervivencia, lo que impediría que estos pacientes se beneficien de ellos174.
EvidenciaSacubitrilo/valsartán (inhibidor del receptor de la angiotensina)El estudio PARAD1GM-HF (en el que un 33% de los pacientes tenían IR con TFGe entre 30 y 60 ml/min/1,73 m2) mostró que el sacubitrilo/valsartán tiene mejor perfil renal que el enalapril, con menor deterioro de la TFGe independientemente de la presencia o no de 1R158. Además, este menor deterioro renal fue el doble en los pacientes con DM2 comparado con los no diabéticos175. Con respecto al objetivo principal del estudio (muerte cardiovascular o un primer ingreso por IC) en pacientes con IR, la reducción del riesgo fue mayor con el sacubitrilo/valsartán158.
Las guías de IC de la ESC5 recomiendan una TFGe > 30 ml/min/1,73 m2 y K+ sérico ≤ 5,4 mEq/l antes de iniciar el sacubitrilo/valsartán. En el consenso norteamericano se contempla que en caso de TFGe < 30 podría usarse con cautela, con dosis inicial de 24 mg/26 mg/12 h y un control más estrecho de la función renal y el K+. En pacientes con IR moderada (TFGe 30-60), se aconseja una dosis inicial de 24 mg/26 mg/12 h, y en aquellos con TFGe entre 60-90, no se requiere ajuste de la dosis. No hay experiencia en IR terminal.
El riesgo de disfunción renal tras el tratamiento con sacubitrilo/valsartán puede aumentar con la deshidratación, la hipotensión o la toma concomitante de A1NE. Por ello, se debe retirar los fármacos innecesarios (p, ej., diuréticos en ausencia de congestión) y se debe considerar la reducción gradual de la dosis de sacubitrilo/valsartán si se produce un deterioro significativo de la función renal.
IECA/ARA-IIEstudios sobre el efecto de los IECA/ARA-II en la IC con IR muestran resultados heterogéneos; además, la IR grave ha sido criterio de exclusión de los ensayos clínicos. Con respecto a los IECA, se ha visto desde ausencia de beneficio en mortalidad, en pacientes con IR moderada (TFGe 30-60 ml/min/1,73 m2) sin DM2176, hasta beneficio únicamente en hospitalizaciones totales y por IC. Tampoco hubo diferencias estadísticamente significativas en la mortalidad según la dosis de enalapril alcanzada. Es decir, las dosis subóptimas de enalapril tendrían el mismo efecto en la mortalidad que las dosis óptimas177,178. En cuanto a los ARA-II, el estudio CHARM179, que incluyó a casi 1.000 pacientes con IR, mostró que la reducción del riesgo del objetivo combinado de mortalidad cardiovascular y hospitalizaciones por empeoramiento de la IC con candesartán frente a placebo fue independiente de la TFGe siempre que esta fuese > 45 ml/min/1,73 m2.
En la IR avanzada, la evidencia con los IECA/ARA-II180,181 es escasa, pero en general, aunque no en todos los estudios182, muestra beneficio en supervivencia pero con mayor incidencia de efectos adversos renales y trastornos hidroelectrolíticos.
El consenso norteamericano de 2017 recomienda68:
- •
Cuando los IECA/ARA-II se inician con una TFGe < 60 ml/min/1,73 m2 y las concentraciones de potasio son ≥ 4,5 mEq/l, el control de la función renal y el K+ debe hacerse cada 4 semanas.
- •
Es aceptable administrar IECA/ARA-II con un aumento de la creatinina hasta un 50% por encima del valor inicial, un valor absoluto < 3 mg/dl o una reducción de la TFGe < 25 ml/min/1,73 m2.
- •
Se debe suspender los IECA/ARA-II cuando el incremento de la creatinina sea > 100% del valor basal o el valor absoluto sea > 3,5 mg/dl o la TFGe sea < 20 ml/min/1,73 m2.
Algunos IECA son poco dializables (fosinopril y ramipril) y otros lo son bastante (captopril, enalapril, lisonipril y perindopril). Ninguno de los ARA-II es dializable183.
Antagonistas de los receptores de mineralocorticoidesLos ARM espironolactona y eplerenona reducen la mortalidad por cualquier causa y las hospitalizaciones por IC en pacientes con IC-FEr con o sin IR184-186, si bien se asocian con un aumento significativo de la hiperpotasemia184-186. La finerenona, un nuevo antagonista del receptor de mineralocorticoides no esteroideo, tiene una menor incidencia de hiperpotasemia187 y el ensayo clínico FINESSE-HF (en curso, con más de 3.000 pacientes con IC-FEr e IR) evaluará su eficacia y su seguridad frente a eplerenona en esta población188.
En IR avanzada, la evidencia científica es escasa. Un registro estadounidense (Medicare en Alabama), observó que la espironolactona en IC-FEr con IR (TFGe < 45 ml/min/1,73 m2)189 se asoció con mayor riesgo de reingreso por cualquier causa a los 30 días y más en los pacientes con TFGe < 15 que con TFGe 15-45 ml/min/1,73 m2. Por último, la espironolactona no se asoció con rehospitalizaciones específicamente por IC ni con mortalidad por cualquier causa. Otro estudio observacional obtuvo unos resultados muy parecidos, aunque también mostró un aumento de los reingresos por hiperpotasemia190.
El uso de ARM requiere un control más estricto de la función renal y del K+.
Las guías de la ESC de 2016 contraindican o indican precaución si el K+ es > 5 mmol/l o en caso de IR grave (TFGe < 30 ml/min/1,73 m2). Recomiendan un control analítico a las semanas 1 y 4 tras inicio o aumento de dosis de ARM, y a las 8 y 12 semanas; después, a los 6 y 12 meses. Si el K+ es > 5,5 mEq/dl; la creatinina > 2,5 mg/dl, o la TFGe < 30 ml/min/1,73 m2, se debe ajustar la dosis y mantener un estrecho control analítico. Si el K+ es > 6,0 mEq/l; la creatinina, > 3,5 mg/dl, y la TFGe, < 20 ml/min/1,73 m2, se debe interrumpir inmediatamente los ARM y mantener un estrecho control analítico.
Bloqueadores betaVarios estudios con bloqueadores beta en la IC (la mayoría con FEr y una TFGe media de 25,7-53,3 ml/min/1,73 m2)191 muestran reducción del riesgo de muerte por cualquier causa y muerte cardiovascular, con incremento del riesgo de bradicardia e hipotensión. En la IR avanzada, aunque la evidencia es escasa, un estudio observacional retrospectivo encontró menor riesgo del objetivo compuesto de muerte u hospitalización por IC, pero no de mortalidad por cualquier causa192. En general los bloqueadores beta no requieren ajuste de dosis en la IR.
La diálisis peritoneal de los pacientes con IC crónica y la ultrafiltración se describen en la sección 6 sobre IC avanzada.
Recomendaciones y resumenSe muestra, a continuación, un resumen y la recomendación de los puntos más destacados de lo expuesto anteriormente68,158,177,178,184-186,191:
- 1.
El tratamiento integral de la IC con iSRAA (INRA, IECA/ARA-II, ARM) en pacientes con IR no difiere en esencia del de cualquier paciente con IC.
- 2.
La función renal y el K+ sérico deben controlarse 1-2 semanas tras el inicio o el cambio de dosis de INRA/IECA/ARA-II, y en el caso de ARM, a los 2-3 días y a los 7 días. Posteriormente, se deben hacer controles según la estabilidad de la función renal y el estado de congestión, pero por lo general 1 vez al mes los primeros 3 meses y trimestralmente después.
- 3.
Si en el transcurso de tratamiento la TFGe se reduce más del 30% o se produce hiperpotasemia, se debe reducir la dosis, sabiendo que los cambios en la TFGe no disminuyen el beneficio de estos fármacos en la supervivencia.
- 4.
Se debe evitar los fármacos nefrotóxicos (AINE) y las dosis excesivas o innecesarias de diuréticos o hipotensores.
Distintos estudios poblacionales han puesto de manifiesto que la IC se asocia con una mayor prevalencia de DM2, en comparación con los pacientes sin IC. La prevalencia estimada de DM2 en la IC puede ser de hasta 3 o 4 veces mayor que en la población sin IC, dependiendo del estudio193-195. De igual manera, los datos de los ensayos clínicos y estudios observacionales en pacientes con IC demuestran una mayor incidencia de DM2 comparado con los pacientes sin IC. Un estudio poblacional danés observó que el 8% de los pacientes con IC contrajeron DM2 durante los primeros 3 años y que, a mayor gravedad de la IC, mayor riesgo de DM2196. Una incidencia similar se encontró en el estudio CHARM, en el que el 7,8% de los pacientes con IC desarrollaron DM2 en un plazo de 2,8 años197,198.
También se ha descrito que los pacientes con IC y DM2 presentan una peor clase funcional de la NYHA, así como más síntomas y signos de la IC que los pacientes con IC sin DM2 (tanto con FEr como con FEp)199.
En cuanto a la mortalidad, la mayoría de los estudios observacionales muestran un mayor riesgo con la presencia de DM2. Incluso en pacientes con IC y DM sin enfermedad coronaria se ha estimado un incremento de riego de muerte del 79% a los 5 años (HR = 1,79; IC95%, 1,33-2,41)200-207. En cuanto a los ensayos clínicos, en el estudio CHARM, los pacientes con DM2 e IC-FEr o IC-FEp presentaron un mayor riesgo de muerte cardiovascular (muerte por IC, muerte súbita, muerte por IAM e ictus)208. El estudio PARADIGM-HF también encontró que los pacientes con DM2 e IC-FEr tenían más riesgo de mortalidad por cualquier causa y por causa cardiovascular que los que no tenían DM2175. La mayoría de los datos disponibles indican que la DM2 se asocia con un mayor riesgo de mortalidad de los pacientes con etiología tanto isquémica como no isquémica200-203.
EvidenciaSacubitrilo/valsartánEn el estudio PARADIGM-HF (2014) se demostró la superioridad del sacubitrilo/valsartán frente al comparador activo enalapril (y dosis óptimas de bloqueadores beta y ARM) en su variable principal, la reducción del riesgo de muerte cardiovascular y de primera hospitalización por IC, en pacientes con IC-FEr, tanto con DM como sin ella.
En un subanálisis de este estudio, se analizó la eficacia del sacubitrilo/valsartán en pacientes con glucemia normal, prediabéticos, con DM2 no diagnosticada y con DM2 diagnosticada175. En el grupo de pacientes con DM2, y en comparación con el enalapril, el sacubitrilo/valsartán redujo de manera estadísticamente significativa la mortalidad cardiovascular u hospitalizaciones por IC en un 13% (HR = 0,87; IC95%, 0,77-0,98), así como en un 21% las hospitalizaciones por IC (HR = 0,79; IC95%, 0,67-0,94). Además, la protección renal observada con este fármaco, independientemente de la presencia o no de IR158, fue superior en los pacientes con DM2 respecto a los no diabéticos175.
En otro análisis post hoc del ensayo PARADIGM-HF209, se comparó la eficacia del sacubitrilo/valsartán frente al enalapril en 3.778 pacientes con DM conocida (el 98% con DM2) o glucohemoglobina (HbA1c) ≥ 6,5%. Durante el primer año, las concentraciones de HbA1c disminuyeron significativamente más con el sacubitrilo/valsartán que con el enalapril (el 0,26 frente al 0,16%; p = 0,002). El porcentaje de pacientes que iniciaron tratamiento con insulina también fue significativamente menor con el sacubitrilo/valsartán (el 29% menor; p = 0,005) que con el enalapril, y hubo una reducción en el número de pacientes que iniciaron antidiabéticos orales, aunque no fue estadísticamente significativa.
Estos datos indican que el sacubitrilo/valsartán produce un beneficio en el control metabólico de la DM2 comparado con el enalapril, ya que disminuye la HbA1c y la progresión a la necesidad de iniciar tratamiento con insulina.
IECA y ARA-IILa eficacia de los IECA en pacientes con DM2 e IC-FEr, de origen isquémico o no, se estudió en un metanálisis que analizó 8 publicaciones de 6 ensayos clínicos aleatorizados de buena calidad con un total 2.398 pacientes210. Los IECA, en comparación con placebo, mostraron superioridad en la reducción de la mortalidad por cualquier causa de pacientes con DM2 (HR = 0,85; IC95%, 0,78-0,92) y sin DM2 (HR = 0,84; IC95%, 0,70-1,00).
Por otro lado, en el estudio CHARM (1.306 pacientes con FEr y DM; media de edad, 65 años; el 72,7% varones; FE media, 28,5%; el 70,5% en NYHA III-IV), el candesartán, comparado con placebo, se asoció a una reducción estadísticamente significativa de la mortalidad total, la mortalidad cardiovascular y la probabilidad de hospitalización por IC de los pacientes con IC-FEr, independientemente de la presencia de DM2208. También, en un subanálisis del estudio Val-HeFT, el tratamiento con valsartán consiguió una reducción significativa del riesgo relativo de muerte u hospitalización por IC independientemente de la presencia de DM2211.
Bloqueadores betaSe ha descrito que la mayoría de los bloqueadores beta producen un aumento de la resistencia a la insulina, pero esto no ocurre con el carvedilol, que además disminuye la HbA1c, mejora la sensibilidad a la insulina y reduce la frecuencia de progresión de la microalbuminuria212,213.
Por otro lado, en un metanálisis ya comentado210, se analizó la eficacia de los bloqueadores beta en pacientes con IC y DM2 (1.883 pacientes) en 11 publicaciones correspondientes a 5 ensayos clínicos. Al igual que en el caso de los IECA, los bloqueadores beta, en comparación con placebo, redujeron significativamente la mortalidad por cualquier causa de pacientes con DM2 (HR = 0,77; IC95%, 0,61-0,96) y sin DM2 (HR = 0,65; IC95%, 0,57-0,74).
ARMEn la IC-FEr el beneficio en la mortalidad con la espironolactona en el estudio RALES y con la eplerenona en el EMPHAS1S-HF (entre otros) fue similar tanto para pacientes con DM2 como sin ella186,214,215.
Nitratos e hidralazinaEl ensayo A-HeFT (1.050 pacientes con IC; el 60% varones; el 95% en NYHA III) examinó la eficacia de una dosis fija de dinitrato de isosorbida y clorhidrato de hidralazina comparadas con placebo en la mortalidad por cualquier causa, la hospitalización, y la calidad de vida. El 41% de los pacientes tenían DM2216. En los análisis de subgrupos, se constató que la dosis fija de dinitrato de isosorbida y clorhidrato de hidralazina reducía de manera estadísticamente significativa la mortalidad por cualquier causa y el primer ingreso por IC de pacientes con DM2 (HR = 0,56; IC95%, 0,38-0,96) y sin DM2 (HR = 0,59; IC95%, 0,25-0,75, extrapolado de la figura).
Tratamiento de la DMA continuación, y a modo de resumen, se muestra la evidencia sobre los distintos tratamientos para la DM2 utilizados en la IC199. Hace muy poco se ha publicado el primer ensayo clínico de un hipoglucemiante en IC, en concreto dapapliflozina en la IC-FEr (tabla 19).
Fármacos para la diabetes mellitus tipo 2 y su evidencia en la insuficiencia cardiaca
| Fármaco/s | Evidencia |
|---|---|
| Metformina | En estudios observacionales en pacientes con IC, la metformina se ha asociado con tasas de mortalidad más bajas que la sulfonilurea o la insulina309 |
| Antagonistas del receptor GLP-1 | Sobre la liraglutida, 2 ensayos clínicos aleatorizados pequeños no encontraron efecto en la función del ventrículo izquierdo310 o la tasa de muerte, hospitalizaciones por IC o cambios en los PN311 |
| Sulfonilureas | Datos equívocos. Algunos estudios observacionales indican mayor riesgo de muerte con las sulfonilureas en comparación con la metformina309,312 |
| Insulina | En estudios observacionales en pacientes con IC, la insulina se asoció con tasas de mortalidad más altas que con la metformina309 |
| Riesgo/beneficio desconocido | |
| Inhibidores de DPP4 | La saxagliptina está contraindicada en la IC313,314 Riesgo/beneficio desconocido |
IC: insuficiencia cardiaca; PN: péptidos natriuréticos. Tabla elaborada con datos de Seferovic et al199.
En otros estudios publicados el objetivo primario es el compuesto de eventos adversos cardiovasculares mayores (MACE): muerte cardiovascular, infarto e ictus.
Papel de los iSGLT2Existen varios ensayos clínicos con estos fármacos en pacientes con DM2 y enfermedad cardiovascular o con riesgo cardiovascular, para demostrar su seguridad cardiovascular5,199,217.
En relación a la IC, el estudio EMPA-REG OUTCOME218, que incluyó a 7.020 pacientes, observó una disminución significativa del objetivo secundario de hospitalización por IC (HR = 0,65; IC95%, 0,5-0,85; p = 0,002) frente a placebo. Este efecto se observó en distintos subgrupos de pacientes con DM2, de los que aproximadamente un 10% eran pacientes con IC (a juicio del investigador). En los estudios CAN-VAS219,220, sobre un total de 10.142 pacientes con DM2, se halló un riesgo significativamente menor de hospitalización por IC en los tratados con canagliflozina (HR = 0,68; IC95%, 0,51-0,90) comparada con placebo. En el estudio CREDENCE221, se comparó la seguridad de la canagliflozina frente a placebo en pacientes con DM2 y enfermedad renal crónica albuminúrica. Aproximadamente el 15% de los pacientes tenían IC. Se observó una reducción del riesgo de hospitalización de casi el 40% con la canagliflozina (HR = 0,61; IC95%, 0,47-0,80). El estudio DECLARE-TIMI 58, con un 10% de pacientes con IC, mostró que la dapagliflozina, en comparación con placebo, disminuía el riesgo de hospitalización por IC (HR = 0,73; IC95%, 0,61 -0,88)222.
Recientemente se ha publicado una revisión sistemática de la literatura y metanálisis con más de 34.000 pacientes que confirma estas observaciones223.
Sobre la base de lo descrito, se ha diseñado y puesto en marcha una serie de estudios para evaluar la eficacia y la seguridad de estos fármacos, específicamente en pacientes con IC. Estos estudios son el EMPEROR-Reduced y el EMPEROR-Preserved (ambos con empagliflozina), que finalizarán en 2020, y el DAPA-HF224, que se ha publicado recientemente. El estudio incluyó a 4.744 pacientes con IC-FEr y comparaba la dapagliflozina con placebo añadidos al tratamiento recomendado para la IC. El objetivo primario compuesto de empeoramiento de la IC (hospitalización o visita a urgencias con tratamiento intravenoso para la IC) o muerte cardiovascular fue menor en el grupo de dapagliflozina que en el de placebo (el 16,3 frente al 21,2%; HR = 0,74; IC95%, 0,65-0,85; p < 0,001)225. La hospitalización por IC fue menor en el grupo de dapagliflozina que en el de placebo (el 9,7 frente al 13,4%; HR = 0,70; IC95%, 0,59-0,83), así como la mortalidad cardiovascular (el 9,6 frente al 11,5%; HR = 0,82; IC95%, 0,69-0,98), independientemente de que los pacientes tuvieran DM2.
Puntos que considerar y recomendacionesImportancia de descartar la enfermedad coronaria como causa tratable5,28,199- •
Se ha observado una estrecha relación entre la DM y la IC. Parece que hay un efecto directo de la DM en el miocardio que origina la IC por mecanismos diferentes de la isquemia o la hipertensión199.
- •
Los pacientes con DM que desarrollan IC tienen mayor riesgo de mortalidad y reingreso hospitalario199.
- •
Sin embargo, las complicaciones cardiovasculares son el principal efecto macrovascular de la DM y su principal causa de mortalidad. La neuropatía asociada a la propia DM puede originar que el paciente padezca un síndrome coronario sin dolor torácico; por este motivo se hace necesario el cribado de isquemia miocárdica en los pacientes con DM e IC concomitantes199.
- •
El cribado inicial se realizará mediante ECG, aunque en casos dudosos podría recurrirse a ergometría, tomografía computarizada por emisión monofotónica (SPECT) e incluso coronariografía.
- •
No se dispone de ningún ensayo clínico que haya estudiado el efecto de la metformina en la IC, pero estudios observacionales han indicado que podría conllevar menor incidencia de mortalidad que las sulfonilureas o la insulina199.
- •
Tampoco se dispone de ensayos clínicos que hayan analizado la seguridad cardiovascular o la seguridad en la IC de las sulfonilureas. Algunos estudios observacionales parecen indicar que con estas se produce una mortalidad mayor que con metformina199.
- •
En el estudio RECORD, la pioglitazona mostró mayor tasa de episodios de IC199.
- •
La saxagliptina, como iDPP4, fue el único del grupo terapéutico que mostró (en el estudio SAVOR-TIMI 53) mayor tasa de ingresos hospitalarios por IC. Bien es cierto que se observó en los pacientes con mayores cifras de NT-proBNP, antecedente de IC y TFGe < 60 ml/min. El resto de las moléculas de iDPP4 se han mostrado seguras en ingresos hospitalarios por IC199.
- •
Los iSGLT2 son el único grupo terapéutico que en todos los ensayos clínicos de seguridad de las moléculas disponibles actualmente en el mercado (empagliflozina, canagliflozina y dapagliflozina) han mostrado reducción de ingresos hospitalarios por IC en pacientes diabéticos. Sin embargo, la recomendación no puede ser firme para todos los fármacos de este grupo, ya que solo se ha publicado un ensayo clínico con dapagliflozina en pacientes con y sin DM2199,225.
- •
Los datos agregados que se han publicado hace poco indican que los análogos del receptor GLP-1 podrían reducir el riesgo de hospitalización por IC en un 9%226.
- •
El efecto de la insulina en la IC está poco estudiado, pero el único ensayo disponible hasta ahora (estudio ORIGIN) no observó mayor tasa de ingresos por IC199.
- 1.
Se ha de valorar el cribado de isquemia miocárdica en los pacientes con DM e IC concomitantes.
- 2.
El tratamiento de la IC en el paciente con DM es similar al del paciente sin DM.
- 3.
Se debería añadir la dapagliflozina (cuando tenga la indicación correspondiente en ficha técnica) al tratamiento de los pacientes con IC-FEr que cumplan los criterios de inclusión y exclusión del estudio DAPA-HF, sean diabéticos o no. Habrá que esperar al resultado de los ensayos con otros iSGLT2 para saber si este efecto beneficioso es un efecto de grupo.
La FA es la arritmia más prevalente en la IC, independientemente de la FEVI del paciente. Se ha estimado una prevalencia de FA en pacientes con IC-FEp del 15-65% en distintos estudios clínicos200,227-229, mientras que en pacientes con IC-FEr la prevalencia de FA se incrementa a peor clase funcional de la NYHA. Así, se estima una prevalencia del 4,2% de los pacientes con IC en NYHA I y hasta un 49,8% de aquellos en NYHA IV229. La IC puede llegar a cuadriplicar el riesgo de FA230,231, y los pacientes con FA tiene un riesgo incrementado hasta 5 veces de desarrollar IC232. Pero, además, la FA aumenta el riesgo de complicaciones tromboembólicas (especialmente ictus), y en los pacientes con IC que las sufren se ha visto que se asocian a mayor riesgo de muerte y deterioro de la función cardiaca233-235. Por su gran prevalencia e impacto, la FA es una comorbilidad de especial relevancia en el tratamiento del paciente con IC. Aunque hay alguna evidencia sobre su tratamiento, aún existen muchas situaciones clínicas sin claras recomendaciones en las guías.
EvidenciaAnticoagulación (NACO frente a AVK)Una revisión sistemática y metanálisis recientes han comparado la anticoagulación con los nuevos anticoagulantes orales no antagonistas de la vitamina K (NACO) frente a los AVK en pacientes con IC236. Es una publicación de calidad que incluye 4 ensayos clínicos de fase III, a su vez de gran calidad (mediana de puntuación Detsky, 100%), sobre la eficacia los NACO y la warfarina. Incluye a más de 55.000 pacientes con FA, de los que 26.384 además estaban diagnosticados de IC (mediana de edad, 70 años; el 36% mujeres; mediana de seguimiento, 1,5-2,8 años). Los NACO, en comparación con la warfarina, disminuyeron de manera significativa los riesgos de accidente cerebrovascular (ACV)/embolia sistémica en un 14,4% (p = 0,01), de hemorragia grave en un 23,2% (p < 0,01), de hemorragia intracraneal de un 57,3% (p < 0,01) y de cualquier hemorragia del 11,6% (p = 0,02). Sin embargo, no hubo diferencias estadísticamente significativas entre grupos en los riesgos de muerte cardiovascular (p = 0,11) o muerte por cualquier causa (p = 0,08). La heterogeneidad de los metanálisis, salvo para la variable hemorragia intracraneal, fue moderada-alta.
Bloqueadores betaVarias revisiones sistemáticas y metanálisis han analizado la eficacia de los bloqueadores beta en pacientes con IC y FA237,238.
Una de ellas, de moderada-buena calidad, analizó a 34.197 pacientes con IC y FA incluidos en 8 estudios clínicos (5 aleatorizados y controlados y 3 estudios observacionales de cohortes, con un comparador diferente de los bloqueadores beta)237. La media de edad de los pacientes incluidos era 70 años, el 76% eran varones, la FE media fue del 27,5% y el 35% estaba en NYHA I-II, mientras que el 65% estaba en NYHA III-IV. El seguimiento medio varió de los 6 meses a los 3,1 años. En el metanálisis se observó que los bloqueadores beta se asociaban con una reducción del 22% del riesgo de mortalidad por cualquier causa (RR = 0,78; IC95%, 0,71-0,86; p < 0,00001), pero no con menos hospitalizaciones por IC (RR = 0,94; IC95%, 0,79-1,11; p = 0,46). En ambos casos la heterogeneidad del metanálisis fue baja-moderada.
La segunda (de buena calidad)238, específicamente analizó los bloqueadores beta en pacientes con FA e IC-FEr y la relación de la frecuencia cardiaca con la mortalidad. Incluyó 11 ensayos clínicos aleatorizados controlados con placebo (de buena calidad), con 2.065 pacientes de edades entre los 59 y los 75 años, el 80% varones, con una mediana de FC a 81 lpm y el 75% en NYHA III-IV. Los bloqueadores beta redujeron la frecuencia ventricular en 12 lpm (tanto en los pacientes con ritmo sinusal como en FA), pero no tuvieron efecto alguno en la mortalidad por cualquier causa a cualquier frecuencia cardiaca (HR = 0,96; IC95%, 0,81-1,12).
Control de la frecuencia cardiacaLa FC en reposo óptima en pacientes con IC y FA es incierta. Las guías y los expertos la suelen situar entre 60 y 100-110 lpm5,233,239,240.
Para alcanzar la FC óptima, son útiles los bloqueadores beta (véase la evidencia en el apartado anterior), pero también otros fármacos como la digoxina.
Una revisión sistemática y metanálisis de calidad, que incluyó tanto ensayos clínicos aleatorizados como estudios observacionales, realizó un análisis de sensibilidad post hoc específico para analizar la mortalidad con la digoxina en pacientes con IC y FA241. Analizó datos brutos de 2 estudios observacionales, datos ajustados de otros 2 estudios observacionales y 2 cohortes emparejadas por puntuación de propensión, con un total de 46.764 pacientes con IC, la mayoría con FEr. Los 3 metanálisis realizados no encontraron una asociación estadísticamente significativa entre el tratamiento con digoxina y la mortalidad (la heterogeneidad fue del 0% en 2 de ellos y del 96% en el tercero, correspondiente a las cohortes).
Por otro lado, en un análisis post hoc del estudio AR1STOTLE242, se analizó el riesgo de muerte con la digoxina. 1ncluyó a 6.663 pacientes con IC (media de edad, 69 años; el 65% varones; FE media, 45% [intervalo, 34%-60%]). Se comparó a los pacientes que tomaban digoxina al inicio del estudio con los que no emparejados por puntuación de propensión. Los resultados mostraron que la digoxina no se asoció con mortalidad por cualquier causa (HR = 1,04; IC95%, 0,83-1,30), muerte cardiovascular (HR = 1,13; IC95%, 0,84-1,54), muerte súbita cardiaca (HR = 1,15; IC95%, 0,72-1,86), muerte no cardiovascular (HR = 1,01; IC95%, 0,65-1,58) y hospitalización por IC (HR = 0,98; IC95%, 0,76-1,27). Por otro lado, en nuevos usuarios de digoxina durante el seguimiento (no se ofrecen datos concretos de tratamientos previos, etc.), comparados con una población emparejada por puntuación de propensión, la digoxina sí que se asoció con mayor mortalidad (HR = 1,78; IC95%, 1,37-2,31) y muerte súbita (HR = 2,14; IC95%, 1,11 -4,12).
Control del ritmo cardiacoEn los últimos años han surgido numerosos estudios individuales, como el CASTLE-AF243, sobre la eficacia y la seguridad de la ablación con catéter para los pacientes con FEr, en los que se ha comparado esta técnica con el tratamiento médico (fármacos para el control de la frecuencia cardiaca o antiarrítmicos), cuya evidencia se ha analizado en varias revisiones sistemáticas de la literatura y metanálisis244-246.
Una de ellas244, de gran calidad, incluyó 6 ensayos clínicos que compararon la ablación con catéter frente al tratamiento médico (fármacos para el control de la FC o el ritmo cardiaco). Se analizó a 775 pacientes, la mayoría varones, con medias de edad de 55-64 años, una FE media del 28,3% y un seguimiento de entre 6 y 60 meses. En los metanálisis se observó que, en comparación con el tratamiento médico, la ablación con catéter disminuye la mortalidad total (el 9,0 frente al 17,6%; RR = 0,52; IC95%, 0,33-0,81) y las hospitalizaciones por IC (el 16,4 frente al 27,6%; RR = 0,60; IC95%, 0,39-0,93). La ablación con catéter también mejoró la FEVI, con una diferencia media del 6,95% (1C95%, 3,0%-10,9%), la distancia recorrida en la prueba de 6 min de marcha, con una diferencia media de 20,93 m (IC95%, 5,91-35,95), el consumo máximo de oxígeno, con una diferencia media de 3,17 ml/kg/min (1C95% 1,26-5,07), y la calidad de vida, con una diferencia media en la puntuación del Minnesota Living with Heart Failure Questionnaire de -9,02 puntos. Los eventos adversos graves fueron más frecuentes con la ablación con catéter, aunque las diferencias no fueron estadísticamente significativas244. La heterogeneidad de los meta-nálisis en general fue baja.
A finales de 2018 se publicó también otra revisión sistemática y metanálisis en red de gran calidad247, con criterios de inclusión similares a los del estudio previo. Este incluyó 17 ensayos clínicos aleatorizados, con 5.460 pacientes. La ablación con catéter, en comparación con el tratamiento médico óptimo, fue más efectiva para reducir los riesgos de muerte por cualquier causa (OR = 0,44; IC95%, 0,27-0,74; p = 0,001) y hospitalización por IC (OR = 0,41; IC95%, 0,28-0,59; p = 0,001) y fue superior en la mejora de la FEV1 (OR = 9,34; IC95%, 7,13-11,55; p = 0,001), el Minnesota Living with Heart Failure Questionnaire (OR = 27,75; IC95%, 213,98-21,52; p = 0,01) y la distancia recorrida en la prueba de los 6 min de marcha (OR = 27,30; IC95%, 5,27-49,33; p = 0,02). En uno de los metanálisis que seguía un modelo de efectos aleatorios, se generó una clasificación de la eficacia en las variables mencionadas, en el que la ablación con catéter estuvo siempre por delante de los fármacos para el control del ritmo y el control de la FC. No hubo grandes diferencias en cuanto a la seguridad (no se describe en detalle).
El consenso de la ESC publicado en 201928, con base en la evidencia comentada, establece las siguientes indicaciones para la ablación en pacientes con FA:
- 1.
Se puede considerar la ablación de venas pulmonares de los pacientes con IC y FA paroxística sintomática, si los episodios paroxísticos causan síntomas molestos a pesar de implementarse un tratamiento médico y con dispositivos recomendados por las guías de práctica clínica.
- 2.
La ablación del nódulo auriculoventricular, generalmente con marcapasos ventricular derecho, puede considerarse si los episodios paroxísticos causan síntomas graves y la ablación de la vena pulmonar ha fallado o no es posible.
- 3.
La ablación de las venas pulmonares para la FA persistente se puede considerar para los pacientes con IC-FEr que tienen un DAI para prevenir la bradicardia, un desfibrilador-cardioversor implantable, terapia de resincronización cardiaca o marcapasos permanente si se considera probable que se logre y se mantenga el ritmo sinusal, especialmente si el inicio de la FA se asoció con un deterioro de los síntomas de la IC o si el paciente lleva terapia de resincronización cardiaca o es candidato a llevarla. Es menos probable que la ablación de la vena pulmonar tenga éxito en pacientes con FA de larga duración y dilatación grave de la aurícula derecha o izquierda.
La IC es uno de los parámetros incluidos en la escala CHA2DS2-Vasc, por lo que un paciente con FA que sufre IC (o tiene una FEr) tiene indicación de anticoagulación232,233. Un metanálisis ha puesto de manifiesto que los anticoagulantes orales de acción directa (ACOD), en comparación con la warfarina, reducen de manera significativa los riesgos de ictus/embolia sistémica en un 14,4% (p = 0,01), de hemorragia grave en un 23,2% (p < 0,01), de hemorragia intracraneal en un 57,3% (p < 0,01) y de cualquier hemorragia en un 11,6% (p = 0,02), sin diferencias estadísticamente significativas en la muerte cardiovascular o la muerte por cualquier causa236. Por lo tanto, también en el subgrupo de pacientes con FA e IC, los ACOD deben considerarse como primera opción de tratamiento, igual que para el conjunto de pacientes con FA232.
¿Control de ritmo o control de frecuencia? Ablación de venas pulmonaresNinguno de los ensayos clínicos aleatorizados que han comparado la estrategia de control de ritmo frente a la de control de frecuencia en pacientes con FA, en la era previa a las ablaciones, ha demostrado un mayor beneficio en el pronóstico de la estrategia de control de ritmo, por lo que su elección debe ser individual y basada en los síntomas y la calidad de vida de los pacientes232. Sin embargo, sobre la ablación de venas pulmonares como método de control del ritmo, en los últimos años se han publicado algunos estudios individuales, como el CASTLE-AF243, que han comparado esta técnica con el tratamiento médico (fármacos para el control de la frecuencia cardiaca o antiarrítmicos) en pacientes con IC-FEr, y su evidencia se ha analizado en varias revisiones sistemáticas y metanálisis que incluyen hasta 17 ensayos clínicos aleatorizados244-246. En dichos metanálisis, se ha demostrado que la ablación reduce de manera significativa la mortalidad total y los ingresos por IC, y mejora la FE, la capacidad funcional (medida por la prueba de los 6 min de marcha y el consumo de oxígeno) y la calidad de vida, con un ligero aumento de efectos adversos relacionados con la ablación.
Por ello y por la mejora de los resultados conseguidos por las técnicas de ablación, y de acuerdo con el reciente consenso de la ESC publicado en 201928, consideramos que debe recomendarse una estrategia de control de ritmo mediante la ablación de venas pulmonares para algunos subgrupos de pacientes con FA e IC-FEr:
- •
Pacientes con IC y FA paroxística sintomática si los episodios paroxísticos causan síntomas molestos a pesar del tratamiento médico y con dispositivos recomendados por las guías de práctica clínica.
- •
Pacientes con IC-FEr portadores de DAI, terapia de resincronización cardiaca o marcapasos permanente si se considera probable que se logre y se mantenga el ritmo sinusal, especialmente si el inicio de la FA se asoció con un deterioro de los síntomas de la IC o si el paciente lleva terapia de resincronización cardiaca o es candidato a ella.
Es menos probable que la ablación de venas pulmonares tenga éxito en pacientes con FA de larga duración y dilatación auricular importante. Para los pacientes con FA paroxística sintomática cuya ablación de las venas pulmonares ha fallado o para quienes no está claramente indicada, puede considerarse la ablación del nódulo auriculoventricular con implante de un marcapasos o un resincronizador según los casos.
Bloqueadores beta para pacientes con FA e IC-FErLos bloqueadores beta reducen la mortalidad y los reingresos por IC de los pacientes con IC-FEr, por lo que tienen una indicación I A para estos pacientes. Sin embargo, no está tan claro su beneficio para los pacientes en FA, como se ha puesto de manifiesto en varias revisiones sistemáticas y metanálisis recientes237,238. En una de ellas se observó que los bloqueadores beta redujeron la mortalidad, pero no la incidencia de reingresos por descompensación de la IC237, mientras que en otra tampoco redujeron la mortalidad238.
A pesar de estos datos, como no hay ningún estudio específicamente diseñado para probar el valor de estos fármacos en el subgrupo de pacientes con IC-FEr y FA, y teniendo en cuenta que los bloqueadores beta son los fármacos con mayor efecto en el pronóstico de la IC-FEr, consideramos que se debe seguir prescribiéndolos también a los pacientes con FA.
Control de la frecuencia cardiaca. Papel de la digoxinaMientras que en la IC-FEr se recomienda alcanzar una FC < 70 lpm, no existe un objetivo de frecuencia concreto para los pacientes en FA, ya que los estudios que han comparado una estrategia de control estricto (FC ~70 lpm) frente a otra de control menos estricto (100-110 lpm) no encontraron una diferencia significativa en el pronóstico entre una y otra20,21, por lo que se suele situar en un amplio margen entre 60 y 100-110 lpm, dependiendo de cada caso individual y sobre todo de los síntomas y la limitación funcional que produzcan.
Ya se ha comentado que, en general, los fármacos de primera elección para el control de la FC en cualquier tipo de IC, sobre todo en la IC-FEr, deben ser los bloqueadores beta. No se debe utilizar la ivabradina, por su mecanismo específico de acción en el nódulo sinusal5.
Es controvertido el papel de la digoxina, por su posible asociación con una mayor mortalidad en pacientes con FA, tanto con IC como sin ella241,242. Aunque es posible que, al tratarse en muchos casos de estudios observacionales, pueda haber un sesgo de inclusión (en el sentido de que los pacientes con peor pronóstico y mayor gravedad de la IC sean los que reciben la digoxina)241, parece prudente evitar este fármaco, excepto en casos seleccionados, y siempre con control de la digoxinemia (manteniendo concentraciones séricas < 1 ng/ml) y con especial precaución en mujeres y pacientes con IR5.
Resincronización de pacientes con IC-FEr en FADado que la evidencia sobre la eficacia de la resincronización es menor en casos de FA, la guía europea le da una recomendación IIa B para estos pacientes, y siempre garantizando que al menos el 90% de los latidos sean estimulados5. A veces hay que recurrir a la ablación del nódulo auriculoventricular, aunque esta no debe ser una práctica habitual, sino muy individualizada.
ResumenSe muestra, a continuación, un resumen de los puntos más destacados de lo expuesto anteriormente5,232,233,236-240,243:
- 1.
La FA es la arritmia más prevalente en la IC.
- 2.
Los pacientes con FA e IC (o con FEVI reducida) tienen indicación de anticoagulación.
- 3.
Para los pacientes con FA e IC, los ACOD deben considerarse como primera opción de tratamiento.
- 4.
Identificación de pacientes candidatos a una estrategia de control de ritmo mediante la ablación de venas pulmonares.
- 5.
A los pacientes con FA e IC, no se les debe prescribir la ivabradina ni la digoxina en general, salvo excepciones con una monitorización muy estrecha, y se debe valorar el uso de bloqueadores beta.
Actualmente la principal causa de muerte de los supervivientes a un cáncer es la enfermedad cardiovascular, junto con una segunda neoplasia248. Esto en gran parte se debe a que algunos tratamientos oncohematológicos pueden triplicar el riesgo de eventos cardiovasculares a medio y largo plazo249-254.
La cardiotoxicidad se define como el conjunto de enfermedades cardiovasculares derivadas de los tratamientos, siguiendo los criterios diagnósticos habitualmente utilizados para la población general255. Una de las complicaciones más frecuentes de los tratamientos oncohematológicos es la disfunción ventricular, que se define como una reducción de la FEVI > 10% respecto al valor basal, que además sea inferior al límite normal. Según la ESC, el 50% supone el punto de corte de la normalidad256. Sin embargo, en pacientes tratados con antraciclinas y trastuzumab, una FEVI en la banda baja-normal (50-55%) aumenta de manera significativa el riesgo de disfunción ventricular secundaria a estos fármacos257,258. Pero además la cardiotoxicidad a su vez depende de distintos factores (algunos modificables) tanto del paciente como del tratamiento, lo cual hace que se pueda implantar medidas con el fin de disminuir su riesgo o minimizar su impacto259.
Por todo ello, en el paciente con IC y cáncer resulta fundamental una correcta y exhaustiva evaluación antes de iniciar el tratamiento oncológico. Por otro lado, teniendo en cuenta, como ya se ha comentado, que muchos tratamientos oncológicos pueden empeorar la FE, se debe mantener una estrecha monitorización del paciente con IC.
EvidenciaEn el tratamiento de los pacientes con IC y cáncer, destacan 2 documentos de posicionamiento, uno de la ESC publicado en 2016260 y el de la SEC junto con otras sociedades científicas, publicado en 2017255. También existen documentos relacionados, como el de la European Association of Cardiovascular Imaging o la American Society of Echocardiography261-263.
Criterios de alto riesgo de toxicidad, diagnóstico precoz de complicaciones de la IC y medidas preventivas para el paciente en quimioterapia o radioterapiaPara evitar la aparición de la cardiotoxicidad de los tratamientos o minimizar su impacto en el paciente con IC y cáncer, en primer lugar son fundamentales el diagnóstico y el control de los factores de riesgo modificables255,259,260,264. Actualmente no se dispone de escalas que valoren en conjunto los riesgos cardiovascular y de cardiotoxicidad. Por ello se recomienda usar el SCORE para el riesgo cardiovascular y evaluar una serie de factores asociados con mayor riesgo de cardiotoxicidad.
Dependiendo del fármaco, se han descrito distintos criterios de alto riesgo de toxicidad255,259,260,264. A modo de ejemplo, respecto a las antraciclinas, la cardiotoxicidad se ha relacionado con el sexo femenino, las dosis acumuladas o radioterapia previa o concomitante en una zona muy próxima al corazón. Asimismo es importante la implantación de estrategias y medidas cardioprotectoras (tabla 20)255,259,260,264.
Estrategias preventivas y para el diagnóstico precoz de la cardiotoxicidad inducida por el tratamiento oncológico
| Antes del tratamiento oncológico cardiotóxico | Priorizar los tratamientos antineoplásicos no cardiotóxicos sin comprometer los resultados específicos del cáncer |
|---|---|
| Diagnóstico y control de factores de riesgo cardiovascular y de cardiotoxicidad modificables | |
| Promoción de un estilo de vida cardiosaludable con programas de ejercicio físico regular | |
| Estado clínico de la IC (síntomas, signos ecocardiográficos/de otras técnicas de imagen, ECG, analítica que incluya biomarcadores, etc.) | |
| Referencia a un especialista en casos pertinentes | |
| Durante el tratamiento cardiotóxico | Diagnóstico y control de los factores de riesgo cardiovascular y de cardiotoxicidad modificables |
| Promoción de un estilo de vida cardiosaludable con programas de ejercicio físico regular | |
| Estado clínico de la IC (síntomas, signos ecocardiográficos/de otras técnicas de imagen, ECG, analítica que incluya biomarcadores, etc.) | |
| Referencia a un especialista en casos pertinentes | |
| Quimioterapia cardiotóxica Dar prioridad a la formulación liposomal y la infusión continua de doxorubicina | |
| Anteponer el uso de dexametasona en los casos que se considere adecuado (p. ej., dosis altas de antraciclinas) | |
| Interrumpir la quimioterapia en los casos pertinentes | |
| Valorar uso de fármacos cardioprotectores (dexrazoxano) | |
| Radioterapia mediastínica Dar prioridad a la dosis de radiactividad más baja clínicamente eficaz | |
| mediastínica Técnicas de radioterapia con inspiración profunda y retenida | |
| Radioterapia de intensidad modulada | |
| Suspensión de la radioterapia en los casos pertinentes | |
| Después del tratamiento cardiotóxico | Diagnóstico y control de los factores de riesgo cardiovascular y de cardiotoxicidad modificables |
| Promoción de un estilo de vida cardiosaludable con programas de ejercicio físico regular | |
| Estado clínico de la IC (síntomas, signos ecocardiográficos/de otras técnicas de imagen, ECG, analítica que incluya biomarcadores, etc.) | |
| Referencia a especialistas en los casos pertinentes |
Tabla elaborada con datos de Finet et al259.
Por otro lado, para que sea posible un diagnóstico precoz de la cardiotoxicidad en los pacientes con IC y cáncer, se requiere una monitorización clínica estrecha. En este sentido, los expertos recomiendan ajustar su frecuencia al tipo de tratamiento, la dosis acumulada, la vía de administración y su duración y los factores de riesgo basales del paciente255,259,260,264. Para el diagnóstico precoz, también se recomienda una serie de actuaciones clínicas, como la determinación de biomarcadores y las técnicas de imagen (tabla 20).
Tratamiento de la IC en el paciente con cáncer y tratamiento de la disfunción del VI inducida por tratamientos cardiotóxicos en el paciente con ICEl tratamiento de la IC en el paciente con cáncer, en principio, es el mismo que el pautado para el paciente con IC sin cáncer5,28.
Los expertos coinciden en la necesidad de interrumpir el tratamiento cardiotóxico si la FEV1 disminuye por debajo de un límite; sin embargo, dependiendo del grupo, este se establece en un 40-50%255,260. Junto con esta medida, recomiendan valorar otras causas que hayan podido originar la disfunción ventricular, así como otros tratamientos antineoplásicos259,260,264. Para las demás situaciones clínicas (p. ej., empeoramiento por encima de estos valores de FE), se debe consultar los documentos de expertos, ya que dependiendo de la situación clínica plantean distintas opciones259,260,264.
Plan de seguimiento del paciente oncológico con ICLos expertos coinciden en la necesidad de una coordinación e incluso la evaluación conjunta en determinados casos entre el oncólogo y el cardiólogo (idealmente especialistas con interés y experiencia en el tema)255,259,260,264.
Puntos que considerar y recomendacionesDefinición de disfunción ventricular secundaria a cardiotóxicosSe define como una reducción de la FEVI > 10% respecto al valor basal, con una FEVI inferior al límite normal (el 53%, según las guías ecocardiográficas)255.
Identificación y monitorización del paciente de alto riesgo de ICEs importante identificar a los pacientes que tienen un mayor riesgo de IC y asegurar su adecuada monitorización (tabla 21)255,265,266. Durante el seguimiento se aconsejarán cambios a un estilo de vida saludable, el control estricto de los factores de riesgo cardiovascular y un adecuado tratamiento de las enfermedades cardiovasculares subyacentes (cardiopatía isquémica, IC, etc.). Además, se dará la formación adecuada para que el paciente identifique precozmente los síntomas/signos de alarma (aumento brusco de peso > 2 kg en menos de 48 h, disnea, edemas, dolor torácico, palpitaciones, mareo intenso o síncope). Asimismo se revisarán las posibles interacciones con los distintos tratamientos (oncológicos y no oncológicos) y se realizarán los estudios de imagen y biomarcadores durante el tratamiento según las recomendaciones de oncohematología y cardiología (tabla 20 y figura 8)255,265.
Pacientes de alto riesgo para desarrollar IC y tratamientos cardiotóxicos
| Antecedentes/factores de riesgo de IC | Tratamientos oncológicos que aumentan el riesgo de IC |
|---|---|
| Factores genéticos | |
| Sexo femenino | Antraciclinas ± RT |
| Edad < 15 y > 65 años | Anti-Her2 |
| Diabetes o HTA grave o IR | Inhibidores de la tirosincinasa |
| Obesidad (IMC > 30) | Anti-VEGF |
| Sedentarismo | Inhibidores de MEK |
| 2 o más FRCV | Carfilzomib |
| Cardiopatía isquémica | Dosis acumuladas |
| IC/disfunción del VI (FEVI 50-55%) | |
| Antecedentes de disfunción del VI secundaria a cardiotóxicos o ser portador de mutación patogénica asociada con miocardiopatía por cardiotóxicos | |
| Cáncer previo | |
| QT o RT o combinación de ambas anteriormente | |
| Tiempo transcurrido desde el tratamiento |
Monitorización del paciente en tratamiento antitumoral255. 3D: tridimensional; ECG: electrocardiograma; ETT: ecocardiograma transtorácico; FEVI: fracción de eyección del ventrículo izquierdo; FRCV: factores de riesgo cardiovascular; SLG: strain longitudinal global.
Estas medidas se resumen en la tabla 22255,265.
Medidas para prevenir la aparición de insuficiencia cardiaca en el paciente en tratamiento antitumoral255,265
| Medidas generales | Dieta cardiosaludable |
| Peso adecuado | |
| Ejercicio físico (adaptado a la situación clínica) | |
| Abstención absoluta del tabaco | |
| Evitar el consumo excesivo de alcohol (como máximo 2 vasos de vino o cerveza al día los varones y 1 vaso al día las mujeres) | |
| Presión arterial | < 130/80 mmHg (para los de 65 o más años, el objetivo es < 140/80 mmHg) |
| Dislipemia | cLDL < 100 mg/dl (en caso de diabetes, insuficiencia renal grave o cardiopatía isquémica, < 70 mg/dl) |
| Diabetes | HbA1c < 7% (mayores de 75 años, HbA1c 7,5-8%) |
| Fármacos preferentes, inhibidores de SLGT2 y agonistas de GLP1 | |
| Fármacos preventivos | Dexrazoxano: reduce el riesgo de disfunción del VI por acumulación de altas dosis de antraciclinas |
| No está demostrado que los IECA/ARA-II y los bloqueadores beta en monoterapia o combinados tengan efecto preventivo | |
| Datos prometedores con los antagonistas de la aldosterona y las estatinas | |
| En caso de cardiopatía establecida (IC, cardiopatía isquémica) | Mantener el tratamiento siempre que sea posible |
ARA-II: antagonistas del receptor de la angiotensina II; cLDL: colesterol unido a lipoproteínas de baja densidad; HbA1C: glucohemoglobina; IC: insuficiencia cardiaca; IECA: inhibidores de la enzima de conversión de la angiotensina; VI: ventrículo izquierdo.
Se muestra, a continuación, un resumen de los puntos más destacados de lo expuesto anteriormente5,255,259,260,264,265:
- 1.
En los pacientes con cáncer, se debe identificar a aquellos con mayor riesgo de IC (factores genéticos, sociodemográficos, clínicos y relacionados con el tratamiento) y asegurar su adecuada monitorización.
- 2.
Se debe establecer un algoritmo de monitorización cardiológica del paciente con cáncer.
- 3.
Se debe implementar medidas cardioprotectoras para el paciente con cáncer.
- 4.
En los pacientes con IC y cáncer, además de lo ya expresado, se debe seguir los algoritmos específicos del tratamiento de la IC establecidos y descartar una cardiopatía isquémica.
- 5.
Actualmente el único fármaco con cardioprotección demostrada es el dexrazoxano.
En el paciente anciano las características etiopatogénicas, epidemiológicas e incluso clínicas de la IC difieren significativamente de las que se dan en el paciente más joven.
En las últimas décadas la prevalencia de IC se ha desplazado paulatinamente hacia el grupo de pacientes de más edad, con una proporción cada vez mayor de muy ancianos267-269. En la población general española, los estudios PRICE270 y EPISERVE2 estiman con base en criterios clínicos una prevalencia de IC de un 4,7-6,8% de la población de 45 o más años. En ambos estudios se demuestra un incremento lineal de la prevalencia a medida que aumenta la edad, llegando a alcanzar valores cercanos al 16% de los pacientes mayores de 75 años. Restringiendo los datos a población ingresada, se estima que el 1% del total de altas hospitalarias en España corresponde a episodios de IC descompensada, y la media de edad de los pacientes hospitalizados por este motivo es de 75 años271. Además, la IC es una de las principales causas de morbilidad y mortalidad en este grupo de población267,268,272. La presencia de IC se asocia con un 50% de reducción de la expectativa de vida de los pacientes de 75 o más años273. En pacientes con antecedente de hospitalización por IC, la mortalidad al año del primer ingreso es de un 24-50% y en octogenarios alcanza tasas de hasta el 81% a los 5 años274.
Sin embargo, el tratamiento de la IC puede plantear algunas dificultades. En primer lugar, en cuanto a la evidencia, conviene recordar que muchos ensayos clínicos excluyen a esta población o la tienen infrarrepresentada, por lo que es difícil tener evidencia robusta sobre la eficacia y la seguridad de los tratamientos para la IC en los ancianos. Pero además, desde un punto de vista clínico y asistencial, se deben tener presentes otras cuestiones. El proceso normal de envejecimiento conlleva cambios progresivos en la estructura y la función del corazón275, así como cambios farmacocinéticos y farmacodinámicos que pueden alterar el efecto de los medicamentos en los pacientes ancianos276. Por otro lado, muchos de los ancianos con IC tienen otras comorbilidades. Se ha descrito que hasta 2/3 ancianos tienen más de 2 comorbilidades no cardiacas y el 25%, 6 o más277. Los sistemas y los profesionales sanitarios no siempre disponen de los recursos necesarios o no están lo suficientemente preparados para atender correctamente a este grupo de población278.
EvidenciaEn estos últimos años se han publicado numerosos estudios sobre el tratamiento del paciente anciano-frágil; muchos hacen referencia más bien a la necesidad de generar un marco de atención sanitaria específica para este tipo de población, centrado en un abordaje holístico y multidisciplinar, y otros hacen pequeños subanálisis sobre la eficacia y la seguridad de los fármacos276,279,280.
Sacubitrilo/valsartánUn subanálisis preespecificado del estudio PARADIGM-HF138 analizó la eficacia del sacubitrilo/valsartán en comparación con el enalapril en ancianos con IC-FEr281. Incluyó a 2.557 pacientes con edades de 65-74 años (el 79,2% varones; FE media, 29%; el 76,5% en NYHA I-II) y 1.563 mayores de 74 años (el 72,2% varones; FE media, 30,9%; el 68% en NYHA I-II). La variable principal del estudio era el objetivo compuesto de muerte cardiovascular u hospitalización por IC. En el grupo de edad de 65 a 74 años, el efecto del sacubitrilo/valsartán fue significativamente superior que el del enalapril en la variable principal (HR = 0,80; IC95%, 0,68-0,93), la muerte cardiovascular (HR = 0,74; IC95%, 0,60-0,90) y la mortalidad por cualquier causa (HR = 0,81; IC95%, 0,68-0,97), pero no se hallaron diferencias entre grupos en la hospitalización por IC. En el grupo de mayores de 74 años no hubo diferencias estadísticamente significativas entre grupos. Sin embargo, el valor de p para la interacción entre grupos en todas las variables fue de 0,81 a 0,94 (diferencias estadísticamente no significativas), lo que indica que los efectos del sacubitrilo/valsartán se mantienen constantes en los distintos grupos de edad analizados.
En cuanto a la seguridad, la tasa de eventos adversos fue más alta cuanto mayor era la edad, aunque la magnitud del incremento fue moderada. En el grupo de 65 a 74 años, el evento adverso más frecuente fue la hiperpotasemia > 5,5 mmol/l (con enalapril, el 18,4%; con sacubitrilo/valsartán, el 16,9%), seguido de la hipotensión sintomática (con enalapril, el 9,8%; con sacubitrilo/valsartán, el 15,1%), aunque esta no motivó la interrupción del tratamiento. Los resultados en los mayores de 74 años fueron similares.
IECA y ARA-IIEn los ensayos clínicos de estos grupos farmacológicos tradicionalmente la población anciana ha estado muy infrarrepresentada, por lo que habría que interpretar con cautela incluso los posibles subanálisis. Sí que existe algún ensayo clínico aleatorizado que incluyó principalmente a ancianos, como el ELITE-II, que analizó a 3.162 pacientes mayores de 60 años (media de edad, 71 años; FE media, 31%; mediana de seguimiento, 555 días)282. En este ensayo clínico se comparó la eficacia y la seguridad del losartán frente al captopril. No se encontraron diferencias estadísticamente significativas entre grupos en la mortalidad por cualquier causa (el 11,7 frente al 10,4%), muerte súbita o paradas cardiacas recuperadas (el 9 frente al 7,3%). Sin embargo, con el losartán hubo menos pacientes que interrumpieron el tratamiento por eventos adversos (el 9,7 frente al 14,7%; p < 0,001).
Un metanálisis (aunque antiguo) de los ensayos clínicos más relevantes publicados en ese momento demostró que los IECA seguían ofreciendo beneficios si se restringía el análisis a pacientes mayores de 60 años, aunque partiendo de la premisa de que las dosis utilizadas fueran la dosis diana de estos estudios, difíciles de alcanzar en la población anciana283.
Por otro lado, múltiples estudios observacionales han mostrado el beneficio de estos tratamientos para los ancianos con IC284,285.
Bloqueadores betaAl igual que en los estudios de IECA y ARA-II, la población anciana también está infrarrepresentada en los ensayos clínicos de los blo-queadores beta. Aun así, el estudio SENIORS, un ensayo clínico aleatorizado en pacientes de edad ≥ 70 (media, 76) años con IC mostró que el nebivolol, comparado con placebo, es significativamente superior en pacientes con IC-FEr en la variable principal compuesta de mortalidad por cualquier causa o ingreso por enfermedad cardiovascular (HR = 0,86; IC95%, 0,74-0,99)286. Un posterior metanálisis de calidad con 5 ensayos clínicos aleatorizados y controlados con placebo, que incluyó a más de 12.000 pacientes con IC, confirmó que el beneficio de los bloqueadores beta en mortalidad y reingresos se mantenía en los pacientes mayores de 65 años287.
ARMDistintos estudios han demostrado un claro beneficio en la mortalidad y la morbilidad en la IC-FEr, también en la población anciana186,214,288. Uno de ellos es el estudio EMPHAS1S-HF214, que analizó la eficacia y la seguridad de la eplerenona. Este es un ensayo clínico aleatorizado controlado con placebo que incluyó a 2.737 pacientes con IC-FEr (el 82% varones; media de edad, 68 años). La variable principal del estudio fue un compuesto de muerte cardiovascular u hospitalización por IC, que fue significativamente menor con eplerenona que con placebo (el 18,3 frente al 25,9%; HR = 0,63; IC95%, 0,54-0,74). Fallecieron el 12,5% de los pacientes con eplerenona y el 15,5% de aquellos con placebo (HR = 0,76; IC95%, 0,62-0,93). El porcentaje de hospitalizaciones por IC o por cualquier causa fue significativamente menor también con eplerenona (p < 0,001). Por otro lado, se observó hiperpotasemia (> 5,5 mmol/l) en el 11,8% de los pacientes del grupo de eplerenona y el 7,2% del grupo de placebo (p < 0,001).
DigoxinaLa prescripción de digoxina para pacientes con IC y FA para el control del ritmo sigue generando controversia independientemente de la edad del paciente5,59,289-293.
Conviene recordar que en los pacientes ancianos, en quienes la polifarmacia y la disfunción renal son frecuentes, la digoxina presenta múltiples interacciones farmacológicas294,295 que pueden conllevar, entre otras cosas, altas concentraciones de digoxina.
IvabradinaAunque en el estudio SHIFT296 la media de edad fue menor de 65 años297, un subanálisis posterior analizó la eficacia y la seguridad de la ivabradina en diferentes grupos de edad. Entre ellos, 1.712 pacientes mayores de 69 años (el 66% varones, con una FE media del 29,6%). La variable principal de estudio (mortalidad cardiovascular o ingreso hospitalario por IC) se produjo en el 30% del grupo de ivabradina y el 35% del grupo de placebo (HR = 0,84; IC95%, 0,71-0,99). Los riesgos de ingreso por IC y muerte por IC fueron significativamente menores con ivabradina, pero no se encontraron diferencias entre grupos en la mortalidad cardiovascular. Tampoco se encontraron diferencias estadísticamente significativas en el porcentaje de eventos adversos graves. Sin embargo, el porcentaje de ancianos que podrían alcanzar la dosis de 7,5 mg 2 veces al día fue más bajo entre los mayores de 69 años que en otros grupos de edad, con una mayor tendencia a la bradicardia.
Recomendaciones de las sociedades científicasLas guías de la ESC, aunque no abordan de manera explícita y detallada el tratamiento de la IC en el paciente anciano-frágil, sí que comentan en algunos capítulos distintas cuestiones (tabla 23)5. Así, por ejemplo, en cuanto a la digoxina, recomiendan mucha precaución y también que los ancianos pueden beneficiarse de una monitorización más estrecha.
Recomendaciones de la guía de la Sociedad Europea de Cardiología sobre el tratamiento del paciente anciano5
| Monitorizar la fragilidad y buscar/identificar causas reversibles de su deterioro (cardiovasculares y no cardiovasculares) |
|---|
| Revisión de la medicación: |
| • Optimizar lentamente las dosis de la medicación para la insuficiencia cardiaca y con monitorización frecuente del estado clínico del paciente |
| • Reducir la polifarmacia en número, dosis y complejidad del esquema de tratamiento |
| • Considerar el cese de medicaciones que no consigan un efecto inmediato en la mejoría de los síntomas o la calidad de vida (como las estatinas) |
| • Revisar la dosis e intervalos de diuréticos para reducir el riesgo de incontinencia |
| Considerar la derivación a un equipo especialista en la atención al anciano, al médico de atención primaria, asistente social, etc., para el seguimiento y para dar apoyo tanto al paciente como a su familia |
Por otro lado, en 2019 se publicaron los criterios para una apropiada prescripción de la medicación para los ancianos de la American Geriatrics Society (2019 Updated AGS Beers Criteria® for Potentially Inappropriate Medication Use in Older Adults)298. Estos se basan en un proceso de evaluación de la evidencia y revisión sistemática más un panel interdisciplinario de 13 expertos en geriatría y farmacoterapia. Algunas de las recomendaciones que hacen en torno a los fármacos prescritos a los ancianos son:
- •
Dronedarona. Se han comunicado peores resultados en pacientes que toman dronedarona con FA crónica o IC grave o recientemente descompensada. Se recomienda evitar su uso (calidad de la evidencia, alta; recomendación, fuerte).
- •
Digoxina. No debe emplearse como fármaco de primera línea para el control de la FC en la FA o la IC. Existe evidencia sólida de fármacos alternativos como tratamiento de primera línea. Si se hace necesaria, se recomienda evitar las dosis > 0,125 mg/día, especialmente en caso de enfermedad renal crónica (calidad de la evidencia, moderada; recomendación, fuerte).
- •
Amiodarona. Es eficaz para mantener el ritmo sinusal, pero presenta mayor toxicidad que otros antiarrítmicos utilizados en la FA; puede ser un tratamiento de primera línea razonable para pacientes con IC o hipertrofia del VI sustancial si se prefiere el control del ritmo al control de la frecuencia. Se recomienda evitar como tratamiento de primera línea para la FA, a menos que el paciente tenga IC o hipertrofia del VI sustancial (calidad de la evidencia, alta; recomendación, fuerte).
- •
AINE e inhibidores de la COX2. Se recomienda utilizar con precaución en los pacientes con IC asintomáticos y evitar en pacientes con IC sintomática, por riesgo de retención de líquidos o exacerbación de la IC (calidad de la recomendación, moderada para los AINE y baja para los inhibidores de la COX2).
- •
Además de la precaución existente sobre el dabigatrán, los criterios actualizados destacan la precaución con el rivaroxabán para el tratamiento de la tromboembolia venosa o la FA en adultos de 75 años o más.
También están apareciendo estudios sobre la eficacia del tratamiento cardiogeriátrico de los pacientes con IC. Existe un estudio cuasiexperimental en marcha (fase de reclutamiento), el Geriatric CO-mAnagement for Cardiology patients in the Hospital (G-COACH), que evaluará la eficacia de un programa de atención multidisciplinar que incluye todos los aspectos del tratamiento (cardiología y geriatría), en comparación con el seguimiento habitual, en declive funcional, complicaciones, mortalidad, hospitalización o calidad de vida de los pacientes mayores de 75 años con diversas cardiopatías, entre ellas la IC299.
También se ha descrito otro tipo de programas de atención específicos para el anciano, como el recogido en un estudio observacional prospectivo (de calidad moderada)123 que evaluó a pacientes ancianos al alta tras una hospitalización por IC. En los 7 días posteriores al alta se realizaba una visita ambulatoria, en la que el paciente recibía formación sobre la IC por parte de enfermería, ajuste de dosis del tratamiento, y administración de medicamentos intravenosos cuando fuera necesario. Se incluyó a un total de 518 pacientes, de los que el 57,1% eran mujeres. Se compararon los datos obtenidos por reingresos con los datos de un área sanitaria más amplia que no tenía instaurado el protocolo descrito. Se realizó en análisis durante 2 periodos de tiempo. Los resultados se resumen en la tabla 24. Estos datos indican que una consulta de control precoz tras el ingreso por descompensación de la IC de los pacientes ancianos se asocia con una reducción significativa de los reingresos por cualquier causa, motivada principalmente por la reducción de los reingresos relacionados con la IC.
Programa de atención específico para el anciano
| Área de población del estudio | Área CatSalut | p | |
|---|---|---|---|
| 2012-2013 | |||
| Total de ingresos por IC, n | 1.253 | 31.199 | |
| Reingresos por cualquier causa a 30 días | 184 (14,7) | 4.533 (14,5) | 0,88 |
| Relacionados con la IC | 108 (8,6) | 3.335 (10,7) | 0,02 |
| No relacionados con la IC | 76 (6,1) | 1.198 (3,8) | < 0,001 |
| 2014-2015 | |||
| Total ingresos por IC, n | 1.296 | 31.383 | |
| Reingresos por cualquier causa a 30 días | 130 (10,0) | 4.420 (14,1) | < 0,001 |
| Relacionados con la IC | 71 (5,5) | 3.172 (10,1) | < 0,001 |
| No relacionados con la IC | 59 (4,5) | 1.248 (4,0) | 0,30 |
IC: insuficiencia cardiaca. Tabla elaborada con datos de Pacho et al123.
Clásicamente se ha considerado que el paciente anciano requiere un abordaje específico para sus enfermedades crónicas. La mejora de la calidad de vida incluso a edades avanzadas está modificando el concepto de paciente anciano y se incorpora el término fragilidad, ya que el anciano frágil es quien realmente sufre limitaciones funcionales que requieren un abordaje de sus enfermedades diferente que un paciente más joven5,28,300.
En el paciente anciano, el diagnóstico de IC es más complejo, ya que se produce una serie de cambios fisiológicos, como menor respuesta betaadrenérgica, hipertrofia miocárdica, aumento del depósito intersticial de colágeno en el miocardio y los vasos periféricos y disminución de la vasodilatación mediada por el endotelio, lo que, junto con otras comorbilidades, modifica o enmascara los signos y síntomas empleados para el diagnóstico del síndrome que representa la IC300.
La coordinación entre niveles asistenciales, el abordaje multiprofesional y la colaboración con la familia o el cuidador son estrategias fundamentales para el abordaje del paciente anciano con IC. Si alguna de ellas falla, la situación clínica y el pronóstico del paciente se verán mermados5,28.
- •
El tratamiento diario del paciente anciano con IC debe realizarse desde el punto de vista clínico por especialistas generalistas que incluyan medicina de familia, geriatría y medicina interna, de tal modo que el resto de los especialistas (cardiólogos, neumólogos, nefrólogos, etc.) puedan aportar sus recomendaciones en momentos concretos de la evolución300.
- •
No se debe olvidar otros estamentos, como enfermería y trabajadores sociales, que también pueden aportar valor en el seguimiento300.
- 1.
El primer paso debe ser la identificación de la fragilidad. Para ello se dispone de pruebas que pueden ayudar301: la prueba de velocidad de la marcha, la prueba Timed up and go, el cuestionario PRISMA 7, la FRAIL score301, la FRIED score301 y la Short Physical Performance Battery (SPPB) son los cuestionarios más validados para el diagnóstico de fragilidad. En nuestro país el más utilizado es la FRAIL score. Por otro lado, el deterioro cognitivo y el delirio están estrechamente relacionados con la IC en el anciano y, además, implican mayor tasa de reingresos hospitalarios, mayor estancia hospitalaria y mayor mortalidad. El Mini-Mental State Examination302 y la Evaluación cognitiva de Montreal303 son los cuestionarios utilizados para la identificación del deterioro cognitivo en estos pacientes300.
- 2.
Evaluación pronóstica, perspectiva vital, objetivos generales del paciente (supervivencia frente a calidad de vida): descripción y propuesta de herramientas que ayuden en este enfoque:
- •
La situación clínica del paciente y la expectativa de vida que se pueda estimar son los parámetros necesarios para determinar cuáles son los tratamientos farmacológicos indispensables y cuáles son prescindibles300. El objetivo terapéutico para los pacientes ancianos con IC debe ser reducir la tasa de ingresos y reingresos hospitalarios, que es el factor que condiciona mayor mortalidad, y, especialmente en el anciano frágil, primar estrategias que mejoren la calidad de vida frente a la supervivencia5,28,300.
- •
En los pacientes con mayor fragilidad se debe limitar el uso de fármacos que puedan causar hipotensión y ser causa de caídas, además de afectar a la calidad de vida del paciente300.
- •
En el paciente anciano frágil con IC, cuando se deba elegir entre fármacos que no puedan combinarse, se priorizarán las medidas que aporten calidad de vida frente a las que aporten supervivencia. Cuando el paciente llegue a una situación de calidad de vida, se priorizarán los fármacos que mejor controlen los síntomas y aporten bienestar al paciente5,28,300.
- •
- 3.
Abordaje holístico/integral del paciente anciano con IC:
- •
Más de la mitad de los pacientes ancianos ingresan hasta 4 veces al año, la mayoría de las ocasiones por causa no cardiovascular, lo que obliga a una estrategia multidisciplinar para el control de los factores de riesgo cardiovascular y demás comorbilidades5,28,300.
- •
El seguimiento del paciente anciano con IC debe incluir recomendaciones específicas sobre las pautas terapéuticas que hay que mantener, pero también la monitorización de los síntomas. En este tipo de pacientes, es muy importante la implicación de familiares y cuidadores, ya que son los que realmente permitirán alcanzar una correcta adherencia terapéutica del paciente5,28,300.
- •
La estrategia farmacológica debe centrarse en la revisión periódica de la medicación que incluya, por un lado, la correcta y lenta optimización del tratamiento de la IC y, por otro, reducción de la polifarmacia, lo que incluye número, dosis y complejidad del régimen terapéutico300.
- •
En los casos en que la situación clínica del paciente dificulte o impida los desplazamientos o empeore la clínica, se debe valorar la asistencia domiciliaria. Esto es especialmente relevante en caso de que la asistencia a una consulta o una prueba diagnóstica, invasiva o no, no aporte un beneficio clínico significativo para el paciente.
- •
Habitualmente se puede realizar en el domicilio del paciente toda la actividad asistencial de la consulta diaria. En casos particulares, incluso se puede administrar tratamientos intravenosos en el domicilio del paciente ante una descompensación de la IC que no responda al tratamiento oral.
- •
El tratamiento y el seguimiento del paciente en su domicilio permitirán el inicio de los cuidados paliativos en un entorno más familiar para el paciente y su familia.
- •
En el seguimiento del paciente, es importante decidir cuándo no se puede aportar más y hay que plantearse solamente el control de los síntomas y asegurar un final de la vida lo más confortable posible, es decir, cuándo iniciar los cuidados paliativos. Algunos autores consideran que un paciente está en una situación de cuidados paliativos cuando sufre un deterioro progresivo y dependencia para las actividades diarias o mala calidad de vida a pesar del tratamiento óptimo, caquexia cardiaca o descompensaciones frecuentes, se haya descartado el trasplante cardiaco y la asistencia circulatoria mecánica o cuando se considere que se encuentra en el final de su vida.
- •
En ocasiones es difícil establecer el periodo de cuidados paliativos. Algunos cuestionarios pueden ser de ayuda, como la Palliative Care Outcome Scale304, el Karnofsky Performance Status305 y la Functional Assessment of Chronic Illness Therapy-Palliative Care (FAC1T-Pal)306.
- •
En los cuidados paliativos del paciente con IC, es posible reducir el tratamiento habitual de la enfermedad, particularmente los hipotensores que puedan dificultar la oxigenación, se priorizan los diuréticos para disminuir la congestión y la morfina para el control de la disnea y, por último, se valora la necesidad de oxígeno suplementario. No se debe olvidar la desactivación del DA1 si el paciente, su familia y los profesionales sanitarios (médicos de familia, enfermería y cardiólogo) están de acuerdo300.
- •
Se muestra, a continuación, un resumen de los puntos más destacados de lo expuesto anteriormente5,28,138,298,300,301:
- 1.
Identificación del anciano frágil mediante un procedimiento validado.
- 2.
Evaluación pronóstica que incluya la perspectiva vital, así como establecimiento de los objetivos terapéuticos para el paciente anciano en general y del anciano frágil en particular (supervivencia frente a calidad de vida).
- 3.
Adaptación del plan terapéutico a lo mencionado.
- 4.
Identificación del anciano en situación de tratamiento paliativo y establecimiento de sus objetivos terapéuticos, y con ellos el plan terapéutico.
M. Anguita declara que ha recibido honorarios por ponencias de Pfizer, Bristol-Myers-Squibb, Daiichi-Sankyo, Novartis y Bayer. A.B.G declara haber recibido honorarios por ponencias de Novartis, Roche y Critical Diagnostis. J.M.C. declara haber recibido honorarios por ponencias de Rovi y Novartis. S Cinza no declara ninguno. J. Cosín declara haber recibido honorarios por ponencias de Novartis. M. Crespo Leiro declara haber recibido honorarios por ponencias de C1BERCV, Novartis, MSD y Daiichi-Sankyo. 1. Egocheaga no declara ninguno. C. Escobar no declara ninguno. M. Fauradó no declara ninguno. J.M García Pinilla no declara ninguno. Luís Manzano Espinosa no declara ninguno. J.C. Obaya no declara ninguno. D. Pascual Figal declara haber recibido honorarios por ponencias de Vifor, Novartis y Pfizer. J. Segovia-Cubero no declara ninguno. Estíbaliz Loza no declara ninguno.
Información sobre el suplementoEste suplemento titulado "Consenso de expertos sobre la insuficiencia cardiaca con fracción de eyección reducida: más allá de las guías" ha sido patrocinado por Novartis.