La pandemia causada por el coronavirus del síndrome respiratorio agudo grave de tipo 2 (SARS-CoV-2) ha puesto de manifiesto una serie de complicaciones cardiovasculares, entre las que destaca la miocarditis ocasionada tanto por la propia infección por SARS-CoV-2 (COVID-19) como por la administración de vacunas de ARN mensajero. La elevada prevalencia de primoinfección, la difusión universal de los programas de vacunación y la constante aparición de nueva información sobre la miocarditis en estos contextos, hace necesario condensar el conocimiento adquirido desde el inicio de la pandemia. Con este objetivo, el Grupo de Trabajo Miocarditis de la Asociación de Insuficiencia Cardiaca de la Sociedad Española de Cardiología, con la colaboración de la Agencia Española de Medicamentos y Productos Sanitarios (AEMPS), ha elaborado el presente documento que pretende abordar el diagnóstico y el tratamiento de los casos de miocarditis asociados con la infección por SARS-CoV-2 o la vacuna de ARN mensajero.
Palabras clave
La miocarditis se define como la inflamación del músculo cardiaco; su etiología es diversa e incluye agentes infecciosos o tóxicos y procesos autoinmunitarios1. La pandemia causada por el coronavirus del síndrome respiratorio agudo grave de tipo 2 (SARS-CoV-2) ha puesto de manifiesto una serie de complicaciones cardiovasculares, entre las que destaca la miocarditis ocasionada tanto por la propia infección por SARS-CoV-2 (COVID-19) como por la administración de vacunas de ARN mensajero (ARNm).
En los estudios iniciales de pacientes con COVID-19 se ha observado que un 20-30% presenta cifras de troponina cardiaca por encima del percentil 99 de la normalidad, lo cual refleja daño miocárdico2 y no es secundario a miocarditis en todos los casos3–5. En la infección por SARS-CoV-2 puede existir daño miocárdico, entre otros, por la respuesta inmunitaria asociada6-9, un estado de hipercoagulabilidad con eventos trombóticos7 o debido a isquemia miocárdica por un aumento de las demandas miocárdicas de oxígeno durante la infección (infarto de miocardio tipo 2). Esta variedad de afecciones se refleja en el hecho de que, en la COVID-19 con evidencia de daño miocárdico por elevación de troponinas, solo el 50% de las resonancias magnéticas cardiacas (RMC) muestran hallazgos patológicos; de ellas, un 27% es compatible con miocarditis; un 22%, con cardiopatía isquémica y el resto es inespecífico7.
Con el avance de la pandemia y el programa de vacunación, se ha ido poniendo en evidencia la aparición de casos de miocarditis tras la administración de vacunas de ARNm, sobre todo en varones, adolescentes y jóvenes. Esta forma de miocarditis de mecanismo autoinmunitario y poco conocido, ha supuesto un reto para la gestión de los programas de vacunación.
Por todo ello, y a la luz de la evidencia acumulada, es necesario condensar todo el conocimiento adquirido en estos últimos 2 años para llegar a un consenso. Con este objetivo, el presente documento, auspiciado por el Grupo de Trabajo Miocarditis de la Sociedad Española de la Asociación de Insuficiencia Cardiaca de la Sociedad Española de Cardiología y con la colaboración de la Agencia Española de Medicamentos y Productos Sanitarios (AEMPS), pretende abordar el diagnóstico y el tratamiento de los casos de miocarditis asociados con infección por SARS-CoV-2 o vacuna de ARNm.
FISIOPATOLOGÍA E HISTOPATOLOGÍALa miocarditis se define fisiopatológicamente como una afección inflamatoria del miocardio caracterizada por infiltrado inflamatorio y daño miocárdico sin etiología isquémica subyacente10. Entre sus etiologías, la vírica es la más frecuente en los países desarrollados10. Se han publicado diferentes casos de miocarditis aguda en pacientes con COVID-19 y se considera una complicación cardiovascular infrecuente6,11.
Los mecanismos fisiopatológicos de la miocarditis por SARS-CoV-2 son todavía inciertos y controvertidos12. Entre sus diferentes hipótesis, la más robusta es la citotoxicidad mediada por hiperrespuesta inmunitaria, en la que la liberación excesiva de diferentes mediadores inflamatorios induce desregulación linfocitaria que origina necrosis mediada por linfocitos T13-15. Esta hipótesis concuerda con la mayoría de los casos descritos de miocarditis en COVID-19 sin detección de ARN viral en el miocardio13,15. La evidencia de un daño miocárdico directo es muy débil13,15, ya que, si bien se ha identificado ARN de SARS-CoV-2 en autopsias16 y biopsias endomiocárdicas9, este se localiza en células intersticiales y solo una minoría cumple criterios histopatológicos de miocarditis13,15.
Existen diferentes hipótesis acerca de los mecanismos implicados en la afección cardiaca tras la vacunación contra la COVID-1917,18 con vacunas de ARNm, que incluyen entre otras una respuesta hiperinmunitaria o inflamatoria desencadenada por moléculas de ARNm, fenómenos de hipersensibilidad a la vacuna o alguno de sus componentes y trastornos de autoinmunidad mediados por mimetismo molecular, pero no hay datos que permitan confirmar o refutar ninguna de ellas. Un trabajo reciente19 demostró la presencia de anticuerpos contra el antagonista del receptor de la interleucina 1, y propone la pérdida transitoria de la tolerancia inmunológica periférica como posible mecanismo. Desde el punto de vista histológico, generalmente se observan miocarditis linfocitarias, y en muy raros casos se ha observado miocarditis eosinofílica, descrita respecto de otras vacunas (rubéola, viruela, polio)20.
EPIDEMIOLOGÍAEpidemiología de la miocarditis tras la COVID-19La verdadera prevalencia de miocarditis entre pacientes con COVID-19 es desconocida. La saturación del sistema sanitario durante los primeros meses de la pandemia y el tratamiento clínico guiado por la situación respiratoria sesgaron la identificación de los cuadros de afección cardiaca más graves. Además, las numerosas descripciones publicadas no diferencian entre lesión miocárdica y miocarditis y se han utilizado diferentes aproximaciones diagnósticas.
Entre los pacientes hospitalizados con COVID-19, se estima una prevalencia media de miocarditis definitiva/probable de 2,4 casos/1.000 pacientes hospitalizados21, y en este contexto puede haber una mortalidad elevada (20,4%)22. En un contexto no únicamente hospitalario, se observó que el riesgo de miocarditis aumentó aproximadamente 10 veces en el mes siguiente a una prueba de SARS-CoV-2 positiva, y su aparición fue más frecuente en varones (60%)23.
Se ha descrito la presencia de alteraciones en la ecocardiografía hasta en un 40% de los pacientes hospitalizados, si bien no todas las alteraciones pueden ser secundarias a miocarditis24. Algunos estudios de RMC han descrito hallazgos compatibles con miocarditis en pacientes hospitalizados, tales como realce tardío no isquémico y alargamiento de tiempos T1 y T2 nativos en el 20, el 73 y el 60% respectivamente25,26. Sin embargo, entre los pacientes jóvenes, asintomáticos o paucisintomáticos, la afección cardiaca se objetivó solamente en un 0,5-3% de los casos27.
Los hallazgos de las autopsias de personas con COVID-19 identifican una afección cardiaca muy variable. El trabajo más extenso solo identificó miocarditis clásica en un 7,2% de las autopsias, mientras predominaban otro tipo de alteraciones como isquemia celular, infiltrado inflamatorio sin miocarditis o trombos microvasculares y macrovasculares28.
Epidemiología miocarditis posvacunalCon el inicio de la campaña de vacunación de jóvenes, comenzaron a notificarse casos de miocarditis y/o pericarditis tras la administración de vacunas de ARNm (Comirnaty, BioNTech, Alemania/Pfizer, Estados Unidos; y Spikevax, Moderna, Estados Unidos)29-33. A diferencia de la miocarditis asociada con la COVID-19, la miocarditis posvacunal presenta generalmente un curso benigno34.
Los datos disponibles se revisaron en el Comité para la Evaluación de Riesgos en Farmacovigilancia (PRAC) de la Agencia Europea de Medicamentos35, que concluyó que la miocarditis y la pericarditis son reacciones adversas que pueden darse tras la administración de las vacunas de ARNm, con una frecuencia de aparición muy baja, con mayor riesgo para los varones jóvenes a los pocos días de la segunda dosis. Su curso clínico generalmente benigno hace que el balance riesgo/beneficio se mantenga favorable a la vacunación, considerando su eficacia en prevenir hospitalizaciones y fallecimientos por COVID-19. El Centro de Control de Enfermedades de Estados Unidos alcanzó conclusiones similares36.
Dos estudios epidemiológicos realizados en Francia37 y países nórdicos38 confirmaron un aumento del riesgo de aparición de miocarditis y pericarditis tras la vacunación con vacunas de ARNm, especialmente en varones jóvenes (12-29 años) a lo largo de la primera semana tras la administración de la segunda dosis y con una frecuencia dependiente de la vacuna utilizada (13 casos con Spikevax y 3 casos con Comirnaty cada 100.000 jóvenes vacunados).
Los datos sobre el riesgo tras una tercera dosis son escasos39; se ha estimado la incidencia de miocarditis en una cohorte de jóvenes de 18 a 24 años en 11/100.000 vacunados en las 2 semanas siguientes a recibir la tercera dosis40, y actualmente no puede establecerse que existan diferencias entre la segunda y la tercera dosis.
DIAGNÓSTICOEl diagnóstico de miocarditis relacionada con la infección o la vacunación contra el SARS-CoV-2 se inicia con la presencia de síntomas en un contexto epidemiológico de infección o administración reciente de una vacuna de ARNm. La aparición de dolor torácico persistente, disnea o astenia de esfuerzo, palpitaciones o síncope requiere considerar siempre la posibilidad de miocarditis, que también puede presentarse como shock o muerte súbita41. La presencia de dolor de características pericárdicas es de mayor especificidad por la frecuente afección inflamatoria conjunta de miocardio y pericardio.
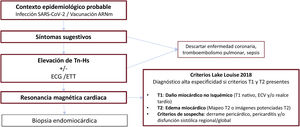
De acuerdo con el algoritmo diagnóstico propuesto (figura 1), cuando exista sospecha clínica siempre deben realizarse un electrocardiograma de 12 derivaciones (ECG), una determinación de troponina sérica de alta sensibilidad (Tn-Hs) y un ecocardiograma transtorácico (ETT). La detección de daño miocárdico por unas concentraciones de Tn-Hs por encima del percentil 99 de la normalidad es la prueba que mejor sustenta el diagnóstico clínico de sospecha de miocarditis en ausencia de enfermedad coronaria u otras causas de daño miocárdico. El ECG apoya dicho diagnóstico en caso de que haya alteraciones compatibles, especialmente elevación del segmento ST. La presencia de alteraciones en el ETT, en particular derrame pericárdico y/o alteraciones de contractilidad segmentaria, también apoyan el diagnóstico42.
Algoritmo diagnóstico de la miocarditis por infección o vacunación contra el coronavirus del síndrome respiratorio agudo grave de tipo 2 (SARS-CoV-2). ARNm: ácido ribonucleico mensajero; ECG: electrocardiograma; ECV: espacio extracelular; ETT: ecocardiograma transtorácico; Tn-Hs: troponina de alta sensibilidad.
En todos los casos la confirmación debería realizarse mediante RMC con base en los criterios de Lake Louise modificados43, que tienen elevadas sensibilidad y especificidad en la fase aguda de un cuadro de gran sospecha clínica (figura 2).
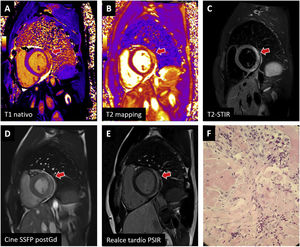
Ejemplos de miocarditis tras vacuna de ARNm contra el coronavirus del síndrome respiratorio agudo grave de tipo 2 (SARS-CoV-2) confirmados con resonancia magnética cardiaca y biopsia endomiocárdica. La afección en la cara lateral basal (flecha) cumple criterios en T1 (A: prolongación en T1 nativo; E: realce tardío) y T2 (B: prolongación en T2; C: hiperintensidad en imágenes potenciadas en T2) y es visible en la secuencia de cine realizada tras la administración de contraste (D). La biopsia (F) muestra inflamación leve linfoplasmohistiocitaria con eosinófilos, edema intersticial y mínima necrosis de miocardiocitos. PSIR: inversión-recuperación sensible a fase; SSFP post-Gd: estado de precesión libre estacionario posterior a la administración de medio de contraste (gadolinio); STIR: triple pulso de inversión-recuperación.
La biopsia endomiocárdica no es necesaria para el diagnóstico de esta forma de miocarditis, pero debe realizarse en caso de que se considere un diagnóstico alternativo, y en particular si se hallan arritmias ventriculares sostenidas recurrentes o shock cardiogénico44,45, para mejorar la toma de decisiones terapéuticas.
TRATAMIENTOEl tratamiento de la miocarditis tras infección o vacunación contra el SARS-CoV-2 es actualmente un verdadero desafío, dada la incertidumbre acerca de sus fisiopatologías junto con la ausencia de ensayos clínicos aleatorizados en ambos contextos. Por ello, los documentos de consenso tanto americanos41 como europeos46 postulan un tratamiento similar al de otras miocarditis virales, centrado principalmente en el tratamiento general de soporte con escasas y débiles recomendaciones respecto a tratamientos específicos.
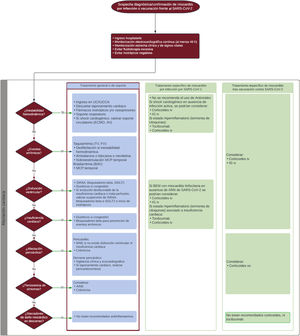
El algoritmo de tratamiento se puede consultar en la figura 3. Todo paciente con elevada sospecha clínica de miocarditis por infección o vacunación por SARS-CoV-2 debe ingresar para monitorización clínica y electrocardiográfica durante al menos 48 h; si es posible, el estudio de confirmación (RMC) se realiza en este momento. Se recomienda ingreso en unidad de cuidados críticos en caso de inestabilidad hemodinámica y/o eléctrica15,41,46. En general, en caso de aparición de arritmias, disfunción sistólica, insuficiencia cardiaca y/o afección pericárdica, se aplicará el tratamiento clínico y farmacológico habitual. Si se han indicado, se recomienda mantener el régimen de bloqueadores beta e inhibidores del sistema renina-angiotensina-aldosterona durante al menos los primeros 3 meses posteriores al alta hospitalaria20,46. El uso de antiinflamatorios se reserva a pacientes con síntomas persistentes, y en general no son necesarios para pacientes con mejoría sintomática precoz.
Algoritmo terapéutico de la miocarditis por infección o vacunación contra el coronavirus del síndrome respiratorio agudo grave de tipo 2 (SARS-CoV-2). AINE: antiinflamatorios no esteroideos; AV: asistencia ventricular; BAV: bloqueo auriculoventricular; ECMO: oxigenador extracorpóreo de membrana; FV: fibrilación ventricular; IG: inmunoglobulinas; iSGLT2: inhibidores del cotransportador de sodio-glucosa tipo 2; iSRAA: inhibidores del sistema renina-angiotensina-aldosterona; i.v.: intravenosa; MCP: marcapasos; PVC: presión venosa central; TV: taquicardia ventricular; UCCA: unidad de cuidados cardiológicos agudos; UCI: unidad de cuidados intensivos; VM: ventilación mecánica; VMNI: ventilación mecánica no invasiva; v.o.: vía oral.
En relación con el tratamiento específico de la miocarditis por COVID-19, algunos autores indican un posible beneficio de los esteroides en dosis altas e inmunoglobulinas intravenosas, por considerarla una miocarditis inmunomediada47. El uso sistemático de corticoides en general no está recomendado en miocarditis46 y hay escasa evidencia sobre la miocarditis en el contexto de la COVID-19. No obstante, con base en el beneficio mostrado con la dexametasona en pacientes hospitalizados con COVID-19 y afección respiratoria48, están recomendados para este tipo de pacientes41,46,48. Respecto a las inmunoglobulinas intravenosas (IVIG) en la miocarditis no asociada con COVID-19, un metanalisis49 comunicó mejoras en la supervivencia y la función ventricular administradas junto con el tratamiento corticoideo. Actualmente no existe evidencia de su uso en miocarditis relacionada con el SARS-CoV-2.
Otros tratamientos inmunomoduladores (tocilizumab, sarilumab, baricitinib o anakinra) son prometedores y actualmente hay estudios en marcha en miocarditis por SARS-CoV-241. Los resultados positivos de tocilizumab en la reducción de la inflamación pulmonar en la COVID-19 con tormenta de citocinas50 justifican su administración junto con esteroides sistémicos, en casos de estado hiperinflamatorio concurrente con la miocarditis15,41,46,51.
PRONÓSTICO Y SEGUIMIENTOPronóstico en función de la presentación del cuadro inicialA pesar de que se han descrito numerosos casos de sospecha clínica de miocarditis en pacientes con infección por SARS-CoV-2, los casos con confirmación histológica son escasos9. Inicialmente, debido a un sesgo de selección de pacientes graves hospitalizados, se describieron presentaciones fulminantes, con elevada necesidad de soporte inotrópico o mecánico. En este contexto de pacientes graves con neumonía asociada, la mortalidad puede llegar al 6,6% a los 3 meses21. Entre los pacientes con miocarditis fulminante, aquellos sin síndrome inflamatorio multisistémico (SIM) asociado presentan un curso más agresivo desde el punto de vista cardiológico, con mayores necesidad de asistencia mecánica y mortalidad52. Por otro lado, existe una implicación pronóstica de la detección de daño miocárdico, no solo debido a la miocarditis, que se ha correlacionado con un aumento de los reingresos53 y la mortalidad a los 30 días de los pacientes ingresados por COVID-1954. La existencia de factores de riesgo cardiovascular y/o cardiopatía previa se ha asociado con un cuadro clínico más grave y peor pronóstico, especialmente en pacientes con antecedente de insuficiencia cardiaca, cuya mortalidad puede ser de hasta el 40%55-57.
El pronóstico de los cuadros clínicos inicialmente más benignos, especialmente fuera del contexto hospitalario, está peor definido y se limita a series de pacientes con criterios de inclusión y diagnóstico diferentes. Por ejemplo, en un estudio de casos y controles con pacientes jóvenes sintomáticos ambulatorios tras COVID-19, se encontró una prevalencia de miocarditis por RMC del 8%, con posterior mejoría progresiva del realce y sin eventos clínicos en el seguimiento58.
La incidencia de miocarditis en caso de reinfecciones por SARS-CoV-2 es desconocida, así como sus características con respecto a la que acontece durante la infección inicial.
Por otra parte, la mayor parte de los casos de miocarditis relacionados con la vacuna contra el SARS-CoV-2 son leves y se resuelven en un periodo de 1 a 3 semanas20. Más del 90% de los pacientes tienen una recuperación clínica completa en los primeros 3-6 meses17. Los casos graves son infrecuentes, sin predilección por sexo, y no se ha hallado relación con haber padecido antes una cardiopatía59.
Seguimiento clínico y pruebas de imagenTras el alta hospitalaria se recomienda un seguimiento ambulatorio. Es obligatoria la valoración clínica con ECG y ETT a todo paciente, aunque no existen pautas definitivas con respecto a los intervalos requeridos. Para los pacientes con mejoría precoz sin disfunción ventricular y leve extensión en el estudio de RMC, la visita podría realizarse a los 3-6 meses. Para los pacientes con mayor riesgo (disfunción ventricular, miocarditis extensa, alto riesgo arrítmico), parece adecuado un seguimiento más precoz. En casos particulares de alto riesgo arrítmico, es aconsejable un Holter-ECG. Si durante el seguimiento se observa un empeoramiento del estado clínico, debería valorarse el ingreso hospitalario, una RMC y/o una biopsia endomiocárdica, según el grado de la enfermedad41.
En cuanto al seguimiento con pruebas de imagen en miocarditis de otras etiologías, un estudio de RMC en el seguimiento a los 6-12 meses permite estratificar el pronóstico según la persistencia de edema, la ausencia de reducción del realce tardío respecto al estudio en fase aguda60 o el patrón de localización del realce tardío residual61. En el contexto de la miocarditis por SARS-CoV-2 o posvacunal, no hay evidencia a largo plazo ni pautas establecidas sobre el momento óptimo del seguimiento con pruebas de imagen. De la evidencia disponible, las alteraciones en T1 nativo y el realce tardío parecen persistir a los 3 meses respecto a los controles, y desparecen a partir de los 4-6 meses tras una miocarditis por COVID-1962,63. Por su parte, pequeñas series muestran una normalización de la función ventricular y el edema miocárdico, con persistencia del realce tardío 3 meses después de la miocarditis posvacunal64, que parece reducirse hasta alcanzar una persistencia mínima y sin eventos clínicos adversos a los 6 meses65. En pacientes con COVID-19 leve y sin afección cardiovascular inicial, la RMC no mostró alteraciones a los 6 meses de seguimiento66. Por lo tanto, teniendo en cuenta los datos disponibles, parece prudente proponer un seguimiento que incluya una RMC67,68 en torno a los 6 meses tras el diagnóstico, que puede adelantarse en casos con síntomas persistentes que hayan cursado con complicaciones (arritmias o disfunción ventricular) o de deportistas de alto nivel o profesiones de riesgo69.
Vacunación tras miocarditis/pericarditis posvacunalNo existen datos sólidos sobre posibles medidas que podrían minimizar el riesgo de aparición de miocarditis/pericarditis. Algunos resultados apuntan a que una separación entre la primera y la segunda dosis superior a 56 días podría disminuir su probabilidad de aparición70 sin impacto en su eficacia71. Sin embargo, estos últimos resultados se refieren a datos previos a ómicron, por lo que su extrapolación a situaciones epidemiológicas posteriores puede ser limitada.
Actualmente no existen vacunas disponibles en nuestro país que puedan representar una alternativa para pacientes diagnosticados de miocarditis/pericarditis relacionadas con la administración de una vacuna de ARNm. Las vacunas basadas en adenovirus no están recomendadas para edades jóvenes por la posible aparición de un infrecuente síndrome de trombosis con trombocitopenia grave. También se ha identificado recientemente la aparición de miocarditis/pericarditis como una posible reacción adversa a la vacuna disponible basada en proteínas (Nuvaxovid, Novavax, Estados Unidos).
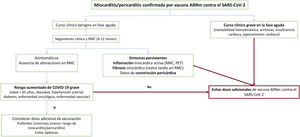
Tampoco existe evidencia científica que permita establecer la actuación óptima para pacientes que han sufrido una miocarditis o pericarditis tras la administración de una dosis de vacuna. Desde una perspectiva clínica y según los principios de prudencia y plausibilidad biológica, la recomendación general es no administrar dosis adicionales a este grupo de pacientes, aunque parece razonable individualizar la actuación según las características de cada caso. La figura 4 recoge el algoritmo de actuación propuesto.
Algoritmo para decidir la administración de nuevas dosis de vacuna de ARNm contra el SARS-CoV-2 a pacientes con miocarditis posvacunal previa. ARNm: ácido ribonucleico mensajero; PET: tomografía por emisión de positrones; RMC: resonancia magnética cardiaca; SARS-CoV-2: coronavirus del síndrome respiratorio agudo grave de tipo 2.
La incidencia de infección sintomática por SARS-CoV-2 en edad pediátrica es baja (1-2%) y son cuadros leves o asintomáticos en la mayoría de los casos72. Además de la afección respiratoria, se ha descrito el SIM pediátrico (SIM-Ped), una complicación posinflamatoria infrecuente (el 8% hospitalizados; un 0,5-3% con COVID-19 pediátrica general), pero de curso clínico potencialmente grave. El SIM-Ped se relaciona con una mala regulación inmunitaria en individuos con susceptibilidad genética, más que con un efecto directo del virus. Su perfil inmunológico y sus manifestaciones clínicas difieren de la infección aguda por COVID-1967 y comparten rasgos superponibles a los de otras enfermedades inflamatorias73. El SIM-Ped se manifiesta unas 2-6 semanas tras la primoinfección por SARS-CoV-2 y cursa con afección cardiovascular en la mayoría de los casos; se han descrito disfunción ventricular, miocarditis, arritmias o inflamación coronaria72,74-76; hasta el 64% de los casos pueden precisar cuidados intensivos pediátricos77. El diagnóstico de SIM-Ped exige la evidencia de infección activa o pasada por SARS-CoV-2 y debe incluir ECG, analítica y pruebas de imagen, y se recomienda una ecocardiografía para todos los pacientes. Ante sospecha de daño miocárdico, la RMC debe realizarse en la fase aguda y tras 1-6 meses en el seguimiento a los pacientes con RMC inicial patológica o aneurismas coronarios67. El tratamiento de SIM-Ped incluye apoyo respiratorio y hemodinámico en los casos más graves78, y se trata con fármacos a la mayoría de los pacientes. El tratamiento inmunomodulador de primera línea incluye IVIG y corticoterapia sistémica, aunque puede precisarse anakinra y tocilizumab75. Además, se utilizará tratamiento antiagregante plaquetario y antitrombótico en casos seleccionados. No están recomendados actualmente los fármacos antivirales. El pronóstico es favorable en la mayoría de los pacientes, si bien se ha descrito un 1% de mortalidad en los casos con manifestación más grave78.
La vacuna contra la COVID-19 está aprobada para personas a partir de los 5 años de edad, y las principales sociedades científicas recomiendan la vacunación sistemática de la población pediátrica78,79.
DeportistasLa miocarditis es una de las causas de muerte súbita de deportistas80. Por ello, la elevada incidencia de miocarditis por COVID-19 en deportistas descrita en un primer momento creó una gran alarma27. Sin embargo, registros más recientes indican que los casos de miocarditis en deportistas que han padecido la COVID-19 son poco frecuentes (0,4%)81,82.
Con el fin de disminuir el riesgo de que se produzcan eventos cardiacos graves tras la COVID-19, se han propuesto numerosos protocolos de cribado previo a la vuelta al entrenamiento o la competición deportiva. Además de conseguir el retorno a una práctica deportiva segura, estos protocolos deben evitar limitaciones innecesarias, de forma que el deportista pueda retomar cuanto antes su actividad física habitual, dados los importantes beneficios cardiovasculares, metabólicos, mentales y emocionales.
Los protocolos de cribado tras enfermedad o vacunación contra la COVID-19 deben basarse en la gravedad del cuadro clínico y la presencia de síntomas cardiacos. Según algunos de los protocolos existentes41,83, los deportistas asintomáticos o con síntomas leves no cardiacos (fiebre, tos, odinofagia, malestar general, mialgias) de menos de 1 semana de duración no precisan ninguna prueba para volver gradualmente a practicar deporte cuando estén asintomáticos (excluidas anosmia y ageusia) y tras cumplir el aislamiento preceptivo. En estos casos, y al igual que en otras viriasis comunes, no es necesaria una valoración médica84. Sin embargo, los deportistas que han cursado con síntomas cardiopulmonares (dolor o sensación de opresión torácica, palpitaciones, disnea, síncope o presíncope) o persistentes (> 7 días) o que han precisado hospitalización con sospecha de afección cardiaca siempre deben someterse a valoración médica antes de reincorporarse a la práctica deportiva41,83. En estos casos la valoración deberá incluir ECG, ecocardiografía y determinación de Tn-Hs, y en caso de hallazgos patológicos, confirmación con RMC.
En caso de miocarditis confirmada tras infección o vacunación contra la COVID-19, se recomienda no practicar ejercicio físico de intensidad moderada y alta durante un periodo de 3 a 6 meses85. La reincorporación a la práctica deportiva debe ser gradual, una vez que el deportista esté asintomático, con capacidad funcional normal y sin arritmias en ergometría máxima y Holter-ECG (de larga duración con sesión de ejercicio físico incluida), y sin datos de afección residual en la RMC (fracción de eyección del ventrículo izquierdo conservada, ausencia de edema y/o fibrosis)85. Sin embargo, recomendamos la evaluación individual de cada caso y plantear un seguimiento específico.
Las recomendaciones recogidas en el presente documento se resumen en la tabla 1.
Recomendaciones sobre diagnóstico, tratamiento, seguimiento y eventual vacunación de pacientes con miocarditis por infección o vacunación contra el SARS-CoV-2
| Diagnóstico |
| En presencia de sospecha clínica de miocarditis y un contexto epidemiológico probable, se debe realizar ECG, Tn-Hs y ETT |
| Se define daño miocárdico como la elevación de Tn-Hs por encima del p99, que es el hallazgo que más sustenta el diagnóstico de sospecha clínica |
| Se deben cribar diagnósticos alternativos (cardiopatía isquémica, tromboembolia pulmonar, sepsis) |
| Se recomienda confirmar con RMC todos los casos de sospecha clínica y presencia de daño miocárdico |
| La biopsia endomiocárdica se reserva para casos con sospecha de diagnóstico alternativo, arritmias ventriculares o inestabilidad hemodinámica |
| Tratamiento |
| Se recomienda ingreso hospitalario y monitorización con ECG al menos 48 h |
| En caso de arritmias y/o inestabilidad hemodinámica, se recomienda ingreso en unidad de cuidados agudos |
| Se recomienda tratar la insuficiencia cardiaca según tratamiento habitual |
| Seguimiento |
| Se debe realizar seguimiento clínico tras el alta hospitalaria incluyendo ECG y ETT |
| Antes de su reincorporación, se recomienda una RMC a los 6 meses tras el diagnóstico, sobre todo para pacientes con síntomas persistentes, arritmias, disfunción ventricular o deportistas de alto nivel o profesionales con riesgo |
| Vacunación |
| Se recomienda la vacunación sistemática para disminuir las complicaciones y hospitalizaciones por COVID-19 |
| Se han descrito miocarditis en relación con las vacunas de ARNm contra el SARS-CoV-2. Son más frecuentes en varones jóvenes y tras la segunda dosis |
| En caso de miocarditis posvacunal, se recomienda una dosis adicional solo para los pacientes cuyo curso clínico fue benigno, que permanecen asintomáticos y sin alteraciones en los estudios de imagen y tienen un riesgo aumentado de sufrir COVID-19 grave |
| Deporte |
| Los deportistas asintomáticos o con síntomas leves no cardiacos de duración < 7 días no precisan valoración médica o prueba complementaria para volver a practicar deporte |
| Antes de la reincorporación deportiva, los deportistas con síntomas cardiacos o persistentes (> 7 días) precisan una valoración médica que incluya ECG, Tn-Hs y ETT |
| En caso de miocarditis confirmada, se recomienda la abstención de ejercicio físico de moderada y alta intensidad durante 3 a 6 meses, una reincorporación gradual cuando no haya síntomas y antes de la valoración médica con ausencia de hallazgos patológicos en las exploraciones complementarias |
ARNm: ácido ribonucleico mensajero; COVID-19: enfermedad coronavírica de 2019; ECG: electrocardiograma de 12 derivaciones; ETT: ecocardiografía transtorácica; RMC: resonancia magnética cardiaca; SARS-CoV-2: coronavirus del síndrome respiratorio agudo grave de tipo 2; Tn-Hs: troponina de alta sensibilidad.
Las miocarditis por COVID-19 o tras la vacunación contra el SARS-CoV-2 son entidades relativamente prevalentes con una fisiopatología no completamente aclarada. La aparición de nuevas variantes y la administración de dosis vacunales requieren establecer unas pautas comunes de diagnóstico, tratamiento clínico y seguimiento de estos pacientes. El presente documento revisa la evidencia disponible y propone algoritmos de utilidad en la práctica clínica.
FINANCIACIÓNEl presente trabajo no ha contado con financiación.
CONTRIBUCIÓN DE LOS AUTORESTodos los autores han participado por igual en la elaboración de este documento.
CONFLICTO DE INTERESESSin conflicto de intereses.