La utilidad de las estatinas en pacientes con insuficiencia cardiaca es motivo de controversia. Bajo la hipótesis de que el tratamiento con estatinas sería útil en los pacientes con insuficiencia cardiaca y mayor actividad inmunoinflamatoria, pretendimos conocer si la elevación del antígeno carbohidrato 125, un biomarcador asociado a la congestión sistémica y actividad inflamatoria, identificaría a los que se beneficiarían, en cuanto a mortalidad, del tratamiento con estatinas tras un ingreso por insuficiencia cardiaca aguda.
MétodosAnalizamos a 1.222 pacientes consecutivos ingresados por insuficiencia cardiaca aguda. El antígeno carbohidrato 125 se determinó durante el ingreso hospitalario y se dicotomizó según los valores de referencia (> 35 U/ml).
ResultadosSe observaron valores elevados del antígeno carbohidrato 125 en 793 pacientes (64,9%) y a 455 (37,2%) se les prescribió estatinas. Entre los pacientes con antígeno carbohidrato 125>35 U/ml, la mortalidad de los tratados con estatinas fue inferior (1,89 frente a 2,80/10 pacientes-año de seguimiento; p<0,001). Por el contrario, la mortalidad de aquellos con valores de antígeno carbohidrato 125 ≤ 35 U/ml fue similar (1,76 frente a 1,63/10 pacientes-años de seguimiento; p=0,862). Tras un minucioso ajuste multivariable, este efecto diferencial atribuible al tratamiento con estatinas persistió (para la interacción, p=0,024). Así, el tratamiento con estatinas se asoció con una reducción significativa del riesgo de muerte de los sujetos con antígeno carbohidrato 125>35 U/ml (hazard ratio=0,65; intervalo de confianza del 95%, 0,51-0,82; p<0,001); sin embargo, no fue así en aquellos con valores de antígeno carbohidrato 125 ≤ 35 U/ml (hazard ratio=1,02; intervalo de confianza del 95%, 0,74-1,41; p=0,907).
ConclusionesLa elevación plasmática del antígeno carbohidrato 125 identificó un subgrupo de población que podría beneficiarse del tratamiento con estatinas en términos de mortalidad a largo plazo.
Palabras clave
La inflamación es un proceso patogénico clave que se asocia a la progresión de la insuficiencia cardiaca (IC)1. Las propiedades antiinflamatorias pleotrópicas de las estatinas parecen ser una característica atractiva de estos fármacos para abordar el componente inflamatorio en los pacientes con IC avanzada2. A diferencia de los estudios observacionales a gran escala, que han mostrado una reducción de los eventos clínicos en los pacientes con IC tratados con estatinas3, 4, 5, dos ensayos controlados y aleatorizados recientes de las estatinas en la IC no han evidenciado efecto beneficioso alguno en cuanto a la supervivencia6, 7. No obstante, un análisis post-hoc del ensayo CORONA mostró una disminución de la mortalidad con rosuvastatina en los pacientes que presentaban una actividad inflamatoria elevada medida con la proteína C reactiva (PCR) en suero (> 2 mg/dl)8.
La evidencia acumulada hasta el momento apunta a que el antígeno carbohidrato 125 (CA125) es un marcador fiable de la congestión y la inflamación en los pacientes con insuficiencia cardiaca aguda (ICA)9, 10, 11, 12 y que se asocia de manera independiente a la mortalidad por todas las causas y a la mortalidad cardiovascular11, 12. El hecho de que se haya observado que la concentración sérica de CA125 es muy fiable a lo largo del tiempo12, 13 ha llevado a proponer este biomarcador como candidato ideal para medir el grado de inflamación en la ICA. Así pues, y partiendo del supuesto de que los pacientes con ICA y valores de CA125 elevados (> 35 U/ml) constituyen un subgrupo de pacientes con una actividad inflamatoria elevada, pretendimos determinar si el tratamiento con estatinas tras un episodio de ICA tiene un efecto pronóstico diferencial en cuanto a la mortalidad total y la mortalidad cardiovascular según las categorías establecidas mediante la concentración de CA125.
MétodosGrupo de estudio y protocoloEstudiamos prospectivamente una cohorte de 1.222 pacientes ingresados consecutivamente en el servicio de cardiología de un centro de nivel terciario, entre el 1 de enero de 2004 y el 1 de noviembre de 2009, con un diagnóstico de ICA según la definición actual de las guías14, 15, 16. Según el diseño del estudio, se excluyó de este análisis a los pacientes que fallecieron antes de que se determinara el CA125 (n=21). Se excluyó también a los pacientes con un diagnóstico principal de síndrome coronario agudo (n=20), cáncer (n=18), neumonía (n=16), sepsis (n=8), hepatopatía grave (n=1) o enfermedad renal terminal en tratamiento de diálisis (n=3).
Se obtuvo sistemáticamente información sobre características demográficas, antecedentes patológicos, constantes vitales, electrocardiograma de 12 derivaciones, datos de laboratorio y uso de medicación, al ingreso y durante todo el curso hospitalario, con el empleo de cuestionarios de registro preestablecidos. Todos los pacientes recibieron tratamiento intravenoso, al menos durante las 48 h siguientes al ingreso. Se determinó la fracción de eyección ventricular izquierda (FEVI) mediante ecocardiografía (Agilent Sonos 5500-Phillips) durante la hospitalización de referencia. El tratamiento con inhibidores de la enzima de conversión de la angiotensina, antagonistas de los receptores de la angiotensina II, bloqueadores beta, antagonistas de la aldosterona, anticoagulantes, diuréticos y otras estrategias terapéuticas se individualizó siguiendo lo indicado en las guías establecidas en vigor en el momento del reclutamiento para el estudio14, 15, 16. La decisión de utilizar un tratamiento con estatinas la tomó el cardiólogo encargado del paciente y no se vio influida ni fue orientada por los valores de CA125.
Se efectuó un seguimiento de los pacientes hasta su muerte, y se les censuró para el análisis en caso de pérdida del seguimiento o de que se les hubiera practicado una sustitución valvular o un trasplante cardiaco. Se tomó como variable de valoración principal la mortalidad por todas las causas, y la mortalidad cardiovascular fue una variable de valoración secundaria. La información relativa a la causa de la muerte se extrajo de la historia clínica del paciente y la adjudicación la realizó un investigador que no conocía el tratamiento recibido por los pacientes ni los valores de CA125. Una vez identificada, la causa de la muerte se clasificó según las categorías establecidas por la American Heart Association17. Las muertes se consideraron de origen no cardiovascular si se identificaba una causa no cardiovascular específica como desencadenante principal del evento. En los demás casos, se consideró una etiología cardiovascular, que incluyó la muerte súbita, la muerte por IC progresiva, otras causas cardiovasculares y la muerte por causa desconocida. La muerte súbita se definió como un evento aparecido de manera inesperada en un paciente por lo demás estable, y la muerte por IC progresiva se definió como la que se producía en el contexto de un deterioro clínico progresivo de los síntomas de IC. Para los fines de este estudio, se supuso que las muertes que se producían fuera del hospital eran de origen cardiovascular si la información acerca de las circunstancias en las que se había producido la muerte provenía de los familiares o de la revisión de las historias clínicas extrahospitalarias. El estudio se atiene a los principios establecidos en la Declaración de Helsinki, fue aprobado por un comité de revisión interno y contó con el consentimiento informado de los pacientes.
Determinaciones del antígeno carbohidrato 125Se determinó el CA125 durante la hospitalización del paciente (72±12 h tras el ingreso) utilizando un kit comercial de inmunoanálisis (Elecsys CA125 II, assay—Roche Diagnostics).
Tratamiento con estatinasSe consideró que los pacientes tomaban estatinas si se les prescribían en el momento del alta hospitalaria o, en los casos de muerte temprana, solamente cuando el tratamiento se había iniciado al menos 24 h antes de la muerte. No se utilizaron directrices específicas para iniciar el tratamiento con estatinas ni para elegir la clase concreta o la posología. Basándose en la eficacia de reducción de las lipoproteínas de baja densidad (LDL)18 y la PCR19, la equivalencia terapéutica entre las diversas estatinas se caracterizó como de dosis baja o media-alta. La dosis baja incluía el empleo de atorvastatina ≤ 10 mg, simvastatina ≤ 20 mg, pravastatina ≤ 40mg, lovastatina ≤ 40mg o fluvastatina ≤ 80mg; y la dosis media-alta incluía el uso de atorvastatina ≥ 20 mg o simvastatina ≥ 40mg.
Análisis estadísticoLas variables continuas se expresaron en forma de media±1 desviación estándar o en forma de mediana [intervalo intercuartílico] cuando ello era apropiado. Las variables discretas se presentaron en forma de porcentajes. Las tasas de mortalidad con los diversos tratamientos de estatinas y en las dos categorías de valores de CA125 (≤ 35 o > 35 U/ml) se describieron con el método de Kaplan-Meier y se evaluaron sus diferencias con la prueba de Peto-Peto Prentice. La asociación independiente entre el tratamiento con estatinas y la mortalidad a largo plazo se evaluó con un análisis de regresión de Cox. Para el análisis secundario, se estableció de forma independiente un modelo de la muerte cardiovascular con un modelo de Cox adaptado para eventos de riesgo en competencia20. Las covariables candidatas para el modelo multivariable inicial se eligieron en función del conocimiento médico previo (véanse las variables en la Tabla 1), y con independencia de su valor de p. Se estableció un modelo reducido y restringido, aunque con un alto valor predictivo, mediante un procedimiento de eliminación retrógrada utilizando el algoritmo «polinomial fraccional multivariable». El supuesto de proporcionalidad para la función del riesgo a lo largo del tiempo se verificó mediante los residuos de Schoenfeld. La capacidad discriminatoria de los modelos se evaluó con el estadístico C de Harrell y su calibrado se basó en la prueba de Gronnesby y Borgan. Las covariables que se incluyeron en los modelos finales se especifican en las respectivas figuras y tablas. Con objeto de dar un significado clínico a los resultados de la regresión de Cox, se calcularon las medidas absolutas de la asociación entre las estatinas y la mortalidad. Se estimaron las diferencias de riesgo absoluto ajustadas para la clasificación binaria según el CA125 y en momentos de valoración específicos durante el seguimiento (3 y 6 meses, 1, 3 y 5 años)21. Se obtuvo el número de pacientes que es necesario tratar (NNT) y su intervalo de confianza del 95% (IC95%) tomando el recíproco de la diferencia de riesgo.
Tabla 1. Características basales de la población estratificada según el tratamiento con estatinas
| Todos (n=1.222) | Estatinas (n=455) | Sin estatinas (n=767) | p | |
| Características demográficas y antecedentes patológicos | ||||
| Edad (años) | 73±11 | 73±10 | 73±12 | 0,559 |
| Mujeres, n (%) | 620 (50,7) | 211 (46,4) | 409 (53,3) | 0,019 |
| Ingreso previo por ICA, n (%) | 458 (37,5) | 170 (37,4) | 288 (37,5) | 0,948 |
| Hipertensión, n (%) | 946 (77,4) | 393 (86,4) | 553 (72,1) | < 0,001 |
| Dislipemia, n (%) | 523 (42,8) | 342 (75,2) | 181 (23,6) | < 0,001 |
| Fumadores actuales, n (%) | 128 (10,5) | 53 (11,6) | 75 (9,8) | 0,302 |
| Ex fumadores, n (%) | 232 (19) | 109 (24) | 123 (16) | 0,001 |
| Cardiopatía isquémica, n (%) | 466 (38,1) | 261 (57,4) | 205 (26,7) | < 0,001 |
| Valvulopatía cardiaca, n (%) | 350 (28,6) | 97 (21,3) | 253 (33) | < 0,001 |
| ICAD, n (%) | 836 (68,4) | 293 (64,4) | 543 (70,8) | 0,02 |
| Edema pulmonar agudo, n (%) | 265 (21,7) | 119 (26,1) | 146 (19) | 0,004 |
| ICA hipertensiva, n (%) | 99 (8,1) | 41 (9) | 58 (7,6) | 0,369 |
| Clase III/IV de la NYHA, n (%) a | 224 (18,3) | 79 (17,4) | 145 (18,9) | 0,501 |
| IC previa, n (%) | 434 (35,5) | 165 (36,3) | 269 (35,1) | 0,674 |
| EPOC, n (%) | 265 (21,7) | 108 (23,7) | 157 (20,5) | 0,18 |
| EAP, n (%) | 87 (7,1) | 43 (9,4) | 44 (5,7) | 0,015 |
| Ictus, n (%) | 126 (10,3) | 58 (12,7) | 68 (8,9) | 0,031 |
| Insuficiencia renal, n (%) | 205 (16,8) | 93 (20,4) | 112 (14,6) | 0,008 |
| Derrame pleural radiológico, n (%) | 539 (44,1) | 185 (40,7) | 354 (46,1) | 0,061 |
| Edema periférico, n (%) | 680 (55,6) | 238 (52,3) | 442 (57,6) | 0,07 |
| Uso previo de diuréticos, n (%) | 756 (61,9) | 288 (63,3) | 468 (61) | 0,428 |
| Uso previo de bloqueadores beta, n (%) | 292 (23,9) | 144 (31,6) | 148 (19,3) | < 0,001 |
| Uso previo de IECA/ARA-II, n (%) | 554 (45,3) | 250 (54,9) | 304 (39,6) | < 0,001 |
| Uso previo de estatinas, n (%) | 330 (27) | 260 (57,1) | 70 (9,1) | < 0,001 |
| Constantes vitales | ||||
| Frecuencia cardiaca (lpm) | 101±29 | 99±28 | 102±30 | 0,018 |
| PAS (mmHg) | 150±36 | 152±36 | 149±36 | 0,152 |
| PAD (mmHg) | 83±20 | 83±21 | 82±20 | 0,291 |
| Electrocardiograma | ||||
| Fibrilación auricular, n (%) | 539 (44,1) | 153 (33,6) | 386 (50,3) | < 0,001 |
| QRS > 120ms, n (%) | 358 (29,4) | 139 (30,5) | 219 (28,7) | 0,494 |
| Parámetros de laboratorio | ||||
| Hemoglobina (g/dl) | 12,7±1,9 | 12,8±1,9 | 12,6±1,9 | 0,09 |
| Creatinina sérica (mg/dl) | 1,3±0,6 | 1,3±0,6 | 1,3±0,6 | 0,146 |
| Urea sérica (mg/dl) | 63±35 | 63±29 | 63±38 | 0,975 |
| Ácido úrico (mg/dl) | 7,9±2,4 | 7,7±2,2 | 8±2,5 | 0,081 |
| Sodio (mEq/l) | 139±5 | 139±4 | 139±5 | 0,459 |
| Troponina I (ng/ml) | 0 [0-0,23] | 0,2 [0-0,33] | 0 [0-0,17] | < 0,001 |
| Troponina I>0,2 ng/ml, n (%) | 336 (27,5) | 150 (33) | 186 (24,2) | 0,001 |
| BNP (pg/ml) | 145 [85-292] | 136 [72-284] | 151 [89-302] | 0,014 |
| Linfocitos (%) | 17,9±9,9 | 18,9±9,9 | 17,3±9,9 | 0,008 |
| CA125 (U/ml) | 57 [25-129] | 53 [24-113] | 59 [26-141] | 0,021 |
| Colesterol total (mg/dl) | 170±44 | 177±47 | 166±41 | < 0,001 |
| Triglicéridos (mg/dl) | 120±57 | 135±65 | 110±49 | < 0,001 |
| cLDL (mg/dl) | 104±35 | 107±40 | 102±32 | 0,019 |
| cHDL (mg/dl) | 42±12 | 44±12 | 42±13 | 0,016 |
| Ecocardiografía | ||||
| FEVI (%) | 51±15 | 49±15 | 52±15 | < 0,001 |
| FEVI ≤ 50%, n (%) | 560 (45,8) | 243 (53,4) | 317 (41,3) | < 0,001 |
| DAI (mm) | 44±8 | 43±7 | 44±8 | 0,001 |
| DDVI (mm) | 56±9 | 57±9 | 55±9 | < 0,001 |
| Tratamiento médico | ||||
| Bloqueadores beta, n (%) | 635 (52) | 258 (56,7) | 377 (49,1) | 0,011 |
| Diuréticos, n (%) | 1.198 (98) | 444 (97,6) | 754 (98,3) | 0,379 |
| Espironolactona, n (%) | 232 (19) | 97 (21,3) | 135 (17,6) | 0,109 |
| IECA, n (%) | 505 (41,3) | 170 (37,4) | 335 (43,7) | 0,03 |
| ARA-II, n (%) | 361 (29,5) | 159 (34,9) | 202 (26,3) | 0,001 |
| Anticoagulantes orales, n (%) | 493 (40,3) | 150 (33) | 343 (44,7) | < 0,001 |
| Nitratos, n (%) | 246 (20,1) | 134 (29,4) | 112 (14,6) | < 0,001 |
| Digoxina, n (%) | 313 (25,6) | 94 (20,7) | 219 (28,5) | 0,002 |
ARA-II: antagonistas de los receptores de la angiotensina II; BNP: péptido natriurético cerebral; CA125: antígeno carbohidrato 125; cHDL: colesterol unido a las lipoproteínas de alta densidad; cLDL: colesterol unido a las lipoproteínas de baja densidad; DAI: diámetro auricular izquierdo; DDVI: diámetro diastólico ventricular izquierdo; EAP: enfermedad arterial periférica; EPOC: enfermedad pulmonar obstructiva crónica; FEVI: fracción de eyección ventricular izquierda; IC: insuficiencia cardiaca; ICA: insuficiencia cardiaca aguda; ICAD: insuficiencia cardiaca aguda descompensada; IECA: inhibidores de la enzima de conversión de la angiotensina; NYHA: New York Heart Association; PAD: presión arterial diastólica; PAS: presión arterial sistólica.
Los valores expresan media±DE, n (%) o mediana [intervalo intercuartílico].
a Última clase funcional de la NYHA determinada en unas condiciones clínicamente estables.
Un valor de p bilateral<0,05 se consideró estadísticamente significativo para todos los análisis. Todos los análisis se llevaron a cabo con el programa STATA 11.1 (StataCorp. 2009. Stata Statistical Software: Release 11. College Station, Texas: StataCorp LP, Estados Unidos).
ResultadosLa media de edad de nuestra muestra fue de 73±11 años; el 50,8% eran mujeres, el 54% tenía una FEVI > 50%, el 64,9% presentaba valores altos de CA125 (> 35 U/ml) y el 37,2% recibía tratamiento con estatinas. En los pacientes tratados con estatinas, las prescripciones más frecuentes eran, por este orden, las de atorvastatina (61,5%), pravastatina (20,7%) y simvastatina (15,4%). En los pacientes tratados con estatinas, la mediana [intervalo intercuartílico] de dosis de atorvastatina, pravastatina y simvastatina era de 20 [20-40], 40 [20-40] y 20 [10-20] mg respectivamente. Según la clasificación de dosis de estatina utilizada, 210 (46,2%) y 245 (53,8%) pacientes recibían tratamiento con dosis bajas y con dosis medias-altas, respectivamente. Las características clínicas de la población en estudio se muestran en la Tabla 1.
Predictores clínicos de la elevación del antígeno carbohidrato 125Los pacientes con valores de CA125 > 35 U/ml eran los que tenían un perfil de riesgo basal más desfavorable, según lo indicado por el elevado porcentaje de ingresos con insuficiencia cardiaca aguda descompensada, una clase III/IV de la NYHA en la fase estable de la enfermedad, derrame pleural, edema periférico, fibrilación auricular y disfunción sistólica ventricular izquierda. De igual modo, en este grupo de pacientes se observaron valores medios más altos de ácido úrico, péptido natriurético cerebral (BNP) y dimensiones de la aurícula y el ventrículo izquierdos, y valores medios más bajos de presión arterial sistólica y diastólica, hemoglobina sérica, porcentaje de linfocitos, colesterol (total, LDL y lipoproteínas de alta densidad [HDL]) y triglicéridos (anexo 1, material adicional). Las variables más importantes que mostraban una asociación independiente con el CA125 > 35 U/ml eran las siguientes: a) presencia de un derrame pleural radiológico; b) valores séricos de BNP, y c) edema periférico, que explicaban el 50,9, el 13,9 y el 8% de la R2 total, respectivamente.
Predictores clínicos de la prescripción de estatinasEn la Tabla 1 se enumeran las variables asociadas significativamente a la prescripción de estatinas. Los predictores independientes más importantes (por orden de importancia) fueron los siguientes: a) tratamiento previo con estatinas (el 60% de la R2 total); b) antecedentes de dislipemia (el 12,8% de la R2 total), y c) antecedentes de infarto de miocardio (el 7,5% de la R2 total). En esta población, las concentraciones séricas de lípidos tenían una contribución marginal a la probabilidad de prescripción de estatinas (el 5,7, el 5,2 y el 2,6% de la R2 total para concentraciones de HDL, LDL y triglicéridos, respectivamente). Es de destacar que el CA125, evaluado en forma de variable continua o binaria (CA125 > 35 U/ml), no se asociaba de manera independiente a la prescripción de estatinas (odds ratio [OR]=0,99; IC95%, 0,99-1; p=0,524, y OR=1,29; IC95%: 0,90-1,87; p=0,168, respectivamente).
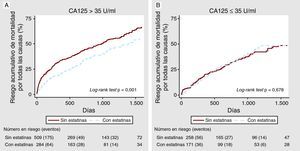
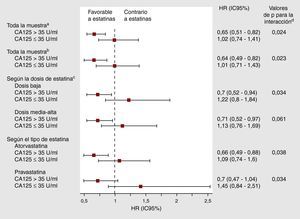
Tratamiento con estatinas y mortalidad por todas las causas según cifras de antígeno carbohidrato 125Tras una mediana de seguimiento de 20 [8-38] meses, se identificaron 542 (44,4%) muertes. De ellas, 418 se atribuyeron a causas cardiovasculares (77,1%) y 194 (35,8%) se debieron a la progresión de la IC. En un análisis univariable, se observó un efecto pronóstico diferencial entre el tratamiento con estatinas y las categorías de CA125 (para la interacción, p=0,019). Entre los pacientes con CA125 > 35 U/ml, la mortalidad de los sujetos tratados con estatinas fue inferior (1,89 frente a 2,80/10 años-paciente de seguimiento, respectivamente, p<0,001), con unas diferencias que se observaban desde los primeros meses de seguimiento y alcanzaban un máximo entre el primer año y el segundo (Figura 1A). Por el contrario, en los pacientes con CA125 ≤ 35 U/ml, las tasas de mortalidad no presentaron diferencias según el tratamiento con estatinas (1,76 frente a 1,63/10 años-paciente de seguimiento; p=0,862) (Figura 1B). Tras un cuidadoso ajuste multivariable, esta interacción persistía (interacción, p=0,024): el tratamiento con estatinas se asociaba a una significativa reducción del riesgo ajustada en los pacientes con valores elevados de CA125 (HR=0,65; IC95%, 0,51-0,82; p<0,001), pero no en los pacientes con valores ≤ 35 U/ml (HR=1,02; IC95%, 0,74-1,41; p=0,907). Esta interacción se daba también cuando se evaluaba el CA125 en forma de variable continua o de variable dicotomizada según el valor de la mediana (anexo 2, material adicional). Además, se realizaron varios análisis de sensibilidad con el objetivo de respaldar los resultados obtenidos. Todos ellos confirmaron el efecto beneficioso en cuanto al pronóstico que tenían las estatinas en los pacientes con CA125 > 35 U/ml: a) al forzar la inclusión en el modelo de las variables más importantes asociadas a la prescripción de estatinas (tratamiento previo con estatinas, antecedentes de dislipemia, infarto de miocardio previo y valores brutos de los lípidos); b) al evaluar las posologías de las estatinas (dosis bajas frente a dosis medias-altas), y c) al analizar de manera independiente el valor predictivo de las dos clases de estatinas prescritas con mayor frecuencia (atorvastatina y pravastatina) (Figura 2).
Figura 1. Riesgo acumulativo de mortalidad según el tratamiento con estatinas. A: en pacientes con antígeno carbohidrato 125 > 35 U/ml. B: en pacientes con antígeno carbohidrato 125 ≤ 35 U/ml. CA125: antígeno carbohidrato 125.
Figura 2. Efecto de las estatinas en pacientes con valores de CA125 > 35 U/ml, hazard ratio ajustada de mortalidad total (intervalo de confianza del 95%). CA125: antígeno carbohidrato 125; HR: hazard ratio; IC95%: intervalo de confianza del 95%.aModelo 1: modelo de Cox multivariable final con un ajuste para: edad, sexo, ingreso previo por insuficiencia cardiaca aguda (sí/no), ingreso con insuficiencia cardiaca aguda descompensada (sí/no), último valor de la clase funcional de la New York Heart Association en una fase estable de la enfermedad, duración de la hospitalización, etiología isquémica, frecuencia cardiaca con interacción con la fibrilación auricular (sí/no), presión arterial sistólica con interacción con la fracción de eyección ventricular izquierdaI<50% (sí/no), evidencia radiológica de derrame pleural (sí/no), enfermedad arterial periférica (sí/no), sodio sérico, péptido natriurético cerebral sérico, hemoglobina sérica, urea sérica, porcentaje de linfocitos, tratamiento con bloqueadores beta (sí/no) y anticoagulantes orales (sí/no). El estadístico C de Harrell del modelo fue de 0,752. La prueba de Gronnesby y Borgan de la bondad de ajuste mostró la buena calibración del modelo (p=0,579). bModelo 2: modelo de Cox multivariable con un ajuste según el mismo conjunto de covariables del modelo 1 más las variables principales asociadas a la prescripción de estatinas: tratamiento previo con estatinas (sí/no), antecedentes de dislipemia (sí/no), infarto de miocardio previo (sí/no) y concentración sérica de lípidos. El estadístico C de Harrell del modelo fue de 0,752. La prueba de Gronnesby y Borgan de la bondad de ajuste mostró la buena calibración del modelo (p=0,555). cCategorías de dosis incluidas: dosis baja (atorvastatina ≤ 10mg, simvastatina ≤ 20mg, pravastatina ≤ 40mg, lovastatina ≤ 40mg y fluvastatina ≤ 80mg) y dosis media-alta (atorvastatina ≥ 20mg y simvastatina ≥ 40mg). dEl valor de p para la interacción se refiere a la interacción entre el tratamiento con estatinas y la clasificación binaria según el valor de CA125.
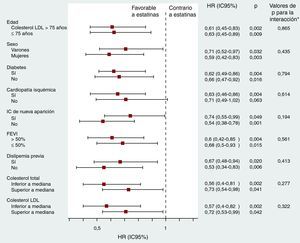
Además, los análisis de subgrupos revelaron que este efecto beneficioso pronóstico de las estatinas (en pacientes con valores altos de CA125) era uniforme en los subgrupos más representativos de pacientes con ICA, como los de pacientes de edad > 75 años, mujeres, pacientes con FEVI<50%, etiología isquémica, diabetes mellitus o ingreso previo por ICA, incluso en pacientes sin dislipemia previa y con colesterol LDL y total inferiores a la mediana (Figura 3).
Figura 3. Efecto de las estatinas en la mortalidad total en los principales subgrupos de pacientes con valores de antígeno carbohidrato 125 > 35 U/ml, hazard ratio ajustada. CA125: antígeno carbohidrato 125; FEVI: fracción de eyección ventricular izquierda; HR: hazard ratio; IC: insuficiencia cardiaca; IC95%: intervalo de confianza del 95%; LDL: lipoproteínas de baja densidad.*El valor de p para la interacción se refiere a la interacción entre el tratamiento con estatinas y cada variable de identificación de subgrupos clínicos.
La asociación absoluta de las estatinas con la mortalidad total en función de la clasificación binaria según el CA125 se evaluó mediante la estimación de una diferencia ajustada del riesgo absoluto (y el NNT) a los 3 y 6 meses y a los 1, 3 y 5 años del ingreso (Tabla 2). En el grupo con valores de CA125 > 35 U/ml, hubo una asociación uniforme de las estatinas con la mortalidad durante todo el seguimiento, y de manera independiente de la función de riesgo basal para la mortalidad; no se observó asociación alguna en los pacientes del grupo con valores de CA125 ≤ 35 U/ml. La traslación de estos datos a los valores equivalentes de NNT se muestra en la Tabla 2. Globalmente, el tratamiento con estatinas en esta población de pacientes con ICA se asoció a 1 muerte menos cada 7–14 pacientes tratados, dependiendo del momento en el que se evaluara.
Tabla 2. Diferencia de riesgo absoluto ajustada y número de pacientes que es necesario tratar para el efecto de las estatinas en la mortalidad, en función de la clasificación binaria según las concentraciones de antígeno carbohidrato 125 y los momentos de valoración especificados
| Momentos de valoración | CA125>35 U/ml | CA125 ≤ 35 U/ml | ||
| DRA ajustada (IC95%) | NNT (IC95%) | DRA ajustada (IC95%) | NNT (IC95%) | |
| 3 meses | 0,08 (0,03 a 0,12) | 13,1 (8,3 a 30,9) | –0,01 (–0,06 a 0,04) | –88,6 (27,5 a –17) |
| (p=0,001) | (p=0,642) | |||
| 6 meses | 0,07 (0,02 a 0,12) | 13,8 (8,1 a 46,8) | –0,004 (–0,06 a 0,06) | –270,9 (18,2 a –16) |
| (p=0,005) | (p=0,902) | |||
| Primer año | 0,11 (0,05 a 0,17) | 9,3 (6,0 a 20,6) | 0,01 (–0,07 a 0,08) | 113,7 (11,9 a –15,1) |
| (p<0,001) | (p=0,819) | |||
| Tercer año | 0,11 (0,03 a 0,19) | 9,2 (5,3 a 35,9) | –0,01 (–0,12 a 0,09) | –73,9 (10,6 a –8,2) |
| (p=0,008) | (p=0,806) | |||
| Quinto año | 0,14 (0,05 a 0,23) | 7,1 (4,3 a 19,7) | –0,004 (–0,13 a 0,12) | –232,5 (8,2 a –7,6) |
| (p=0,002) | (p=0,947) | |||
CA125: antígeno carbohidrato 125; DRA: diferencia de riesgo absoluto; NNT: número de pacientes que es necesario tratar.
Durante el seguimiento, se registraron 418 muertes cardiovasculares (77,1%). De manera similar a lo observado para la mortalidad por todas las causas, los pacientes tratados con estatinas y que tenían valores altos de CA125 mostraron una reducción notable de la función acumulativa de incidencia para la mortalidad cardiovascular en comparación con: a) los pacientes no tratados con estatinas que tenían valores de CA125 > 35 U/ml, y b) los pacientes con valores normales de CA125, tratados o no con estatinas (no hubo diferencias significativas en la incidencia acumulativa de muerte cardiovascular en función del tratamiento con estatinas), tal como se ilustra en el anexo 3 del material adicional. Las probabilidades de fallo según la causa de la muerte mostraron una reducción homogénea de la mortalidad en los pacientes tratados con estatinas que tenían un CA125 > 35 U/ml para las causas más importantes de muerte cardiovascular (muerte por IC progresiva y muerte súbita) y también para las muertes no cardiovasculares (Tabla 3).
Tabla 3. Probabilidades de fallo según la causa de la muerte
| Tiempo (años) | CA125 ≤ 35 U/mlSin estatinas (n=258) | CA125 ≤ 35 U/mlEstatinas (n=171) | CA125>35 U/mlSin estatinas (n=509) | CA125>35 U/mlEstatinas (n=284) | Total (n=1.222) | ||||
| Fallecieron, n | 1–KM | Fallecieron, n | 1–KM | Fallecieron, n | 1–KM | Fallecieron, n | 1–KM | Fallecieron, n | |
| Muerte cardiovascular (n=418) | |||||||||
| 1 | 38 | 0,1575 | 22 | 0,1479 | 134 | 0,2825 | 49 | 0,1826 | 243 |
| 2 | 52 | 0,2312 | 33 | 0,2348 | 168 | 0,3761 | 64 | 0,264 | 317 |
| 3 | 65 | 0,3238 | 44 | 0,3616 | 189 | 0,4549 | 77 | 0,3664 | 375 |
| 4 | 72 | 0,3963 | 46 | 0,3928 | 203 | 0,5331 | 82 | 0,4257 | 403 |
| 5 | 73 | 0,4107 | 47 | 0,4217 | 209 | 0,5778 | 83 | 0,4417 | 412 |
| 6 | 73 | 0,4107 | 48 | 0,4743 | 210 | 0,5947 | 84 | 0,4789 | 415 |
| Muerte por insuficiencia cardiaca progresiva (n=194) | |||||||||
| 1 | 18 | 0,0754 | 11 | 0,0741 | 83 | 0,1799 | 27 | 0,1029 | 139 |
| 2 | 22 | 0,099 | 13 | 0,0924 | 93 | 0,2136 | 33 | 0,1382 | 161 |
| 3 | 26 | 0,1332 | 15 | 0,119 | 98 | 0,2371 | 39 | 0,1954 | 178 |
| 4 | 29 | 0,1729 | 16 | 0,1416 | 103 | 0,278 | 39 | 0,1954 | 187 |
| 5 | 29 | 0,1729 | 16 | 0,1416 | 105 | 0,2998 | 40 | 0,2178 | 190 |
| 6 | 29 | 0,1729 | 16 | 0,1416 | 106 | 0,3278 | 41 | 0,2699 | 192 |
| Muerte súbita (n=55) | |||||||||
| 1 | 6 | 0,0268 | 3 | 0,0223 | 20 | 0,0499 | 8 | 0,0325 | 37 |
| 2 | 6 | 0,0268 | 4 | 0,0313 | 24 | 0,0649 | 9 | 0,0407 | 43 |
| 3 | 8 | 0,0489 | 9 | 0,107 | 25 | 0,0701 | 10 | 0,0524 | 52 |
| 4 | 9 | 0,0631 | 10 | 0,1283 | 26 | 0,082 | 10 | 0,0524 | 55 |
| 5 | 9 | 0,0631 | 10 | 0,1283 | 26 | 0,082 | 10 | 0,0524 | 55 |
| 6 | 9 | 0,0631 | 10 | 0,1283 | 26 | 0,082 | 10 | 0,0524 | 55 |
| Muerte no cardiovascular (n=124) | |||||||||
| 1 | 12 | 0,0547 | 5 | 0,0330 | 28 | 0,0730 | 6 | 0,0253 | 51 |
| 2 | 19 | 0,0958 | 11 | 0,0952 | 38 | 0,1106 | 19 | 0,1073 | 87 |
| 3 | 24 | 0,1356 | 12 | 0,1129 | 46 | 0,1582 | 20 | 0,1167 | 102 |
| 4 | 25 | 0,1461 | 14 | 0,1524 | 52 | 0,2105 | 22 | 0,1497 | 113 |
| 5 | 25 | 0,1461 | 15 | 0,1877 | 55 | 0,2529 | 24 | 0,1998 | 119 |
| 6 | 26 | 0,1802 | 15 | 0,1877 | 55 | 0,2529 | 24 | 0,1998 | 120 |
CA125: antígeno carbohidrato 125; KM: Kaplan-Meier.
En el análisis multivariable, al considerar la muerte no cardiovascular como un evento en competencia, la interacción entre CA125 y estatinas estaba en el límite de la significación estadística (interacción, p=0,051). Con la limitación impuesta por esta interacción, los pacientes que presentaban CA125 > 35 U/ml y recibían tratamiento con estatinas mostraban una significativa reducción del riesgo del 38% (HR=0,62; IC95%, 0,47-0,81; p<0,001), mientras que el tratamiento con estatinas no mostraba efecto beneficioso alguno en los pacientes con valores normales de CA125 (HR=0,97; IC95%, 0,66-1,41; p=0,703), tal como se muestra en el anexo 2 del material adicional.
DiscusiónEn el presente estudio, observamos que, en los pacientes con ICA, la asociación de las estatinas con la mortalidad a largo plazo estaba determinada de manera diferente según la concentración sérica de CA125. A diferencia de los pacientes con valores normales de CA125 (≤ 35 U/ml), en los que no se observó asociación alguna, en los pacientes con valores altos de CA125 (> 35 U/ml) el tratamiento con estatinas se asoció a una reducción significativa de la mortalidad total de un 35%. La consistencia de este efecto pronóstico diferencial se confirmó a pesar de un ajuste cuidadoso para las covariables (incluida la concentración de lípidos), y se observó también en los subgrupos clínicos más importantes, como los pacientes con etiología no isquémica de la IC y los pacientes con función sistólica preservada. Además, la asociación favorable de las estatinas observada en el subgrupo de pacientes con CA125 > 35 U/ml se confirmó también por la presencia de una diferencia significativa del riesgo absoluto observada durante todo el seguimiento.
Aunque hay que interpretar con precaución los resultados de los análisis de subgrupos, creemos que nuestros resultados principales aportan un respaldo adicional a los resultados de un reciente análisis del ensayo CORONA6, en el que el beneficio principal de las estatinas en cuanto al pronóstico en la IC se observó solamente en los pacientes con una actividad proinflamatoria elevada8.
El antígeno carbohidrato 125 como marcador de la inflamación y sus ventajas teóricas respecto a otros biomarcadores inflamatoriosEstá en aumento la evidencia del valor pronóstico del CA125 en la IC avanzada11, 12. Aunque no se ha determinado todavía el mecanismo exacto de esta asociación, se cree que está relacionada con procesos fisiopatológicos complejos que relacionan la inflamación con la congestión sistémica22. Por ejemplo, en el contexto de la ICA, los valores de CA125 no mostraron una correlación con las citocinas proinflamatorias y con el porcentaje bajo de linfocitos9, 10. Además, los estudios in vitro han puesto de manifiesto23 que citocinas proinflamatorias como la interleucina 1, el factor de necrosis tumoral alfa y el lipopolisacárido pueden estimular las células mesoteliales humanas para que aumenten la secreción de CA125.
En comparación con otros biomarcadores inflamatorios que no están disponibles todavía para un uso clínico habitual, el CA125 tiene algunas posibles ventajas importantes, como la amplia disponibilidad en la práctica clínica habitual, la determinación estandarizada, el bajo coste y la fiabilidad farmacocinética. Es bien sabido que la mayor parte de las citocinas proinflamatorias presentan una alta variabilidad temporal por razones que quedan fuera del ámbito de este trabajo (técnicas de medición no estandarizadas, liberación pulsátil, semivida corta, etc.)24. En cambio, la cinética del CA125 muestra una semivida media superior a 1 semana13, que es muy superior incluso a la semivida plasmática de 18-20 h de la PCR25, lo cual nos permite proponer el CA125 como biomarcador fiable para la identificación basal de una actividad inflamatoria elevada. Por otra parte, las observaciones clínicas han puesto de manifiesto que los cambios seriados del CA125 con el tiempo se mantienen dentro de unos valores que reflejan el estado clínico y el pronóstico del paciente26, 27. Teniendo en cuenta todas estas propiedades atractivas, creemos que esta glucoproteína puede tener utilidad para la monitorización y la orientación del tratamiento en la IC, ya sea por sí sola o en combinación con los péptidos natriuréticos. No resulta extraño que el principal uso clínico de este biomarcador fuera del contexto de la IC sea la monitorización del tratamiento en el cáncer de ovario28.
Efectos pleotrópicos de las estatinas. Una cuestión controvertidaSe han propuesto varios mecanismos para explicar los resultados inesperados (y desalentadores) de los ensayos CORONA6 y GISSI7. Por un lado, se ha demostrado que las lipoproteínas neutralizan la respuesta inflamatoria a las endotoxinas, por lo que, al reducirlas con las estatinas, puede aumentar la bioactividad de las endotoxinas bacterianas2, 29. Las estatinas reducen también la concentración plasmática de ubiquinona, una coenzima de la respiración mitocondrial que, al menos desde un punto de vista teórico, puede afectar a la función del miocardio2. Sin embargo, en el lado positivo, un gran número de estudios han demostrado los efectos de las estatinas en la reducción de los marcadores inflamatorios (PCR, factor de necrosis tumoral alfa e interleucinas 1 y 6) incluso en los pacientes con IC30. El éxito que han tenido desde hace tiempo las estatinas en la IC va a favor de la hipótesis de que el efecto neto de estas fuerzas contrapuestas es favorable al efecto antiinflamatorio. El beneficio clínico aportado por el tratamiento con estatinas, en función del estado inflamatorio, se ve reforzado también por los resultados del ensayo JUPITER en la población general, puesto que se observó que, en los individuos sanos sin dislipemia pero con cifras de PCR elevadas, rosuvastatina reducía significativamente la incidencia de eventos cardiovasculares mayores31. No obstante, para generar una mayor controversia, un reciente subestudio del Heart Protection Study ha mostrado que la reducción del colesterol LDL con simvastatina reduce el riesgo de eventos vasculares mayores en un grado similar con independencia de la concentración de PCR existente32.
En la ICA, la actividad inflamatoria elevada interacciona a través de vías fisiopatológicas complejas con la congestión sistémica22, y se cree que contribuye a producir las elevevadas morbilidad y mortalidad que se observan tras los primeros meses siguientes a un episodio agudo. Varios estudios observacionales han descrito una mejor supervivencia de los pacientes tratados con estatinas en el contexto de la ICA3, 5 y los pacientes con infecciones bacterianas graves33, en las que la inflamación desempeña un papel patogénico crucial. Sin embargo, creemos que la ICA es una entidad clínica no homogénea, no sólo en su etiología y en la FEVI, sino también en el grado de inflamación sistémica. Los pacientes con ICA, y especialmente los que presentan hiperactividad del sistema inmunitario, constituyen un objetivo plausible para ulteriores estudios sobre los efectos terapéuticos de las estatinas.
LimitacionesEste estudio tiene algunas posibles limitaciones: a) se trata de un estudio observacional realizado en un solo centro, que por su diseño puede estar sujeto a diferentes tipos de sesgo y factores de confusión residuales; b) la adjudicación de la causa específica de la muerte se basó principalmente en la revisión de la historia clínica de los pacientes, y ello puede introducir, en cierta medida, algún grado de error en la clasificación de la variable de valoración; c) con los datos actuales, no podemos abordar los mecanismos patogénicos complejos que pueden intervenir en la relación entre estatinas, IC y mortalidad; d) sabiendo que la indicación para el uso de estatinas en nuestra cohorte fue el tratamiento de la dislipemia, no podemos descartar que nuestros resultados puedan estar afectados por un factor de confusión derivado de esta indicación; e) dado el pequeño tamaño muestral de nuestra cohorte y los muchos tipos y dosis diferentes de estatinas, no fue posible determinar si había o no un efecto de la clase de medicación o una relación dosis-respuesta; f) no evaluamos la adherencia al tratamiento con estatinas ni las consecuencias que los cambios seriados del CA125 podían tener en nuestros resultados, y g) el hecho de que no se determinara la PCR en todos los pacientes impide incluir este biomarcador en el presente análisis.
ConclusionesEn este estudio de generación de hipótesis, el tratamiento con estatinas en la ICA se asoció a una reducción del riesgo de mortalidad, pero únicamente en los pacientes con cifras de CA125 > 35 U/ml. Estos resultados constituyen un fundamento para continuar estudiando el papel terapéutico de las estatinas en los pacientes con IC que presentan evidencia de inflamación sistémica, según lo indicado por la elevación de las concentraciones de CA125, en un contexto más controlado.
FinanciaciónEste estudio fue financiado por una subvención de la Conselleria de Sanitat (Dirección General de Ordenación, Evaluación e Investigación Sanitaria para el fomento de la investigación en la Comunidad Valenciana: AP-132/08) y por el Ministerio de Sanidad y Consumo, Instituto de Salud Carlos III, RED HERACLES RD06/0009/1001 (Madrid, España).
Conflicto de interesesEl Dr. Gregg Fonarow realiza investigación financiada por los National Institutes of Health, ha recibido honorarios de GlaxoSmithKline, Medtronic, Novartis y Pfizer, y ha sido consultor de GlaxoSmithKline, Merck, Novartis y Pfizer.
Material adicional.Se puede consultar material adicional a este artículo en su versión electrónica disponible en doi:10.1016/j.recesp.2011.05.029.
Material suplementario.Recibido 15 Marzo 2011
Aceptado 29 Mayo 2011
Autor para correspondencia: Servicio de Cardiología, Hospital Clínico Universitario, Avda. Blasco Ibáñez 17, 46010 Valencia, España. yulnunez@gmail.com