Full English text available from: www.revespcardiol.org/en
INTRODUCCIÓNLa endocarditis infecciosa (EI) es una enfermedad infrecuente de diagnóstico difícil, tratamiento complejo y costoso y elevada morbimortalidad. La mortalidad estimada es del 20%. Los cambios recientes más apreciables son epidemiológicos, con incremento de EI en los portadores de prótesis y dispositivos intracardiacos y la población que recibe cuidados de la salud, incremento de casos estafilocócicos y cambios en los patrones de sensibilidad antibiótica, con especial impacto en la vancomicina1–3. La EI requiere ingreso hospitalario prolongado y gran consumo de recursos porque los antimicrobianos, los cuidados intensivos y el tratamiento quirúrgico son parte del proceso.
Un 40-50% de los pacientes necesitan tratamiento quirúrgico en fase aguda. La mortalidad de la EI con o sin intervención es del 30% al año del diagnóstico. Hay grupos con elevada mortalidad, como los portadores de prótesis valvulares y especialmente los pacientes con hemorragia intracraneal4.
El diagnóstico y el tratamiento precoces pueden mejorar los resultados. Un tratamiento eficaz puede retrasarse por baja sospecha, lo que conlleva elevada mortalidad5. El retraso en una orientación terapéutica apropiada, en nuestra experiencia, se cuantifica en una media de 27 días cuando el caso es externo.
La EI es paradigma de colaboración. Los equipos multidisciplinarios (EMD) dedicados a la EI han sido pioneros en la organización de una estructura hospitalaria de tercer nivel dedicada a la enfermedad6,7. El grupo International Collaboration in Endocarditis ha tenido impacto crucial en la última década para comprender la EI8. La British Heart Valve Society ha propuesto la integración de especialistas para las valvulopatías y la EI9, y comunicaciones recientes refuerzan este modelo10.
Este artículo describe las recomendaciones para la organización de un EMD de EI basadas en la experiencia de 30 años del Grupo de Trabajo de la Endocarditis Infecciosa del Hospital Clínic de Barcelona y tiene como objetivo que esta experiencia sea útil para el Sistema Nacional de Salud.
CONSIDERACIÓN PREVIALa EI es una enfermedad medicoquirúrgica en la que el tratamiento quirúrgico es una parte del proceso y no un fracaso de la terapéutica. El cuidado de los pacientes afectos de EI debe ofrecerse por EMD con profesionales con intereses compartidos.
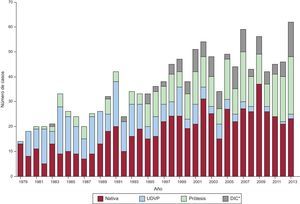
CONSIDERACIONES HISTÓRICASLa organización y desarrollo del Grupo de Trabajo de la Endocarditis Infecciosa del Hospital Clínic de Barcelona ha sido paralela a la progresión de los servicios de enfermedades infecciosas, cardiología, microbiología, anatomía patológica y cirugía cardiovascular desde 1979. La figura 1 muestra la actividad actualizada de EI en este centro, de 1.256 casos. Los hechos fundamentales han sido el establecimiento de una base de datos específica, el inicio de la actividad del servicio de cirugía cardiovascular en 1979, la constitución de un banco de tejido cardiovascular (válvulas cardiacas y arterias criopreservadas) en 1989, la introducción de la ecocardiografía transesofágica en 1991 y la historia clínica informatizada en la intranet del hospital en 1999.
Realizan el seguimiento los especialistas en enfermedades infecciosas, cardiología y cirugía cardiovascular desde 1986. El almacenamiento de las cepas de patógenos se organizó en el biobanco microbiológico en 1993. El laboratorio de endocarditis experimental desarrolla su actividad desde 1993 y el Grupo de Trabajo de la Endocarditis Infecciosa del Hospital Clínic de Barcelona mantiene reuniones semanales específicas desde 1994.
ESTRUCTURA Y ORGANIZACIÓN EN CENTROS DE TERCER NIVELEl beneficio de un EMD es innegable. La EI debe tratarse en centros de tercer nivel con un servicio de cirugía cardiovascular acreditado6. Los miembros del EMD deben ser:
- •
Especialista en enfermedades infecciosas.
- •
Microbiólogo.
- •
Cardiólogo con dedicación en enfermedades valvulares.
- •
Ecocardiografista experto en la interpretación de las enfermedades valvulares.
- •
Cirujano cardiovascular.
- •
Especialista en anatomía patológica.
- •
Especialista en tratamiento antimicrobiano domiciliario intravenoso.
Los hospitales terciarios cuentan con los servicios de anestesiología y reanimación, diagnóstico por la imagen, medicina nuclear, nefrología, neurología y neurocirugía, ortopedia y traumatología y hemoterapia y hemostasia. La complejidad de la EI justifica la atención de tercer nivel.
La experiencia acumulada aconseja la existencia de un equipo de atención domiciliaria para la administración y control de terapia parenteral antimicrobiana11.
El servicio de enfermedades infecciosas revisa diariamente los hemocultivos de la institución. Si hay positividad, se consensúa con el servicio de origen la actitud que hay que seguir.
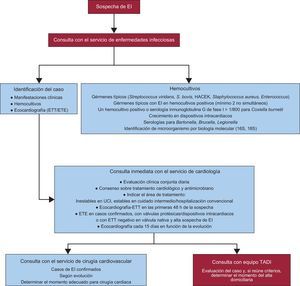
Dinámica del procesoEl proceso de atención al paciente con EI es complejo e incluye diversos pasos desde que se inicia una sospecha diagnóstica. El índice de sospecha debe ser alto, ya que el diagnóstico se retrasa con frecuencia por lo inespecífico de los síntomas5. El paso inicial es el contacto con el servicio de enfermedades infecciosas, una vez detectada la sospecha clínica o la positividad de hemocultivos en muestras enviadas al laboratorio de microbiología por diversas razones. Una vez detectado el caso y confirmados los criterios de EI, se contacta con los servicios de cardiología y cirugía cardiovascular a fin y efecto de consensuar la terapia cardiológica y antimicrobiana, así como establecer la indicación y el momento de una intervención quirúrgica si procede. Este proceso se resume en el diagrama de la figura 2.
Proceso de atención al paciente ingresado con endocarditis infecciosa en un hospital con servicio de cirugía cardiovascular. EI: endocarditis infecciosa; ETE: ecocardiografía transesofágica; ETT: ecocardiografia transtorácica; HACEK: Haemophilus parainfluenzae, H. aphrophilus, H. paraphrophilus, H. influenzae, Actinobacillus actinomycetemcomitans, Cardiobacterium hominis, Eikenella corrodens, Kingella kingae, and K. denitrificans; TADI: tratamiento antibiótico domiciliario intravenoso; UCI: unidad de cuidados intensivos.
Como la EI es un proceso complejo y atendido por un EMD, es obligada la revisión de los casos y el establecimiento de políticas de actuación comunes. Por ello se recomienda que el grupo medico-quirúrgico mantenga reuniones con frecuencia semanal, para revisar los casos ingresados, los remitidos desde otras instituciones y los atendidos de urgencia. En esta reunión se debe confirmar las decisiones medicoquirúrgicas y valorar los casos para tratamiento antimicrobiano en régimen domiciliario. Es obligado asimismo perseguir el control de calidad del proceso, lo que incluye el análisis del estudio post mórtem, si existe, de los casos con desenlace negativo.
ESTRUCTURA Y ORGANIZACIÓN EN CENTROS SIN SOPORTE QUIRÚRGICOEn los hospitales sin servicio acreditado de cirugía cardiovascular, la atención de los pacientes con EI es con frecuencia difícil y compleja. La colaboración interhospitalaria es fundamental, lo que facilita la estabilidad y la referencia de casos.
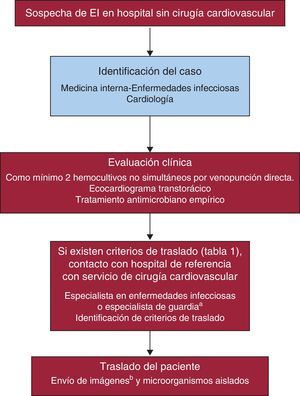
Dinámica del procesoCuando hay sospecha de EI en un hospital de segundo nivel, los pasos para confirmación de diagnóstico y tratamiento una vez establecida la sospecha diagnóstica incluyen el contacto con el hospital de tercer nivel y el envío del material iconográfico (ecocardiografías, tomografías computarizadas) y microbiológico relacionado con el caso. Es importante establecer con claridad los criterios de traslado. Los pasos básicos se resumen en el diagrama de la figura 3.
Proceso de atención al paciente ingresado con endocarditis infecciosa en un hospital sin servicio de cirugía cardiovascular. aEnfermedades infecciosas, cardiología o cirugía cardiaca. bEcocardiografía, ecografía abdominal, tomografía computarizada craneal/corporal, resonancia magnética craneal.
Si es posible, es recomendable que los médicos de los hospitales remitentes asistan a la reunión semanal para exponer sus casos, aportando la iconografía. El EMD debe compartir los protocolos de endocarditis con los médicos de los hospitales remitentes y debe asegurar la formación continuada de sus médicos. El servicio de microbiología del hospital remitente debería guardar y enviar las cepas de los microorganismos aislados al centro de referencia para estudios adicionales.
Se recomienda que las indicaciones de traslado sean amplias. La tabla 1 muestra las indicaciones básicas para considerar un traslado a un centro de referencia.
Criterios de traslado de pacientes desde hospitales sin cirugía cardiovascular
| 1. Pacientes en situación hemodinámica inestable (apoyo inotrópico, ventilación mecánica) |
| 2. Insuficiencia valvular grave (criterios clínicos y ecocardiográficos) |
| 3. Endocarditis protésica |
| 4. Endocarditis sobre dispositivos intracardiacos (marcapasos, desfibriladores, resincronizadores) |
| 5. Complicaciones extravalvulares (abscesos, fístulas) |
| 6. Sepsis persistente (hemocultivos positivos > 7 días) |
| 7. Accidente cerebrovascular |
| 8. Embolias recurrentes |
| 9. Vegetaciones residuales de gran tamaño (> 10 mm) |
| 10. Gérmenes agresivos o de difícil tratamiento (p. ej., Staphylococcus aureus, bacilos Gram negativos, hongos, endocarditis con hemocultivos negativos) |
El diagnóstico y el tratamiento de la EI se basan en los criterios modificados de Duke12. La toma de hemocultivos debe ser previa a la administración de antimicrobianos. El examen ecocardiográfico debe realizarse en las primeras 48h. Los pacientes con EI complicada sobre válvula nativa, sobre una prótesis valvular o sobre dispositivos intracardiacos deben ingresar en el servicio de cardiología y los demás, en los de enfermedades infecciosas o medicina interna. A los pacientes con insuficiencia cardiaca, shock séptico, afección neurológica o trastornos de la conducción, se los debe ingresar en unidades de cuidados intensivos o intermedios. El tratamiento de la EI se rige por la buena práctica basada en la experiencia y juicio clínico del EMD y la aplicación de las recomendaciones aprobadas por sociedades científicas1.
La gravedad de la EI plantea problemas éticos en determinados subgrupos, como los pacientes neoplásicos, los infectados por el virus de la inmunodeficiencia humana y los afectados de cirrosis hepática avanzada. El papel del EMD en estos subgrupos de pacientes es fundamental para identificar a los beneficiarios del tratamiento quirúrgico.
La protocolización institucional permite una asistencia homogénea. La responsabilidad última debe recaer en el médico responsable del caso, con independencia de la opinión del grupo. La responsabilidad individual es la que tiene impacto medicolegal.
RUTINA DE ATENCIÓN AL PACIENTE CON ENDOCARDITIS INFECCIOSAEs de particular importancia la exposición de opciones terapéuticas y sus riesgos. Es fundamental informar al entorno del paciente de la situación y definir las decisiones cuando el paciente no pueda decidir. La atención de los pacientes con EI debe seguir el esquema sistematizado que se muestra en la tabla 2.
Monitorización y acciones obligadas durante el ingreso de un paciente con endocarditis infecciosa
| Antes del tratamiento |
| 1. Muestras para hemocultivos (3) por punción venosa antes de la administración de agentes antimicrobianos |
| 2. Ecocardiografía transtorácica en el momento de la sospecha de endocarditis infecciosa |
| 3. Ecocardiografía transesofágica para el diagnóstico de certeza y para las mismas indicaciones descritas en la figura 2 |
| 4. Antibiograma y concentración mínima inhibitoria de los microorganismos aislados |
| 5. Colocación de vía venosa central |
| 6. Electrocardiograma para determinar alteraciones de ritmo o de conducción en condiciones basales |
| 7. Determinación analítica con bioquímica general, proteína C reactiva (o procalcitonina), hematimetría y perfil de coagulación, sedimento de orina |
| 8. Radiología simple de tórax en proyecciones posteroanterior y lateral si la condición del paciente lo permite. Si no es así, radiología con sistema portátil en unidad de hospitalización o unidad especial |
| Durante el ingreso |
| 1. Monitorización clínica diaria o frecuencia en función del estado clínico |
| 2. Control bioquímico cada 3-4 días con especial atención a la función renal y perfil de coagulación |
| 3. Ecocardiografía transesofágica si persiste la fiebre o si hay cambios clínicos y antes del alta. |
| 4. Monitorización de concentraciones de antibióticos |
| 5. Revisión semanal en reunión medicoquirúrgica para evaluación del caso y toma de decisiones |
| 6. Consulta inmediata con el servicio de cirugía cardiovascular si hay cambios en la evolución |
| 7. Valoración por el equipo de tratamiento domiciliario intravenoso en las endocarditis no complicadas |
| Al alta |
| 1. Control clínico y analítico a la semana y 1, 3, 6 y 12 meses por el servicio de enfermedades infecciosas |
| 2. Hemocultivos de control 48 h y 4 y 12 semanas después de finalizado el tratamiento antibiótico |
| 3. Para pacientes no operados con insuficiencia valvular modera-grave residual, seguimiento por el servicio de cardiología con ecocardiografía cada 6–12 meses, según gravedad |
| 4. Para los pacientes intervenidos quirúrgicamente, control anual con ecocardiografía por el servicio de cirugía cardiaca |
| 5. Recomendaciones de profilaxis antibiótica de la endocarditis infecciosa |
La tabla 3 muestra la lista de signos y síntomas que deben monitorizarse y los exámenes y acciones que deben llevarse a cabo durante el tratamiento de un paciente con EI.
Controles de calidad del Grupo de Trabajo Multidisciplinario de Endocarditis Infecciosa
| Aspectos organizativos |
| 1. Proporcionar respuesta en menos de 24 h a consultas de otros centros, incluyendo solicitudes de traslado, vía telefónica/telemática |
| 2. Recogida prospectiva de datos clínicos, ecocardiográficos, microbiológicos, quirúrgicos y evolutivos en una base de datos diseñada a tal efecto |
| 3. Sesiones semanales con todos los miembros del grupo |
| 4. Prevención de la endocarditis nosocomial: información y docencia con el objeto de disminuir la bacteriemia por catéter y la infección de los dispositivos cardiacos implantables |
| Aspectos clínicos |
| 1. Realización del ecocardiograma en menos de 48 h desde la sospecha de endocarditis infecciosa |
| 2. Estudio de posibles embolias en las primeras 72 h, especialmente en el caso de endocarditis infecciosas fúngicas o estafilocócicas (Staphylococcus aureus, Staphylococcus lugdunensis) |
| 3. Revisión constante de la adecuación, duración y toxicidad de las pautas antibióticas empíricas y definitivas |
| Aspectos microbiológicos |
| 1. Toma de como mínimo 2 dos hemocultivos no simultáneos por venopunción directa en diferentes venas en el momento de la sospecha. Hemocultivos de control a los 3 y a los 7 días |
| 2. Comunicación en tiempo real por parte del microbiólogo del grupo al especialista en enfermedades infecciosas en caso de crecimiento de patógenos típicamente causantes de endocarditis infecciosa en los hemocultivos (< 24 h) |
| 3. Tinción, cultivo y biología molecular (16S y 18S) de todas las vegetaciones valvulares, material embolico y dispositivos intracardiacos de pacientes con sospecha de endocarditis infecciosa |
| Aspectos quirúrgicos |
| 1. Comentar con cirujano los pacientes con indicación quirúrgica en menos de 24 h |
| 2. Cumplir los plazos recomendados en las guías en los casos con indicación quirúrgica urgente y emergente |
| 3. Extracción de todos los dispositivos intracardiacos infectados. Revisión y discusión de los casos en que no se realiza |
| Aspectos científico-académicos |
| 1. Formación continuada dentro y fuera del grupo |
| 2. Colaboración con grupos de estudios locales, nacionales e internacionales |
| 3. Comunicación a congresos; publicaciones en revistas científicas; participación en la elaboración de guías clínicas locales, nacionales e internacionales |
| Aspectos generales |
| 1. Realización de estudios necrópsicos en más del 50% de los fallecimientos intrahospitalarios |
| 2. Seguimiento clínico, microbiológico y ecocardiográfico mínimo de 1 año de todos los pacientes |
Uno de los aspectos más importantes en la EI es la prevención13. Las guías de práctica clínica recomiendan profilaxis antibiótica para los pacientes con episodio previo de EI1. Las instituciones y las sociedades deben diseminar información mediante folletos informativos o por vía telemática. Los trípticos representan una actividad educacional de primer orden para población general sobre la sospecha de EI y la necesidad de revisión dental. La educación del paciente y su entorno es necesaria para la prevención de episodios futuros y sobre los procedimientos que pueden producir bacteriemia y son susceptibles de profilaxis antimicrobiana.
Las infecciones asociadas a catéteres venosos en el medio hospitalario están asociadas a morbimortalidad (EI incluida), por lo que es fundamental la educación con respecto al lavado de manos y el seguimiento de los protocolos de bacteriemia cero, tal como preconiza la Organización Mundial de la Salud.
TRATAMIENTO QUIRÚRGICOUn 40-50% de los pacientes afectados de EI necesitarán tratamiento quirúrgico2,11. Las indicaciones para el tratamiento quirúrgico en fase aguda son insuficiencia cardiaca, trastornos de conducción, complicaciones perianulares y sepsis persistente a pesar de tratamiento antimicrobiano dirigido durante al menos 1 semana, y son las que se utilizan en nuestro entorno.
El tema de mayor actualidad es cuándo debe indicarse la intervención quirúrgica. Se admite que la «cirugía precoz» se refiere a una intervención en el mismo ingreso en que se diagnostica y se trata la EI. Los pacientes en situación crítica necesitan tratamiento de urgencia vital, en el plazo de 24h tras el diagnóstico.
Se debería tratar a los pacientes estables por lo menos 1 semana para controlar el proceso infeccioso. Es para este grupo que no está definido el mejor momento de la intervención. Lalani et al14 confirman, en un complejo análisis de propensión, que hay que intervenir a los pacientes en el ingreso por EI durante el tratamiento antimicrobiano, con una ventana de indicación de 4 semanas, que es el tratamiento parenteral esperado. La reciente contribución de Kang et al15 indica la intervención en un plazo de 48h para pacientes con insuficiencia valvular grave que tienen embolias y vegetaciones (> 10mm), aunque en esta pequeña serie no se ha demostrado mejora en supervivencia. A la espera de los resultados del estudio prospectivo y aleatorizado ENDOVAL 1 (Rationale, Design and Methods for the Early Surgery in Infective Endocarditis Study, NCT00624091) de 2008, la intervención precoz con indicación debería realizarse en un plazo de 1-2 semanas de tratamiento antimicrobiano.
En la reunión semanal del EMD se confirman las indicaciones. No es necesario revisar formalmente los casos preferentes o de urgencia vital, que se debe individualizar. Se utilizan los sistemas de estratificación preoperatoria del riesgo quirúrgico para evaluar el caso.
Dinámica del proceso quirúrgicoEstablecida la indicación, el cirujano responsable debe confirmar los siguientes pasos:
- •
Inclusión del caso en la lista del servicio. En los casos urgentes se debe intervenir en cualquier momento.
- •
Consentimiento informado.
- •
Planificación del procedimiento cardiaco y extracardiaco si procede (esplenectomía, etc.).
- •
Confirmación de lesiones en ecocardiografía transesofágica en quirófano antes del inicio de la intervención.
- •
Previsión de posibles complicaciones intraoperatorias (check-list habitual).
- •
Obtención de muestras para anatomía patológica y microbiología (tinciones, cultivos y estudios moleculares).
- •
Confirmación de que las solicitudes están almacenadas en el sistema informático y que las muestras han llegado a los laboratorios correspondientes.
- •
Control postoperatorio en unidad de cuidados intensivos y convencional.
- •
Confirmación de estudio con ecocardiografía transtorácica antes del alta.
Los pacientes intervenidos de EI deben ser controlados por los médicos tratantes. Los pacientes deben ser citados 1, 3 y 12 meses después de la intervención. Los no intervenidos deben ser controlados en el hospital o en su domicilio una vez finalizado el tratamiento antimicrobiano domiciliario intravenoso para evaluar posibles recidivas y la disfunción valvular tras el episodio de EI. Los intervenidos deben ser evaluados en esos plazos para monitorizar las funciones cardiaca y valvular y practicar hemocultivos a las 48h de finalizado el tratamiento antibiótico, al mes y a los 3 meses del alta. Debe indicarse al paciente que en caso de fiebre acuda al hospital y no tome antibióticos para evitar la negativización de los hemocultivos. La tasa de recurrencia tras el episodio inicial de EI es baja (< 5%) y suele ocurrir en las primeras 12 semanas. La EI que se desarrolla tras la cirugía valvular se considera precoz si hay un nuevo episodio en los primeros 12 meses y tardía más allá de este plazo.
CONCLUSIONESLa EI es una enfermedad infrecuente con impacto en la comunidad por su morbimortalidad y el consumo de recursos que conlleva. El EMD es fundamental en el proceso, pretende llegar a un diagnóstico precoz, uniformar criterios de tratamiento y optimizar los resultados. Debe revisar los casos locales y facilitar la transferencia de casos desde hospitales que no dispongan de servicio de cirugía cardiovascular. A los pacientes afectados de EI los deben seguir los miembros del EMD tras el episodio inicial. El EMD debe participar en la educación del paciente y su entorno y de los profesionales con bajo nivel de exposición a la enfermedad. El EMD debe auditar su actividad según los criterios que se especifican en la tabla 3.
CONFLICTO DE INTERESESNinguno.
A todos los compañeros que durante estos 30 años nos han ayudado a mejorar el manejo de los pacientes con EI en el Hospital Clínic de Barcelona. A la Dra. Magda Heras, recientemente fallecida, que siempre creyó en el EMD de EI, facilitó desde el inicio la integración de los cardiólogos y apoyó su desarrollo. Siempre le estaremos en deuda. Al Sr. Modesto Sánchez por el diseño de la base de datos y la historia clínica informatizada de la EI.
José M. Miró, Juan M. Pericás, Carlos Cervera, Cristina García de la María, Yolanda Armero, Asunción Moreno, José M. Gatell (Servicio de Enfermedades Infecciosas); Francesc Marco, Manel Almela, Jordi Vila (Servicio de Microbiología); Carlos A. Mestres, J. Carles Paré, Carlos Falces, Ramón Cartañá, Salvador Ninot, Manuel Azqueta, Marta Sitges, Magda Heras†, José L. Pomar (Servicio de Cardiología y Servicio de Cirugía Cardiovascular); José Ramírez (Servicio de Anatomía Patológica); Guillermina Fita, Irene Rovira (Servicio de Anestesiología, Reanimación y Terapéutica del Dolor); Mercè Brunet (Servicio de Toxicología); Dolors Soy (Servicio de Farmacia); David Fuster (Servicio de Medicina Nuclear) y Jaume Llopis (Departamento de Estadística, Universidad de Barcelona).