La estructura helicoidal del miocardio ventricular ofrece una comprensión simple de la anatomía cardiaca bajo un argumento fisiológico demostrado en estudios experimentales y de imagen cardiaca que da sentido a la contracción electromecánica durante el ciclo cardiaco. Se ha estandarizado descriptivamente la técnica de preparación y disección del miocardio propuesta empíricamente por Torrent-Guasp mediante digitodisección para correlacionar anatómica y topográficamente la banda helicoidal con proyecciones ecocardiográficas de eje largo, eje corto y de 4 cámaras.
MétodosSe disecaron 42 corazones —20 bovinos, 20 porcinos y 2 humanos— para estandarizar la técnica de disección del miocardio; después se identificaron con colores los diferentes segmentos para correlacionar las piezas anatómicas con las proyecciones ecocardiográficas.
ResultadosLa pérdida del 38% de la masa estandariza la disección, y resulta eficiente para realizar la disección del miocardio. No se encontró diferencia morfológica en la banda de los corazones estudiados. En las proyecciones ecocardiográficas se pueden identificar los 4 segmentos miocárdicos.
ConclusionesLa estandarización de la técnica es útil para disecar cualquier tipo de corazón. El ecocardiograma es útil para valorar los diferentes segmentos en que se divide el miocardio. Se necesitan más estudios que generen otras aplicaciones prácticas de este conocimiento a la ecocardiografía y otros campos.
Palabras clave
La estructura helicoidal del miocardio ventricular, a modo de una banda muscular única, ofrece una comprensión simple de la anatomía cardiaca1 con un argumento fisiológico ampliamente demostrado en estudios experimentales2,3 y de imagen cardiaca4,5 que da sentido a la contracción electromecánica del miocardio.
El miocardio ventricular se compone de 2 lazadas (lazada basal [LB] y lazada apexiana [LA]) y 4 segmentos (derecho [SDer], izquierdo [SI], descendente [SD] y ascendente [SA]) que, al enrollarse sobre sí mismos, definen una banda que parte de la raíz de la arteria pulmonar y culmina en la raíz de la aorta6; una lazada separa a la otra cuando el miocardio gira 180° formando un segmento endocárdico con fibras descendentes en el ventrículo izquierdo (VI), que al llegar al ápex cambian de dirección mediante un giro a fibras epicárdicas ascendentes7 (figura 1).
Para correlacionar anatómicamente la banda con proyecciones ecocardiográficas, se ha estandarizado la técnica de disección propuesta empíricamente por Torrent-Guasp, partiendo de la dificultad que supone la disección. Disecar objetivamente los corazones independientemente de la especie y el tamaño permite reproducir las proyecciones ecográficas al modelo helicoidal.
El objetivo es estandarizar y describir detalladamente la técnica de preparación y disección que permite evidenciar la estructura helicoidal de los ventrículos por medio de digitodisección, y correlacionar la distribución topográfica de la banda helicoidal y sus segmentos en proyecciones ecocardiográficas de eje largo, eje corto y de 4 cámaras.
MÉTODOSSe utilizaron una báscula Adam Equipment AQ 2610S, estuche de disección, xileno 80%, acetona 100%, una fuente de calor para ebullición, 20 corazones bovinos, 20 corazones porcinos y 2 corazones humanos sin enfermedad. El estudio fue aprobado por el comité de investigación y ética de la Sociedad Venezolana de Ultrasonografía en Obstetricia y Ginecología (SOVUOG), siguiendo la normativa vigente en la Ley General de Salud de México para disposición y control sanitario de órganos y tejidos.
Preparación del corazónCorazones de bovino y porcinoSin fijación previa, no es necesaria la inmersión en los hidrocarburos; el tejido adiposo no fijado es fácil de retirar después de hervido.
Corazones humanosSe disecan de los cadáveres pertenecientes a la Escuela Superior de Medicina del Instituto Politécnico Nacional, previamente fijados en formol al 10%. Luego los corazones se sumergen en acetona al 100% durante 1 semana para deshidratación muscular y después en xileno al 80% 1 semana más, con lo que se crea un efecto lipofílico para disecar el tejido adiposo, que es una aportación original a la técnica de disección.
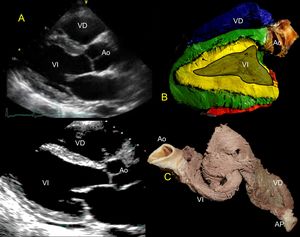
EbulliciónLa disección tradicional indica hervir los corazones de manera empírica según el tamaño, hasta lograr un tejido maleable gracias a la desnaturalización del tejido conectivo. El tiempo necesario varía de 10 min a 2 h8, lo cual dificulta estimar el tiempo sin experiencia. Para estandarizar el hervor y realizar una disección objetiva, se prefirieron los corazones bovinos de mayor tamaño. La determinación del tiempo en ebullición se cuantificó con una pérdida porcentual del 38% de la masa logrando una maleabilidad muscular adecuada; después se buscó la misma pérdida en corazones de porcino y humano logrando la maleabilidad. La pérdida porcentual se obtiene pesando los corazones antes y durante la ebullición hasta que se ha perdido el 38% del peso inicial (figura 1A-C).
Disección del miocardioPara facilitar la comprensión, es necesario observar las .
Se disecó el tejido adiposo en los surcos interventricular anterior, interventricular posterior y auriculoventricular (AV), así como el sistema circulatorio.
Desprendimiento de las aurículasSe ejerce presión digital contra el surco AV hasta penetrar en las aurículas, traccionándolas hacia arriba hasta desprenderlas.
Longitud de la arteria pulmonar y la aortaSe cortan de 3 a 5cm por encima de su origen para facilitar la manipulación del corazón, tomando en cuenta la separación entre la arteria pulmonar y la aorta. Es referencia para iniciar la disección de la LB en su segmento derecho (SDer)8.
Lazada basalSe compone del SDer y el segmento izquierdo (SI). La pared libre del ventrículo derecho (VD) la forma el SDer y la pared libre del ventrículo izquierdo (VI), el SI; la arteria marginal izquierda define el trayecto que sigue el SI hasta llegar a la base de la aorta.
Separación de los grandes vasosCon el dedo pulgar se ejerce tracción hasta separar la arteria pulmonar de la aorta, llegando al anillo fibroso de la válvula tricúspide, que se corta. Esto se facilita apoyando un dedo en el interior de la aorta para fijar el corazón y limitar su movimiento.
Disección del segmento derechoEn el surco interventricular anterior, se debe presionar toda su longitud hasta ingresar al VD. Se encuentra la trabécula septomarginal, que se separa de la pared septal para obtener una cubierta muscular el SDer.
Referencias importantesSe localiza el fondo del VD, que corresponde en el exterior al surco interventricular posterior. En el fondo de la cavidad se forma un ángulo diedro de 90° por la intersección de la LB con el tabique interventricular (TAIV), correlación anatómica descrita previamente por Torrent-Guasp8-10 y retomada para encontrar el plano laminar del ángulo diedro que libera el SI.
Disección del segmento izquierdoCon el índice o el pulgar, se presiona el fondo del VD o surco interventricular posterior en el exterior; aquí se forma el ángulo diedro y se desprende hasta encontrar un cambio de fibras de endocardio a miocardio con dirección horizontal. Para liberarlo se tracciona lateralmente el segmento descendente (SD) con ambos pulgares. Debido a que el grosor de las fibras en el corazón humano es menor, la tracción se puede realizar con una sonda acanalada en el mismo sentido. Encontrado el plano muscular, este debe seguirse hasta la base del VI por su parte posterior. Se debe tener cuidado con sus fibras, tienen una dirección ascendente y oblicua siguiendo el trayecto de la arteria marginal izquierda hasta su origen, donde se encuentra la inserción del trígono fibroso izquierdo, que hay que escindir.
Corte de los trígonos fibrososEstructuras fibrosas que unen la aorta a la base del VI en los extremos derecho e izquierdo. Una vez disecada totalmente la LB, se debe escindir el trígono izquierdo, y cuando se inicie la disección de la lazada apexiana, se podrá cortar el trígono derecho y desmontar la aorta.
Lazada apexianaForma el VI, compuesta por 2 segmentos: uno (SD) endocárdico y otro ascendente (SA) epicárdico. Ambos cierran la cavidad en helicoide y cuando se cruzan generan un ángulo recto y forman el TAIV10.
Disección del segmento descendenteAl terminar de disecar la LB, se observa el cambio de fibras musculares hacia el endocardio, donde se introduce el dedo índice siguiendo su trayectoria disecando los planos.
Identificación del ángulo de 90°Donde se ubica el ángulo diedro en el VD y el inicio del SI de la LB con el surco interventricular posterior, se observa un cruce de fibras musculares en un ángulo de 90° entre el SD y el músculo papilar septal del VD. Las fibras que cruzan horizontalmente (subendocardio) corresponden al SD y las de dirección vertical (subepicardio), al SA.
Disección del segmento ascendente y desmontaje de la aortaUna vez localizado el cruce a 90°, se ejerce presión con el pulgar o el índice (según el manipulador) entre los planos horizontal y transversal. El objetivo es encontrar un cambio en la dirección de las fibras musculares para liberar el SA hasta la base del VI cortando el trígono fibroso derecho. Una vez separados los 2 planos musculares, hay que regresar al sitio donde se encuentra el cambio del SI con el SD, se introduce el dedo índice para disecar por completo el trayecto del SD y SA y se desmonta la aorta que queda unida al SA.
Apertura de la banda miocárdicaEl paso anterior es importante, ya que al realizarlo correctamente solo habrá que seguir la dirección natural de las fibras epicárdicas hasta ingresar al endocardio del VI por su parte posterior (MPP), donde se encuentra como referencia el músculo papilar posterior, que es el límite del inicio del SA. Se corta el anillo mitral y se desenrolla el VI para obtener la banda miocárdica helicoidal.
Cortes ecocardiográficosRealizada la disección miocárdica en los corazones estudiados, se identificaron los segmentos mediante codificación de colores (LB: SDer, Azul; SI, Rojo; LA: SD, Amarillo; SA, Verde). Se enrollaron los corazones nuevamente a su posición original sin las aurículas, con el objetivo de realizar los cortes según las proyecciones ecocardiográficas por correlacionar (eje largo, eje corto y apical de 4 cámaras). Las imágenes ecocardiográficas se obtuvieron de pacientes adultos sanos; las imágenes de vectores de velocidad pertenecen a un corazón fetal de 40,2 semanas sin enfermedad.
RESULTADOSEstandarizaciónSe determinó que no importan el peso ni el tamaño del corazón ni el método usado para hervirlo, la maleabilidad adecuada para disecar se logra en todos los corazones mediante la pérdida del 38% de su masa. Al hacer descriptiva y específica la técnica, resultó más fácil disecar el miocardio que con el procedimiento original. No se encontró diferencia anatómica de la banda entre los corazones humano, bovino y porcino. La fijación previa de los corazones humanos dificulta la disección en comparación con los de origen fresco.
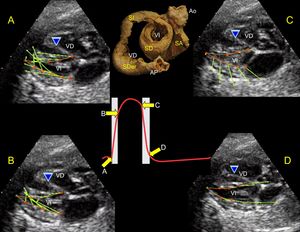
Correlación topográfica: ecocardiografíaEje largo paraesternalLa pared libre del VD está formada en su totalidad por el SDer de la LB (azul), su continuidad al SI (rojo) aporta una pequeña porción en la región posterobasal de la pared libre del VD cubriendo el SA. El TAIV está formado en su totalidad por los 2 SD, SA (amarillo y verde). En la base del VI se aprecian los 4 segmentos de la banda, mientras que en la porción medial y del ápex únicamente están los SD y SA (figura 2). Es importante tener en consideración que, después del MPP, se inicia el SA, por lo que visualizarlo a la mitad no permitirá apreciar el SA.
A: proyección de eje largo paraesternal. B: correlación con el eje largo; permite visualizar el TAIV con doble plano muscular y la pared libre del VI; el SD (verde) rodea el SA (amarillo). C: corazón bovino parcialmente enrollado. Ao: aorta; AP: arteria pulmonar; SA: segmento ascendente; SD: segmento descendente; TAIV: tabique interventricular; VD: ventrículo derecho; VI: ventrículo izquierdo. Esta figura se muestra a todo color solo en la versión electrónica del artículo.
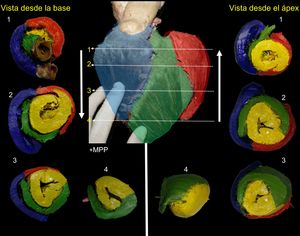
El SDer (azul) forma toda la pare libre del VD, el SI (rojo), de menor tamaño, cubre la porción posterolateral del VI; es interesante apreciar que el SD ocupa la mayor parte del VI, gira 360° y cierra el VI en todos los cortes (figura 3). Sin embargo, dependiendo de la altura o la profundidad del corte, los segmentos aportan más o menos a la anatomía (figura 4). Después del MPP, se inicia el SA, que gira 180° y cubre a su homólogo endocárdico hasta llegar al surco interventricular posterior, donde se intersectan los 4 segmentos (figura 3 y figura 4).
Cortes correlativos de eje corto visto desde la parte superior hasta el ápex y desde el ápex hasta la parte superior. Los números representan el sitio de corte de cada pieza. Nótese que el SD (amarillo) cierra completamente el VI y después del MPP (*) da inicio al SA, que gira 180° sobre su homólogo endocárdico. En la vista anterior central, la arteria descendente anterior divide al SDer (azul) del SA (verde); la arteria marginal marca la división del SI (rojo) del SA (verde). SA: segmento ascendente; SD: segmento descendente; SDer: segmento derecho; SI: segmento izquierdo; MPP: músculo papilar posterior; VI: ventrículo izquierdo. Esta figura se muestra a todo color solo en la versión electrónica del artículo.
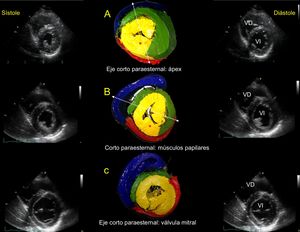
Correlación ecográfica con proyecciones de eje corto en sístole y diástole. Énfasis en 3 relaciones anatómicas: eje corto apical (A), eje corto de músculos papilares (B) y eje corto de válvula mitral (C). El asterisco marca el MPP. Las líneas punteadas en A y B muestran que, según el ángulo de corte usado, cambia la apariencia del SA en la pared libre del VI; cuanto más vertical sea el corte, más pasa sobre el MPP, y cuanto más oblicuo sea y pase sobre el músculo papilar anterior, se observa el SA en la pared libre del VI y se puede evaluarlo. SA: segmento ascendente; MPP: músculo papilar posterior; VD: ventrículo derecho; VI: ventrículo izquierdo.
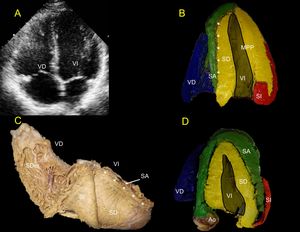
El endocardio del VI siempre va a estar ocupado por el SD (amarillo). Dependiendo de la profundidad ecocardiográfica, aparece el SA (verde) en la pared lateral del VI (figura 5). En el TAIV se observa la separación del SD y el SA, como una línea brillante en la ecografía estándar (figuras 5A, 5B y 5D). Cuando se observa el MPP, difícilmente se encuentra parte del SA, debido a que este músculo papilar aún forma parte del SD (amarillo) (figura 5B). En cortes más superficiales hacia la cara anterior del VI, es posible observar que el SA (verde) rodea al SD (amarillo) (figura 5C), que es importante para evaluar la fase de relajación isovolumétrica por vectores de deformación radial/longitudinal (figura 6).
A: proyección de 4 cámaras. B: la línea ecogénica brillante divide el septo en el SD y el SA (asteriscos). C: corazón humano en vista posterolateral derecha que demuestra la superposición del SD y el SA en el septo que genera la línea ecogénica brillante (asteriscos). D: cuanto más se acerca el corte a la cara anterior del corazón, este tendrá el SA en la pared libre del VI; cuanto más se aleje y se cruce sobre el MPP, únicamente se verá en la pared libre el SD y SI, como ocurre en A superior. Ao: aorta; MPP: músculo papilar posterior; SA: segmento ascendente; SD: segmento descendente; SDer: segmento derecho; SI: segmento izquierdo; VD: ventrículo derecho; VI: ventrículo izquierdo.
Proyecciones de 4 cámaras y vectores de velocidad en corazón fetal de 40,2 semanas por ultrasonido. A: vectores de velocidad (flechas verdes) de la base del VI en dirección caudal durante el movimiento de acortamiento axial. B: los vectores se desplazan hacia el interior en la pared lateral y la porción superior del TAIV por la contracción del SD durante la eyección. C y D: inicio del periodo de relajación isovolumétrica en el que el SA se contrae, los vectores de velocidad en dirección lateral y hacia afuera en dirección cefálica, lo que causa la destorsión y el alargamiento axial del corazón. Corazón humano parcialmente enrollado. Curva de Wiggers; destaca los movimientos durante el ciclo cardiaco relacionados con los vectores de velocidad. A: contracción de la lazada basal. B: contracción del SD. C: contracción del SA, relajación ventricular. Ao: aorta; AP: arteria pulmonar; SA: segmento ascendente; SD: segmento descendente; SDer: segmento derecho; SI: segmento izquierdo; TAIV: tabique interventricular. VD: ventrículo derecho; VI: ventrículo izquierdo. Esta figura se muestra a todo color solo en la versión electrónica del artículo.
Las fibras musculares giran 180° en la transición del SI al SD y orientan en un ángulo de 45° las fibras subendocárdicas con un patrón de orientación vertical hacia el ápex cardiaco, y después del MPP se reorientan a 45° para convertirse en fibras subepicárdicas con orientación oblicua predominante, con lo cual se originan el helicoide, la conicidad y el vórtice del ápex.
DISCUSIÓNLa importancia de la disecciónTorrent-Guasp determinó en su amplísima investigación la anatomía del miocardio como una banda única mediante una técnica de disección manual que él desarrolló durante más de 50 años de estudio1. Sin embargo, realizar la disección es difícil y reproducirla sin las indicaciones adecuadas no lleva al éxito. Torrent-Guasp proporciona los puntos clave que definen los planos de escisión para dividir el miocardio6,8-10; sin embargo, en la preparación empírica que él tenía dominada omite detalles importantes para que otros la realicen. La ausencia de estandarización e instrucciones detalladas ha llevado a diversos autores a publicar técnicas de disección que no logran desplegar la banda por completo11 ni respetan los segmentos en que se divide12. La técnica descrita es más específica y descriptiva, hace hincapié en cómo usar las referencias anatómicas de Torrent-Guasp durante la digitodisección. La inmersión en acetona es una aportación original que facilita la deshidratación del tejido y el xileno brinda un efecto lipofílico para el tejido adiposo humano fijado. Gunther von Hagens y otros autores han usado hidrocarburos al deshidratar y eliminar lípidos tisulares13,14. Otro aporte importante es la pérdida del 38% de la masa, que garantiza la textura y la maleabilidad para la digitodisección miocárdica de cualquier tamaño, incluido el corazón humano. Este parámetro no se incluye en otros estudios y da un carácter objetivo a la disección.
Comprender la anatomíaSin necesidad de disecar el corazón, se ha comprobado la disposición helicoidal de las fibras mediante tractografía15,16, lo que valida la disección. Comprender teóricamente su anatomía no es suficiente para desarrollar más aplicaciones clínicas del concepto; saber disecarlo correctamente supone entender la arquitectura estructural con que se distribuyen las fibras miocárdicas aplicando el concepto desde cirugía17,18 a técnicas de imagen2,19,20. Las correlaciones revelan morfológicamente la distribución de los segmentos en las proyecciones ecocardiográficas de eje largo, eje corto y 4 cámaras. Las correlaciones adquieren mayor validez si se buscan intencionadamente y se evalúan por strain, strain rate y vectores de velocidad.
Implicaciones correlativas al ecocardiogramaSe debe entender que cada segmento correlacionado en este estudio representa movimientos ya definidos y acciones mecánicas que involucran 6 movimientos durante el ciclo cardiaco21-23 (figura 6).
Sístole:
- 1.
Estrechamiento: disminuye el diámetro transversal, se contraen la LB y sus 2 segmentos (contracción isovolumétrica).
- 2.
Torsión: contracción del SD (eyección rápida).
- 3.
Acortamiento axial: gracias a la contracción del SD, la base se acerca al ápex.
Diástole:
- 4.
Alargamiento axial: contracción del SA, genera un movimiento de destorsión durante la relajación isovolumétrica.
- 5.
Destorsión durante la relajación isovolumétrica.
- 6.
Ensanchamiento: se atribuye al llenado de las cavidades, reposo de la LB y la consecuente rotación horaria al momento de destorcer el corazón.
Durante la evaluación, el ángulo entre el SD y el SA parece ser crucial para la función sistólica eficiente24. Para evaluar el ángulo de desplazamiento de las fibras durante la torsión y destorsión por speckle tracking o imágenes vectoriales de velocidad, el eje corto cercano a la base o porción media del VI25 (figuras 4B y 4C) permite observar definidamente los 4 segmentos. Una ventana cercana al ápex muestra únicamente los componentes de LA (SD, SA) (figura 3, número 4). Se ha determinado por proyección de 4 cámaras una línea ecogénica brillante en el TAIV que marca la separación entre el SD y el SA26 (figura 5).
Contexto clínicoEl componente sistólico del SD y el diastólico del SA (figuras 6B y 6C) se evaluaron en pacientes hipertensos y sanos, y se halló que los pacientes normales mostraban similares picos de velocidad de torsión en sístole, de 1,9±0,2 cm/s, mientras que los hipertensos mostraban más velocidad de deformación 2,3±0,2 cm/s. Al cuantificar la velocidad de destorsión ventricular durante la fase de relajación isovolumétrica de pacientes sanos, el valor fue de 1,7±0,1 cm/s, mientras que en los hipertensos fue menor, 1,1±0,1 cm/s27. La generación de menor fuerza contráctil por el SA podría explicar morfológicamente el desarrollo de la disfunción diastólica temprana, lo cual agilizaría en un futuro el diagnóstico ecográfico.
Conocer la anatomía topográfica de la banda en el ecocardiograma podría brindar un estándar de velocidad de deformación de cada segmento en pacientes sanos y enfermos que incluir como un parámetro clínico con el que estratificar y pronosticar enfermedades, como la disfunción sistólica y diastólica subclínica en el síndrome metabólico28,29 y la predicción de cardiotoxicidad en el paciente oncológico30,31. Tras un infarto agudo de miocardio, algunos pacientes sufren roturas y hematomas disecantes intramiocárdicos que por ecografía parecen seguir el patrón arquitectónico helicoidal, disecando el ápex en el endomiocardio y el TAIV por la mitad, como se muestra; en otros hay disección hemorrágica donde los 4 segmentos se conectan, y estos casos tienden a evolucionar disecando los segmentos de la banda32.
ControversiasSe han propuesto diversos modelos de la arquitectura de las fibras miocárdicas, como el de malla cardiaca, en el que los miocitos se distribuyen a diferente profundidad en trayectos longitudinales y radiales33. Sin embargo, el modelo helicoidal ha ayudado a esclarecer eficientemente la dinámica de contracción durante el ciclo cardiaco34. Paralelamente se ha determinado que la pérdida de torsión del VI es el más temprano signo de insuficiencia cardiaca, el cual se puede esclarecer mediante el estudio de la contracción aplicando la correlación anatómica presentada. Recientemente se ha encontrado que, en el punto de cruce de los segmentos helicoidales en el TAIV, se produce una extensión de la activación eléctrica de forma radial desde el SD al SA, mientras comienza una activación simultánea y opuesta del SA proximal y distal, lo que confirma la presencia de fibras circunferenciales no descritas en el modelo helicoidal35.
CONCLUSIONESLa estandarización de la disección permite disecar las fibras helicoidales en corazones humanos y de otras especies de manera exitosa respetando la segmentación del miocardio. No se encontraron diferencias anatómicas entre los corazones bovinos, porcinos y humanos. La correlación ecográfica permite identificar dónde se encuentra cada segmento de la banda en los cortes de eje largo, eje corto y apical de 4 cámaras, fundamentales para el análisis de la función miocárdica, que es el único sello distintivo para determinar la credibilidad de la estructura. El ecocardiograma es útil para identificar los diferentes segmentos del miocardio helicoidal y su desempeño por deformación.
CONFLICTO DE INTERESESNo se declara ninguno.
- –
Se sabe que la anatomía del corazón divido en 4 segmentos de forma helicoidal explica la mecánica cardiaca durante el ciclo cardiaco en 6 movimientos definidos; por lo tanto, la forma del corazón explica su movimiento.
- –
Algunos hematomas intramiocárdicos y roturas miocárdicas siguen el trayecto de los segmentos helicoidales.
- –
Conocer la anatomía topográfica del corazón es de amplia utilidad en el diagnóstico por imagen.
- –
Aporta un proceso de disección estandarizado. Para no cometer errores al realizar la disección, se acompaña material en vídeo que explica paso a paso los movimientos más importantes en corazones humanos, bovinos y porcinos.
- –
Se trata de una técnica mejorada para la docencia y la investigación. Se muestra una amplia correlación anatómica con las proyecciones ecocardiográficas más usadas, con lo que se puede realizar evaluaciones centradas en algún segmento de interés sabiendo claramente en qué proyección encontrarlo, y ello genera un nuevo panorama para la evaluación de enfermedades estructurales.
Agradezco al Dr. C.M. Alberto Sosa Olavarría por proporcionar las imágenes de ecocardiografía para la presente correlación, y al Dr. Cristóbal Rubén Villavicencio Nava por facilitar las instalaciones del laboratorio durante su coordinación.