El envejecimiento rápidamente progresivo en los países occidentales hace prever que en el año 2050 en torno a un tercio de la población tenga más de 65 años1. En este contexto, determinar el riesgo de fibrilación auricular (FA) y qué pacientes debieran recibir anticoagulación es uno de los mayores desafíos de la cardiología moderna2,3. El tratamiento de la FA con anticoagulantes desde finales de los años ochenta4 ha disminuido significativamente la incidencia de ictus, aunque aún no se sabe con precisión su impacto en el déficit cognitivo, a pesar de que recientemente se han publicado algunas evidencias sobre la relación entre la FA y el deterioro cognitivo5. Por otro lado, hay nuevos datos6,7 sobre la identificación de pacientes en riesgo y la importancia que la FA tiene como factor causal de embolias. En este sentido, la información brindada por los dispositivos de monitorización cardiaca continua (registradores subcutáneos implantables, marcapasos y desfibriladores) permite determinar la ausencia de relación temporal entre FA y accidente cerebrovascular. De hecho, en pacientes con FA paroxística, casi nunca hay FA en el momento en que se produce el ictus, sino que es un marcador más de disfunción endotelial y otro factor de riesgo de accidente cerebrovascular8–11. Asimismo, el valor del ECG de superficie, y en concreto de los trastornos de conducción interauricular (TCIA), con que contribuye a determinar el riesgo de FA se ha revalorizado recientemente.
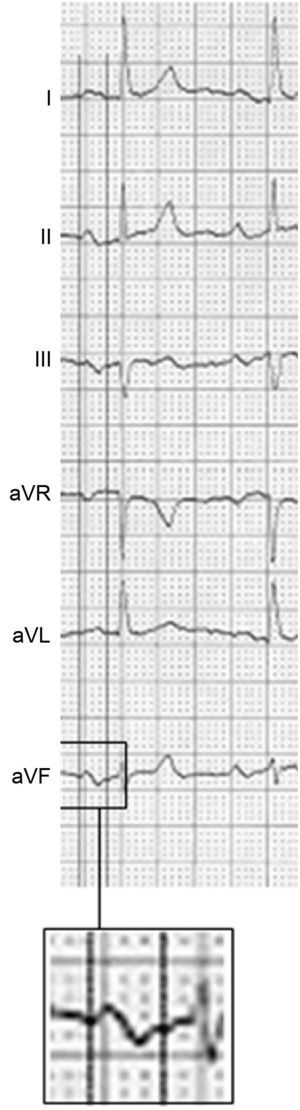
El diagnóstico y la clasificación de los TCIA (parcial y avanzado) se publicaron en los años ochenta por Bayés de Luna12,13 y más tarde por el grupo de Spodick14, entre otros. Finalmente, sus criterios diagnósticos se definieron en el consenso de 201215. El diagnóstico del TCIA parcial se realiza en presencia una onda P ≥ 120 ms y el del avanzado si, además, hay morfología±en II, III y aVF (figura 1). También está presente, casi siempre, P±de V1 a V3, pero este criterio puede encontrarse también en el crecimiento auricular izquierdo aislado. Se ha comprobado que, cuando el TCIA avanzado presenta una onda P de muy larga duración (≥ 160 ms), el paciente es portador de cardiopatía estructural evidente o tiene un elevado CHA2DS2-VASc11 (insuficiencia cardiaca o disfunción sistólica, hipertensión arterial, edad ≥ 75 años, diabetes mellitus, ictus, vasculopatía, edad 65-74 años, sexo femenino) y arritmias auriculares ambientales (más de 40 complejos auriculares prematuros/h en el registro de Holter), la posibilidad de presentar FA/flutter auricular en los próximos 2-3 años es muy alta. Por otra parte, varios trabajos han confirmado el valor del TCIA avanzado como predictor de FA16–22. Por todo ello, recientemente se ha denominado a esta anomalía síndrome de Bayés23–26. Por último, hay que subrayar que los TCIA y las arritmias ambientales se asocian también frecuentemente con ictus y déficit cognitivo26–31.
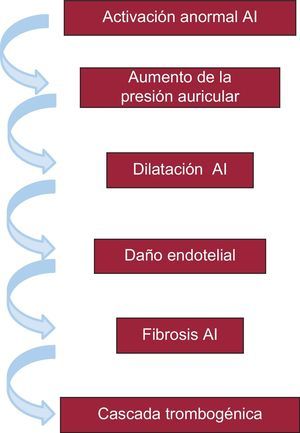
La fisiopatología de la asociación entre TCIA avanzado y FA e ictus probablemente dependa de una serie de alteraciones electromecánicas en cadena que, empezando en una activación anormal y retrasada de la aurícula izquierda, acaban en la cascada trombogénica, sobre todo en el apéndice auricular izquierdo32 (figura 2). Es interesante señalar la importancia de la fibrosis en este mecanismo, ya que la fibrosis está íntimamente relacionada con el daño endotelial y propicia la aparición de FA y la cascada trombogénica33–38.
Alteraciones electromecánicas que podrían explicar la asociación del trastorno de conducción interauricular avanzado con la fibrilación auricular y el riesgo de accidentes embólicos cerebrales (ictus y déficit cognitivo asociados o no a la presencia de fibrilación auricular). AI: aurícula izquierda.
Esta secuencia de eventos ha llevado a considerar que tiene sentido identificar a los pacientes con TCIA avanzado que presenten las características incluidas en la tabla, porque sabemos que estos pacientes tienen alto riesgo de FA e ictus, por lo que podrían beneficiarse del uso de anticoagulación precoz, aun sin evidencia de FA. Este enfoque queda ahora reforzado6,7 por la demostración reciente de que en los pacientes con CHA2DS2-VASc alto la prevalencia de FA aumenta, pero que cuando ese indicador es muy alto las complicaciones troboembólicas aparecen independientemente de que haya FA. Si además se asocia la presencia de TCIA avanzado, se origina un subgrupo de pacientes que, probablemente, presentarán un riesgo aún mayor de sufrir a corto plazo complicaciones embólicas con o sin la aparición de FA. También queda abierta la posibilidad de que esta estrategia evite, por lo menos en parte, el déficit cognitivo que parece estar asociado a la FA, pero que seguramente se debe considerar ligado a procesos microembólicos que frecuentemente sufren estos pacientes antes de un ictus5.
La hipótesis de anticoagular a los pacientes en ritmo sinusal con las características de la tabla pero sin FA confirmada nos parece, pues, muy lógica y atractiva. Es más, en casos puntuales podría considerarse ya de aplicación clínica. Además, el diagnóstico del TCIA es sencillo y solo requiere un análisis del electrocardiograma39. Sin embargo, antes de proponerla como recomendación general, es necesario que se cumplan dos premisas. La primera, la realización de un registro que incluya a pacientes con TCIA avanzado junto con las características de la tabla y un grupo control integrado por pacientes con perfil clínico semejante, pero con TCIA parcial. La segunda es que, si este registro demostrara que los pacientes con TCIA avanzado tienen mayor riesgo de ictus independientemente que tengan FA documentada o no, sería aconsejable la realización de un ensayo clínico con anticoagulantes (posiblemente usando los «nuevos» anticoagulantes orales) y un grupo control para determinar si la anticoagulación de estos pacientes puede reducir la incidencia de ictus y deterioro cognitivo. De ser así, el tratamiento anticoagulante sería aconsejable para estos pacientes pues, aunque no evitaría la aparición de FA o flutter auricular, podría disminuir los efectos colaterales y las secuelas (ictus y déficit cognitivo). Como recientemente ha señalado Fabritz, una pequeña onda P bifásica en los ancianos podría tener un gran impacto40.
Full English text available from: www.revespcardiol.org/en
CONFLICTO DE INTERESESNinguno.