A pesar del uso de la hipotermia terapéutica, los pacientes recuperados tras sufrir una parada cardiaca extrahospitalaria tienen un elevado riesgo de muerte o deterioro neurológico grave. Se analizaron la utilidad de diversas variables disponibles al ingreso hospitalario para predecir su evolución a los 6 meses.
MétodosSe desarrolló un estudio multicéntrico en 3 unidades de cuidados intensivos cardiacos. El análisis se realizó sobre 153 pacientes ingresados en dos centros tras sufrir una parada cardiaca extrahospitalaria recuperada y que se trataron con control de temperatura, entre enero de 2007 y julio de 2015. Se consideraron secuelas neurológicas significativas si la Cerebral Performance Categories Scale > 2 a los 6 meses. Los resultados se validaron externamente con los datos procedentes de otros 91 pacientes ingresados en un tercer hospital, durante el mismo periodo de tiempo.
ResultadosDel total de 244 pacientes (mediana de edad, 60 años; 77,1% varones; 50,0% en el contexto de isquemia miocárdica aguda), 107 (43,8%) sobrevivieron a los 6 meses con una evolución neurológica favorable. Se calculó un modelo predictivo que incluyó 5 variables (primer ritmo, edad, lactato al ingreso, tiempo hasta recuperación de circulación espontánea y diabetes), con un área bajo la curva de 0,90 (IC95%, 0,85-0,95). Cuando se realizó la validación externa del modelo, la sensibilidad fue de 73,5%, con una especificidad de 78,6% y un área bajo la curva de 0,82 (IC95%, 0,73-0,91).
ConclusionesUn modelo predictivo que incluye cinco variables disponibles en el momento de ingreso de pacientes recuperados tras sufrir una parada cardiaca extrahospitalaria puede ayudar a predecir la probabilidad de supervivencia libre de secuelas neurológicas graves en el seguimiento.
Palabras clave
La parada cardiorrespiratoria (PCR) extrahospitalaria es un importante problema de salud que afecta a entre 76 y 110 pacientes por cada 100.000 habitantes al año. A pesar de los importantes esfuerzos realizados para tratar a estos pacientes y los altos costes que ello implica1, el pronóstico a largo plazo continúa siendo malo, puesto que 2 de 3 pacientes reanimados fallecen antes del alta hospitalaria2. Además, la mortalidad a largo plazo continúa siendo elevada después del alta, sobre todo de pacientes de edad> 65 años, de los que casi 1 de cada 3 fallecen en el primer año3. En los pacientes con una PCR extrahospitalaria debida a arritmias ventriculares que se mantienen inconscientes tras la reanudación de la circulación espontánea (RCE), se ha demostrado que una hipotermia leve tiene efectos neuroprotectores4,5 y su aplicación se ha extrapolado a los supervivientes de una parada cardiaca con ritmos cardiacos que inicialmente no son desfibrilables6. Se han descrito resultados similares en pacientes tratados con control de temperatura a 33°C o a 36°C7. Según lo indicado por estos datos, actualmente las guías internacionales sobre reanimación recomiendan el control de temperatura a una temperatura constante entre 32 y 36°C durante un mínimo de 24 h8. A pesar del control de temperatura, el daño neurológico es frecuente y desempeña un papel clave en la limitación del pronóstico de estos pacientes. Además, la necesidad de mantener la sedación y la parálisis en este contexto reduce la exactitud de la exploración clínica y hace que la determinación del pronóstico en los primeros momentos tras la reanimación sea una tarea difícil. Varios estudios han examinado la exactitud de diferentes pruebas diagnósticas que pueden realizarse al ingreso en el hospital, como los resultados del electroencefalograma9, los potenciales evocados10, las exploraciones de imagen cerebrales11 y los marcadores en sangre12,13 o una combinación de varios parámetros14-16 para estimar el pronóstico neurológico de los pacientes que están en coma tras una PCR. A este respecto, las guías actuales resaltan la necesidad de esperar cierto tiempo antes de pronosticar una mala evolución neurológica después del restablecimiento de la normotermia en los pacientes tratados con control de temperatura, con objeto de minimizar el porcentaje de resultados falsamente positivos8. Sin embargo, es poco lo que se sabe acerca del valor pronóstico de las variables disponibles en las primeras horas al momento del ingreso. En esos pacientes, la toma de decisiones inicial puede implicar el empleo de tratamientos muy agresivos, tales como el uso de un oxigenador extracorpóreo de membrana17 y dispositivos de asistencia ventricular18. Además, este periodo de incertidumbre, que puede durar varios días, también conlleva una importante carga emocional para la familia19.
El objetivo es evaluar la asociación de las variables disponibles en los momentos iniciales tras la reanimación con el pronóstico a los 6 meses y generar y validar un modelo predictivo para calcular la probabilidad de supervivencia sin un daño neurológico importante a los 6 meses.
MÉTODOSContexto y población en estudioSe llevó a cabo un estudio prospectivo multicéntrico en 3 hospitales académicos de España. Se incluyó a adultos consecutivos supervivientes de una PCR extrahospitalaria no traumática, ingresados en la unidad de cuidados intensivos cardiacos y tratados con control de temperatura entre enero de 2007 y julio de 2015 (tan solo se analizó a los pacientes que sobrevivieron hasta el ingreso en el hospital y fueron tratados con control de temperatura). La población total se dividió en 2 grupos: los datos de los pacientes ingresados en 2 hospitales (Hospital General Universitario Gregorio Marañón y Hospital Universitario de Salamanca: grupo de desarrollo) se utilizaron para crear un modelo predictivo, mientras que los datos de los pacientes tratados en un tercer hospital (Hospital Universitario de Bellvitge: grupo de validación) se utilizaron para llevar a cabo una validación externa del modelo.
Tratamiento con control de temperaturaTodos los supervivientes de una PCR extrahospitalaria con escala del coma de Glasgow ≤ 8 puntos ingresaron en la unidad de cuidados intensivos cardiacos para monitorización y tratamiento según las normas clínicas internacionales y los protocolos de los centros, incluida una sedación adecuada, parálisis para prevenir el temblor durante la hipotermia y ventilación mecánica y, en caso necesario, se les administró un apoyo vasoactivo o inotrópico para mantener una presión arterial media> 80 mmHg. Cuando había indicación para ello (en resumen, si no había una causa extracadiaca obvia o si se sospechaba isquemia miocárdica persistente), se realizó una coronariografía precoz y revascularización percutánea. En un subgrupo de pacientes, se inició la hipotermia antes de la llegada al hospital, pero en la mayoría se inició lo antes posible tras el ingreso en el hospital. La temperatura objetivo fue de 32-34°C mantenida durante 24 h. Se utilizaron para ello 3 métodos: control de temperatura no automático con mantas térmicas y hielo (el 12,0% de los pacientes) y sistemas de control de temperatura automáticos, ya fuera con un dispositivo de enfriamiento de superficie (en el 79,3% de los pacientes) o con un sistema endovascular (en el 8,7% de los casos). El recalentamiento se aplicó gradualmente, evitando la hipertermia. Al finalizar el recalentamiento, se detuvo la sedación y se evitó la hipertermia.
Recogida de datos y parámetros de valoraciónLos datos se recogieron de manera prospectiva siguiendo las recomendaciones de Utstein20 a partir de las historias clínicas prehospitalarias y hospitalarias de los pacientes. Se obtuvo información demográfica y de otras características generales, como las constantes vitales, si la PCR extrahospitalaria había sido presenciada o no, y la presencia o ausencia de reanimación cardiopulmonar por testigos presenciales. Se registró el tiempo entre el colapso y la primera reanimación cardiopulmonar (tiempo estimado aproximado en los pacientes con una PCR no presenciada), el tiempo entre el colapso y la RCE, y el tiempo entre la RCE y el inicio de la hipotermia terapéutica. Se obtuvo una muestra de sangre arterial al ingreso. Las paradas cardiacas se dicotomizaron en ritmos cardiacos desfibrilables (fibrilación ventricular y taquicardia ventricular) y ritmos cardiacos no desfibrilables (incluida la asistolia y la actividad eléctrica sin pulso). El shock circulatorio tras reanimación se definió por una hipotensión arterial (presión arterial media <60 mmHg o presión arterial sistólica <90 mmHg) mantenida más de 60 min después del ingreso en el hospital, refractaria a la sobrecarga de volumen y que requirió la administración de noradrenalina. El resultado neurológico se determinó aplicando la Pittsburgh Cerebral Performance Category (CPC)21 a los pacientes que seguían con vida al alta. La evaluación con esta escala se realizó en el momento del alta y a los 6 meses. Los datos sobre el estado neurológico a los 6 meses se obtuvieron de las historias clínicas realizadas por los médicos encargados del seguimiento ambulatorio (que no conocían los resultados de predicción del modelo). El objetivo principal fue la supervivencia con un resultado neurológico favorable a los 6 meses, que se definió como un nivel de CPC de 1 (buena recuperación) o 2 (discapacidad moderada), mientras que las CPC 3 (discapacidad grave), 4 (estado vegetativo) y 5 (muerte) se consideraron resultados desfavorables.
Como regla general, los criterios para la retirada del tratamiento de apoyo vital en nuestros centros son la ausencia bilateral de potenciales evocados N20 y/o un patrón de electroencefalograma maligno arreactivo en un paciente que se mantiene en coma al menos 72 h después de la RCE y al menos 48 h después del recalentamiento.
El estudio se llevó a cabo cumpliendo lo establecido en la Declaración de Helsinki y fue aprobado por el comité de ética de investigación del Hospital General Universitario Gregorio Marañón, Madrid (España).
Análisis estadísticoLas variables continuas se resumen con la mediana [intervalo intercuartílico] y las diferencias se analizaron con la prueba de la t de Student o la prueba de suma de orden de Wilcoxon (si la distribución no era normal). Las variables discretas se presentan mediante frecuencias y porcentajes y se compararon con la prueba de la χ2 o la prueba exacta de Fisher.
Se elaboró un modelo de regresión logística multivariable con los datos del grupo de desarrollo, mediante una eliminación por pasos de las variables. Las variables con un valor de p <0,2 en un análisis univariable se consideraron candidatas para la inclusión en el modelo multivariable. Se utilizó la prueba de Hosmer-Lemeshow para determinar la bondad de ajuste. Se evaluaron los posibles términos de interacción relevantes entre las variables examinadas. La exactitud de la detección del modelo para identificar un mal resultado a los 6 meses (que se definió como muerte, estado vegetativo o discapacidad grave; CPC 3-5), partiendo de los datos disponibles al ingreso en el hospital, se analizó con la odds ratio en una regresión logística multivariable, el área bajo la curva (AUC), los coeficientes de sensibilidad y especificidad y la tasa de resultados falsamente positivos. Se evaluó el modelo final y se realizó una validación externa con los datos del grupo de validación.
La recolección de los datos fue local y tras eliminar cualquier información que permitiera la identificación del paciente se introdujeron en una base de datos FileMaker (FileMaker Inc.; Santa Clara, California, Estados Unidos). Todas las pruebas fueron bilaterales y se realizaron con el programa Stata 12.1 (StataCorp; Lakeway, Texas, Estados Unidos). A los pacientes de los que faltaba el valor de alguna de las variables de interés, se los registró y se los excluyó del análisis.
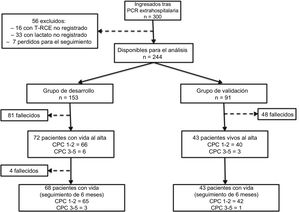
RESULTADOSPoblación del estudioEntre enero de 2007 y julio de 2015, un total de 300 pacientes con diagnóstico de PCR extrahospitalaria y una puntuación de la escala del coma de Glasgow ≤ 8 persistente ingresaron en nuestros centros y fueron tratados con control de temperatura. Se excluyó del análisis a un total de 56 pacientes: de 33 no se disponía de una determinación del lactato al ingreso, de 16 no había información respecto al tiempo entre la PCR y la RCE, y de 7 se perdió el seguimiento. Así pues, se dispuso de 244 pacientes para el análisis. Según lo descrito antes, la población total se dividió en 2 grupos: 153 pacientes en el grupo de desarrollo y 91 en el de validación.
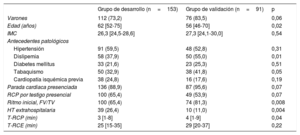
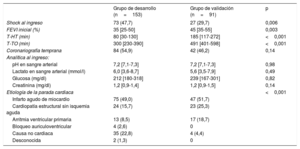
Características de los pacientes y resultadosLas características clínicas de toda la cohorte de pacientes se presentan en la tabla 1 y la tabla 2. Hubo varias diferencias entre los 2 grupos: los pacientes incluidos en el grupo de desarrollo eran de más edad, tenían menor incidencia de ritmos desfibrilables, menos etiología cardiaca y un peor estado hemodinámico al ingreso, con una mayor tasa de utilización de hipotermia extrahospitalaria, y un menor tiempo hasta el inicio de la hipotermia terapéutica en comparación con los del grupo de validación.
Características basales de los pacientes, antes del ingreso hospitalario
| Grupo de desarrollo (n=153) | Grupo de validación (n=91) | p | |
|---|---|---|---|
| Varones | 112 (73,2) | 76 (83,5) | 0,06 |
| Edad (años) | 62 [52-75] | 56 [46-70] | 0,02 |
| IMC | 26,3 [24,5-28,6] | 27,3 [24,1-30,0] | 0,54 |
| Antecedentes patológicos | |||
| Hipertensión | 91 (59,5) | 48 (52,8) | 0,31 |
| Dislipemia | 58 (37,9) | 50 (55,0) | 0,01 |
| Diabetes mellitus | 33 (21,6) | 23 (25,3) | 0,51 |
| Tabaquismo | 50 (32,9) | 38 (41,8) | 0,05 |
| Cardiopatía isquémica previa | 38 (24,8) | 16 (17,6) | 0,19 |
| Parada cardiaca presenciada | 136 (88,9) | 87 (95,6) | 0,07 |
| RCP por testigo presencial | 100 (65,4) | 49 (53,9) | 0,07 |
| Ritmo inicial, FV/TV | 100 (65,4) | 74 (81,3) | 0,008 |
| HT extrahospitalaria | 39 (26,4) | 10 (11,0) | 0,004 |
| T-RCP (min) | 3 [1-8] | 4 [1-9] | 0,04 |
| T-RCE (min) | 25 [15-35] | 29 [20-37] | 0,22 |
FV: fibrilación ventricular; HT: hipotermia terapéutica; IMC: índice de masa corporal; RCP: reanimación cardiopulmonar; T-RCE: tiempo entre colapso y reanudación de la circulación espontánea; T-RCP: tiempo entre colapso y primera reanimación cardiopulmonar; TV: taquicardia ventricular.
Los valores expresan n (%) o mediana [intervalo intercuartílico].
Características de los pacientes tras el ingreso y durante la hospitalización
| Grupo de desarrollo (n=153) | Grupo de validación (n=91) | p | |
|---|---|---|---|
| Shock al ingreso | 73 (47,7) | 27 (29,7) | 0,006 |
| FEVI inicial (%) | 35 [25-50] | 45 [35-55] | 0,003 |
| T-HT (min) | 80 [30-130] | 185 [117-272] | <0,001 |
| T-TO (min) | 300 [230-390] | 491 [401-598] | <0,001 |
| Coronariografía temprana | 84 (54,9) | 42 (46,2) | 0,14 |
| Analítica al ingreso: | |||
| pH en sangre arterial | 7,2 [7,1-7,3] | 7,2 [7,1-7,3] | 0,98 |
| Lactato en sangre arterial (mmol/l) | 6,0 [3,6-8,7] | 5,6 [3,5-7,9] | 0,49 |
| Glucosa (mg/dl) | 212 [180-318] | 239 [167-301] | 0,82 |
| Creatinina (mg/dl) | 1,2 [0,9-1,4] | 1,2 [0,9-1,5] | 0,14 |
| Etiología de la parada cardiaca | <0,001 | ||
| Infarto agudo de miocardio | 75 (49,0) | 47 (51,7) | |
| Cardiopatía estructural sin isquemia aguda | 24 (15,7) | 23 (25,3) | |
| Arritmia ventricular primaria | 13 (8,5) | 17 (18,7) | |
| Bloqueo auriculoventricular | 4 (2,6) | 0 | |
| Causa no cardiaca | 35 (22,8) | 4 (4,4) | |
| Desconocida | 2 (1,3) | 0 | |
FEVI: fracción de eyección del ventrículo izquierdo; T-HT: tiempo desde la reanudación de la circulación espontánea hasta el inicio de la hipotermia terapéutica; T-TO: tiempo desde la reanudación de la circulación espontánea hasta la temperatura objetivo.
Los valores expresan n (%) o mediana [intervalo intercuartílico].
Entre los pacientes con una causa no cardiaca (39 pacientes), había un grupo diverso de etiologías: 15 estaban relacionadas con trastornos hidroelectrolíticos graves (principalmente hipopotasemia), 9 se debían a insuficiencia respiratoria aguda de origen no cardiológico, 6 estaban relacionadas con una enfermedad cerebrovascular aguda (estos 6 pacientes fallecieron durante el ingreso), 6 se debían a una tromboembolia pulmonar extensa y, por último, en 3 pacientes la PCR extrahospitalaria se debió a una intoxicación con cocaína.
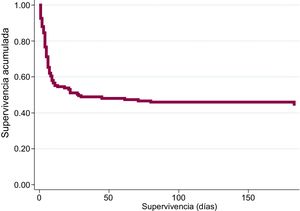
Durante el ingreso, fallecieron 129 de los 244 pacientes (52,9%): 81 (52,9%) del grupo de desarrollo y 48 (52,7%) del grupo de validación. La causa más frecuente de muerte fue el daño cerebral posanóxico (70,6%), seguido del shock cardiogénico (18,8%), las complicaciones infecciosas (5,9%) y otras causas (4,7%). Durante el periodo de seguimiento de 6 meses, fallecieron otros 4 pacientes (todos ellos del grupo de desarrollo). La supervivencia global a los 6 meses fue del 45,5% (el 44,4% del grupo de desarrollo y el 47,3% del de validación). En la figura 1 se muestra la supervivencia acumulada. Por lo que respecta a los resultados neurológicos a los 6 meses, 107 de los 111 supervivientes (96,4%) no presentaron secuelas neurológicas significativas (98 pacientes con CPC=1, y 9 pacientes con CPC=2), mientras que en 4 hubo un daño neurológico importante (3 pacientes con CPC=3 y 1 con CPC=4). Por grupos, 65 de los 68 supervivientes del grupo de desarrollo (95,6%) y 42 de los 43 supervivientes del grupo de validación (97,7%) no presentaron secuelas neurológicas importantes (figura 2).
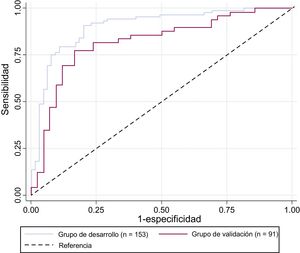
Modelo predictivoEn el grupo de desarrollo, 5 variables disponibles al ingreso mostraron una asociación con el resultado a los 6 meses (muerte o CPC> 2): ritmo cardiaco desfibrilable, edad, concentración de lactato, tiempo transcurrido hasta la RCE y diabetes (SALTED) (tabla 3). No se observaron interacciones significativas entre las diversas variables seleccionadas. Se elaboró una curva de características operativas del receptor (AUC, 0,90; intervalo de confianza del 95% [IC95%], 0,85-0,95) y se calculó la sensibilidad (79,6%) y la especificidad (84,6%) del modelo de predicción, con una tasa de resultados falsamente positivos del 12,5%. Este modelo demostró un buen ajuste con un valor de Hosmer-Lemeshow, de 0,97. Al aplicar este modelo de predicción al grupo de validación, la curva de características operativas del receptor mostró un AUC de 0,82 (IC95%, 0,73-0,91), con una sensibilidad del 73,5% y una especificidad del 78,6% (figura 3).
Variables disponibles al ingreso que muestran asociación independiente con un resultado desfavorable a los 6 meses (muerte o Pittsburgh Cerebral Performance Category> 2)
| ORa (IC95%) | p | |
|---|---|---|
| Ritmo no desfibrilable | 14,86 (3,96-55,79) | <0,001 |
| Edad (cada 1 año adicional) | 1,04 (1,01-1,07) | 0,02 |
| Concentración de lactato (cada 1 mmol/l adicional) | 1,31 (1,09-1,58) | 0,004 |
| Tiempo transcurrido hasta la reanudación de la circulación espontánea | 1,04 (1,00-1,08) | 0,03 |
| Diabetes mellitus | 4,30 (1,40-13,16) | 0,01 |
IC95%: intervalo de confianza del 95%; ORa: odds ratio ajustada.
Curvas de características operativas del receptor para el modelo predictivo empleando los grupos de desarrollo y de validación. Las curvas se basan en modelos de predicción de diagnóstico para el mal pronóstico a los 6 meses con 5 variables: ritmo cardiaco desfibrilable, edad, concentración de lactato, tiempo transcurrido hasta la reanudación de la circulación espontánea y diabetes (SALTED).
Aunque la fracción de eyección del ventrículo izquierdo al ingreso fue significativamente inferior en los pacientes con una peor evolución posterior (el 38,7 frente al 43,1%; p=0,01), esta variable se excluyó del modelo de regresión logística multivariable durante su desarrollo (selección de las variables mediante eliminación por pasos).
El modelo se diseñó para estimar el pronóstico a largo plazo (6 meses), pero un gran porcentaje de los pacientes fallecieron durante el ingreso hospitalario (52,9%), lo cual podría ser una importante fuente de error. En consecuencia, se aplicó el modelo también al subgrupo de pacientes que sobrevivieron hasta el alta del hospital (115 pacientes). Esta análisis mostró que el modelo mantenía una potencia diagnóstica suficiente, con un AUC de 0,86 (IC95%, 0,79-0,93) ( y ).
El análisis de la etiología de la parada cardiaca puso de manifiesto que los pacientes con una causa no cardiaca tenían una evolución mucho peor (CPC ≤ 2 a los 6 meses en el 12,8% en comparación con el 49,8% en los demás pacientes; p <0,001). Sin embargo, cuando se aplicó el modelo pronóstico propuesto al subgrupo de pacientes con causas no cardiacas, la curva de características operativas del receptor mantuvo un AUC de 0,86 (IC95%, 0,71-1,00). Se recalculó el modelo tras la exclusión de los pacientes con PCR de causa extracardiaca, siguiendo los mismos principios que se han descrito para el modelo principal (en este caso, con un grupo de desarrollo de 118 pacientes y un grupo de validación de 87 pacientes). Este subanálisis produjo unos resultados bastante similares a los del modelo principal, y se mantuvieron como factores predictivos pronósticos independientes las mismas variables. La principal diferencia fue que la variable «ritmo cardiaco no desfibrilable» pasó a ser mucho más relevante en la estimación del pronóstico: odds ratio ajustada=43,01 (IC95%, 39,43-47,08) frente a 14,86 (IC95%, 3,96-55,79) en el modelo principal. Las características de este modelo, así como su comportamiento en la validación externa (AUC, 0,84; IC95%, 0,75-0,93) cuando se aplicó al grupo de validación, se detallan en la .
DISCUSIÓNEl presente estudio, realizado en pacientes en coma ingresados tras una PCR extrahospitalaria y tratados con hipotermia terapéutica, describe y valida un modelo predictivo diseñado a partir de variables obtenidas al ingreso para estimar la probabilidad de supervivencia sin un daño neurológico importante a los 6 meses. La supervivencia total hasta el alta del hospital fue del 47%, mientras que la supervivencia acumulada con una buena evolución neurológica a los 6 meses fue del 44%. Estos datos coinciden con los de estudios publicados anteriormente que incluyeron a pacientes tratados con un abordaje tras la reanimación intensificado (que incluía control de temperatura y una coronariografía precoz si estaba indicado)4,5,7,13.
Se halló que 5 variables fácilmente valorables en los momentos iniciales tras la reanimación permiten estimar la probabilidad de supervivencia sin un daño neurológico importante a los 6 meses: ritmo cardiaco desfibrilable, edad, concentración de lactato, tiempo transcurrido hasta la RCE y diabetes. Dada la complejidad del cálculo del modelo predictivo basado en coeficientes de regresión logística multivariable, la estimación de la probabilidad de un resultado desfavorable en cada paciente individual puede resultar ardua en la práctica clínica, por lo que hemos diseñado una calculadora para teléfonos móviles basada en la aplicación de FileMaker Go denominada SALTED, que facilita este cálculo. El cálculo tan solo es posible si se conocen todos los ítems, y el resultado indica directamente la probabilidad estimada de tener una evolución desfavorable en cada paciente concreto.
Este no es el primer intento de diseñar un modelo para predecir el pronóstico tras la PCR extrahospitalaria22-32. Además existen modelos predictivos diseñados para otras enfermedades que también se han validado en el contexto del estudio de pacientes con PCR extrahospitalaria33. Sin embargo, otros modelos predictivos tienen diferentes limitaciones al aplicarlos en la evaluación temprana de los pacientes:
- •
En varios casos, se incluyó en los análisis a pacientes no tratados con control de temperatura24-27.
- •
Algunos modelos incluyen parámetros cuya determinación se ve impedida por la sedación necesaria en los primeros días22,24.
- •
En otros casos, los modelos utilizan parámetros que no se determinan en el momento del ingreso del paciente24,25.
- •
En algunos estudios, el objetivo fue predecir el resultado de la reanimación inicial (probabilidad de RCE en la puntuación RACA23 o probabilidad de muerte en los primeros momentos tras el ingreso en el hospital en la puntuación NULL-PLEASE29,31). Sin embargo, la mortalidad durante el ingreso de los pacientes con RCE continúa siendo muy alta (alrededor del 50%).
- •
En la mayor parte de ellos, la variable de valoración principal fue el estado neurológico al alta25,26,28, pero en los primeros meses siguientes al alta puede haber aún cierto grado de recuperación funcional con medidas como la rehabilitación, por lo que creemos que puede ser más apropiado considerar la situación una vez transcurridos los primeros 6 meses.
- •
Por último, algunos modelos no se han sometido a validación externa24,30,32, y por lo tanto es preciso aplicarlos con cautela.
En la tabla 4 se presentan las características de diferentes modelos aplicables a la evaluación pronóstica de los pacientes recuperados tras una PCR extrahospitalaria. Se debe tener precaución al generalizar los modelos que no han sido objeto de validación externa. Aunque la multitud de modelos existentes probablemente indique que no hay un modelo ideal, se debe tener en cuenta también, además de su potencia diagnóstica, su facilidad de uso en la práctica clínica diaria. A este respecto, se debe considerar el empleo de modelos que puedan calcularse a partir de una puntuación simple o con una calculadora diseñada específicamente para ello. Uno de los modelos más robustos y ampliamente utilizados es la puntuación CAHP26. Sin embargo, una limitación importante es que, de las 7 variables requeridas para su aplicación, 3 (tiempo desde el colapso hasta la asistencia vital básica, tiempo desde la asistencia vital básica hasta la RCE y dosis de adrenalina) pueden conllevar un importante grado de error, dadas las características de la asistencia inicial de estos pacientes.
Características de los diferentes modelos predictivos aplicables para la evaluación pronóstica de los pacientes que han sufrido una parada cardiaca
| Autor (puntuación) | Fecha de inclusión | Ubicación | Pacientes (muestra para el modelo), n | Diseño del estudio | Incluye a pacientes no tratados con control de temperatura | Variables | Resultado principal | Método de cálculo | Validación |
|---|---|---|---|---|---|---|---|---|---|
| Hayakawa et al.27 | 2005-2007 | Osaka, Japón | 862 | Estudio de cohorte prospectivo | Sí | 4: edad, tiempo hasta la RCE, presencia de RCE prehospitalaria, conversión a FV | CPC a 1 mes | Coeficientes de regresión | Validación externa |
| Grasner et al.23(puntuación RACA) | 1998-2008 | Multicéntrico, Alemania | 5.471 | Estudio de cohorte prospectivo | No procede | 8: sexo, edad ≥ 80 años, presenciado, asistolia, ubicación, etiología presumible, RCP por testigo presencial, tiempo hasta la llegada de profesionales | Probabilidad de RCE | Puntuación (ecuación) | Validación externa |
| Aguila et al.32 | Enero de 2005-diciembre de 2008 | Rochester, Estados Unidos | 80 | Estudio de cohorte retrospectivo | No | 5: FV como forma de presentación, uso de ácido acetilsalicílico antes de la parada cardiaca, RCE <20 min, ausencia de enfermedad coronaria, función renal conservada | Supervivencia hasta el alta hospitalaria | Coeficientes de regresión | No realizado |
| Albaeni et al.25(puntuación de PCR extrahospitalaria) | 2004-2010 | Baltimore, Estados Unidos | 96 | Estudio de cohorte retrospectivo | Sí | 3: FV como forma de presentación, RCE ≤ 20 min, puntuación de reflejos de tronco encefálico ≥ 3 en un plazo de 24 h | CPC al alta del hospital | Puntuación | Validación interna |
| Kiehl et al.28(puntuación C-GRApH) | 2008-2012 | Cleveland, Estados Unidos | 122 | Estudio de cohorte retrospectivo | No | 5: (C): enfermedad arterial coronaria conocida antes de PCR extrahospitalaria; (G): glucosa ≥ 200 mg/dl; (R): ritmo de parada distinto de la taquicardia/fibrilación auricular; (A): edad> 45 años; (pH): pH arterial ≤ 7,0 | CPC al alta del hospital | Puntuación | Validación externa |
| Maupain et al.26(puntuación CAHP) | Mayo de 2011-diciembre de 2012 | Paris, Francia | 819 | Estudio de cohorte prospectivo | Sí | 7: edad, ritmo cardiaco no desfibrilable, tiempo desde el colapso hasta el AVB, tiempo desde el AVB hasta la RCE, ubicación del paro cardiaco, dosis de adrenalina y pH arterial | CPC al alta del hospital | Puntuación (nomograma) | Validación externa con una cohorte retrospectiva y una prospectiva |
| Youn et al.24 | Abril de 2010-junio de 2013 | Seúl, Corea del Sur | 331 | Estudio de cohorte retrospectivo | Sí | 2: exploración neurológica inicial (puntuación FOUR o PCAP), patrones de EEG malignos (registro continuo de 48 h) | Supervivencia hasta el alta hospitalaria | Coeficientes de regresión | No realizado |
| Martinell et al.30(puntuación de riesgo de control de temperatura) | Noviembre de 2010-julio de 2013 | Multicéntrico, Europa y Australia | 933 | Estudio de cohorte retrospectivo | No | Edad, parada cardiaca en el domicilio, primer ritmo, duración de ausencia de flujo, tratamiento con adrenalina, reflejos pupilares/corneales, pH, puntuación motora de GCS, PaCO2 (al ingreso) | CPC a los 6 meses | Puntuación | Validación interna |
| Ahmad et al.29(puntuación NULL-PLEASE) | 2014 | Birmingham, Reino Unido | 56 | Estudio de cohorte retrospectivo | No procede | Ritmo no desfibrilable, parada no presenciada, largo periodo de «flujo lento», pH (< 7,2), lactato (> 7), insuficiencia renal terminal en diálisis, edad (> 85 años), RCP aún en curso, causa no cardiaca | Supervivencia temprana en el hospital | Puntuación | Validación externa31 |
| Otani et al.33(puntuación GRACE para PCR extrahospitalaria)a | Octubre de 2009-octubre de 2015 | Osaka, Japón | 91 | Estudio de cohorte retrospectivo | Sí | 8: edad, frecuencia cardiaca, presión arterial sistólica, clase de Killip, creatinina, desviación del segmento ST, en parada cardiaca al ingreso, troponina elevada | Supervivencia y resultado neurológico al alta del hospital | Coeficientes de regresión con calculadora específica | No procede |
| Pérez-Castellanos et al.b(SALTED) | Enero de 2007-julio de 2015 | Multicéntrico, España | 153 | Estudio de cohorte prospectivo | No | 5: ritmo cardiaco desfibrilable, edad, lactato al ingreso, tiempo hasta la RCE, diabetes | CPC a los 6 meses | Coeficientes de regresión con calculadora específica | Validación externa |
AVB: asistencia vital básica; CAHP: Cardiac Arrest Hospital Prognosis; CPC: Pittsburgh Cerebral Performance Category; EEG: electroencefalograma; FOUR: Full Outline of UnResponsiveness; FV: fibrilación ventricular; GCS: escala de coma de Glasgow; GRACE: Global Registry of Acute Coronary Events; PaCO2: presión parcial de dióxido de carbono en sangre arterial; PCAP: gravedad del estado posterior a parada cardiaca; PCR: parada cardiorrespiratoria; RACA: RCE después de parada cardiaca; RCE: reanudación de la circulación espontánea; RCP: reanimación cardiopulmonar.
Se cree que este modelo tiene varias ventajas: a) se realizó empleando a pacientes tratados con un abordaje tras la reanimación intensificado (que incluye control de temperatura y una coronariografía precoz cuando está indicada); b) SALTED utiliza solamente variables de fácil acceso tras una parada cardiaca; c) este modelo se ha validado externamente, y d) se ha diseñado una calculadora para facilitar la estimación.
Puntos fuertes y limitacionesEl modelo predictivo se obtuvo con datos de 153 pacientes tratados en 2 hospitales y posteriormente ha sido objeto de una validación externa en un segundo grupo de 91 pacientes ingresados en un tercer hospital. Aunque hubo diferencias significativas entre los pacientes de los 2 grupos, el modelo conservó una alta potencia diagnóstica.
Recientemente se ha descrito la utilidad del análisis espectral de los registros de fibrilación en la evaluación pronóstica de estos pacientes34. Este parámetro tiene también la ventaja de estar disponible al ingreso del paciente, si bien no se ha evaluado en el análisis, puesto que el presente estudio incluye a pacientes con ritmos cardiacos desfibrilables y no desfibrilables.
Probablemente la limitación más importante de este estudio sea la tasa relativamente alta de resultados falsamente positivos (12,5%) en un modelo que tiene como objetivo determinar qué pacientes tendrán un resultado desfavorable, lo cual hace que el modelo pueda clasificar a unos pocos pacientes erróneamente como pacientes de mal pronóstico, cuando su recuperación a los 6 meses podría ser buena. No obstante, es importante resaltar que esta estimación no debe tomarse como una conclusión definitiva respecto al estado neurológico del paciente, sino solo como una información adicional para facilitar la toma de decisiones inicial y como apoyo para informar a los familiares. El estudio se llevó a cabo en 3 centros académicos grandes, por lo que es posible que los resultados no sean generalizables a otros hospitales. Por consiguiente, serán necesarios nuevos estudios en poblaciones diferentes, para contrastar este modelo. Otra limitación es la dificultad de obtener una información precisa respecto al momento en el que se ha producido la parada cardiaca, el inicio de la reanimación y su duración, ya que esta información procede de los servicios de emergencias médicas prehospitalarios y de los testigos presenciales. En los supervivientes tras una parada cardiaca presenciada (el 91% de los pacientes de la base de datos), el tiempo hasta la RCE constituye una buena estimación de la duración de la parada circulatoria, mientras que en los pacientes con una parada cardiaca no presenciada, es posible que subestime la duración real del tiempo de parada.
CONCLUSIONESUn modelo predictivo basado en 5 variables clínicas y fácilmente valorables al ingreso (ritmo desfibrilable, edad, concentración de lactato, tiempo transcurrido hasta la RCE y diabetes [SALTED]) puede ser útil para predecir la probabilidad de supervivencia sin un daño neurológico importante tras la PCR extrahospitalaria.
FINANCIACIÓNFinanciado en parte por el Ministerio de Ciencia e Innovación de España (Red RIC, PLE2009-0152), el Fondo de Investigaciones Sanitarias de España (PI14/00857) y la Sociedad Española de Cardiología (subvenciones de investigación clínica de 2015).
CONFLICTO DE INTERESESNo se declara ninguno.
- –
Los pacientes inconscientes tras sobrevivir a una PCR extrahospitalaria tienen un riesgo elevado de muerte o de mala evolución neurológica.
- –
El daño neurológico es frecuente y desempeña un papel clave en la limitación del pronóstico de estos pacientes.
- –
Aunque se recomienda la control de temperatura para mejorar el pronóstico, esta también limita el papel de la exploración neurológica y hace que la determinación del pronóstico en los momentos iniciales tras la reanimación sea una tarea difícil.
- –
SALTED es un modelo predictivo basado en 5 variables clínicas fácilmente valorables al ingreso (ritmo cardiaco desfibrilable, edad, concentración de lactato, tiempo transcurrido hasta la RCE y diabetes) que puede aportar una información complementaria para ayudar en la toma de decisiones iniciales para los pacientes que sobreviven a una PCR extrahospitalaria y puede servir de apoyo para informar a sus familiares.