Un tercio de los pacientes con miocardiopatía dilatada no isquémica (MCDNI) mueren de muerte súbita (MS). Las guías actuales recomiendan el uso de desfibrilador automático implantable (DAI) en pacientes con MCDNI e insuficiencia cardiaca (IC) sintomática y FEVI = 35%. Sin embargo, si bien la evidencia del beneficio pronóstico es clara para los pacientes con etiología isquémica, los resultados no son tan consistentes para el grupo de origen no coronario. Los resultados del estudio DANISH (Danish Study to Assess the Efficacy of ICDs in Patients With Non-Ischemic Systolic Heat Failure on Mortality) indican que el DAI en pacientes con MCDNI no aumenta la supervivencia. Hasta ahora, la fracción de eyección del ventrículo izquierdo y la clase funcional de la New York Heart Association han sido los marcadores utilizados para seleccionar a los pacientes con MCDNI candidatos a DAI en prevención primaria. Actualmente se dispone de nuevos fármacos que podrían proporcionar una mayor reducción del riesgo de MS y marcadores alternativos más específicos para una aproximación más precisa al riesgo de los pacientes. En este capítulo, se revisan y discuten los trabajos que han evaluado el uso del DAI en pacientes con MCDNI y se analiza el uso de marcadores de riesgo, clásicos y emergentes. Finalmente se aporta una propuesta futura para la estratificación individualizada del riesgo de MS.
Información sobre el suplemento: este artículo forma parte del suplemento titulado «Controversias para una nueva era en el tratamiento de la insuficiencia cardiaca», que ha sido patrocinado por Novartis.
Palabras clave
La miocardiopatía dilatada no isquémica (MCDNI) es, después de la cardiopatía isquémica, una de las principales causas de muerte súbita junto con los trastornos eléctricos primarios1, y las arritmias ventriculares son su principal causa desencadenante2.
Un 35% de los pacientes con MCDNI fallecen de muerte súbita (MS)3. El tratamiento con DAI es actualmente la principal herramienta para la prevención de MS en pacientes con alto riesgo, y por ello las guías de práctica clínica, tanto europeas como americanas, recomiendan el implante de un desfibrilador automático implantable (DAI) en prevención primaria en pacientes con miocardiopatía dilatada que, tras un tratamiento médico optimo (TMO), presentan sintomas en clase funcional de la New York Heart Association (NYHA) II.III y fraccion de eyeccion del ventriculo izquierdo (FEVI) reducida (recomendacion de clase I)4,5. Sin embargo, es conocido que la evidencia que justifica el beneficio es mas consistente en los pacientes con etiologia isquemica que en la MCDNI, lo cual se refleja en el nivel de recomendacion que se establece en la propia guia europea de insuficiencia cardiaca (IC), clase I nivel A, para los pacientes con cardiopatia isquemica (datos procedentes de multiples ensayos clinicos aleatorizados o metanalisis) y clase I nivel B en el caso de la MCDNI (datos procedentes de un unico ensayo clinico aleatorizado o de grandes estudios no aleatorizados).
Por otra parte, la publicación de las guías de práctica clínica actuales fue previa a la publicación del estudio DANISH3, por lo que, a la hora de establecer las recomendaciones, no se consideraron los resultados de este trabajo. En él, como se analiza más adelante, se cuestiona la indicación de DAI en prevención primaria en pacientes con MCDNI.
DAI EN PREVENCIÓN PRIMARIA EN LA MCDNI: ¿LA INDICACIÓN ACTUAL ESTÁ JUSTIFICADA POR LA EVIDENCIA?Son muchos los trabajos de investigación que han evaluado la utilidad del DAI en prevención primaria en el grupo de pacientes con MCDNI. En la tabla 1 se resumen el diseño, las características y los resultados de los 5 principales ensayos clínicos clásicos que han servido para sustentar la indicación de las guías junto con las características del más reciente estudio DANISH3.
Principales ensayos clínicos que han evaluado el uso del DAI en pacientes con MCDNI
| CAT | AMIOVIRT | DEFINITE | COMPANION | SCD-HeFT | DANISH | |
|---|---|---|---|---|---|---|
| Pacientes totales/MCDNI | 104/100 | 103/100 | 458/100 | 1.520/682 | 2.521/792 | 1.116/1.116 |
| Año | 2002 | 2003 | 2004 | 2004 | 2005 | 2016 |
| Criterios de inclusión | FEVI ≤ 30%, NYHA II-III | FEVI ≤ 35%, NYHA I-III, TVNS | FEVI ≤ 35%, NYHA II-III, EV o TVNS | FEVI ≤ 35%, NYHA III-IV, QRS > 120 ms | FEVI ≤ 35%, NYHA II-III | FEVI ≤ 35% NYHA II-III (IV si TRC) NT-proBNP > 200 pg/ml |
| Diseño | DAI frente a TMO | DAI frente a TMO | DAI frente a amiodarona | TMO frente a TRC-P frente a TRC-D | DAI frente a amiodarona frente a TMO | DAI frente a TMO |
| Objetivo primario | Mortalidad total | Mortalidad total | Mortalidad total | Mortalidad total/ hospitalización | Mortalidad total | Mortalidad total |
| Tratamiento médico | IECA, 94% BB, 4% ARM, — | IECA, 85% BB, 51,5% ARM, 20% | IECA, 97% BB, 86% ARM, — | IECA, 89% BB, 67% ARM, 55% | IECA, 94% BB, 69% ARM, 20% | IECA, 96% BB, 92% ARM, 59% |
| Resultado principal | DAI no reduce mortalidad (p = 0,5) | DAI no reduce mortalidad (p = 0,8) | Reducción del RR un 35% a favor del DAI (p = 0,08) | Reducción del RR un 36% con DAI-TRC (p = 0,001) | Reducción del RR un 23% a favor del DAI (p = 0,007) | DAI no reduce mortalidad total (p = 0,28). Reducción del 50% del RR de muerte súbita (p = 0,005) |
ARM: antagonistas del receptor de mineralocorticoides; BB: bloqueadores beta; DAI: desfibrilador automático implantable; EV: extrasístoles ventriculares; FEVI: fracción de eyección del ventrículo izquierdo; IECA: inhibidores de la enzima de conversión de la angiotensina; MCDNI: miocardiopatía dilatada no isquémica; NR‐proBNP: fracción N‐terminal del propéptido natriurético cerebral; NYHA: New York Heart Association; RR: riesgo relativo; TMO: tratamiento médico óptimo; TRC‐D: terapia de resincronización cardiaca-desfibrila‐ dor; TRC‐P: terapia de resincronización cardiaca-pacing; TVNS: taquicardia ventricular no sostenida. Elaboración propia.
Es destacable que la mayoría de la evidencia científica generada en este campo se ha desarrollado durante un periodo corto de 4 años (de 2002 a 2005) y con una separación de 15 años del estudio DANISH.
Al analizar aspectos interesantes en cuanto al diseño, se observa que los primeros 3 trabajos, CAT6, AMIOVIRT7 y DEFINITE8 tienen un tamaño muestral pequeño (CAT, n = 104; AMIOVIRT, n = 103; DEFINITE, n = 458). Estos estudios iniciales se siguieron de ensayos clínicos multicéntricos, el estudio SCD-HeFT9 y COMPANION10, que incluyeron muestras más grandes. Estos 2 últimos no fueron, sin embargo, trabajos diseñados exclusivamente para pacientes con MCDNI, sino que se trata de estudios mixtos, que incluyeron a pacientes pacientes con y sin enfermedad coronaria, y en ambos trabajos más de la mitad de los pacientes tenían una miocardiopatía dilatada de origen isquémico, por lo que a la hora de considerar sus resultados se estaría realmente ante un análisis de subgrupo.
Si se analiza cada uno de los trabajos en cuanto a resultados, el CAT y el AMIOVIRT no consiguieron demostrar beneficio del DAI en reducción de mortalidad total, posiblemente por unas tasas de mortalidad muy bajas en el grupo de control. El estudio DEFINITE tampoco demostró diferencias significativas en mortalidad total, aunque sí en MS (hazard ratio [HR] = 0,20; intervalo de confianza del 95% [IC95%], 0,06-0,71; p = 0,006). Valorando los ensayos clínicos de mayor tamaño muestral, en el caso del COMPANION, sí se demostró una reducción de la mortalidad total en el grupo de intervención frente al TMO; sin embargo, la intervención no era exclusivamente con DAI, sino con DAI-terapia de resincronización cardiaca (TRC), por lo que tampoco se puede extrapolar los resultados a la población con DAI solo. En el caso del estudio SCD-HeFT, trabajo que posiblemente terminó de asentar la indicación en las guías, se demostró una reducción del 23% del riesgo relativo (RR) en la mortalidad por cualquier causa a los 5 años de seguimiento; sin embargo, cuando se evaluaron los resultados de este objetivo primario exclusivamente en el subgrupo de pacientes con MCDNI, no se consiguió alcanzar la significación estadística (HR = 0,73; IC95%, 0,50-1,07; p = 0,06).
Finalmente, otro aspecto destacable es que, al tratarse de estudios antiguos, los pacientes no tenían tasas adecuadas de TMO (sobre todo de bloqueadores beta e inhibidores del receptor de mineralocorticoides) y tampoco se disponía de nuevos fármacos con los que se cuenta en el arsenal terapéutico actual, como sacubitrilo-valsartán, de los que se han demostrado mejoría pronóstica y un efecto protector contra las arritmias ventriculares11.
Por lo tanto, teniendo en cuenta este contexto de ensayos clínicos que respaldan la evidencia actual sobre la indicación de DAI en prevención primaria para pacientes con MCDNI, que se puede resumir en estudios antiguos, pequeños o mayores pero mixtos, sin tratamiento adecuadamente optimizado y que no demuestran de manera firme el beneficio del DAI en esta población de pacientes no isquémicos, surge la necesidad, más de una década después, de desarrollar un nuevo ensayo clínico que replantee la utilidad del DAI en estos pacientes y, en este contexto se publicó en 2016 el estudio DANISH3.
El estudio DANISH aleatorizó a 1.116 pacientes, todos con MCDNI y FEVI ≤ 35% y sintomática (NYHA II‐IV) a implante de DAI frente a TMO, con un objetivo primario de mortalidad total. Como objetivos secundarios se incluyeron la MS y la muerte cardiovascular. Tras un periodo de seguimiento medio de 67,6 meses, no se consiguió demostrar reducción de mortalidad total ni de mortalidad cardiovascular en el grupo de DAI, a pesar de que sí se redujo de forma contundente y estadísticamente significativa la MS (el 4,3% en el grupo de DAI y el 8,2% en el grupo de control; HR = 0,5; IC95%, 0,31-0,82; p = 0,005). En el análisis de subgrupos destacó una interacción clara de la mortalidad total con la edad, ya que fue significativamente más baja en los pacientes del grupo de DAI menores de 68 años (HR = 0,64; IC95%, 0,45-0,9; p = 0,01), especialmente entre los menores de 59 años.
Entre los principales argumentos que explican estos hallazgos, se puede considerar los bajos riesgos de MS (el 8,2% anual) y de otras causas de mortalidad cardiovascular (el 8,8% anual), lo cual hace difícil que un tratamiento adicional como el DAI, dirigido a reducir la MS arrítmica, pueda demostrar un beneficio en reducción de la mortalidad total.
La publicación de estos resultados ha supuesto una auténtica revolución que hace necesario replantear la indicación actual del DAI y su indicación en guías clínicas.
¿LOS RESULTADOS DEL ESTUDIO DANISH DEBERÍAN CAMBIAR LA INDICACIÓN DE DAI EN PREVENCIÓN PRIMARIA EN LAS GUÍAS?Esta ha sido una de las principales cuestiones de debate desde que se conocieron los datos del DANISH. Incluso en un editorial posterior al estudio, en el que se comentaba la publicación de la guía europea de IC de 2016, se postulaba que estos resultados supondrían un cambio drástico en la indicación de DAI12, pero en la guías americanas publicadas posteriormente, tanto en la de arrítmias ventriculares y prevención de la MS13 como en la actualización americana de la guía de IC14, se ha mantenido una indicación similar. Es cierto que estas últimas guías reflejan una serie de matices o puntualizaciones que desescalan el nivel de evidencia pero, pese a ello, la indicación general se mantiene sin grandes cambios respecto a la establecida antes del DANISH y continúan recomendando el DAI en prevención primaria para pacientes con IC y MCDNI con FEVI ≤ 35% a pesar de TMO (I A)14.
Sin embargo, más recientemente, en el documento de consenso publicado por la Heart Failure Association (HFA) en 201915, que supone una actualización de la guía europea de IC previa, sí se recogen los resultados del DANISH para hacer una recomendación práctica y se señala que se puede considerar no implantar un DAI en prevención primaria para pacientes con IC y MCDNI de edad avanzada (> 70 años), en NYHA III-IV o con comorbilidades graves que impliquen corta expectativa de vida, ya que la probabilidad de que estos pacientes mueran de MS es mucho menor que por otras causas.
El motivo fundamental por el cuál en las últimas guías americanas no haya variado de forma sustancial la indicación de DAI tras el estudio DANISH posiblemente sea la publicación de varios metanálisis16.18 posteriores, con resultados heterogéneos entre ellos, pero que en general siguen demostrando una reducción de la mortalidad total y la MS en el grupo de DAI frente a TMO.
Sin embargo, es importante analizar la composición y las características de estos metanálisis, en los que se agruparon los datos de todos los estudios clásicos mencionados más los resultados del estudio DANISH, de manera que se debe ser cautelosos a la hora de interpretar sus resultados, ya que podrían ser el residuo de agrupar los datos de varios de estos estudios, con las limitaciones previamente comentadas, junto con el DANISH.
Otro aspecto que es necesario tener en cuenta a la hora de valorar la utilidad del DAI en prevención primaria es el tratamiento que recibe el grupo de control, no solo en cuanto al mayor o menor uso y a las dosis alcanzadas de los fármacos clásicos empleados con beneficio pronóstico demostrado en este perfil de pacientes (inhibidores de la enzima de conversión de la angiotensina [IECA], antagonistas del receptor de la angiotensina II [ARA-II], bloqueadores beta, antagonistas del receptor de mineralocorticoides), sino que hay que tener en cuenta que en ninguno de los estudios clásicos descritos, incluido el más reciente DANISH, se contaba con fármacos actuales como sacubitrilo‐valsartán, con el que se ha demostrado una mejoría pronóstica adicional en estos pacientes y, además, parece tener impacto en la reducción de arritmias ventriculares y MS11, lo cual nos lleva a una nueva reflexión.
¿TENEMOS NUEVAS OPCIONES FARMACOLÓGICAS PARA REDUCIR EL RIESGO DE MUERTE SÚBITA DE LOS PACIENTES CON IC Y FEVI REDUCIDA?En los últimos años y, de manera más significativa en las últimas 2 décadas, hemos asistido a una reducción progresiva de la MS en los pacientes con IC y FEVI reducida, como resultado del beneficio acumulado de los diferentes tratamientos. Se ha pasado de tasas de MS en la población de estudios más antiguos —como el RALES19 con espi- ronolactona— del 6,5% anual a tasas del 3,3% anual en el reciente ensayo clínico PARADIGM20 con sacubitrilo-valsartán. En el trabajo de Li Shen et al.21, con más de 40.000 pacientes con IC y FEVI reducida portadores de DAI, se observó una reducción de las tasas de MS en pacientes ambulatorios del 44% en 19 años (desde 1995 hasta 2014), resultados acordes con el beneficio pronóstico acumulado con estos fármacos (IECA, ARA-II, bloqueadores beta y antagonistas del receptor de mineralocorticoides).
Más recientemente, la combinación de tratamiento con sacubitrilo y valsartán ha supuesto una mayor reducción del riesgo de MS comparado con el enalapril11. Sacubitrilo-valsartán es un complejo supramolecular con un mecanismo de acción que afecta a varias vías biológicas. Una de ellas es la inhibición del sistema renina-angiotensina-aldosterona (SRAA), con los beneficios conocidos que se obtienen al contrarrestar la hiperactivación compensadora de este eje en IC; la segunda vía es la inhibición de la neprilisina, que supone una inhibición de la degradación de péptidos natriuréticos, que aumentan en sangre. El aumento de péptidos natriuréticos conlleva una serie de efectos cardioprotectores: vasodilatación, natriuresis y reducción de la fibrosis, hipertrofia e inflamación. Todo ello implica una reducción del sustrato (fibrosis) para el desarrollo de arritmias ventriculares y una reducción del estrés de la pared22. Esto se ha evaluado en estudios preliminares y observacionales que han demostrado que la inhibición del SRAA junto con la inhibición de la vía de la neprilisina, comparado con la inhibición exclusivamente del SRAA, supone una mayor reducción del remodelado cardiaco y de la fibrosis23, que es uno de los marcadores de riesgo de arritmias ventriculares más reconocidos.
Como consecuencia de esta reduccion de la MS demostrada con sacubitrilo-valsartan11, tanto la guia europea5 como la americana14 han incluido su uso con indicacion de clase I A para la reduccion de las arritmias ventriculares y la MS en pacientes con IC y FEVI reducida. Posteriormente, nuevos estudios de investigacion han intentado profundizar en estos hallazgos y valorar el impacto del tratamiento con sacubitrilo-valsartan en la MS y su mecanismo. De Diego et al.24 encontraron en 120 pacientes con IC y FEVI reducida sintomaticos, portadores de DAI y con monitorizacion a distancia que sacubitrilovalsartan es superior en la reduccion de las arritmias ventriculares y choques apropiados comparado con el tratamiento previo con IECA o ARA.II. Aunque no se trata de un ensayo aleatorizado, sus resultados indican que el farmaco podria tener un efecto antiarritmico, bien directo, bien a traves de la modulacion del remodelado cardiaco y el sistema neurohormonal. Esto se ha confirmado con los resultados recientemente publicados del estudio PROVE-HF, con 794 pacientes con IC y FEVI reducida tratados con sacubitrilo-valsartan, en el que se ha demostrado que el farmaco mejora todos los parametros de remodelado (FEVI, volumenes ventriculares, volumen de la auricula izquierda y relacion e/e'), con un seguimiento a 1 ano25. Estos datos justifican el efecto en la reducción de eventos cardiovasculares y la muerte súbita demostrados previamente con sacubitrilo-valsartán.
Otro aspecto importante que no se puede dejar de reflejar y que hay que tener en cuenta en la balanza a la hora de decidir si se implanta o no un DAI es lo relacionado con la seguridad del dispositivo, las complicaciones y los costes asociados. Aunque son mucho menos frecuentes que en la década previa, la incidencia de choques inapropiados se asocia con mayor morbimortalidad y peor calidad de vida3. Las infecciones asociadas con el dispositivo están presentes hasta en un 4,9% de los casos3, y además todo ello supone un aumento del coste sanitario.
Teniendo en cuenta todo lo anteriormente expuesto, se puede resumir en:
- •
Evidencia científica cuestionada del beneficio del DAI en prevención primaria en la reducción de la mortalidad total de los pacientes con MCDNI.
- •
Una importante y progresiva reducción de la MS en los últimos años con la suma de los beneficios pronósticos de los fármacos clásicos.
- •
Reducción adicional y superior que con el enalapril de la MS con sacubitrilo-valsartán (cuyo efecto además no se consideró en los estudios clásicos).
- •
Posibles efectos adversos y complicaciones con el uso del desfibrilador.
- •
Costes.
Con todo ello, el umbral de beneficio del DAI queda mucho más reducido y es necesario ser más selectivos a la hora de determinar qué pacientes son los que tendrán mayor riesgo de MS y, por lo tanto, más se van a beneficiar del tratamiento con DAI. Esto lleva a la necesidad de buscar estrategias que permitan hacer una mejor aproximación a la estratificación del riesgo de los pacientes.
¿CÓMO SE ESTRATIFICA EL RIESGO DE MUERTE SÚBITA EN LA MCDNI?La MCDNI está constituida por un grupo heterogéneo de enfermedades en las que el beneficio del DAI depende del riesgo individual de MS.
Estan disponibles diferentes marcadores que permiten una aproximacion a este riesgo. Los marcadores clasicos mas usados, que son los indicados en las guias de practica clinica para discriminar el riesgo de MS y tomar la decision de implantar un DAI, son la clase funcional medida con la escala de la NYHA y la FEVI. Sin embargo, estos parametros no son buenos marcadores del riesgo del paciente, pues la clase funcional se relaciona mas con el riesgo de muerte no subita y la FEVI tiene poca sensibilidad y especificidad para identificar adecuadamente el riesgo de los pacientes3. De los pacientes con DAI que tenian una FEVI ≤ 35% y miocardiopatia dilatada, el 80% no tuvo ninguna intervencion para arritmias ventriculares durante un periodo de seguimiento de 5 anos26.
Para mejorar la aproximación al riesgo de los pacientes, se han desarrollado diferentes calculadoras de riesgo, como el modelo de Seattle (Seattle Heart Failure Model27), validado en múltiples cohortes, que intenta mejorar la predicción del riesgo de MS con un modelo multivariable que incluye variables clínicas, FEVI, datos de laboratorio y tratamientos, entre otras.
Actualmente hay evidencia científica disponible que posiciona nuevos marcadores (biomarcadores, de imagen, de inestabilidad eléctrica, moleculares…) como mejores predictores del riesgo de MS que, por lo tanto, se debe conocer e incorporar a la hora de realizar la evaluación del riesgo de los pacientes.
- •
Biomarcadores.Varios biomarcadores se han asociado con estrés miocárdico y fibrosis, como el péptido natriurético cerebral, la troponina troponina, la galectina-3 y el ST-2 soluble. Algunos de estos marcadores se han relacionado mas con la muerte no subita por disfuncion cardiaca que con la muerte arritmica; de hecho, en el analisis por subgrupos del DANISH3, los pacientes con DAI y valores de NT.pro-BNP > 1.177 pg/ml tuvieron una mortalidad por cualquier causa similar a la del grupo de control. Otros trabajos si han postulado una clara asociacion entre concentraciones de ST2 aumentadas y MS y han demostrado que la combinacion de ST2 elevado con NT.proBNP elevado es la estrategia que mejor predice la MS28.
- •
Marcadores electrocardiográficos de inestabilidad eléctrica.Se han evaluado diferentes marcadores de inestabilidad eléctrica como predictores del riesgo de MS, entre los que destacan la duración del QRS, el QRS fragmentado, la alternancia de la onda T, el bloqueo de rama izquierda, la variabilidad de la frecuencia cardiaca y la taquicardia ventricular no sostenida. De ellos, los marcadores con mayor evidencia y más prometedores en cuanto a la predicción del riesgo son los QRS fragmentados y la alternancia de la onda T29.
- •
Marcadores genéticos.De entre todas las mutaciones relacionadas con la aparición de la miocardiopatía dilatada, la mutación en la lamina A/C (LMNA) confiere peor pronóstico y mayor riesgo de MS que otras formas de cardiomiopatía30. Otros genes asociados con un riesgo aumentado son mutaciones en el gen PLN31 y mutaciones o truncamientos en el gen de la filamina31 (FLNC).
- •
Marcadores de cardiorresonancia.La identificación de fibrosis miocárdica por la presencia de realce tardío de gadolino en la resonancia cardiaca posiblemente sea uno de los marcadores de riesgo más consolidados. Múltiples estudios33,34 han demostrado una fuerte asociación entre la presencia y el grado de fibrosis miocárdica y el riesgo de arritmias ventriculares. En un metanálisis de 9 estudios con 1.488 pacientes con miocardiopatía dilatada, la presencia de realce tardío aumentó el riesgo de MS o arritmias ventriculares frente al grupo de control sin gadolinio35 (odds ratio [OR] = 5,32; p < 0,00001). En la MCDNI, la presencia de realce tardío medioventricular se ha asociado con mayor riesgo de arritmias y MS36 incluso en pacientes con FEVI > 40%. La GPC vigente14 respalda el uso de cardiorresonancia en pacientes con miocardiopatías no isquémicas específicas como la sarcoidosis, para guiar la toma de decisiones en el implante de DAI. Otra técnica emergente dentro de las técnicas de imagen con cardiorresonancia es el mapeo T1, que proporciona una evaluación cuantitativa de la fibrosis difusa. Recientemente Chen et al.37 mostraron, en una población de 130 pacientes con IC y FEVI reducida con DAI, que la fibrosis intersticial difusa evaluada con mapeo T1 antes de implantar el DAI predice las descargas apropiadas durante el seguimiento. Por lo tanto, estos hallazgos respaldan la utilización de cardiorresonancia para la estratificación del riesgo de MS, especialmente en aquellos con función sistólica límite o no reducida (FEVI > 40%).
- •
Medicina nuclear.La activación sostenida del sistema nervioso simpático en la IC es un factor que contribuye a la progresión de la enfermedad y al aumento de eventos adversos, incluida la MS. La determinación del estado de inervación simpática mediante técnicas no invasivas de medicina nuclear con metayodobencilguanidina (MIBG) con 123I se perfila como un nuevo marcador de riesgo de arritmias ventriculares y MS en pacientes con IC y FEVI reducida38,39.
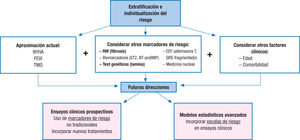
Para terminar, teniendo en cuenta toda esta información e intentando responder a la pregunta ¿a qué pacientes indicar un DAI en la actualidad?, la respuesta más razonable posiblemente sea que no a todos, sino que, por una parte, es necesario contar con la mayor reducción del riesgo de MS que aportan nuevos fármacos como sacubitrilo-valsartán (que posiblemente estreche aún más el umbral de beneficio del DAI) y, por otra, es fundamental hacer una adecuada estratificación del riesgo individual del paciente, teniendo en cuenta no solamente marcadores clásicos como la clase funcional o la FEVI, sino otros nuevos, tanto emergentes como con evidencia consolidada (figura 1), entre los que destacan la identificación de fibrosis por resonancia o determinadas mutaciones como la de la lamina.
El futuro en este campo posiblemente esté orientado al desarrollo de estudios multicéntricos y prospectivos que incorporen todos estos marcadores para una mejor aproximación al riesgo, con el objetivo de crear modelos estadísticos para desarrollar escalas de riesgo multivariables que ayuden a perfilar mejor el riesgo individual de cada paciente.
CONCLUSIONESLas arritmias ventriculares son una complicación frecuente y grave en pacientes con MCDNI. El DAI es actualmente el principal tratamientopara la prevención de la MS. El estudio DANISH ha cuestionado el beneficio de esta terapia en prevención primaria en pacientes con MCDNI y disfunción ventricular y posiblemente la principal enseñanza que transmite este trabajo es que se debe evitar la indicación generalista y basar la decisión del implante del dispositivo en una adecuada estratificación e individualización del riesgo de los pacientes, incorporando a los marcadores de riesgo clásicos la información de nuevos y mejores marcadores que permitan establecer una aproximación más precisa al riesgo de los pacientes.
CONFLICTO DE INTERESESC. Ortiz declara que ha recibido honorarios por desarrollo de ponencias de Novartis.
CONCLUSIONESAunque los avances en el tratamiento de la cardiopatía isquémica han conseguido que mejore el pronóstico de esta enfermedad en las últimas décadas, no se debe escatimar esfuerzos a la hora de conseguir el objetivo de reducir la morbimortalidad de las enfermedades cardiovasculares.
INFORMACIÓN SOBRE EL SUPLEMENTOEste artículo forma parte del suplemento titulado «Controversias para una nueva era en el tratamiento de la insuficiencia cardiaca», que ha sido patrocinado por Novartis.