La insuficiencia cardiaca secundaria al tratamiento del cáncer continúa siendo una causa significativa de morbilidad y mortalidad en el paciente oncológico. A menudo estos pacientes no tienen manifestaciones de la enfermedad hasta que la insuficiencia cardiaca se presenta. Sería necesario identificar de manera precisa qué individuos están en riesgo de cardiotoxicidad, incluso antes de las manifestaciones clínicas. El objetivo de este trabajo es ofrecer una revisión sobre el papel prometedor de las técnicas de imagen y las tecnologías «ómicas», especialmente la proteómica y la genómica, en la prevención y el diagnóstico precoz de la cardiotoxicidad, así como en la respuesta individual de cada paciente al tratamiento antineoplásico.
Palabras clave
La cardiotoxicidad inducida por los fármacos antineoplásicos es un problema de salud cada vez más importante para los pacientes oncológicos tratados tanto con los fármacos tradicionales (antraciclinas y ciclofosfamida) como con los nuevos (anticuerpos monoclonales e inhibidores de la tirosincinasa)1. La mayoría de estos pacientes no tienen previamente ninguna manifestación de enfermedad2. Además, los índices y biomarcadores convencionales de la cardiotoxicidad a menudo muestran un cambio manifiesto solo después de que se haya producido el daño cardiaco3. Por consiguiente, es necesario identificar exactamente a los individuos en riesgo de sufrir una enfermedad cardiaca antes de que aparezcan las manifestaciones clínicas. La identificación de nuevos genes y vías de señalización mediante las tecnologías «ómicas» en la práctica clínica puede ser útil para detectar tempranamente el daño cardiaco, así como nuevas dianas terapéuticas4,5. En este artículo se presenta una visión general de las técnicas de imagen cardiacas y las nuevas tecnologías «ómicas», en especial la genómica y la proteómica, como instrumentos prometedores para la detección temprana y la predicción de la cardiotoxicidad y las respuestas individuales a los fármacos antineoplásicos.
CARDIOTOXICIDAD INDUCIDA POR FÁRMACOS ANTINEOPLÁSICOS: DEFINICIÓN DEL PROBLEMALa cardiotoxicidad se define como la aparición de una disfunción del músculo cardiaco a causa de la exposición a un tratamiento antineoplásico, con la posibilidad de que progrese a insuficiencia cardiaca (IC). Se denomina cardiotoxicidad subclínica o cardiotoxicidad preclínica a la fase inicial de esta miocardiopatía, cuando la enfermedad aún no es clínicamente manifiesta. Dado que el diagnóstico actual de la cardiotoxicidad sigue basándose en la aparición de síntomas de IC o una disminución de la fracción de eyección del ventrículo izquierdo (FEVI), y teniendo en cuenta la variabilidad interobservadores existente en la determinación de la FEVI, la incidencia de la cardiotoxicidad puede variar según el tipo de tratamiento antineoplásico y el tipo de sistema de detección utilizado para establecer el diagnóstico6. El empleo de la troponina I cardiaca de alta sensibilidad y los nuevos parámetros ecocardiográficos, como el strain (deformación)/tasa de strain, así como de nuevos biomarcadores capaces de identificar a los pacientes con riesgo de sufrir una enfermedad cardiaca, pueden ser útiles para establecer un diagnóstico precoz de la enfermedad. Los fármacos antineoplásicos más comúnmente utilizados para tratar el cáncer son las antraciclinas, los antimetabolitos, los inhibidores del receptor de factor de crecimiento epidérmico humano 2 (HER2) y los inhibidores de la tirosincinasa. Las antraciclinas (doxorubicina y epirubicina), que se emplean principalmente para el tratamiento del cáncer de mama y los cánceres hematológicos, inducen una cardiotoxicidad irreversible, de manera dependiente de la dosis y a través de la generación de radicales libres, el daño de ADN y la muerte celular de los miocardiocitos y las células progenitoras cardiacas. En un análisis retrospectivo de Von Hoff et al.7, el porcentaje de pacientes que tuvieron una disfunción del ventrículo izquierdo (detectada mediante la estimación ecocardiográfica de la FEVI), con una dosis acumulada de doxorubicina de 400 mg/m2 fue del 3%, y aumentó al 7% con 550 mg/m2, y al 18% con 700 mg/m2. En un análisis retrospectivo de 3 ensayos prospectivos8, en los que se evaluó la FEVI mediante ventriculografía isotópica con adquisición sincronizada múltiple (MUGA), se observó que un 5% de los pacientes presentaron una disfunción del ventrículo izquierdo con una dosis acumulada de 400 mg/m2; el 26%, con 550 mg/m2, y el 48%, con 700 mg/m2. Los inhibidores del receptor HER2 (trastuzumab) son anticuerpos monoclonales que se emplean principalmente para el tratamiento del cáncer de mama y el cáncer gástrico, e inducen una cardiotoxicidad reversible a través del bloqueo del HER2 en los miocardiocitos y las células progenitoras cardiacas, con independencia de la dosis utilizada. En los pacientes tratados con trastuzumab, la IC sintomática puede darse en un 1,7-20,1% de los casos9. Los inhibidores de tirosincinasa (sunitinib) se utilizan principalmente para el tratamiento del carcinoma renal, y pueden inducir una IC sintomática a través del daño mitocondrial y la apoptosis de miocardiocitos, con una incidencia que va del 4,1 al 33,8%10.
PAPEL DEL BALANCE REDOX (REDUCCIÓN/OXIDACIÓN) EN LA CARDIOTOXICIDADLos mecanismos de cardiotoxicidad de diversos fármacos antineoplásicos, como las antraciclinas, los inhibidores de la tirosincinasa y los antimetabolitos, pueden estar relacionados con el estrés oxidativo a causa de una inactivación insuficiente de las especies de oxígeno reactivas (ROS), así como un aumento de la generación de ROS por las xantina oxidasas, las NAD(P)H oxidasas (NOX) y los complejos mitocondriales I y III11–15. Concretamente, los electrones que escapan de los complejos mitocondriales I y III pueden constituir la principal fuente de aniones superóxido (O2–)16,17. Los fármacos antineoplásicos pueden activar la NOX2 miocárdica, que se encuentra normalmente en estado latente, la cual produce a su vez O2–, mientras que la NOX4, que es activa de forma constitutiva, genera peróxido de hidrógeno (H2O2). El estrés oxidativo se amplifica, además por la conversión de las ROS en el radical hidroxilo más tóxico (OH–) a través de varios procesos que tienen lugar dentro y fuera de las mitocondrias, incluida la reacción del óxido nítrico (NO) con posterior formación de especies de nitrógeno reactivas (RNS)13. Generan el NO las óxido nítrico sintasas endotelial (eNOS o NOS3) y neuronal (nNOS o NOS1), que se expresan de forma constitutiva en los miocardiocitos, así como por la NOS2 inducible (iNOS), que se estimula por mediadores proinflamatorios o preacondicionamiento isquémico18–20. El NO puede producirse también por otras reacciones, a las que se denomina globalmente procesos «no NOS». Entre ellas se encuentran las reacciones catalizadas por «enzimas no NOS», como el citocromo C, la hemoglobina y la xantina oxidorreductasa, y reacciones debidas a procesos «no enzimáticos» en condiciones ácidas, como la reducción del nitrito a NO. El nitrito y el NO pueden producir diferentes acciones biológicas a través de una nitración postraslacional directa o indirecta (formación de 3-nitrotirosina) o la nitrosación/nitrosilación de dianas específicas, como los metales y los residuos de cisteína tiol16–20. El NO y las ROS conducen a la formación de RNS, incluido el peroxinitrito (ONOO–). Las altas concentraciones de ROS y RNS pueden dañar las células cardiovasculares o afectar a las vías de señalización celular en el sistema cardiovascular. Concretamente, las ROS pueden causar una peroxidación de los lípidos de la membrana y un daño del ADN, con posterior lesión de la membrana y muerte celular por apoptosis. Las ROS/RNS estimuladas y el daño causado por la NOX contribuyen a producir el inicio y la progresión de muchos cánceres sólidos y hematopoyéticos21, mientras que los fármacos antineoplásicos, y en especial las antraciclinas, pueden inducir cardiotoxicidad a través de una alteración de la producción de ROS/RNS o del sistema antioxidante endógeno en el sistema cardiovascular22,23. Las alteraciones redox específicas inducidas por las antraciclinas pueden rastrearse hasta la generación de metabolitos inestables (como la doxorubicina-semiquinona), que a su vez pueden reaccionar con O2 y producir H2O2 y O2–. Además, las antraciclinas producen una quelación del hierro libre intracelular, formando complejos de hierro-doxorubicina. Estos compuestos pueden reaccionar con el O2 y dar lugar a la generación de ROS. Además, las antraciclinas pueden interferir directamente en las proteínas transportadoras y fijadoras del hierro24, lo que causa una acumulación de hierro mitocondrial y una mayor generación de ROS. Finalmente, las ROS interaccionan con la cardiolipina, un fosfolípido de la membrana mitocondrial que interviene en las vías apoptóticas causando la liberación de factores apoptogénicos mitocondriales, como el citocromo C. Dado que el NO puede bloquear la oxidación de la cardiolipina al inhibir la actividad de peroxidasa del citocromo C en el complejo de cardiolipina, las cantidades apropiadas en lugares específicos de NO pueden contrarrestar los efectos tóxicos de las antraciclinas25,26. El estrés oxidativo puede desempeñar también un papel en la cardiotoxicidad derivada de los inhibidores de la tirosincinasa: la infusión directa del sunitinib en diferentes preparaciones experimentales tuvo un efecto cardiodepresor dependiente de la dosis, acompañado de una reducción de las concentraciones de Ca2+, junto con un aumento simultáneo de la generación de ROS27. Por otra parte, el 5-fluorouracilo, así como la capecitabina y la gemcitabina, pueden inducir un estrés oxidativo en los miocardiocitos y una desregulación de la NOS endotelial, una regulación positiva de la endotelina 1 y la activación de la proteincinasa C. Estos efectos pueden conducir a una vasoconstricción dependiente e independiente del endotelio, y luego a espasmos coronarios28–30. Aunque el estrés oxidativo es esencial para que se produzca la cardiotoxicidad inducida por las antraciclinas, los estudios clínicos han indicado que el bloqueo de las reacciones redox mediante productos antioxidantes no tiene un efecto de protección cardiaca2,6. La falta de resultados de estos productos puede atribuirse a la etiología multifactorial de la cardiotoxicidad, que no se debe exclusivamente al estrés oxidativo. Otra razón de su falta de efecto es el papel fisiológico de las ROS/RSN, que se ve alterado por los productos antioxidantes. En consecuencia, es importante desarrollar tratamientos inteligentes y sofisticados que permitan modificar el sistema redox en puntos clave, sin alterar el papel fisiológico del estrés oxidativo. No obstante, cualquier fármaco nuevo requiere experimentos realizados en modelos apropiados in vitro y en animales, así como estudios comparativos con otros fármacos cardioprotectores ya autorizados (p. ej., dexrazoxano) y ensayos aleatorizados en el contexto de la cardiotoxicidad de los antineoplásicos31,32.
DETECCIÓN Y SEGUIMIENTO DE LA CARDIOTOXICIDAD MEDIANTE TÉCNICAS DE IMAGEN CARDIACALas técnicas de imagen cardiaca aplicadas a los pacientes tratados con quimioterapia constituyen un paso esencial en el diagnóstico precoz de la cardiotoxicidad una vez se ha producido ya un daño, aunque todavía en una fase inicial33,34. Las modalidades de imagen cardiaca combinadas que integran las ventajas de cada una de ellas y eliminan al mismo tiempo las limitaciones de una modalidad específica podrían aportar una mejora del diagnóstico y el seguimiento terapéutico de la cardiotoxicidad34. Sin embargo, durante la quimioterapia, el empleo de diferentes técnicas de imagen cardiaca, como ecocardiografía, MUGA y cardiorresonancia magnética, para evaluar los volúmenes y la función del VI en el mismo paciente, no se recomienda debido a las diferencias significativas en los resultados obtenidos con las diversas técnicas. Se prefiere elegir un único método para el seguimiento secuencial de la función del VI durante la quimioterapia. Dada la necesidad de exposición a radiación y la escasa capacidad de aportar una información detallada sobre la función del ventrículo derecho y sobre la presencia de enfermedad pericárdica o valvular, el empleo de MUGA tiene poca aceptación como técnica de imagen para el diagnóstico de la cardiotoxicidad. Debido a su seguridad, amplia disponibilidad, repetibilidad y bajo coste, la ecocardiografía bidimensional (2D) se considera el método de primera línea para la evaluación de los cambios de la función ventricular y la estratificación del riesgo de IC y el manejo de los tratamientos35. Los criterios utilizados para el diagnóstico de la miocardiopatía debida al tratamiento anticanceroso tienen como objetivo identificar la reducción general o regional de la función sistólica con un descenso de la FEVI ≥ 5-< 55%, o una disminución de la FEVI de más de 10 unidades porcentuales36. Se han desarrollado nuevos parámetros como el strain (deformación)/tasa de strain, para una detección más temprana de la disfunción del VI. Además, la evaluación ecocardiográfica de la función diastólica mediante la prolongación del tiempo de relajación isovolumétrico y las imágenes de Doppler tisular pueden ser útiles para detectar el daño cardiaco causado por el tratamiento del cáncer37. Dado que la quimioterapia puede conducir a un aumento del riesgo de endocarditis, en especial en los pacientes con cáncer, que presentan inmunodepresión y son más propensos a las lesiones trombóticas no bacterianas, como consecuencia de una trombofilia asociada al cáncer38, se requiere una evaluación sistemática de la presencia de vegetaciones valvulares y de la gravedad de la insuficiencia valvular. Por otra parte, la irradiación del corazón puede causar la complicación denominada cardiopatía inducida por radiación, que incluye estenosis o insuficiencia valvular39. La ecocardiografía 2D transtorácica debe ser la exploración de primera línea para los pacientes en los que se sospecha una lesión valvular debida al tratamiento del cáncer, mientras que la ecocardiografía transesofágica es el patrón de referencia para un diagnóstico más detallado36. Aunque la disfunción del VI y la IC pueden ser frecuentes en los pacientes con cáncer después de un tratamiento antineoplásico, la evidencia clínica de IC derecha es extremadamente infrecuente, si bien algunos fármacos, como las antraciclinas, la ciclofosfamida y el 5-fluorouracilo, pueden inducir un deterioro de la función ventricular derecha sistólica y diastólica40. Así pues, se debe examinar a todos los pacientes tratados con fármacos antineoplásicos mediante ecografía para evaluar el ventrículo derecho, con las siguientes determinaciones: diámetro y área basales, desplazamiento sistólico del plano anular tricuspídeo, velocidad sistólica máxima del anillo tricuspídeo mediante la técnica de Doppler tisular y cambio del área fraccional41. La ecocardiografía transtorácica es el método de elección para la evaluación del pericardio, ya que el tratamiento contra el cáncer puede dañarlo. Las observaciones ecocardiográficas realizadas en estos pacientes pueden ser completamente normales o mostrar signos claros de un derrame pericárdico. La ecocardiografía permite diagnosticar el derrame pericárdico y el taponamiento cardiaco, a la vez que sirve de guía para la pericardiocentesis42. Se debe considerar el posible empleo de la cardiorresonancia magnética cuando la información ecocardiográfica no sea satisfactoria o se necesite una caracterización del tejido6,43.
DETECCIÓN Y PREDICCIÓN DE LA CARDIOTOXICIDAD MEDIANTE LAS TECNOLOGÍAS «ÓMICAS»Los datos genómicos y proteómicos disponibles hasta la fecha sobre la toxicidad cardiaca inducida por los fármacos antineoplásicos convencionales como las antraciclinas y los antimitóticos todavía son escasos. Dada la importancia de la producción de ROS/RNS como mediadores iniciales de la cardiotoxicidad asociada a la quimioterapia, se puede identificar los biomarcadores importantes para el estado redox (denominados biomarcadores de la cardiotoxicidad oxidativa/nitrosativa) con métodos «ómicos». Este enfoque podría aportar nuevos instrumentos para identificar los marcadores tempranos de la cardiotoxicidad y para el desarrollo de fármacos cardioprotectores innovadores4,5. Se ha considerado biomarcadores tempranos de la cardiotoxicidad inducida por las antraciclinas una reducción de la actividad de nicotinamida adenina dinucleótido fosfato (NAD(P)H):quinona oxidorreductasa 1 y un aumento de la producción de ROS por las NAD(P)H oxidasas44. Se ha observado que hay una variación significativa de las ROS, junto con un cambio de la actividad enzimática de las glutatión peroxidasas, correlacionada con una variación temprana en la función sistólica longitudinal de los pacientes a los que se había administrado epirubicina45. Las variantes genéticas pueden permitir que se identifique la variabilidad individual de la respuesta a los fármacos antineoplásicos, lo cual puede ser esencial para una medicina personalizada y reducir los efectos adversos de la quimioterapia46,47. Entre los polimorfismos de un solo nucleótido (SNP) significativos asociados a mayor riesgo de cardiotoxicidad inducida por antraciclinas, se identificaron los de la NAD(P)H oxidasa y los de los genes transportadores de expulsión de la doxorubicina48,49. En un estudio de casos y controles realizado por Wojnowski et al.48, se examinó a 109 pacientes con linfomas no hodgkinianos tratados con antraciclinas y 363 controles para determinar los SNP relacionados con 82 genes involucrados en la generación de ROS. Los autores identificaron 5 SNP significativos en la NAD(P)H oxidasa asociados a mayor riesgo de cardiotoxicidad. Concretamente, la cardiotoxicidad crónica se asoció a una variante de la subunidad p40phox de la NAD(P)H oxidasa (gen NCF4, SNP rs1883112, -212A>G), mientras que la cardiotoxicidad aguda se asoció a un SNP de la subunidad p22phox de la NAD(P)H oxidasa (gen CYBA, SNP rs4673 c.242C>T)48. Estas mutaciones producen una variación missense en His72Tyr, que se asocia a una disfunción de la NAD(P)H oxidasa. La intervención de un SNP relacionado con la NAD(P)H oxidasa en el desarrollo de la cardiotoxicidad quedó demostrada también por Cascales et al.49, que observaron una asociación intensa entre el SNP rs1883112 NCF4 y la fibrosis intersticial cardiaca. Por último, el papel del SNP de NCF4 rs1883112 como predictor independiente de cardiotoxicidad se confirmó en un estudio posterior, llevado a cabo en pacientes con linfoma macrocítico de células B difuso tratados con R-CHOP21 (rituximab con ciclofosfamida, DXR, vincristina y prednisona)50. Se han identificado otros SNP igualmente importantes en su contribución a la cardiotoxicidad inducida por las antraciclinas, a través de la generación de radicales libres o de metabolitos tóxicos, entre los genes que codifican proteínas involucradas en el gen de la oxidorreductasa P45051–53. En un estudio de casos y controles realizado por Lubieniecka et al.52, se examinó a 286 pacientes con leucemia mieloide aguda tratados con daunorubicina para identificar los SNP (rs2868177, rs13240755 y rs4732513) del gen de la oxidorreductasa P450 (POR). Estos SNP mostraron una asociación significativa con una disminución de la FEVI tras la administración de daunorubicina52. Wasielewski et al.54 utilizaron también un estudio de detección sistemática genética en 6 familias con miocardiopatía dilatada (MCD), que puso de manifiesto la presencia de 3 mutaciones (c.1633G>A, p.Asp545Asn; c.2863G>A, p.Asp955Asn y c.4125T>A, p.Tyr1375X) en el gen sarcomérico MYH7 en 2 pacientes con MCD inducida por antraciclinas y antecedentes familiares de MCD positivos. Visscher et al.46 examinaron 2 cohortes de 156 y 188 niños tratados con antraciclinas para identificar 2.977 SNP en 220 genes clave de biotransformación de fármacos. Los autores identificaron una asociación muy significativa de los SNP rs7853758 (c.1381C>T) en el gen SLC28A3 que confería una protección significativa contra la cardiotoxicidad inducida por las antraciclinas.
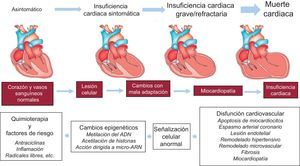
Hay menos datos sobre la epigenética de la cardiotoxicidad inducida por los fármacos antineoplásicos55–61. Las modificaciones epigenéticas, como las modificaciones de la citosina y la histona, son características genómicas heredables que no modifican la secuencia del ADN. Intervienen en la regulación de la expresión de los genes que codifican proteínas y los ARN no codificadores (miARN), que son ARN no codificadores que intervienen en la regulación postranscripcional de la expresión del gen59. Además, un grupo específico de miARN (definidos como epi-miARN) puede actuar directamente sobre efectores de los mecanismos epigenéticos, como las ADN metiltransferasas (DNMT), las histona desacetilasas (HDAC) o los genes polycomb, y puede afectar indirectamente a la expresión de genes cuya manifestación está controlada por factores epigenéticos62. Esta compleja red de retroacciones entre los miARN y las vías epigenéticas parece formar un circuito de regulación de epigenética-miARN y organizar todo el perfil de expresión génica63. Cuando este circuito se altera, se interrumpen las funciones fisiológicas normales, y ello contribuye a producir diversos procesos patológicos o a causar una variabilidad en las respuestas a los fármacos, incluidos los antineoplásicos. La determinación del perfil de miARN miocárdico de los corazones de ratones expuestos de forma crónica o aguda a la doxorubicina mostró una regulación negativa de la familia miR-30 a través de GATA-656. Los autores llegaron a la conclusión de que las altas concentraciones de miR-30 tienen un efecto protector contra la toxicidad de la doxorubicina y correlacionaron esta observación con una menor generación de ROS56. Hasta el momento, solo un grupo de investigación ha descrito una regulación positiva del miR-146a con el tratamiento con doxorubicina en los miocardiocitos, de tal manera que las células eran más resistentes a la doxorubicina cuanto más se reducía artificialmente la expresión de miR-146a in vitro60. En un modelo de ratones transgénicos con sobrexpresión del dominio de reclutamiento de caspasa (ARC)64 y expuesto a un tratamiento con doxorubicina, se observó una reducción de la cardiotoxicidad, y este efecto se produjo a través de la supresión del miR-532-3p55. En este modelo, se observó que el miR-532-3p sensibilizaba los miocardiocitos contra la fisión mitocondrial inducida por la doxorubicina y la apoptosis al actuar sobre el ARC55. Recientemente se han publicado resultados contradictorios de estudios sobre el miR-208a57,58,65,66. De hecho, un grupo de investigación demostró el potencial del miR-208a de silenciar la cardiotoxicidad inducida por la doxorubicina en los ratones58. Los autores administraron 20mg/kg de doxorubicina en una dosis única, al cabo de 7 días extrajeron los corazones de los ratones y los analizaron. Observaron un aumento de 4 veces en la expresión de miR-208a y una regulación negativa pronunciada de GATA4 en el grupo de control. Al mismo tiempo, el otro grupo al que se había aplicado un pretratamiento con miR-208a antagomir, mostró una atenuación de la expresión de miR-208a y un restablecimiento de las concentraciones de GATA4. En cambio, los ratones pretratados mostraron un aumento del nivel de expresión del gen antiapoptótico BCL-2 y una disminución de la apoptosis en comparación con el grupo de control58. El papel protector del miR-208a ha sido respaldado por el estudio de Vacchi-Suzzi et al.67, en el que se observó que el nivel de expresión de miR-208a en los corazones de los ratones se reduce durante el tratamiento con doxorubicina. Sin embargo, también ha habido estudios con resultados contradictorios que han mostrado que, tras la administración de 24 mg/kg de doxorubicina, el nivel de expresión de miR-208b aumentó en 8,2 veces en los corazones de los ratones, mientras que no se observó cambio alguno en el miR-208a65. Igualmente, en otro estudio se observó que, tras la administración de una sola dosis alta de doxorubicina (30 mg/kg) en ratones, el nivel de miR-208a circulante y el de las troponinas cardiacas (cTnI y cTnT) no se modificó de manera significativa, mientras que hubo un aumento de miR-1, miR-133a/b y miR-20666. Además, no se observaron cambios histopatológicos en los corazones de los ratones. Por último, el miR-208a circulante no se detectó en el plasma de pacientes con cáncer de mama durante todo el tratamiento de quimioterapia con 4 dosis acumulativas de 60 mg/m2 de doxorubicina57. Teniendo en cuenta todos los datos existentes, aunque el tratamiento basado en miARN y los tratamientos más recientes de epi-miARN parecen ser instrumentos prometedores para la protección del corazón contra la cardiotoxicidad inducida por las antraciclinas, se debe tener mucha precaución, ya que estos miARN son moduladores clave de la expresión génica en el corazón y silenciarlos puede conllevar diversas anomalías cardiacas (figura).
La espectroscopia de masas ha permitido la identificación preclínica de biomarcadores que son prometedores en los modelos preclínicos de la cardiotoxicidad de las antraciclinas16–20,68–71. Los primeros intentos de utilizar la proteómica en la cardiotoxicidad inducida por antraciclinas se remontan al año 2004, cuando Petricoin et al.72,73 analizaron los espectros de masas obtenidos de más de 200 muestras de suero de ratas tratadas con doxorubicina o mitoxantrona +/– dexrazoxano. En estos experimentos se observó que la troponina T era un marcador del daño inicial. Es de destacar que las muestras de sangre de animales tratados con docetaxel y adriamicina mostraron una expresión superior de las proteínas involucradas en las vías de producción de energía, incluida la glucolisis, el ciclo de Krebs y la cadena de transporte de electrones mitocondrial74. Ohyama et al.74 realizaron estos experimentos en muestras de tejido cardiaco procedentes de ratas de control y ratas expuestas a docetaxel y adriamicina, e identificaron 9 proteínas que tenían una expresión diferente en el grupo de control y en los 2 grupos de tratamiento. Sorprendentemente, la expresión de la glicerilaldehído-3-fosfato deshidrogenasa fue mayor en el grupo con una tasa de mortalidad inferior. Además, Sterba et al.75 analizaron los espectros de masas obtenidos de muestras de corazones de conejos tratados con daunorubicina. Los cambios más importantes fueron los observados en las proteínas mitocondriales involucradas en la fosforilación oxidativa y los sistemas antioxidantes75. La importancia del metabolismo de la energía se confirmó también en los modelos preclínicos de la cardiotoxicidad inducida por daunorubicina, en los que el análisis de proteómica mostró cambios en las proteínas mitocondriales que participan en la fosforilación oxidativa, una canalización de la energía y un aumento de la abundancia de chaperonas y proteínas involucradas en la autofagia, la reparación de las membranas y la apoptosis75. Por último, los modelos preclínicos de la cardiotoxicidad inducida por la doxorubicina mostraron un aumento de la expresión de marcadores del estrés celular (adenosina trifosfato sintasa, enolasa alfa, alfa B-cristalina, proteína de translocación 1 y fosfoproteína 1 inducida por el estrés) y el daño apoptótico/celular (p38 alfa, lipocortina, proteína selectiva aniónica dependiente de voltaje 2, creatincinasa y MTUS1)76.
Otro campo de estudio nuevo e interesante es el de la aplicación de la metabolómica en la detección precoz de la cardiotoxicidad. A diferencia de la proteómica, que tiene como objetivo evaluar el espectro completo de las proteínas celulares, la metabolómica permite el estudio de las moléculas pequeñas de una muestra biológica que intervienen en el metabolismo celular. Andreadou et al.50,77 examinaron los perfiles metabólicos de NMR en corazones de ratas tratadas con doxorubicina. Estos autores observaron diferencias entre los grupos de control y de tratamiento por lo que respecta a la concentración miocárdica de acetato y succinato, que estaban aumentados en las ratas expuestas a la doxorubicina, mientras que había una disminución de los aminoácidos de cadena ramificada50,77. Los autores llegaron a la conclusión de que el acetato y el succinato podían ser biomarcadores de cardiotoxicidad útiles. Tan et al.78 confirmaron la participación de reacciones metabólicas energéticas en la producción de la cardiotoxicidad. Estos autores analizaron los perfiles metabólicos de los corazones de ratas tratadas con doxorubicina empleando metabolómica con cromatografía de gases-espectrometría de masas78. Identificaron 24 metabolitos que intervenían en la glucolisis, el ciclo del citrato y el metabolismo de algunos aminoácidos y lípidos que estaban aumentados en el grupo tratado con doxorubicina78. Más recientemente, Li et al.79,80 llevaron a cabo un análisis metabolómico de muestras de plasma de ratones tratados con doxorubicina utilizando una técnica de cromatografía de líquidos de ultraalta resolución y espectrometría de masas de tiempo de vuelo con cuadrupolo. Los autores identificaron 39 biomarcadores que podrían predecir la cardiotoxicidad antes que otros análisis bioquímicos y evaluaciones histopatológicas80.
Considerados en conjunto, se considera nuevos marcadores potenciales a los biomarcadores identificados con los métodos «ómicos», en especial para el diagnóstico y la estratificación del riesgo de los síndromes coronarios agudos inducidos por los fármacos antineoplásicos, y pueden ser útiles para la detección precoz de la cardiotoxicidad de los antineoplásicos; sin embargo, los datos clínicos existentes respecto a la cardiotoxicidad inducida por la quimioterapia aún son insuficientes.
PERSPECTIVAS CLÍNICAS Y POSIBILIDADES FUTURASEn las últimas décadas, hemos asistido a un aumento de la efectividad del tratamiento del cáncer que ha conducido a una disminución de la incidencia de esta enfermedad. Sin embargo, la introducción de tratamientos antineoplásicos más eficaces ha conllevado una mayor incidencia de cardiotoxicidad, con una repercusión negativa en la calidad de vida y la morbilidad y la mortalidad cardiovasculares. Para el diagnóstico precoz de la cardiotoxicidad, las guías actuales no recomiendan que la evaluación y el seguimiento de la disfunción ventricular izquierda se realice mediante técnicas de imagen cardiaca diferentes, debido a que entre ellas hay diferencias de resultados significativas. En vez de ello, las guías recomiendan elegir una tecnología que aporte la evaluación más exacta posible de la función cardiaca, y hacer un uso uniforme de la misma técnica, de tal manera que los estudios de seguimiento sean comparables y pueda seguirse la repercusión que tiene el tratamiento antineoplásico en la función cardiaca. Dada su seguridad, amplia disponibilidad, repetibilidad y bajo coste, la ecocardiografía 2D es el método más ampliamente aplicado y estandarizado en la práctica clínica y se considera de primera línea para evaluar las alteraciones de la función ventricular, estratificar el riesgo de IC y manejar los tratamientos. Sin embargo, la ecocardiografía 2D requiere la presencia de una cantidad significativa de lesión miocárdica para detectar la cardiotoxicidad, lo que impide toda posibilidad de prevenir su aparición. Para diagnosticar la enfermedad en las fases más tempranas posibles y predecir el riesgo de que aparezca, es necesario, pues, integrar la evaluación ecocardiográfica con otros biomarcadores que permitan una mejor estratificación anticipada y una detección precoz del riesgo. Los métodos «ómicos» pueden aportar instrumentos novedosos y prometedores para la detección de moduladores génicos cardioprotectores y actuar directamente sobre los receptores, con un enfoque más sólido y predecible de la cardioprotección y la detección precoz de la cardiotoxicidad y las respuestas individuales a los fármacos antineoplásicos. Esto podría conducir a un cambio de la definición actual de la cardiotoxicidad, para pasar de una definición clínica a una subclínica basada en biomarcadores más tempranos, sensibles y específicos.
CONFLICTO DE INTERESESNinguno.