Se ha propuesto el empleo de la diálisis peritoneal como alternativa para los pacientes con insuficiencia cardiaca congestiva refractaria. El objetivo de este estudio es evaluar su efecto en la evolución clínica a largo plazo de los pacientes con insuficiencia cardiaca avanzada y disfunción renal.
MétodosSe invitó a un total de 62 pacientes, con insuficiencia cardiaca avanzada (clase III/IV), disfunción renal (filtrado glomerular < 60ml/min/1,73 m2), congestión persistente por exceso de líquidos a pesar del tratamiento con diuréticos de asa y al menos dos hospitalizaciones previas por insuficiencia cardiaca, a participar en un programa de diálisis peritoneal ambulatoria continua. De ellos, se excluyó a 34 y se los asignó al grupo control. Las razones de exclusión más importantes fueron la negativa a participar, la incapacidad de aplicar la técnica y la presencia de defectos de la pared abdominal. El objetivo primario fue la mortalidad por cualquier causa y la combinación de mortalidad y reingreso por insuficiencia cardiaca. Para tener en cuenta el desequilibrio existente en la situación basal, se estimó una puntuación de propensión que se utilizó como ponderación en todos los análisis.
ResultadosLos grupos de diálisis peritoneal (n = 28) y de control (n = 34) eran similares respecto a todas las covariables basales. Durante una mediana de seguimiento de 16 meses, 39 (62,9%) fallecieron, 21 (33,9%) pacientes fueron rehospitalizados por insuficiencia cardiaca y 42 (67,8%) presentaron el objetivo combinado. En los modelos ajustados según la puntuación de propensión, la diálisis peritoneal, comparada con el grupo control, se asoció a una reducción sustancial del riesgo de mortalidad en el seguimiento completo (razón de riesgos = 0,40; intervalo de confianza del 95%, 0,21-0,75; p = 0,005), la mortalidad evaluada con los días de vida fuera del hospital (razón de riesgos = 0,39; intervalo de confianza del 95%, 0,21-0,74; p = 0,004) y el objetivo combinado (razón de riesgos = 0,32; intervalo de confianza del 95%, 0,17-0,61; p = 0,001).
ConclusionesEn la insuficiencia cardiaca congestiva refractaria con disfunción renal concomitante, la diálisis peritoneal se asoció a una mejoría de la evolución clínica a largo plazo.
Palabras clave
La congestión sistémica se produce con frecuencia en los pacientes con insuficiencia cardiaca (IC) avanzada y se considera una característica distintiva en los que sufren una insuficiencia cardiaca aguda (ICA)1. Además, hay evidencia clara de que la congestión puede desempeñar un papel importante en la progresión de la enfermedad2, 3, 4. De hecho, datos recientes respaldan el papel de la retención de líquidos en la patogenia de la disfunción renal (síndrome cardiorrenal) y la posterior resistencia a los diuréticos5, 6, lo cual es una situación con limitadas opciones terapéuticas7, 8 y mal pronóstico9, 10, 11. En este contexto, se han propuesto dos métodos relacionados para el tratamiento de estos pacientes: a) ultrafiltración intermitente, especialmente útil durante los episodios de descompensación aguda12, 13, y b) diálisis peritoneal continua ambulatoria (DPCA), considerada una alternativa atractiva para el tratamiento de la insuficiencia cardiaca congestiva (ICC) refractaria, puesto que proporciona un proceso de ultrafiltración continuo y más fisiológico14, 15, 16, 17, 18, 19, 20, 21. De hecho, nuestro grupo, al igual que otros, ha descrito una mejoría del estado clínico y funcional de los pacientes, cambios favorables en los parámetros ecocardiográficos y hemodinámicos y una reducción de las tasas de hospitalización asociados al uso de la DPCA, con una tasa de efectos adversos aceptable14, 15, 16, 17, 18, 19, 20, 21. No obstante, no se conoce aún el efecto de la DPCA en la evolución clínica a largo plazo.
El objetivo de este estudio es comparar los resultados clínicos obtenidos en los pacientes incluidos en un programa de DPCA con los de una cohorte similar de pacientes con ICC aptos para la DPCA pero que rechazaron la inclusión o fueron excluidos del programa.
MétodosGrupo de estudio y protocoloSe estudió prospectivamente una cohorte de 62 pacientes, que fueron objeto de seguimiento en la unidad de IC del Hospital Clínico Universitario de Valencia entre el 1 de agosto de 2008 y el 1 de junio de 2011 y cumplían los siguientes criterios de inclusión: a) al menos dos hospitalizaciones previas por ICA, con el último episodio en los 6 meses anteriores; b) clase funcional III-IV de la New York Heart Association (NYHA); c) congestión persistente a pesar de un tratamiento óptimo con diuréticos de asa, y d) presencia de una disfunción renal documentada en al menos una ocasión en los últimos 12 meses (tasa de filtrado glomerular estimado [TFGe] < 60ml/min/1,73 m2).
La ICA se definió como la aparición rápida de signos y síntomas secundarios a una función cardiaca anormal y evidencia objetiva de anomalías estructurales o funcionales del corazón en reposo (como cardiomegalia, tercer ruido cardiaco, soplo cardiaco, anomalía demostrada mediante ecocardiografía o elevación de péptidos natriuréticos)7, 8.
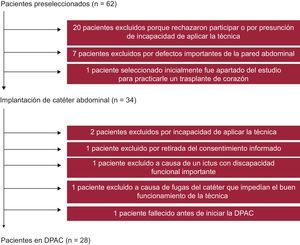
Durante su última hospitalización, se invitó a los pacientes que cumplían los criterios de inclusión (n = 62) a participar en el programa de DPCA como opción terapéutica alternativa para el control de la sobrecarga de volumen. De esos 62 pacientes, 20 rechazaron participar o se mostraron incapaces de aplicar la técnica en su domicilio, se excluyó a 7 por la presencia de defectos de la pared abdominal y a 1 paciente seleccionado inicialmente luego se lo apartó del estudio para practicarle un trasplante cardiaco (Figura 1). Así pues, se colocó un catéter abdominal a los 34 pacientes restantes, tras una mediana de 31 [intervalo intercuartílico, 22-37] días después de la última hospitalización. Posteriormente, 6 pacientes no iniciaron la diálisis por razones diversas, que se indican en la Figura 1. Finalmente, se pudo iniciar la DPCA en 28 pacientes, con una mediana de 58 [40-64] días tras la implantación del catéter abdominal. El programa de DPCA consistió en sesiones aplicadas 2-3 veces/día de intercambio de solución de diálisis (con el 1,36-2,27% de glucosa), ajustándola en función de la respuesta del paciente. Nuestro protocolo siguió las actuales guías internacionales sobre el tratamiento de las infecciones relacionadas con la diálisis peritoneal22, 23 y sobre el acceso peritoneal24.
Figura 1. Diagrama de flujo. DPAC: diálisis peritoneal ambulatoria continua.
Se obtuvieron de manera sistemática, por medio de cuestionarios preestablecidos, datos de información demográfica, antecedentes patológicos, constantes vitales, electrocardiograma de 12 derivaciones, ecocardiografía, análisis de laboratorio y tratamientos farmacológicos. El empleo concomitante de fármacos para el tratamiento de la IC se individualizó según lo indicado por las guías establecidas7, 8, y todos los pacientes (incluidos los controles) siguieron un régimen similar de visitas de seguimiento. Según lo previsto en el protocolo, la posología de diuréticos de asa no se modificó inicialmente hasta haber verificado una reducción clínica de la congestión sistémica. El comité ético de nuestro centro aprobó el protocolo, que se atuvo a los principios de la Declaración de Helsinki y las regulaciones nacionales.
Intervención terapéuticaEl grupo de tratamiento activo se formó sólo con los pacientes que cumplían los criterios de inclusión y recibieron el tratamiento de DPCA (n = 28). A los pacientes que cumplían también los criterios de inclusión pero finalmente no se incluyó en el programa de DPCA se los asignó al grupo control (n = 34) y se les dio tratamiento según las guías terapéuticas establecidas7, 8.
Objetivos de valoraciónEl objetivo primario fue la mortalidad por cualquier causa (utilizando el seguimiento completo y los días de vida fuera del hospital [DVFH] como tiempo de seguimiento) y la combinación de muerte/reingreso por ICA.
Análisis estadísticoEl análisis de los datos se realizó según el plan de análisis estadístico elaborado por Cuore International, Inc. (Scottsdale, Arizona, Estados Unidos). Las variables continuas se expresan en forma de media ± 1 desviación estándar o mediana [intervalo intercuartílico] según sea apropiado. Las variables discretas se presentan en forma de porcentajes.
Para estimar los efectos causales de la DPCA, se calculó una puntuación de propensión (PS) ponderada utilizando un algoritmo CART reforzado25 implementado en el programa R (paquete informático TWANG)26. Las variables incluidas en la ponderación por PS se indican en la Tabla 1. Utilizamos 20.000 iteraciones, un parámetro de reducción de 0,0005 y una regla de detención que minimiza la media del estadístico de la prueba de Kolmogorov-Smirnov. Para reducir el error de tipo I preservando el tamaño muestral, se estabilizó la PS según el siguiente esquema: si DPAC=1, sPS = p / PS, y si DPAC = 0, sPS = (1 – p) / (1 – PS), donde p es la probabilidad de tratamiento sin considerar las covariables27. El rendimiento de la PS se evaluó calculando la magnitud del efecto estandarizada y examinando la extensión de la PS en los grupos de tratamiento y de comparación26. A continuación se incorporó la PS en forma de ponderaciones a un modelo de regresión con tan sólo el tratamiento como variable predictiva y sin ninguna covariable. Según lo recomendado, los intervalos de confianza del 95% (IC95%) se estimaron utilizando los valores de error estándar «robustos» (también denominados «estimador sándwich de Huber»)27.
Tabla 1. Comparación de las características basales antes y después de la ponderación con la puntuación de propensión
| Estadístico para evaluar el equilibrio entre los grupos | ||||||
| Sin ponderación | Con ponderación | |||||
| Variables | MEE | KS | p (KS) | MEE | KS | p (KS) |
| Edad (años) | –0,129 | 0,233 | 0,260 | –0,094 | 0,205 | 0,405 |
| Varones | –0,034 | 0,015 | 0,921 | 0,011 | 0,005 | 0,975 |
| Peso (kg) | 0,054 | 0,179 | 0,578 | 0,026 | 0,175 | 0,602 |
| Razón de la última hospitalización | ||||||
| ICAD | 0,139 | 0,057 | 0,601 | 0,193 | 0,078 | 0,466 |
| Edema pulmonar | –0,268 | 0,099 | 0,302 | –0,348 | 0,128 | 0,180 |
| Relacionado con la hipertensión | 0,284 | 0,036 | 0,305 | 0,313 | 0,039 | 0,152 |
| Shock | 0,036 | 0,006 | 0,869 | 0,057 | 0,01 | 0,717 |
| Hipertensión | 0,299 | 0,082 | 0,255 | 0,287 | 0,078 | 0,283 |
| Dislipemia | 0,425 | 0,197 | 0,103 | 0,347 | 0,161 | 0,171 |
| Diabetes | 0,272 | 0,137 | 0,291 | 0,184 | 0,093 | 0,482 |
| Diabetes insulinodependiente | 0,206 | 0,099 | 0,419 | 0,111 | 0,053 | 0,674 |
| Fumador actual | 0,050 | 0,013 | 0,889 | 0,028 | 0,007 | 0,964 |
| Ex fumador | –0,303 | 0,149 | 0,241 | –0,278 | 0,137 | 0,283 |
| Abuso de alcohol | –0,106 | 0,023 | 0,713 | –0,113 | 0,025 | 0,619 |
| Etiología | ||||||
| Cardiopatía isquémica | 0,149 | 0,061 | 0,886 | 0,116 | 0,067 | 0,856 |
| Valvulopatía cardiaca | 0,143 | 0,069 | 0,581 | 0,190 | 0,092 | 0,461 |
| Antecedentes de IM | 0,128 | 0,065 | 0,610 | 0,057 | 0,029 | 0,817 |
| Antecedentes de ictus | –0,033 | 0,011 | 0,946 | –0,078 | 0,025 | 0,732 |
| Antecedentes de EAP | 0,262 | 0,116 | 0,300 | 0,172 | 0,076 | 0,510 |
| Antecedentes de insuficiencia renal | 0,012 | 0,034 | 0,844 | –0,049 | 0,044 | 0,741 |
| Antecedentes de EPOC | 0,259 | 0,109 | 0,312 | 0,240 | 0,101 | 0,354 |
| Edema periférico | 0,195 | 0,069 | 0,449 | 0,201 | 0,072 | 0,426 |
| Derrame pleural | 0,522 | 0,25 | 0,043 | 0,473 | 0,226 | 0,071 |
| Clase III de la NYHA | –0,316 | 0,078 | 0,244 | –0,327 | 0,08 | 0,251 |
| Índice de comorbilidad de Charlson | 0,247 | 0,197 | 0,252 | 0,161 | 0,162 | 0,445 |
| Frecuencia cardiaca | 0,100 | 0,227 | 0,262 | 0,056 | 0,189 | 0,462 |
| Presión arterial sistólica | 0,050 | 0,174 | 0,559 | –0,006 | 0,15 | 0,734 |
| Ritmo cardiaco | ||||||
| Ritmo sinusal | 0,450 | 0,225 | 0,081 | 0,434 | 0,217 | 0,099 |
| Fibrilación auricular | –0,263 | 0,126 | 0,313 | –0,222 | 0,106 | 0,390 |
| Flutter auricular | –0,108 | 0,023 | 0,725 | –0,137 | 0,029 | 0,532 |
| Tipo de BRH | ||||||
| Ninguno | 0,308 | 0,153 | 0,231 | 0,208 | 0,103 | 0,421 |
| BRIH completo | –0,457 | 0,221 | 0,073 | –0,410 | 0,198 | 0,106 |
| BRDH completo | 0,263 | 0,097 | 0,324 | 0,345 | 0,127 | 0,185 |
| Ritmo de marcapasos | –0,464 | 0,187 | 0,074 | –0,402 | 0,162 | 0,119 |
| Hemoglobina (g/dl) | –0,233 | 0,105 | 0,959 | –0,241 | 0,103 | 0,964 |
| Recuento leucocitario (×106células/μl) | 0,050 | 0,17 | 0,606 | 0,025 | 0,152 | 0,744 |
| Neutrófilos (×106células/μl) | –0,018 | 0,158 | 0,700 | –0,028 | 0,161 | 0,676 |
| Linfocitos (×106células/μl) | 0,315 | 0,288 | 0,101 | 0,226 | 0,233 | 0,269 |
| Creatinina sérica (mg/dl) | 0,217 | 0,193 | 0,465 | 0,143 | 0,171 | 0,632 |
| TFGe (ml/min/1,73 m2) | 0,040 | 0,21 | 0,395 | 0,155 | 0,193 | 0,502 |
| Sodio (mEq/l) | 0,122 | 0,208 | 0,299 | 0,081 | 0,204 | 0,321 |
| NT-proBNP (pg/ml) | –0,217 | 0,181 | 0,567 | –0,205 | 0,184 | 0,538 |
| CA125 (U/ml) | 0,024 | 0,214 | 0,360 | 0,003 | 0,215 | 0,370 |
| FEVI (%) | –0,064 | 0,139 | 0,808 | –0,045 | 0,144 | 0,766 |
| En tratamiento con bloqueadores beta | –0,164 | 0,082 | 0,526 | –0,144 | 0,072 | 0,559 |
| Diuréticos | ||||||
| En tratamiento con IECA | 0,070 | 0,036 | 0,779 | 0,099 | 0,05 | 0,694 |
| En tratamiento con ARA-II | 0,050 | 0,013 | 0,886 | 0,057 | 0,014 | 0,828 |
| DAI | –0,232 | 0,092 | 0,378 | –0,170 | 0,068 | 0,505 |
| TRC | –0,237 | 0,076 | 0,375 | –0,173 | 0,055 | 0,496 |
ARA-II: antagonistas de los receptores de la angiotensina II; BRDH: bloqueo de rama derecha del haz; BRH: bloqueo de rama del haz; BRIH: bloqueo de rama izquierda del haz; CA125: antígeno carbohidrato 125; DAI: desfibrilador automático implantable; EAP: enfermedad arterial periférica; EPOC: enfermedad pulmonar obstructiva crónica; FEVI: fracción de eyección del ventrículo izquierdo; ICAD: insuficiencia cardiaca aguda descompensada; IECA: enzima de conversión de la angiotensina; IM: infarto de miocardio; KS: estadístico de la prueba de Kolmogorov-Smirnov; MEE: magnitud del efecto estandarizada; NT-proBNP: fracción aminoterminal del propéptido natriurético cerebral; NYHA: New York Heart Association; TFGe: tasa de filtrado glomerular estimado; TRC: terapia de resincronización cardiaca.
Para todos los análisis de supervivencia, se censuró el seguimiento de los pacientes en caso de muerte o trasplante cardiaco durante el periodo de seguimiento.
El riesgo acumulado de mortalidad por cualquier causa (utilizando el seguimiento completo y los DVFH) y del objetivo combinado de mortalidad y reingreso por ICA se presentó con el método de Kaplan-Meier, y las diferencias se evaluaron con la prueba de Cox. El efecto de la intervención se evaluó estimando una razón de riesgos (HR) ponderada con la PS a través de una regresión ajustada de Cox.
Las diferencias de riesgo absoluto ponderadas por la PS y su recíproco (número de pacientes que es necesario tratar) para el grupo de DPCA se estimaron a partir de un análisis de Cox y para cada objetivo clínico28. Según lo recomendado, estas estimaciones se calcularon en momentos determinados durante el seguimiento29. En todos los análisis se consideró estadísticamente significativo un valor de p bilateral < 0,05. Todos los análisis se realizaron con los programas STATA 12.0 y R.
ResultadosSegún lo establecido en los criterios de inclusión, todos los pacientes se encontraban en clase III-IV de la NYHA, habían sido hospitalizados anteriormente por ICA y mostraban signos y síntomas de congestión persistentes (a pesar del tratamiento con diuréticos de asa). La media de edad era 73,4 ± 9,2 años; el 75,8% de los pacientes eran varones y el 66,1% tenía antecedentes de cardiopatía isquémica. Las medianas de índice de comorbilidad de Charlson, TFGe, fracción de eyección del ventrículo izquierdo, fracción aminoterminal del propéptido natriurético cerebral en plasma y dosis diaria de furosemida fueron 4 [3-6], 30,6 [20-44,5] ml/min/1,73 m2, 38,5% [30-49%], 10.703 [5.672-23.075] pg/ml y 160 [120-160] mg respectivamente. No se observaron diferencias significativas en los parámetros clínicos, electrocardiográficos, analíticos y de tratamiento médico entre los pacientes del grupo de DPCA y los de control (Tabla 2). La comparación ponderada de las covariables basales mostró un equilibrio excelente de los dos grupos de tratamiento de DPCA (Tabla 1).
Tabla 2. Características basales
| Grupo control (n = 34) | Pacientes en DPAC (n = 28) | p | |
| Características demográficas y antecedentes patológicos | |||
| Edad (años) | 77 [69-79] | 75 [68-78] | 0,322 |
| Varones | 26 (76,5) | 21 (75) | 1 |
| Peso (kg) | 80 [66-90] | 76 [70-86] | 0,994 |
| Hipertensión | 30 (88,2) | 27 (96,4) | 0,366 |
| Dislipemia | 20 (58,8) | 22 (78,6) | 0,112 |
| Diabetes | 10 (29,4) | 11 (39,3) | 0,434 |
| Fumador actual | 2 (5,9) | 2 (7,1) | 1 |
| Ex fumador | 16 (47,1) | 9 (32,1) | 0,301 |
| Cardiopatía isquémica | 22 (64,7) | 19 (67,9) | 1 |
| Valvulopatía cardiaca | 11 (32,3) | 11 (39,3) | 0,604 |
| EPOC | 6 (17,6) | 8 (28,6) | 0,368 |
| Edema periférico | 28 (82,3) | 25 (89,3) | 0,494 |
| Clase III-IV de la NYHA | 34 (100) | 28 (100) | 1 |
| Índice de comorbilidad de Charlson | 4 [3-6] | 4,5 [4-5,5] | 0,334 |
| Constantes vitales | |||
| Frecuencia cardiaca (lpm) | 76 [65-90] | 79 [72-100] | 0,419 |
| PAS (mmHg) | 120 [112-140] | 129 [111-150] | 0,656 |
| PAD (mmHg) | 70 [60-80] | 70 [61-80] | 0,814 |
| Electrocardiografía | |||
| Fibrilación auricular | 18 (52,9) | 10 (35,7) | 0,207 |
| QRS > 120 ms | 21 (61,8) | 13 (46,4) | 0,306 |
| BRIH | 16 (47,1) | 7 (25) | 0,113 |
| Laboratorio | |||
| Hemoglobina (g/dl) | 11 [9,8-12,8] | 11,1 [9,7-12,6] | 0,692 |
| Creatinina sérica (mg/dl) | 2,15 [1,42-2,78] | 2,22 [1,64-3,27] | 0,432 |
| Urea (mg/dl) | 97 [76-140] | 106 [67-145] | 0,882 |
| TFGe a (ml/min/1,73 m2) | 31 [22-49] | 30 [18-39] | 0,404 |
| Sodio (mEq/l) | 137 [135-141] | 139 [136-142] | 0,259 |
| NT-proBNP (pg/ml) | 10.703 [5.672-34.837] | 10.565 [5.506-18.985] | 0,733 |
| CA125 (U/ml) | 60 [31-145] | 86 [40-142] | 0,515 |
| Ecocardiografía | |||
| FEVI (%) | 39 [29-51] | 37 [31-46] | 0,887 |
| DDVI (mm) | 60 [53-72] | 60 [50-66] | 0,213 |
| PAPS b (mmHg) | 47 [38-56] | 52 [42-63] | 0,206 |
| Tratamiento médico y uso de dispositivos | |||
| Bloqueadores beta | 20 (58,8) | 16 (57,1) | 1 |
| Dosis de furosemida (mg) | 160 [120-160] | 150 [120-180] | 0,922 |
| Tiacidas | 3 (8,8) | 2 (7,1) | 1 |
| Espironolactona | 14 (41,2) | 9 (32,1) | 0,599 |
| IECA | 11 (32,3) | 8 (28,6) | 0,788 |
| ARA-II | 6 (17,6) | 6 (21,4) | 0,755 |
| Estatinas | 17 (50) | 20 (71,4) | 0,120 |
| Anticoagulantes orales | 15 (44,2) | 14 (50) | 0,799 |
| Nitratos | 10 (29,4) | 8 (28,6) | 1 |
| Digoxina | 4 (11,8) | 5 (17,9) | 0,719 |
| Marcapasos | 10 (29,4) | 3 (10,7) | 0,116 |
| DAI | 8 (23,5) | 4 (14,3) | 0,521 |
| TRC | 5 (14,7) | 2 (7,14) | 0,442 |
ARA-II: antagonistas de los receptores de la angiotensina II; BRIH: bloque de rama izquierda del haz; CA125: antígeno carbohidrato 125; DAI: desfibrilador automático implantable; DDVI: diámetro diastólico del ventrículo izquierdo; DPAC: diálisis peritoneal ambulatoria crónica; EPOC: enfermedad pulmonar obstructiva crónica; FEVI: fracción de eyección del ventrículo izquierdo; IECA: inhibidores de la enzima de conversión de la angiotensina; NT-proBNP: fracción aminoterminal del propéptido natriurético cerebral; NYHA: New York Heart Association; PAD: presión arterial diastólica; PAPS: presión arterial pulmonar sistólica; PAS: presión arterial sistólica; TFGe: tasa de filtrado glomerular estimado; TRC: terapia de resincronización cardiaca.
Los valores expresan mediana [intervalo intercuartílico] o n (%).
a Basada en la fórmula de Modification of Diet in Renal Disease.
b Datos disponibles para 51 pacientes.
Entre los 62 pacientes considerados inicialmente elegibles para participar en el programa de DPCA, hubo 39 muertes (62,9%), 21 reingresos por ICA (33,9%) y 42 muertes/reingresos por ICA (67,8%) durante el seguimiento (tras una mediana de 16 [6-22] meses). Se identificó la causa de la muerte como cardiovascular en 31 (79,5%); de estos casos, en 18 la causa de la muerte se clasificó como secundaria a una IC progresiva.
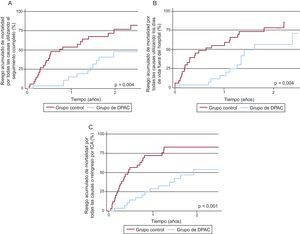
Al estratificar los resultados según la intervención terapéutica, los pacientes tratados con DPCA mostraron unas tasas más bajas de: a) mortalidad durante todo el periodo de seguimiento (2,81 frente a 7,34 cada 10 años-paciente de seguimiento; p = 0,004); b) mortalidad aplicando los DVFH (3,55 frente a 9,50 cada 10 años-paciente de seguimiento; p = 0,004); c) reingreso por ICA (2,13 frente a 5,99 cada 10 años-paciente de seguimiento; p = 0,011), y d) la variable de valoración combinada de muerte/reingreso por ICA (3,57 frente a 10,91 cada 10 años-paciente de seguimiento; p < 0,001). Se observaron diferencias sustanciales en cuanto a la mortalidad por cualquier causa al emplear el seguimiento completo (Figura 2A), los DVFH (Figura 2B) y el objetivo combinado de muerte/reingreso por ICA (Figura 2C), que se observaron ya en los primeros meses y alcanzaron su máximo aproximadamente al año. Además, los pacientes del grupo de tratamiento mostraron menor número de muertes por causas cardiovasculares que los controles: 8 frente a 23 pacientes (p < 0,001), lo cual se atribuyó sobre todo a una reducción sustancial de la mortalidad debida a progresión de la IC (4 frente a 14 pacientes; p = 0,004). No se observaron diferencias significativas en la mortalidad por causas no cardiovasculares (3 frente a 5 pacientes; p = 0,493). Es de destacar que, entre los pacientes tratados con DPCA, solamente hubo 4 muertes atribuidas a IC progresiva, mientras 2 de las muertes registradas se debieron a peritonitis complicada.
Figura 2. Incidencia acumulada de mortalidad por todas las causas y de la variable de valoración combinada de mortalidad por todas las causas y reingreso por insuficiencia cardiaca aguda, estratificada según el tratamiento con diálisis peritoneal ambulatoria continua. A: mortalidad por todas las causas utilizando el seguimiento completo. B: mortalidad por todas las causas utilizando los días de vida fuera del hospital como tiempo de seguimiento. C: mortalidad por todas las causas o reingreso por insuficiencia cardiaca aguda. DPAC: diálisis peritoneal ambulatoria continua; ICA: insuficiencia cardiaca aguda.
Análisis ajustados mediante puntuación de propensiónEn la Tabla 3 se muestra la HR ponderada con la PS asociada al tratamiento para cada criterio de valoración final. Los pacientes tratados con DPCA presentaron una reducción significativa del riesgo de todos los objetivos clínicos, en comparación con el grupo control. El grado de reducción del riesgo osciló entre el 60 y el 70%, excepto para la mortalidad cardiovascular, que mostró una reducción próxima al 80%.
Tabla 3. Diálisis peritoneal ambulatoria continua y resultados clínicos. Riesgos ajustados
| HR (IC95%) | p | |
| Muerte por todas las causas | ||
| Seguimiento completo | 0,40 (0,21-0,75) | 0,005 |
| Días de vida fuera del hospital | 0,39 (0,21-0,74) | 0,004 |
| Muerte cardiovascular | 0,18 (0,04-0,74) | 0,017 |
| Muerte por insuficiencia cardiaca progresiva | 0,29 (0,10-0,86) | 0,026 |
| Combinación de muerte por todas las causas y rehospitalización por ICA | 0,32 (0,17-0,61) | 0,001 |
HR: razón de riesgos; IC95%: intervalo de confianza del 95%; ICA: insuficiencia cardiaca aguda.
Mediante la emulación de un análisis por intención de tratar, en el que se consideró a todos los pacientes a los que se implantó un catéter peritoneal (n = 34) con independencia de si se había iniciado o no una DPCA, se observó que las HR ajustadas para los objetivos clínicos apuntaban también a un beneficio pronóstico con el uso de DPAC. Estas diferencias fueron de una magnitud importante, pero no alcanzaron significación estadística para la mortalidad al utilizar el seguimiento completo (HR = 0,62; IC95%, 0,32-1,20; p = 0,155) o para la mortalidad usando los DVFH (HR = 0,63; IC95%, 0,32-1,22; p = 0,167), pero sí fueron significativas para la combinación de muerte y reingreso por ICA (HR = 0,52; IC95%, 0,28-0,98; p = 0,042).
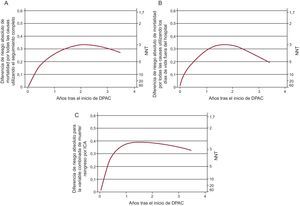
Como medida absoluta de la asociación entre la DPCA y la mortalidad por cualquier causa, se estimaron las diferencias de riesgo absoluto ajustadas con la PS, así como el número de pacientes que es necesario tratar, y se representaron gráficamente a lo largo del periodo de seguimiento (Figura 3). Según la evaluación a 1 año, era necesario tratar con DPCA a 3-5 pacientes para prevenir 1 muerte o un episodio del objetivo final combinado de muerte/reingreso por ICA. Los beneficios máximos para todos los objetivos se observaron entre el primer y el segundo año después del inicio de la DPCA.
Figura 3. Reducciones del riesgo absoluto y el número que es necesario tratar para los resultados de tiempo hasta el evento. A: mortalidad por todas las causas utilizando el seguimiento completo. B: mortalidad por todas las causas utilizando los días de vida fuera del hospital como tiempo de seguimiento. C: mortalidad por todas las causas o reingreso por insuficiencia cardiaca aguda. DPAC: diálisis peritoneal ambulatoria continua; ICA: insuficiencia cardiaca aguda; NNT: número de pacientes que es necesario tratar.
DiscusiónLos resultados de este estudio indican que la DPAC puede desempeñar un papel importante en la modificación de la evolución natural de los pacientes con ICC refractaria, en los que se da una sobrecarga de líquidos persistente (a pesar del tratamiento diurético intensivo) y la coexistencia de insuficiencia renal. De hecho, la magnitud de la reducción de mortalidad atribuida a la DPCA fue muy notable en cuanto a disminución del riesgo relativo y absoluto. Se observó una reducción del riesgo relativo de más del 50% para todos los objetivos clínicos, lo cual va en la misma línea que la estimación del número de pacientes que es necesario tratar entre 3 y 6. Empleando la misma cohorte, la evidencia presentada recientemente por nuestro grupo indica que la DPAC se asoció a una mejoría notable y significativa de la clase funcional de la NYHA, la capacidad física (distancia recorrida en 6 min de marcha), la calidad de vida (Minnesota Living With Heart Failure Questionnaire) y el perfil bioquímico a los 45 y 180 días20. Es de destacar que otros grupos han presentado resultados similares en cuanto a la mejora de criterios de valoración intermedios14, 15, 16, 17, 18, 19. Sin embargo, no hay datos respecto al efecto de la DPCA en criterios de valoración «duros», tal vez por la dificultad de seleccionar un grupo de comparación apropiado.
Hasta el momento, este es el primer estudio que realiza una comparación formal con un grupo control. Además, a diferencia de otras series, nuestra población incluyó a un grupo no seleccionado de pacientes y la indicación de la DPCA se estableció por condiciones cardiacas.
Ultrafiltración en la insuficiencia cardiacaDurante las últimas décadas, la ultrafiltración extracorpórea se ha utilizado para la extracción de líquido de pacientes hipervolémicos refractarios a los diuréticos. Algunos ensayos recientes en los que se han utilizado aparatos de manejo sencillo han demostrado su eficacia para reducir la congestión de los pacientes con sobrecarga de volumen12, 13. Por ejemplo, en pacientes con IC descompensada, el ensayo UNLOAD (The randomized Ultrafiltration vs IV Diuretics for Patients Hospitalized for Acute Decompensated CHF) demostró que la ultrafiltración produce de manera segura una reducción de peso y una pérdida de líquido a corto plazo superiores a las obtenidas con los diuréticos intravenosos30. Además, el grupo de pacientes asignado a la ultrafiltración tuvo menos reingresos hospitalarios en un plazo de 90 días, pero no evidenció beneficio en cuanto a la supervivencia30. Por otro lado, la aplicación de esta técnica requiere capacitación, equipamiento y seguimiento especializados, lo cual limita a unidades específicas su empleo durante los episodios de descompensación. Además, hay ciertas cuestiones económicas y de seguridad que son aún motivo de preocupación12, 13.
La diálisis peritoneal es una terapia sustitutiva renal que ha surgido como alternativa terapéutica para el control de la sobrecarga de líquidos en los pacientes con ICC refractaria y brinda la posibilidad de aplicar una ultrafiltración lenta, diaria y ambulatoria.
Estudios previosNuestros resultados van en la misma línea con reportes de casos y series observacionales que muestran un efecto favorable de la DPCA en parámetros clínicos, hemodinámicos, bioquímicos y ecocardiográficos14, 15, 16, 17, 18, 19. Sin embargo, la mayoría de estos estudios son retrospectivos, no definieron claramente los criterios de inclusión y la mayor parte de los pacientes incluidos presentaban insuficiencia renal en fase terminal. Por ejemplo, en uno de los estudios más amplios, Gotloib et al14 observaron una mejoría clínica y hemodinámica significativa 1 año después del inicio de la diálisis peritoneal en una muestra de 20 pacientes con ICC en fase terminal y TFG medio de 14,84 ± 3,8ml/min. Por el contrario, los pacientes de nuestra cohorte presentaron signos de disfunción renal en estadio 2-4 (mediana de TFGe, 30 ml/min/1,73 m2), valores estos con los que actualmente no está indicado el tratamiento sustitutivo renal. De igual modo, un estudio reciente llevado a cabo en España (similar al de nuestra cohorte por lo que respecta a la TFG) describió una notable mejoría clínica (NYHA) y hemodinámica (presión arterial pulmonar) asociada a la DPAC en 17 pacientes con ICC refractaria16. Además, estos autores observaron unas tasas de mortalidad similares (esperanza de vida del 82% tras 12 meses de tratamiento y del 70 y el 56% tras 18 y 24 meses respectivamente) a las observadas en este trabajo (Figura 2A). Por último, esos autores indicaron que la diálisis peritoneal tuvo una relación de coste-efectividad favorable en comparación con el tratamiento estándar16. Recientemente, sobre 118 pacientes con ICC refractaria incluidos en un programa de diálisis peritoneal, Koch et al21 han descrito unas tasas de supervivencia a los 3, 6 y 12 meses del 77, el 71 y el 55%.
Por lo que respecta a la seguridad de esta intervención, anteriormente hemos descrito una tasa elevada de peritonitis (1 episodio cada 16,18 meses) en comparación con otras series actuales de pacientes en diálisis peritoneal22, pero similar a las observadas en los pacientes cardiorrenales14. Creemos que se puede atribuir en parte estos resultados a la elevada edad de nuestra cohorte, que se traduce en más comorbilidades. Sin embargo, si tenemos en cuenta el mal pronóstico de estos pacientes (Figura 2), el riesgo de peritonitis asociado a la intervención parece aceptable, en especial ante la inexistencia de tratamientos bien establecidos para estos pacientes7, 8.
FisiopatologíaLa evidencia reciente ha resaltado el papel de la congestión, no sólo como marcador de la gravedad de la IC, sino también como factor asociado a la activacion de complejos mecanismos (sistémicos, cardiacos, renales y neurohormonales), que promueven la progresión de la enfermedad4. Por ejemplo, se ha propuesto que los siguientes mecanismos desempeñan un papel importante en la fisiopatología de la congestión sistémica y la progresión de la IC1, 2, 3, 4, 5: a) activación neurohormonal (que favorece la retención de sodio); b) disminución del filtrado renal secundario a la congestión venosa renal; c) predisposición a la isquemia cardiaca subendocárdica; d) modificaciones de la arquitectura ventricular; e) translocación de endotoxinas, y f) interacciones endoteliales.
De acuerdo con las anteriores premisas, nuestros resultados muestran que la inclusión de estos pacientes en un programa de DPCA se asocia a una reducción sustancial de marcadores indirectos de congestión venosa sistémica y renal20, 31. De igual modo, a los 6 meses de iniciada la DPCA, todos los pacientes excepto uno toleraron una reducción de la furosemida a 80 mg/día tras una mediana de dosis inicial de 160 mg. Queda por esclarecer si el efecto pronóstico atribuible a la DPCA en los pacientes con ICC refractaria se limita al control de la sobrecarga de volumen o hay un efecto pleotrópico adicional, como la eliminación de mediadores inflamatorios32.
Cuestiones logísticasEn este artículo ponemos de relieve que se puede considerar la DPCA como alternativa factible para el tratamiento de los pacientes con ICC en la práctica clínica diaria. De hecho, la DPCA se inició en hasta un 82% de los pacientes a los que se implantó un catéter abdominal. Desde una perspectiva logística, la DPCA ofrece algunas ventajas respecto a otras técnicas de ultrafiltración; las más importantes son: la ultrafiltración ambulatoria lenta y diaria, la sencillez (la intervención es fácil de aplicar), la preservación de la función renal residual y la estabilidad hemodinámica.
LimitacionesLa principal limitación de este estudio deriva de que es un estudio observacional pequeño, de un solo centro. No obstante, creemos que nuestros resultados son lo suficientemente sólidos como para tener relevancia clínica. A pesar de que no se asignó aleatoriamente la intervención, el grupo control tenía unas características basales similares a las del grupo de DPCA, puesto que ambos grupos cumplían los criterios de inclusión; además, el uso exhaustivo de ajuste mediante PS aseguró que ambos grupos fueran comparables, como mínimo para todos los factores de confusión medidos. Además, pensamos que, por razones éticas, en este contexto sería difícil realizar un ensayo clínico aleatorizado, teniendo en cuenta la dificultad de aplicar un diseño que enmascarara la intervención utilizada a los pacientes y al investigador33.
Sin embargo, dada la escasa información existente sobre la eficacia, la tolerabilidad y la seguridad de la DPCA en esta población de pacientes con IC, creemos que está justificada la realización de nuevos estudios para confirmar nuestros resultados y definir el perfil óptimo de los candidatos a tratamiento con esta técnica, así como el enfoque logístico óptimo para ella.
ConclusionesEn este estudio observacional, hallamos que el riesgo de eventos clínicos importantes se redujo de manera significativa en los pacientes con ICC avanzada refractaria y disfunción renal concomitante tratados con DPCA. Serán necesarios nuevos estudios, es de esperar que en escenarios más controlados, para confirmar estos resultados y definir la utilidad clínica de la técnica en este subgrupo de pacientes con IC especialmente difíciles de tratar.
FinanciaciónEste estudio se financió con subvenciones no condicionadas del Ministerio de Sanidad y Consumo, Instituto de Salud Carlos III, RED HERACLES RD06/0009/1001, FEDER (Madrid, España), ayuda para proyectos de grupos emergentes en 2010 de la Conselleria de Sanitat de Valencia (DOCV 6.175, 30/12/2009-Annex III), Sociedad Española de Cardiología (Beca Esteve 2009) y Fresenius Medical Care.
Conflicto de interesesNinguno.
Recibido 14 Marzo 2012
Aceptado 6 Mayo 2012
Autor para correspondencia: Servicio de Cardiología, Hospital Clínico Universitario, Avda. Blasco Ibáñez 17, 46010 Valencia, España. yulnunez@gmail.com