Palabras clave
INTRODUCCION
La fibrilación auricular (FA) y el aleteo auricular (AA) son dos arritmias frecuentes. Los pacientes que primariamente presentan FA en general también experimentan AA a lo largo de su vida, y viceversa1,2.
El mecanismo electrofisiológico en ambas arritmias y las alternativas terapéuticas disponibles actualmente son diferentes, por lo que resulta fundamental diferenciar con claridad ambas condiciones3,4.
A veces se plantean problemas de diagnóstico diferencial entre el AA y la FA, que incluso con la obtención de electrogramas intracavitarios es difícil de resolver, especialmente cuando se obtienen registros con un solo catéter en la aurícula derecha, situación que ocurre, por ejemplo, con los dispositivos que tratan taquiarritmias supraventriculares, debido a que algunos episodios de fibrilación auricular pueden presentarse con un patrón eléctrico organizado en esta cavidad.
El propósito de nuestro estudio fue buscar algún parámetro electrofisiológico, fácil de identificar con un solo catéter electrodo en la aurícula derecha, que permita discriminar entre un AA y una FA organizada.
MÉTODOS
En pacientes con indicación de estudio electrofisiológico para ablación de FA, AA típico y AA atípico (se excluyeron las taquicardias focales) se colocó un catéter de 24 polos sobre el seno coronario y el anillo tricúspide lateral (Orbiter®, Bard Electrophysiology). Con este catéter se obtuvo un registro bipolar simultáneo de aurícula derecha (anillo tricúspide lateral e istmo cavotricuspídeo) y aurícula izquierda.
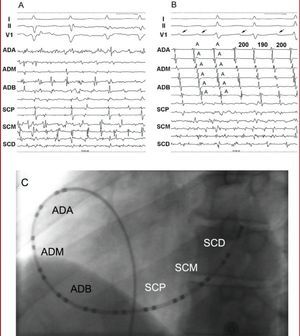
Nuestros pacientes se seleccionaron entre los remitidos a nuestra unidad para ablación de FA (n = 32), AA típico (n = 81) y AA atípico (n = 15) que en el momento del estudio electrofisiológico presentaran la arritmia que se iba a tratar o la desarrollaron durante el procedimiento, espontáneamente o con estimulación programada, y que cumpliesen con los criterios de inclusión. Los casos de FA debían cumplir con la característica de presentar un patrón eléctrico organizado en los registros de aurícula derecha durante períodos de más de 30 s del registro, definido como una secuencia fija y reproducible, y desorganizado (registro con señales fragmentadas, definidas como los registros auriculares con una duración ≥ 150% del electrograma auricular basal o cuya duración sea > 100 ms) en seno coronario (fig. 1). Se definió como AA típico al que cumpliera con la característica de ser dependiente del istmo cavotricuspídeo y como AA atípico a toda arritmia macrorreentrante que se presentara con un patrón eléctrico completamente organizado en los 12 dipolos del registro y que no tuviera dependencia del istmo cavotricuspídeo, utilizando estimulación programada.
Fig. 1. A y B: registros de superficie e intracavitarios de 2 pacientes con fibrilación auricular. Se observan señales irregulares y fragmentadas en los canales correspondientes a ambas aurículas (A) y señales irregulares y fragmentadas en los canales correspondientes a aurícula izquierda y, simultáneamente, señales organizadas en los canales de aurícula derecha (B). En la derivación V1 del electrocardiograma se observa un patrón auricular organizado (flecha). C: proyección radiológica en oblicua anterior izquierda que muestra la disposición del catéter de 24 polos en el seno coronario y la aurícula derecha. I, II, V1: derivaciones del electrocardiograma; A: electrograma auricular; ADA: aurícula derecha alta; ADM: aurícula derecha media; ADB: aurícula derecha baja; SCP: seno coronario proximal; SCM: seno coronario medio; SCD: seno coronario distal.
Se midieron la longitud de ciclo y la variación de cada ciclo auricular en los electrogramas obtenidos en la aurícula derecha alta, en la proximidad de la orejuela derecha (región donde habitualmente se sitúa el cable auricular en los dispositivos de tratamiento de bradiarritmias o taquiarritmias) en 3 canales bipolares consecutivos durante un registro de 15 s. La medición se realizó a una velocidad de registro de 400 mm/s con el fin de que ésta fuera lo más exacta posible.
Los pacientes estudiados no tenían estudio electrofisiológico previo y se encontraban sin tratamiento antiarrítmico en el momento del estudio.
Análisis estadístico
Los valores se expresan como media ± desviación estándar (DE). Para la comparación de variables cuantitativas se utilizó el test de ANOVA y para establecer las diferencias entre las variables se utilizó la corrección de Bonferroni.
Se construyeron curvas ROC para determinar el punto discriminativo de las variables cuantitativas. Se obtuvo el área bajo la curva y su intervalo de confianza (IC) del 95%. Se calcularon los índices de validez de criterio de los test para el punto de máximas sensibilidad y especificidad en relación con el diagnóstico de aleteo: sensibilidad, especificidad, cociente de probabilidad positivo y negativo y valores predictivos positivos y negativos. Los valores de p ≤ 0,05 fueron considerados estadísticamente significativos. Los análisis se realizaron mediante el empleo del software SPSS (versión 13.0) para Windows.
RESULTADOS
Se incluyó en el estudio a un total de 45 pacientes: 15 pacientes con AA atípico, 15 pacientes con AA típico y 15 pacientes con FA. La edad de los pacientes fue de 58 ± 11 años, 28 pacientes (62%) eran varones, 19 pacientes (42%) tenían hipertensión arterial, 6 pacientes (13%) tenían diabetes mellitus y 12 pacientes (27%) tenían cardiopatía estructural: hipertensiva en 7 (16%), isquémica en 4 (9%) y valvular en uno (2%). El tamaño de la aurícula izquierda fue de 43 ± 6 mm. No se observaron diferencias significativas en las características basales de los 3 grupos, salvo en la edad, que fue significativamente menor en el grupo de pacientes con FA (tabla 1).
Los pacientes con AA típico y atípico ingresaron al estudio electrofisiológico con la arritmia, y de los 15 pacientes con FA, 10 de ellos se presentaron con la arritmia y en 5 pacientes ésta fue inducida de forma sostenida (más de 10 min) con estimulación programada auricular.
En los pacientes con FA, la dirección del frente de activación en aurícula derecha fue en sentido craneocaudal en todos los casos y en todos ellos se observó una onda F discernible en la derivación V1 del electrocardiograma de superficie en estable relación con la activación endocárdica (fig. 1).
Longitud de ciclo
La longitud de ciclo medida en los electrogramas bipolares de aurícula derecha fue 232 ± 21 ms en el grupo de AA atípico (rango, 224 ± 22 a 240 ± 21 ms), 234 ± 24 ms en el grupo de AA típico (rango, 227 ± 24 a 240 ± 25 ms) y 183 ± 16 ms en el grupo de FA (rango, 172 ± 15 a 194 ± 17 ms) (p = NS entre los grupos AA típico y atípico y p < 0,05 entre los dos grupos con AA y FA). Una longitud de ciclo ≥ 203 ms permitió discriminar un AA de una FA con una sensibilidad del 97% (IC del 95%, 90,2-100%) y una especificidad del 87% (IC del 95%, 69,5-100%) (p < 0,001) (figs. 2A y 3A). El cociente de probabilidad positivo para este valor fue 7,25 (IC del 95%, 1,99-26,39) y el cociente de probabilidad negativo fue 0,04 (IC del 95%, 0,01-0,27). El valor predictivo positivo con este valor de corte fue del 94% (IC del 95%, 84,9-100%) y el valor predictivo negativo fue del 93% (IC del 95%, 79,4-100%).
Fig. 2. Valor de corte discriminativo entre ambos grupos de aleteo y fibrilación auricular y variación de la longitud de ciclo (B) en los 3 grupos. AAA: aleteo auricular atípico; AAT: aleteo auricular típico; FA: fibrilación auricular; LC: longitud de ciclo.
Fig. 3. Curvas ROC para longitud de ciclo (A) y variación de longitud de ciclo (B) AUC: área bajo la curva; IC: intervalo de confianza del 95%.
Variación del ciclo
La variación del ciclo fue de 16 ± 7 ms en el grupo AA atípico, 13 ± 4 ms en el grupo AA típico y 22 ± 7 ms en el grupo FA (p < 0,05 entre AA común y FA; p = NS entre los otros grupos) (fig. 2B). Una variación de la longitud de ciclo ≤ 18 ms permitió discriminar un AA de una FA con una sensibilidad del 70% (IC del 95%, 53,6-86,4%) y una especificidad del 80% (IC del 95%, 59,8-100%) (fig. 3B). El cociente de probabilidad positivo para este valor fue 3,5 (IC del 95%, 1,24-9,89) y el cociente de probabilidad negativo fue 0,38 (IC del 95%, 0,21-0,67). El valor predictivo positivo con este valor de corte fue del 88% (IC del 95%, 74,3-100%) y el valor predictivo negativo fue del 57% (IC del 95%, 36-78,3%).
Longitud y variación de ciclo
Al utilizar ambos criterios en conjunto para discriminar un AA de una FA (longitud de ciclo [LC] ≥ 203 ms y variación de LC ≤ 18 ms) se obtuvo una sensibilidad del 99%, una especificidad del 69%, un valor predictivo positivo del 26% y un valor predictivo negativo del 99%.
DISCUSION
Hallazgos principales
Las dos observaciones principales de nuestro estudio fueron, en primer lugar, que hay diferencias significativas entre la LC y la variación de éste en la aurícula derecha, entre el AA y la FA que se presenta con un patrón de activación organizado en dicha cavidad. La LC fue mayor y la variación de éste fue menor en el AA respecto a la FA, sin encontrarse diferencias significativas entre ambos tipos de AA. En segundo lugar, la longitud de ciclo fue mejor parámetro diferenciador que la variación de éste entre un AA y este subgrupo de FA. Con una longitud de ciclo ≥ 203 ms se logró discriminar un AA de una FA con buena sensibilidad y especificidad, resultando 7,25 veces más probable que se trate de un AA cuando la LC se encuentre por encima de este valor de corte y 25 veces más probable que con un valor menor de LC se descarte este diagnóstico. Por otra parte, al combinar ambos parámetros se observó un leve aumento de la sensibilidad del test a expensas de una disminución significativa de la especificidad, por lo que el uso conjunto de ambas variables no mejoró el rendimiento diagnóstico.
No se consideraron en la evaluación las longitudes de ciclo mínimas, ya que éstas podrían considerar la presencia de artefactos, que determinarían intervalos excesivamente cortos y sobrestimarían el diagnóstico de FA.
Fibrilación auricular organizada en la aurícula derecha
En el momento actual no hay una definición de FA simple y aplicable tanto al electrocardiograma como a los registros electrofisiológicos. Se ha descrito que la FA y el AA son dos arritmias que están interrelacionadas y que, por distintos mecanismos, una participa en la génesis de la otra, y viceversa5. Sin embargo, ambas arritmias pueden coexistir en un mismo paciente haciendo difícil su diagnóstico diferencial, especialmente cuando se trata de un AA atípico o una FA organizada. Este tipo de FA se caracteriza por presentar un patrón de activación endocárdico desorganizado en la aurícula izquierda y organizado en aurícula derecha, tal como han descrito algunos autores y como hemos ilustrado en nuestro trabajo6-9. Roithinger et al9, en una serie de 16 pacientes con FA en los que que realizó un mapeo endocárdico de diferentes sitios de aurícula derecha y seno coronario en un lapso de 50 min, observaron que hasta en el 72% de este tiempo había una activación organizada de la zona trabeculada de aurícula derecha, en contraste con sólo el 19% del tiempo en la zona lisa de esta cavidad y el 51% del tiempo en el seno coronario. Sin embargo, esto no ha sido estudiado sistemáticamente en la población de pacientes con FA, por lo que no se conocen su prevalencia, su significado clínico y sus implicaciones terapéuticas, y no hay una clara explicación de su mecanismo. Una posible hipótesis que explica este patrón eléctrico en algunos pacientes es que el circuito primario causante del sostenimiento de la FA se encuentra en la aurícula izquierda, y la aurícula derecha es activada de manera pasiva. En este sentido, se ha estudiado la conducción interauricular y se ha demostrado que ambas aurículas se comunican entre sí por medio de rutas preferenciales de conducción ubicadas en torno al ostium del seno coronario, la fosa oval y la región anterosuperior del septo interauricular10. Probablemente, de forma similar a lo que ocurre en la génesis del AA, este patrón eléctrico en la aurícula derecha observado durante la FA se produce debido a la presencia de un bloqueo funcional a través de la cresta terminal, de tal manera que la conducción fibrilatoria proveniente de aurícula izquierda, modulada de alguna forma a través de las ramas del haz de Bachmann y el resto de fibras preferenciales, se organiza y muestra un patrón de activación organizado en sentido craneocaudal en la pared lateral y caudocraneal en la pared septal de la aurícula derecha, o viceversa, simulando la secuencia de activación de un AA dependiente del istmo11. Esta modulación de la conducción entre aurícula izquierda y derecha ha sido estudiada, de alguna manera, por O'Donnell et al12. Estos autores analizaron los períodos refractarios y los tiempos de conducción del haz de Bachmann y de la región del ostium del seno coronario en pacientes referidos para ablación de FA, y observaron que tanto los períodos refractarios como el retraso en la conducción a trav&ea cute;s de estas estructuras durante la estimulación decremental desde aurícula izquierda eran significativamente mayores en pacientes con FA comparados con un grupo control, lo que indica que estas estructuras poseen un comportamiento electrofisiológico distinto en cada paciente12.
Utilidad clínica
Una rápida detección de taquiarritmias auriculares y una segura discriminación entre AA y FA tienen importantes implicaciones clínicas en el uso y la programación de marcapasos y desfibriladores con posibilidad de terapias auriculares. En estos pacientes, la eficacia comunicada con terapias de estimulación auricular antitaquicardia va desde un 30 hasta un 50% de los episodios, dependiendo de las series13-15. Se sabe que las arritmias auriculares (taquicardia auricular, AA y FA) están interrelacionadas y, en este sentido, la baja eficacia relativa de las terapias de estimulación puede deberse a una mala interpretación de la arritmia detectada por el dispositivo, más aún si la detección auricular se realiza con un solo catéter electrodo implantado en la aurícula derecha. Esto puede ser causa de error de detección y terapia ineficaz. Sin embargo, desde el punto de vista clínico interesa programar el dispositivo de tal forma que no ocurra una infradetección significativa de episodios de AA aunque trate con sobreestimulación algunos de FA. El empleo de este algoritmo fácil de utilizar también tiene utilidad práctica durante el estudio electrofisiológico de pacientes con taquicardias en los casos en que se disponga de un solo catéter en la aurícula derecha, para poder discriminar de forma rápida un AA de una FA organizada.
Estudios previos
Se han utilizado diversos métodos para poder diferenciar un AA de una FA. Algunos de estos métodos son fáciles de aplicar. Jung et al estudiaron a 28 pacientes y encontraron que una longitud de ciclo media mayor de 315 ms discriminaba a los pacientes con ritmo sinusal de los que tenían AA o FA, y que una desviación estándar mayor a 11,5 ms discriminaba a los que tenían una FA de un AA16. Sin embargo, este estudio no especifica si los episodios de FA incluidos presentan o no un patrón organizado en el registro de aurícula derecha. Otros autores han utilizado métodos complejos que requieren el empleo de analizadores específicos para discriminar un AA de una FA, como son la evaluación de la variabilidad entre las señales mediante la aplicación de una transformada y el cálculo de una desviación estándar para diferentes escalas17, análisis bayesianos con una suma de elementos como la regularidad, frecuencia, distribución de la energía de las señales obtenidas, etc.18, y análisis del dominio de tiempo del complejo QRS sustraído en el electrocardiograma19. En general, todos estos algoritmos propuestos tienen un rendimiento adecuado para realizar el diagnóstico diferencial entre ambas arritmias. Sin embargo, su utilización se limita prácticamente a la investigación debido a que se requiere tiempo para su análisis y el empleo de tecnología específica.
Limitaciones
La principal limitación de nuestro estudio es que los pacientes con FA pertenecen a una población seleccionada de pacientes referidos para ablación de FA, por lo que los resultados pueden no ser aplicables a pacientes con FA en general.
CONCLUSIONES
La longitud de ciclo y la variación de la longitud de ciclo de los electrogramas medidos en la aurícula derecha son significativamente diferentes entre el AA y la FA organizada en la aurícula derecha, por ser la longitud de ciclo mayor y la variación de éste menor en el AA. Una longitud de ciclo ≥ 203 ms permitió discriminar un AA de una FA con buena sensibilidad y especificidad. La variación de la longitud de ciclo no mejoró el rendimiento diagnóstico entre ambas arritmias.
Correspondencia: Dr. J. Villacastín.
Unidad de Arritmias. Instituto Cardiovascular. Hospital Clínico San Carlos.
Prof. Martín Lagos, s/n. 28040 Madrid. España.
Correo electrónico: jvillacastin@secardiologia.es
Recibido el 12 de diciembre de 2005.
Aceptado para su publicación el 2 de noviembre de 2006.