Al parecer, la enfermedad coronavírica de 2019 (COVID-19) se asocia con mayor riesgo de lesión miocárdica, especialmente en pacientes críticos1. Las definiciones anteriores del síndrome cardiovascular agudo por COVID-192 han sido heterogéneas, por lo que su incidencia real, su relevancia clínica y su impacto en el pronóstico continúan sin estar claros. El objetivo de este estudio es analizar las alteraciones ecocardiográficas y los biomarcadores en pacientes con COVID-19 que requieren cuidados intensivos y su asociación con la supervivencia a 30 días.
Se trata de un estudio de cohortes prospectivo y observacional de pacientes ingresados en la unidad de cuidados intensivos (UCI) del Hospital Universitario La Paz (Madrid, España) con infección confirmada por COVID-19 y síndrome de dificultad respiratoria aguda entre el 1 de marzo y el 8 de abril de 2020. Se analizaron los biomarcadores séricos de todos los pacientes. Siguiendo las recomendaciones actuales3,4, se realizó un estudio ecocardiográfico3 dirigido por cardiólogos acreditados. El objetivo principal fue la supervivencia a 30 días. Se registraron eventos cardiovasculares mayores durante el seguimiento, como miocarditis, pericarditis, embolia pulmonar (EP) y arritmias ventriculares. Se hizo un seguimiento de los pacientes hasta el alta hospitalaria o la muerte. El estudio se realizó conforme a la Declaración de Helsinki y fue aprobado por el comité de ética del centro.
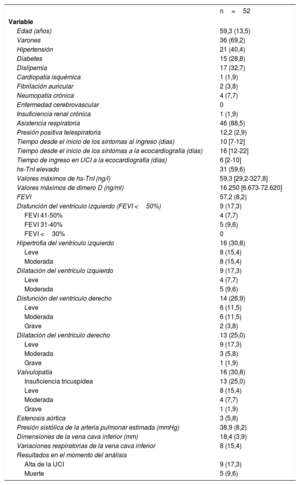
Se incluyó a 52 pacientes (tabla 1) y la mediana [intervalo intercuartílico] de seguimiento fue de 46 [22-54] días. Los hallazgos más frecuentes de nuestro estudio fueron las alteraciones del ventrículo derecho (VD), principalmente disfunción sistólica (26,9%) y dilatación del VD (25,0%). La disfunción y la dilatación del ventrículo izquierdo fueron menos prevalentes en nuestra cohorte.
Características de los pacientes
| n=52 | |
|---|---|
| Variable | |
| Edad (años) | 59,3 (13,5) |
| Varones | 36 (69,2) |
| Hipertensión | 21 (40,4) |
| Diabetes | 15 (28,8) |
| Dislipemia | 17 (32,7) |
| Cardiopatía isquémica | 1 (1,9) |
| Fibrilación auricular | 2 (3,8) |
| Neumopatía crónica | 4 (7,7) |
| Enfermedad cerebrovascular | 0 |
| Insuficiencia renal crónica | 1 (1,9) |
| Asistencia respiratoria | 46 (88,5) |
| Presión positiva telespiratoria | 12,2 (2,9) |
| Tiempo desde el inicio de los síntomas al ingreso (días) | 10 [7-12] |
| Tiempo desde el inicio de los síntomas a la ecocardiografía (días) | 16 [12-22] |
| Tiempo de ingreso en UCI a la ecocardiografía (días) | 6 [2-10] |
| hs-TnI elevado | 31 (59,6) |
| Valores máximos de hs-TnI (ng/l) | 59,3 [29,2-327,8] |
| Valores máximos de dímero D (ng/ml) | 16.250 [6.673-72.620] |
| FEVI | 57,2 (8,2) |
| Disfunción del ventrículo izquierdo (FEVI <50%) | 9 (17,3) |
| FEVI 41-50% | 4 (7,7) |
| FEVI 31-40% | 5 (9,6) |
| FEVI <30% | 0 |
| Hipertrofia del ventrículo izquierdo | 16 (30,8) |
| Leve | 8 (15,4) |
| Moderada | 8 (15,4) |
| Dilatación del ventrículo izquierdo | 9 (17,3) |
| Leve | 4 (7,7) |
| Moderada | 5 (9,6) |
| Disfunción del ventrículo derecho | 14 (26,9) |
| Leve | 6 (11,5) |
| Moderada | 6 (11,5) |
| Grave | 2 (3,8) |
| Dilatación del ventrículo derecho | 13 (25,0) |
| Leve | 9 (17,3) |
| Moderada | 3 (5,8) |
| Grave | 1 (1,9) |
| Valvulopatía | 16 (30,8) |
| Insuficiencia tricuspídea | 13 (25,0) |
| Leve | 8 (15,4) |
| Moderada | 4 (7,7) |
| Grave | 1 (1,9) |
| Estenosis aórtica | 3 (5,8) |
| Presión sistólica de la arteria pulmonar estimada (mmHg) | 38,9 (8,2) |
| Dimensiones de la vena cava inferior (mm) | 18,4 (3,9) |
| Variaciones respiratorias de la vena cava inferior | 8 (15,4) |
| Resultados en el momento del análisis | |
| Alta de la UCI | 9 (17,3) |
| Muerte | 5 (9,6) |
FEVI: fracción de eyección del ventrículo izquierdo; hs-TnI: troponina I de alta sensibilidad; UCI: unidad de cuidados intensivos.
Los valores expresan n (%), media±desviación estándar o mediana [intervalo intercuartílico].
La mediana [intervalo intercuartílico] de troponina I de alta sensibilidad (hs-TnI) y los valores máximos del dímero D se muestran en la tabla 1. El dímero D fue significativamente más alto en pacientes con dilatación del VD (69.645 [36.621-122.040] frente a 11.344 [6.519-52.363] ng/ml; p=0,02) y disfunción sistólica del VD (63.872 [25.284-112.085] frente a 10.972 [6.498-59.450] ng/ml; p=0,01) en comparación con aquellos con un VD normal. Por el contrario, la mediana de hs-TnI no se asoció con mayor incidencia de alteraciones cardiacas estructurales. No se encontraron diferencias entre la presión positiva telespiratoria y la función o las dimensiones del VD.
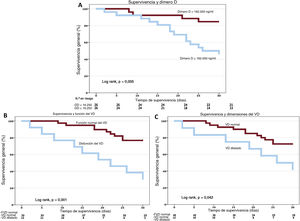
Se realizaron análisis de supervivencia de Kaplan-Meier de todos los pacientes. La supervivencia a los 30 días de los pacientes con valores de dímero D más altos que la mediana fue significativamente menor (figura 1). También se encontraron tasas más bajas de supervivencia a 30 días entre los pacientes con disfunción y dilatación del VD.
Análisis de supervivencia. Curvas de supervivencia de Kaplan-Meier que representan la supervivencia acumulada a 30 días mediante los valores máximos de dímero D, teniendo en cuenta un valor medio de 16.250 ng/ml (A), el funcionamiento del ventrículo derecho (B) y las dimensiones del ventrículo derecho (C). DD: dímero D; FVD: funcionamiento del VD; VD: ventrículo derecho.
Se realizó un análisis multivariante de regresión de riesgos proporcionales de Cox que incluía la edad, los valores del dímero D y la disfunción del VD. La función del VD se identificó como un factor independiente pronóstico de supervivencia a 30 días en nuestra cohorte (hazard ratio = 3,71; intervalo de confianza del 95%, 1,28-10,76; p=0,02).
La tasa de eventos cardiovasculares mayores fue relativamente baja en nuestra cohorte; 3 pacientes sufrieron EP y necesitaron tratamiento de reperfusión; solo 1 se confirmó por angiografía pulmonar con catéter, que mostró numerosos trombos en vasos distales; en 2 pacientes se encontraron manifestaciones compatibles con pericarditis y 3 mostraron datos compatibles con miocarditis. En nuestra cohorte no se identificaron arritmias ventriculares.
La disfunción y la dilatación del VD son hallazgos ecocardiográficos frecuentes en pacientes de UCI y se asocian con peores resultados. Además, los valores aumentados de dímero D indican un estado protrombótico y se correlacionan con alteraciones del VD y peores tasas de supervivencia. No parece que el solo aumento de la hs-TnI se asocie con alteraciones cardiacas estructurales o clínicamente relevantes en pacientes con COVID-19.
Estos hallazgos pueden estar relacionados con una mayor prevalencia de EP en pacientes con COVID-19. Sin embargo, en el ámbito de la UCI, los pacientes con síndrome de dificultad respiratoria aguda que necesitan asistencia respiratoria también pueden presentar cor pulmonale agudo, que puede ser indistinguible. Sorprendentemente, las altas presiones positivas telespiratorias que presentó nuestra población no se correlacionaron con alteraciones del VD. Por lo tanto, debe plantearse la hipótesis de un estado protrombótico pulmonar que tiene repercusiones en el VD y podría estar relacionado con peores resultados. Nuestros datos son coherentes con los informes de autopsias5 y tomografías computarizadas6 de pacientes con COVID-19, que muestran dilatación del VD y numerosos trombos en pequeños vasos pulmonares.
Puesto que nuestro estudio es una experiencia de un solo centro con un tamaño de muestra pequeño, presenta algunas limitaciones; la principal es que no se realizaron tomografías computarizadas debido al estado crítico de los pacientes y los protocolos de aislamiento. Se necesita más investigación para confirmar nuestros hallazgos.
Agradecemos a los Dres. M.J. Asensio Martín, J.M. Añón Elizalde, S.M. Sánchez y A. García de Lorenzo su contribución a este artículo.