La enfermedad de Chagas es un mal endémico en Latinoamérica, causado por el parásito Trypanosoma cruzi, que generalmente afecta al funcionamiento del corazón. Estudiamos la regulación del calcio intracelular en cardiomiocitos de pacientes chagásicos con diversos grados de deterioro funcional.
MétodosSe utilizaron microelectrodos selectivos para el calcio para determinar simultáneamente la concentración diastólica de calcio ([Ca2+]d) y el potencial de membrana en biopsias endomiocárdicas de pacientes chagásicos y controles.
ResultadosLa [Ca2+]d aumentó el 123, el 295 y el 738% en los pacientes chagásicos de los grupos funcionales I, II y III, respectivamente, respecto a los controles. El potencial de membrana mostró una parcial despolarización de un 6% en el grupo funcional I, el 10% en el II y el 22% en el III respecto a los controles. La [Ca2+]d se revirtió parcialmente con 1-[6-[[(17ß)-3-metoxiestra-1,3,5(10)-trieno-17-il]amino]hexil]-1H-pirrole-2,5-diona (U-73122), antagonista de la betafosfolipasa C, y 2-aminoetoxidifenil borato (2-APB), inhibidor de los receptores de inositol 1,4,5-trifosfato. La fenilefrina, fármaco que induce una rápida elevación del contenido intracelular del inositol 1,4,5-trifosfato, incrementó la [Ca2+]d en cardiomiocitos controles y chagásicos, que fue mayor en los cardiomicitos chagásicos y se inhibió por 2-APB.
ConclusionesEn cardiomiocitos de pacientes chagásicos hay una disfunción de la regulación de la [Ca2+]d correlacionada con las alteraciones cardiacas observadas en las diferentes fases de la enfermedad. Esta perturbación en dicha regulación se asocia, aparentemente, a una alteración en la regulación del mediador intracelular inositol 1,4,5-trifosfato.
Palabras clave
Entre las 80 enfermedades referidas como tropicales, la enfermedad de Chagas representa el problema de salud de mayor trascendencia en el continente americano1. Esta parasitemia se produce por el hemoflagelado Trypanosoma cruzi, el cual afecta primaria pero no exclusivamente al corazón, produciendo lesiones referidas clínicamente como cardiomiopatía chagásica. Esta suele evolucionar a través de tres etapas, una aguda, una indeterminada y una crónica, que es la principal expresión clínica y patológica2. Esta fase emblemática se expresa inicialmente como una cardiomiopatía no dilatada que evoluciona lentamente para transformarse en una dilatada, y se observan arritmias, disfunción diastólica y sistólica ventricular izquierda, episodios tromboembólicos y muerte súbita3.
Estudios previos en tejidos no cardiacos han demostrado una posible vinculación entre la infección chagásica y alteraciones en la regulación del calcio intracelular y del mensajero intracelular inositol 1,4,5-trifosfato4, 5. Sin embargo, estos estudios se realizaron en modelos animales y la información obtenida de ellos no necesariamente podría extrapolarse a lo que ocurre en cardiomiocitos humanos de pacientes chagásicos. En el presente estudio, hemos investigado si la cardiomiopatía chagásica se asocia a alteraciones en la concentración diastólica de calcio ([Ca2+]d) en biopsias endomiocárdicas del ventrículo izquierdo de pacientes chagásicos. Además, hemos explorado el papel del mediador intracelular inositol trifosfato.
MétodosPoblación estudiadaEste estudio se llevó a cabo en 15 pacientes chagásicos (4 mujeres y 11 varones; edad promedio, 46±1,6 años). Se agrupó a los pacientes según la clasificación de la New York Heart Association (NYHA), la cual toma en consideración las manifestaciones clínicas del paciente y los factores de riesgo que inciden en su mortalidad: temprano, grupo funcional (GF) I; intermedio, GFII, y tardío, GFIII. Según esta clasificación, se incluyó a 4 pacientes en el GFI, 6 en el GFII y 5 en el GFIII. Todos los pacientes chagásicos del presente estudio presentaron una historia epidemiológica positiva, un electrocardiograma de reposo anormal (arritmias ventriculares, bloqueo de la rama derecha) y positividad al hemocultivo y al test de ELISA para la enfermedad de Chagas. De los 15 pacientes estudiados, 11 habían recibido tratamiento convencional (amiodarona, digitálicos y diuréticos) (Tabla 1).
Tabla 1. Número de cardiomiocitos obtenidos por paciente para las determinaciones del potencial de membrana y de la [Ca2+]d
| Paciente | Control | GFI | GFII | GFIII |
| 1 | 10 | 10 | 5 | 3 |
| 2 | 6 | 6 | 5 | 2 |
| 3 | 10 | 10 | 6 | 4 |
| 4 | 4 | 3 | 4 | 0 |
| 5 | 0 | 0 | 5 | 0 |
| 6 | 0 | 0 | 3 | 0 |
[Ca2+]d: concentración diastólica de calcio; GF: grupo funcional.
Se incluyó a 10 pacientes (4 mujeres y 6 varones, con una edad promedio de 32±1,5 años) que sufrían de regurgitación o insuficiencia de la válvula mitral como grupo control en el presente estudio. Ninguno de ellos presentó evidencias de padecer la enfermedad de Chagas.
Biopsias endomiocárdicas de ventrículo izquierdoLas biopsias endomiocárdicas del ventrículo izquierdo de los pacientes chagásicos se obtuvieron bajo observación fluoroscópica, y las de los sujetos controles durante el acto quirúrgico para el reemplazo de la válvula mitral, tratando de que la toma de las biopsias fuera de regiones similares en ambas poblaciones de sujetos. Si bien no todos los sujetos incluidos en el presente estudios estaban en tratamiento medicamentoso, a quienes lo recibían se les suspendió la medicación 48 h antes de la toma de las biopsias endocárdicas. Las biopsias fueron colocadas inmediatamente en solución Tyrode con baja concentración de Ca2+ y suplementada con 20 mM 2,3-butanediona monoxima, un potente inhibidor de la interacción de la miosina y la actina, a fin de prevenir activación mecánica, y burbujeada con una mezcla del 95% de O2 y el 5% de CO2 a 37°C. Mediante disección del tejido conectivo, se obtuvieron pequeños segmentos del ventrículo izquierdo, de unos 10-15 cardiomiocitos cada uno. Los cardiomiocitos fueron colocados en una cámara experimental, que se perfundió con una solución Tyrode (37°C), burbujeada con O2 (95%) y CO2 (5%). La preparación muscular se sujetó al piso de la cámara experimental mediante alfileres para la realización de las mediciones de la [Ca2+]d. Las biopsias se obtuvieron con el consentimiento previo de los pacientes y la aprobación del comité de bioética de las instituciones hospitalarias correspondientes.
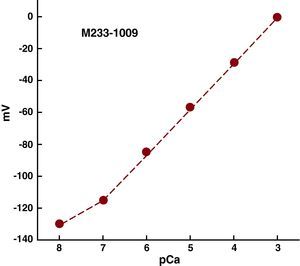
Microelectrodos selectivos para calcio de doble barreraCapilares de vidrio de doble barrera (WPI-PB150F-4, Sarasota, Florida, Estados Unidos) se lavaron con ácido clorhídrico y luego con agua destilada y se secaron en un horno (200°C), estirados en un estirador de pipetas (P-97 Flaming/Brown, Automate Scientific, Berkeley, California, Estados Unidos) a fin de obtener microelectrodos de punta pequeña (< 1 μM). Los microelectrodos se prepararon y calibraron como se ha descrito previamente6. Sólo los microelectrodos con una respuesta tipo Nernst (30,5 mV por unidad de pCa a 37°C) se usaron experimentalmente (Figura 1).
Figura 1. Curva de calibración de un microelectrodo selectivo para calcio. El eje de las ordenadas muestra el potencial medido por el microelectrodo de calcio y el eje de la abscisas, las diversas concentraciones de calcio (pCa3-pCa8), donde pCa=–log [Ca2+]. La respuesta fue tipo Nernst (30,5mV por unidad de pCa a 27°C) en el intervalo pCa3-pCa7. La resistencia del microelectrodo fue de 5,2×1011Ω.
Cuantificación de la concentración intracelular de calcioLos experimentos fueron realizados en un periodo no mayor que las 3 h siguientes a la toma de la muestra. Los cardiomiocitos se empalaron individualmente con el microeléctrodo sensible a Ca2+ de doble barrera, considerando sólo registros obtenidos de cardiomiocitos controles y chagásicos con potenciales estables (potencial de membrana [Vm] y potencial específico para calcio [VCae]) por un lapso no menor que 40 s. Todos los microelectrodos fueron recalibrados después de realizadas las mediciones de la [Ca2+]d, y si las dos curvas de calibración (pre y post) mostraban una diferencia > 3 mV en el intervalo de pCa6-pCa7, los datos experimentales se descartaban6.
Los potenciales obtenidos Vm y potencial inespecífico de calcio (VCa) se registraron usando un amplificador de alta impedancia (WPI FD-223, Sarasota, Florida). El VCae se obtuvo mediante la sustracción Vm – VCa registrado inicialmente. Las señales potenciométricas se almacenaron en una computadora (Macintosh MA878LL/A; Cupertino, California) para su posterior análisis.
SolucionesLa composición de la solución Tyrode fue la siguiente (mM): 130 NaCl, 3 KCI, 1,8 CaCI2, 1 MgCI2, 12 NaHCO3, 5 glucosa, 4 (4-(2-hidroxietil)-1-ácido piperacinaetanosulfónico (HEPES), y el pH se ajustó a 7,4 con NaOH. La solución baja en calcio tenía la siguiente composición (mM): 130 NaCl, 3 KCI, 1 MgCI2, 5 piruvato de sodio, 20 glucosa, 20 2,3-butanediona monoxima, 10 HEPES, 6 ácido nitroloacético, y el pH se ajustó a 7,4.
EstadísticaLos datos se expresan como media±error estándar de la media y número de cardiomiocitos ventriculares en que se determinó la [Ca2+]d. La diferencia estadística se consideró significativa mediante el uso del análisis de varianza de un solo factor, la prueba de Tukey para múltiples muestras y el test de la t de Student para muestras apareadas y se consideró significativo un valor de p<0,05.
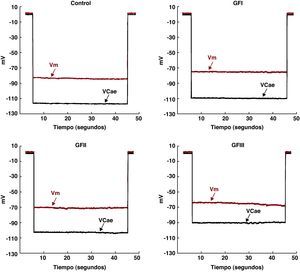
ResultadosCalcio diastólico intracelularLos valores de Vm y de la [Ca2+]d obtenidos de los cardiomiocitos ventriculares chagásicos se agruparon según la clasificación funcional de la NYHA. En los cardiomiocitos aislados de pacientes chagásicos se observó una despolarización parcial de la membrana asociada a un incremento en la [Ca2+]d en comparación con los controles (Figura 2), alteraciones que parecen estar asociadas con la severidad de la enfermedad.
Figura 2. Registros simultáneos de Vm y [Ca2+]d en cardiomiocitos de sujetos controles y chagásicos de los grupos funcionales I, II y III. En los controles los valores fueron: Vm, –84mV y [Ca2+]d, 118nM. En el paciente del GFI fueron: Vm, –75mV y [Ca2+]d, 233 nM. En el paciente del GFII: Vm, –70 y [Ca2+]d, 387 nM. En el del GFIII: Vm, –65 y [Ca2+]d, 950 nM. [Ca2+]d: concentración diastólica de calcio; GF: grupo funcional; VCae: potencial específico para calcio; Vm: potencial de membrana.
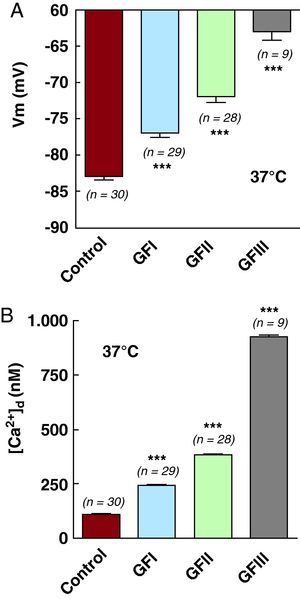
En cardiomiocitos en reposo obtenidos de sujetos sanos, el valor promedio de Vm fue de –83±2,3mV (n=30), y la [Ca2+]d fue de 111±4,4nM (n=30) (Tabla 1 y Figura 3A y B), mientras que en los obtenidos de pacientes chagásicos clasificados en el GFI el valor promedio para Vm fue de –77±3mV (n=29) (p<0,001 en comparación con el valor control) (Figura 3A) y la [Ca2+]d fue de 245±12nM (n=29) (p<0,001) (Figura 3B). En los pacientes del GFII, el valor de Vm fue –72±4mV (n=28) (p<0,001) (Tabla 1 y Figura 3A) y la [Ca2+]d fue de 385±12 (n=28) (p<0,001) (Figura 3B). En células ventriculares obtenidas de pacientes del GFIII, Vm fue de 63±3,5mV (n=9) (p<0,001) (Tabla 1 y Figura 3A) y la [Ca2+]d fue de 922±33nM (n=9) (p<0,001) (Tabla 1 y Figura 3B).
Figura 3. Medidas simultáneas del potencial de membrana (A) y de la [Ca2+]d (B) para los grupos control, y grupos funcionales I, II y III en cardiomiocitos. ***Diferencias estadísticas observadas con relación al control. (Véase la tabla 1 ). [Ca2+]d: concentración diastólica de calcio; GF: grupo funcional; Vm: potencial de membrana.
Nótese que, en los cardiomiocitos de pacientes con cardiomiopatía chagásica, hay una despolarización parcial de la membrana celular y una elevación de la [Ca2+]d correlacionada con el grado de deterioro funcional del músculo cardiaco, expresado mediante la clasificación de la NYHA. En los cardiomiocitos de pacientes del GFI, se observó una reducción del 7% del valor promedio de Vm y un incremento del 120% de la [Ca2+]d. En las células del GFII, el decremento en Vm fue de un 13% y el incremento de la [Ca2+]d, del 246%; en los cardiomiocitos de pacientes del GFIII, se observó un decremento de Vm de un 24% y un incremento en la [Ca2+]d de un 730%.
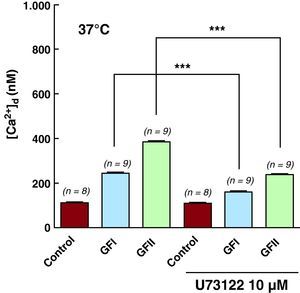
Efecto de U-73122 en la concentración sistólica intracelularA fin de explorar la participación del inositol 1,4,5-trifosfato en la disfunción de la homeostasis del calcio intracelular en los cardiomiocitos chagásicos, se los trató con 1-[6-[[(17ß)-3-metoxiestra-1,3,5(10)-trieno-17-il]amino]hexil]-1H-pirrole-2,5-diona (U-73122), un antagonista de la betafosfolipasa C, que participa en la transducción de señales en la membrana plasmática catalizando la hidrolisis de los fosfolípidos de la membrana de fosfaditil-inositol-4-5-bifosfato a inositol-1,4,5-trifosfato y 1,2-diacilglicerol. La incubación de cardiomiocitos controles con 2 μM de U-73122 por 10min no redujo la [Ca2+]d (112±3,9nM, n=8 antes y 109±4 nM, n=8 después). Sin embargo, este mismo protocolo redujo significativamente la [Ca2+]d en los cardiomiocitos obtenidos de pacientes del GFI de 243±19 nM (n=9) a 160±7,5 nM (n=9), un decremento de un 34%, y en los del GFII de 383±14 nM (n=9) a 238±15 nM (n=9), equivalente a una disminución del 38% (Tabla 2 y Figura 4). No se observó ningún efecto en los valores de Vm. La incubación de los cardiomiocitos de los GFI y II con U-7334, el análogo inactivo, no produjo ningún cambio en los valores de Vm y de la [Ca2+]d (resultados no mostrados). No se exponen datos sobre el efecto del U-73122 en la [Ca2+]d en los cardiomiocitos del GFIII por no disponerse de células viables.
Tabla 2. Número de cardiomiocitos obtenidos por paciente para las determinaciones del potencial de membrana y la [Ca2+]d realizadas en los diferentes tratamientos farmacológicos
| Pacientes | Tratamiento farmacológico | 1 | 2 | 3 | 4 | 5 | 6 |
| GFI | U-73122 | 3 | 2 | 4 | 0 | 0 | 0 |
| 2-APB | 3 | 2 | 3 | 3 | 0 | 0 | |
| Fenilefrina | 4 | 2 | 3 | 0 | 0 | 0 | |
| GFII | U-73122 | 2 | 3 | 2 | 2 | 0 | 0 |
| 2-APB | 0 | 0 | 2 | 2 | 3 | 3 | |
| Fenilefrina | 3 | 2 | 2 | 0 | 2 | 0 |
2-APB: 2-aminoetoxidifenil borato; [Ca2+]d: concentración diastólica de calcio; GF: grupo funcional. U-73122: 1-[6-[[(17ß)-3-metoxiestra-1,3,5(10)-trieno-17-il]amino]hexil]-1H-pirrole-2,5-diona.
No se incluye el GF III porque no fue posible obtener cardiomiocitos viables para fines experimentales.
Figura 4. Efecto de U-73122 en la [Ca2+]d en cardiomiocitos obtenidos de los grupos control (sujetos sanos), y grupo funcional I y II. ***Diferencias estadísticas observadas en el mismo grupo, antes y después del tratamiento con U-73122, antagonista de la betafosfolipasa. (Véase la tabla 2 ). [Ca2+]d: concentración diastólica de calcio; GF: grupo funcional; U-73122: 1-[6-[[(17ß)-3-metoxiestra-1,3,5(10)-trieno-17-il]amino]hexil]-1H-pirrole-2,5-diona.
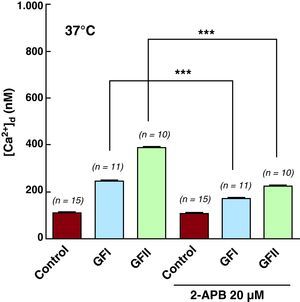
Efecto de 2-aminoetoxidifenil borato en la concentración diastólica intracelularLos cardiomiocitos de sujetos controles y pacientes chagásicos se trataron con 2-aminoetoxidifenil borato (2-APB), un compuesto permeante que se ha propuesto como inhibidor de los receptores del inositol 1,4,5-trifosfato. La incubación de cardiomiocitos controles con 20mM de 2-APB por 10 min no tuvo efecto em la [Ca2+]d (111±3nM, n=15 antes y 109±5nM, n=15 después de ser tratados con 2-APB) ni en el Vm (82±2,8mV, n=15 y 84±3,1mV, n=15). Sin embargo, este mismo tratamiento produjo una reducción significativa de la [Ca2+]d en los cardiomiocitos de pacientes chagásicos (Tabla 2 y Figura 5), sin modificaciones del Vm. En cardiomiocitos chagásicos del GFI, la [Ca2+]d se redujo de 245±24nM (n=11) a 172±8nM (n=11), una disminución de un 30%, y de 388±18nM (n=10) a 224±10,7nM (n=10) en cardiomiocitos del GFII, equivalente a una reducción del 42%. Sin embargo, no se observó ningún efecto del 2-APB en los valores Vm de las células chagásicas obtenidas de pacientes de GFI y GFII (78±2,6mV, n=11 y 71±4,4mV, n=11 respectivamente). No fue posible estudiar el efecto del 2-APB en la [Ca2+]d en cardiomiocitos de pacientes chagásicos del GFIII por la inviabilidad de las células.
Figura 5. Efecto de 2-APB en la [Ca2+]d en cardiomiocitos obtenidos de los grupos control (sujetos sanos) y grupo funcional I y II. ***Diferencias estadísticas observadas en el mismo grupo, antes y después del tratamiento con 2-APB. (Véase la tabla 2 ). [Ca2+]d: concentración diastólica de calcio; 2-APB: 2-aminoetoxidifenil borato; GF: grupo funcional.
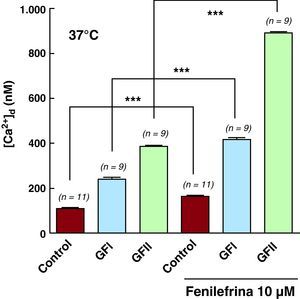
Efecto de la fenilefrina en la concentración sistólica intracelularEs conocido que la estimulación de los receptores α1-adrenérgicos con fenilefrina activa la proteincinasa C como resultado de una cascada de reacciones que involucra una proteína G y la betafosfolipasa C, produciéndose finalmente inositol 1,4,5-trifosfato y diacilglicerol. La incubación de los cardiomiocitos controles o chagásicos en 10 μM de fenilefrina por 5 min produjo una elevación de la [Ca2+]d en todos las células estudiadas. Pero este incremento fue mayor en cardiomiocitos chagásicos que en los controles (GFII > GFI > controles). La fenilefrina elevó la [Ca2+]d de 110±2,5nM (n=11) a 163±7,7 (n=11) en los cardiomiocitos controles, de 242±27,8nM (n=9) a 416±21,7nM (n=9) en los cardiomiocitos del GFI y de 387±17,4nM (n=9) a 888±20,9nM (n=9) en cardiomiocitos del GFII (Tabla 2 y Figura 6). No se observaron modificaciones en el Vm en ninguno de los grupos estudiados.
Figura 6. Efecto de la fenilefrina en la [Ca2+]d en cardiomiocitos aislados del grupo control (sujetos sanos) y el grupo funcional I y II. ***Diferencias estadísticas observadas en el mismo grupo, antes y después del tratamiento con fenilefrina, un agonista de los receptores α1-adrenérgicos. (Véase la tabla 2 ). [Ca2+]d: concentración diastólica de calcio; GF: grupo funcional.
El efecto farmacológico de la fenilefrina en la [Ca2+]d en cardiomiocitos controles y chagásicos fue bloqueado por 20μM de 2-APB. Estos resultados refuerzan la hipótesis de que una alteración en el metabolismo del inositol 1,4,5-trifosfato está asociada a la cardiomiopatía chagásica. No fue posible estudiar el efecto de la fenilefrina en la [Ca2+]d en cardiomiocitos de pacientes chagásicos del GFIII por la inviabilidad celular.
DiscusiónEste estudio demuestra que: a) en los cardiomiocitos ventriculares en reposo obtenidos de pacientes que sufren una cardiomiopatía chagásica hay una despolarización parcial de la membrana plasmática que se asocia con una elevación en la [Ca2+]d; b) las alteraciones en el Vm y la [Ca2+]d se correlacionan con el grado de deterioro funcional del músculo cardiaco establecido mediante evaluación clínica (clasificación NYHA); c) la incubación de cardiomiocitos chagásicos en U-73122, un antagonista de la betafosfolipasa C, o en 2-APB, un inhibidor de los receptores del inositol 1,4,5-trifosfato, redujeron significativamente los valores de la [Ca2+]d, pero no en los cardiomiocitos controles, y d) la fenilefrina produjo una elevación de la [Ca2+]d en cardiomiocitos chagásicos y no chagásicos, aunque este efecto fue mayor en los chagásicos (GFII > GFI) que en los controles.
Estos resultados muestran por primera vez que en las células la cardiomiopatía chagásica se asocia con una despolarización parcial de la membrana y una elevación en la [Ca2+]d que varía según el estado clínico del paciente. Pensamos que estas alteraciones son genuinas de la cardiomiopatía chagásica y no los efectos secundarios del tratamiento farmacológico, ya que todos los medicamentos se suspendieron 48 h antes de la toma de la biopsia, a fin de evitar el potencial efecto de esos fármacos en los parámetros evaluados (Vm y [Ca2+]d). Sin embargo, es bien conocido que la eliminación de la amiodarona es por demás lenta7 y que pudo alterar los valores de Vm y [Ca2+]d en los cardiomiocitos de los pacientes chagásicos que estaban tomando el fármaco. Quian et al8 publicaron que la amiodarona, a concentraciones clínicas, reduce la [Ca2+]d, por lo que creemos que los valores en el presente estudio reflejan una alteración inducida por la parasitosis, más que un efecto residual de la amiodarona. En el peor de los casos, nuestras mediciones de la [Ca2+]d reflejarían una subestimación, lo cual podríamos descartar, ya que no detectamos diferencias significativas en los valores de la [Ca2+]d entre los cadiomiocitos de pacientes chagásicos que recibían amiodarona y los de los que no.
Igualmente, mostramos una adecuada correlación entre las manifestaciones clínicas del paciente, basada en la clasificación de la NYHA, con las alteraciones funcionales celulares (Vm y [Ca2+]d) producidas por la parasitemia. Una moderada alteración en Vm (despolarización de un 6%) y una significativa elevación de la [Ca2+]d (aumento en un 123%) se observaron en los pacientes con menos manifestaciones clínicas (GFI). Estas se tornaron más evidentes en cardiomiocitos del GFII (despolarización de un 10%) y un incremento de la [Ca2+]d del 295% y se hicieron aún mayores en los provenientes del GFIII (despolarización de un 22% y un aumento de la [Ca2+]d en un 738%). Lamentablemente, la alteración en la [Ca2+]d en los cardiomiocitos obtenidos del GFIII no se pudo explorar en detalle debido a que mostraron membrana plasmática muy frágil, así como mayor cantidad de tejido conectivo, lo cual dificultó la obtención de cardiomiocitos viables para los fines experimentales (Tabla 2). A pesar de los elevados valores de [Ca2+]d cuantificados en los cardiomiocitos obtenidos del GFIII (con Vm estable), no se detectó activación mecánica. Una posible explicación de ello es que la concentración de Ca2+ intracelular (regulador fisiológico de la contracción muscular) no alcanzó su nivel crítico (1 μM), que inhibe el efecto de la troponina C, permitiendo la interacción de la actina con la miosina. Sin embargo, otros estudios han demostrado en fibras estriadas una activación mecánica a más bajas concentraciones de Ca2+ intracelular (0,5 μM). Estas diferencias podrían explicarse por la diversidad en las especies, así como por las preparaciones celulares empleadas experimentalmente (fibras desnudas —desprovistas de membrana plasmática— o fibras con una membrana plasmática hiperpermeable). Igualmente, a la contribución de otros factores tales y como: a) el nivel de carga de Ca2+ del RS9; b) la [Mg2+] en la vecindad de los miofilamentos contráctiles; c) la temperatura, que influye en los procesos de liberación y retoma de Ca2+ por el RS9 y modifica la sensibilidad de los miofilamentos por el ión Ca2+, y d) la longitud inicial del sarcómero, lo cual determina la magnitud de la tensión generada tanto en el músculo esquelético como en el cardiaco.
La alteración en la [Ca2+]d encontrada en células chagásicas es cualitativamente similar a lo comunicado sobre células epiteliales infectadas con T. cruzi: se pudo apreciar un aumento significativo en los valores basales intracelulares de [Ca2+], así como alteraciones en el patrón de movilización del Ca2+ intracelular en respuesta a la bradiquinina y otros agonistas10. La [Ca2+]d en el músculo cardiaco depende de una serie de mecanismos fisiológicos localizados en la membrana plasmática (intercambiador Na+/Ca2+ y la bomba Ca2+-ATPasa) y en el retículo sarcoplásmico (la bomba de Ca2+-ATPasa)11. El funcionamiento normal de estos mecanismos permite mantener la [Ca2+]d durante el «reposo cardiaco» (diástole) en la franja fisiológica (∼100nM)12. El hecho de que la [Ca2+]d en cardiomiocitos chagásicos alcanza valores anormales implica una pérdida en la regulación intracelular de este catión, lo cual podría relacionarse con un mal funcionamiento, inducido por el parásito directa o indirectamente, de uno o varios de estos mecanismos vinculados a la homeostasis intracelular del calcio. Igualmente, podría ser la consecuencia directa de un aumento persistente de la liberación de calcio desde el retículo sarcoplásmico o entrada desde el exterior, mediada por el modulador intracelular inositol 1,4,5-trifosfato, en respuesta a una sobrestimulación adrenérgica o activación del metabolismo del inositol 1,4,5-trifosfato inducida directa o indirectamente por el parásito.
El inositol 1,4,5-trifosfato, mensajero intracelular presente en el músculo estriado (cardiaco-esquelético) y el músculo liso, es capaz de liberar calcio desde depósitos intracelulares mediante la activación de un receptor (canal de calcio) localizado en la membrana del retículo sarcoplásmico o modular la entrada del ión calcio desde el espacio extracelular13. En diversas zonas del músculo cardiaco se han identificado receptores de inositol 1,4,5-trifosfato tipos 1 y 2. Mientras el inositol 1,4,5-trifosfato tipo 1 predomina en las células cardiacas neuronales, el inositol 1,4,5-trifosfato tipo 2 está localizado fundamentalmente en los cardiomiocitos, en la vecindad de las líneas Z, en la región perinuclear y en la membrana nuclear14. Sin embargo, la relevancia funcional de los diversos tipos de receptores de inositol 1,4,5-trifosfato en el corazón sigue siendo controvertida15. Diversas publicaciones han señalado que entre sus funciones estaría la modulación de trascripción genética15, la amplificación de las señales del receptor de rianodina16 y la regulación de la entrada de calcio desde el espacio extracelular15. Además, se ha propuesto su posible participación en la fisiopatología de la hipertrofia ventricular, la fibrilación auricular, la taquicardia ventricular y la hipoxia cardiaca.
Nuestros resultados indican que la elevación de la [Ca2+]d observada en los cardiomiocitos chagásicos está parcialmente mediada por inositol 1,4,5-trifosfato, puesto que el tratamiento con U-73122, un inhibidor de la betafosfolipasa C, y 2-APB, un inhibidor del receptor del inositol 1,4,5-trifosfato, permitió reducir parcialmente la elevación de la [Ca2+]d, observada en los cardiomiocitos chagásicos de GFI y GFII. Esta reducción de la [Ca2+]d fue más marcada en los cardiomiocitos chagásicos del GFII: el 38 y el 41% inducida por U-73122 y 2-APB respectivamente, que en los obtenidos de pacientes chagásicos del GFI: el 34 y el 29% con U-73122 y 2-APB respectivamente. Esta elevación en la [Ca2+]d parece estar asociada a un incremento en el metabolismo de los fosfoinositoles que conlleva una mayor liberación de calcio desde el RS y/o un incremento en la entrada de calcio desde el espacio extracelular durante la fase diastólica. Esta potencial disfunción en el metabolismo de los fosfoinositoles varía en función del estadio clínico del paciente, puesto que fue más evidente en los cardiomiocitos de los pacientes clasificados en el GFI que en los clasificados en el GFII. Esta hipótesis se vio reforzada por el mayor efecto de la fenilefrina en la [Ca2+]d en cardiomiocitos chagásicos (1,6 y 2,3 veces en GFI y GFII) que en controles (1,4 veces) y por el hecho de que el efecto de la fenilefrina en la [Ca2+]d se inhibió por 2-APB, un inhibidor del inositol 1,4,5-trifosfato tipo 3, en todos los grupos celulares estudiados.
Estudios previos han demostrado la presencia de receptores M3-muscarínicos en células ventriculares del corazón humano17. Igualmente se ha comunicado una sobrexpresión de estos receptores en corazones de animales infectados con T. cruzi18. Además, estos receptores M3-muscarínicos están preferencialmente acoplados a proteínas Gq/11, mediadoras de la activación de la fosfolipasa C, la cual una vez activada produce la hidrolisis del fosfatidil-4,5-difosfato a inositol 1,4,5-trifosfato y diacilglicerol19.
ConclusionesLas evidencias presentadas nos permiten tener una mayor comprensión sobre la fisiopatología de la cardiomiopatía chagásica, específicamente sobre participación del inositol 1,4,5-trifosfato en la disfunción de la regulación de la [Ca2+]d en cardiomiocitos chagásicos. Los presentes resultados no explican en su totalidad esta alteración en la homeostasis intracelular del calcio, puesto que U-73122 o 2-APB, si bien permitieron reducir significativamente la [Ca2+]d observada, no lograron su normalización a valores fisiológicos. Además, ninguno de los tratamientos farmacológicos empleados permitió revertir la despolarización parcial de la membrana en las células chagásicas, lo que indicaría la existencia de otras posibles alteraciones inducidas directamente o indirectamente por el parásito, tal vez sobre otras estructuras o vías metabólicas, como el receptor de dihidropiridina de membrana plasmática (canal lento de Ca2+) o el receptor de rianodina (canal de Ca2+) del retículo sarcoplásmico. Nuevos estudios se hacen necesarios para dilucidar esta compleja fisiopatología.
Conflicto de interesesNinguno.
Agradecimientos
Nuestro agradecimiento a los Dres. Carlos Moratinos y Michael Ferguson por la toma de las biopsias endomiocárdicas.
Recibido 27 Abril 2010
Aceptado 21 Enero 2011
Autor para correspondencia: Apartado de correo 2127, Centro de Biofísica y Bioquímica, Instituto Venezolano de Investigaciones Científicas, Caracas 1020A, Venezuela. amijares@ivic.gob.ve