El interés por el ventrículo derecho ha aumentado significativamente gracias a los avances en el conocimiento de su fisiopatología e impacto pronóstico en un gran espectro de enfermedades. Sin embargo, todavía nos encontramos lejos de entender los múltiples mecanismos que influyen en su disfunción; su evaluación sigue planteando retos, y continuamos sin disponer de tratamientos específicos en la mayoría de los escenarios. Esta revisión pretende, desde una perspectiva traslacional, actualizar los conocimientos sobre la fisiología del ventrículo derecho, y su transición a la disfunción, las herramientas diagnósticas y los tratamientos disponibles.
Palabras clave
En las últimas décadas, hemos asistido al reconocimiento creciente del papel fundamental que desempeña la disfunción del ventrículo derecho (VD) en el estado funcional y pronóstico de múltiples enfermedades en las que su incidencia supera el 50%1, como la insuficiencia cardiaca (IC) izquierda2, la hipertensión arterial pulmonar (HAP)3, las cardiopatías congénitas o las miocardiopatías4–6. Los modelos experimentales han contribuido en gran medida al mayor conocimiento de los mecanismos fisiopatológicos y vías moleculares subyacentes a este daño del VD en los diferentes escenarios. Simultáneamente, la imagen cardiaca ha evolucionado permitiendo una evaluación precisa de su anatomía y función, e incluso el diagnóstico temprano de afección mediante técnicas de deformación miocárdica y caracterización tisular. Todo ello ha conducido a una mayor investigación en nuevas dianas terapéuticas, la expansión de procedimientos percutáneos y el refinamiento de las indicaciones de intervenciones dirigidas a prevenir su daño irreversible. Sin embargo, aún estamos lejos de comprender los múltiples mecanismos que influyen en la disfunción del VD; su evaluación sigue planteando retos, y continuamos sin tratamientos específicos en la mayoría de los casos, por lo que debemos persistir en su estudio. Esta revisión pretende, desde una perspectiva traslacional, actualizar los conocimientos sobre la fisiología del VD en condiciones normales y en su transición a la disfunción en diferentes escenarios, las herramientas diagnósticas y los tratamientos disponibles.
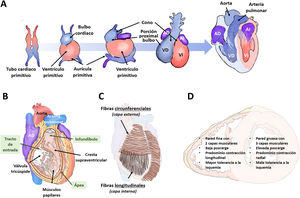
EMBRIOLOGÍA, ANATOMÍA Y FISIOLOGÍA DEL VENTRÍCULO DERECHOEl VD difiere de su homónimo izquierdo en múltiples características, incluido en su origen embrionario, lo cual ayuda a entender las cardiopatías congénitas y puede contribuir a descubrir por qué, ante un mismo daño, las vías de señalización que se activan difieren entre ambas cavidades. Así, el VD procede del campo cardiaco secundario (o anterior), y el ventrículo izquierdo (VI), del campo cardiaco primario. Las células del campo primario forman el tubo cardiaco primitivo, el cual se expande anteriormente por células procedentes del campo secundario (figura 1A). En el embrión y el feto, el VD es la cámara dominante responsable del ∼60% del gasto cardiaco, facilitando la perfusión sistémica a través del foramen oval y ductus arterioso. Al nacimiento, con el cierre de ambas comunicaciones, los gastos de ambos ventrículos se equilibran y el VD se adapta a bombear la sangre únicamente hacia la circulación pulmonar (de baja presión), con lo que su pared se adelgaza durante el primer año de vida.
Embriología, anatomía y fisiología del ventrículo derecho. A: origen y desarrollo embriológico de ambos ventrículos. B: anatomía del VD. C: disposición de las fibras musculares. D: principales características diferenciales entre ambos ventrículos. AD: aurícula derecha; AI: aurícula izquierda, VD: ventrículo derecho; VI: ventrículo izquierdo.
Anatómicamente el VD se sitúa anterior, inmediatamente detrás del esternón; su pared es fina (2-3 mm), y su cavidad tiene forma de semiluna, acomodando un volumen un 10-15% mayor que el VI. Se distinguen 3 partes (figura 1B): tracto de entrada, que incluye la válvula tricúspide, cuerdas tendinosas y músculos papilares (3 o más); ápex trabeculado, e infundíbulo o tracto de salida, estructura muscular tubular que soporta la válvula pulmonar. La cresta supraventricular separa el tracto de entrada y de salida, y se continúa por el septo interventricular hasta la inserción de los músculos papilares anteriores, formando la banda moderadora. La pared del VD está compuesta por 2 capas de células musculares (figura 1C), la interna o subendocárdica, con disposición longitudinal desde el ápex hacia los músculos papilares y tracto de salida, y la externa o superficial, con disposición circunferencial, la cual se continúa a través del septo con la capa superficial del VI. Esta continuidad de fibras, el septo interventricular compartido y el pericardio que los engloba contribuyen a la interdependencia ventricular.
La función normal del VD depende del retorno venoso sistémico, la poscarga, la función diastólica, la contractilidad de la pared libre del VD y del septo interventricular, y la distensibilidad del pericardio. La poscarga hace referencia al estrés de pared durante la eyección sistólica, y es el sumatorio del componente resistivo y pulsátil del flujo sanguíneo. De hecho, el VD y la circulación pulmonar deben considerarse como una unidad funcional combinada. La contractilidad del VD es la resultante de la contracción de las fibras longitudinales, que provoca un acercamiento entre la válvula tricúspide y el ápex; la contracción de las fibras circunferenciales que genera un movimiento de la pared libre hacia el septo; y la tracción de los puntos de inserción del VD en el VI provocada por la contracción de este último. En condiciones normales la contractilidad es predominantemente longitudinal; sin embargo, ante un aumento significativo de la poscarga o tras la cirugía cardiaca7, la contracción longitudinal decrece y la circunferencial aumenta. El VD se perfunde mayoritariamente por la arteria coronaria derecha a través de sus ramos marginales (pared libre) y conal (infundíbulo). En comparación con el VI, presenta mayor resistencia a la isquemia debido al flujo coronario más equilibrado durante sístole y diástole, menor extracción de oxígeno, un sistema de colaterales más extenso8 y mayor expresión miocárdica de enzimas glucolíticas aerobias9. La figura 1D resume las principales características diferenciales entre ambos ventrículos.
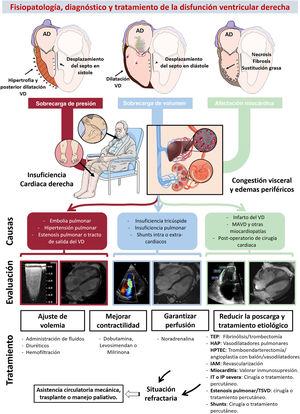
FISIOPATOLOGÍA DE LA DISFUNCIÓN DEL VENTRÍCULO DERECHOSe distinguen 3 mecanismos fisiopatológicos fundamentales (tabla 1 y figura 2): sobrecarga de presión, sobrecarga de volumen y afección miocardiopática, los cuales coexisten frecuentemente. A ellos se suman la disfunción diastólica y la interdependencia ventricular. Un estudio reciente que incluyó la evaluación hemodinámica del llenado del VD en pacientes con hipertensión pulmonar (HP) y experimentos con cardiomiocitos aislados demuestra el papel de la disfunción diastólica y el novedoso concepto de desacoplamiento de la aurícula derecha (AD)-VD10, calculado como volumen mínimo AD/volumen telediastólico VD. La interdependencia ventricular, conocida a partir de estudios clásicos en modelos animales experimentales11, se refiere a que el tamaño, contractilidad y distensibilidad de uno de los ventrículos puede afectar al otro a través de interacciones mecánicas directas. Sabemos que aproximadamente el 20-40% del volumen sistólico del VD resulta de la contractilidad del VI. A la inversa, el desplazamiento del septo hacia el VI y la caída del volumen sistólico del VD reducen la precarga del VI, lo que contribuye a la hipoperfusión periférica. Por último, se entiende la interacción diastólica como la competencia por la distensibilidad y llenado de ambos ventrículos dentro de un espacio pericárdico confinado.
Causas de la disfunción del ventrículo derecho según el mecanismo fisiopatológico
| Sobrecarga de presión | Sobrecarga de volumen | Afección miocardiopática | |
|---|---|---|---|
| Causas agudas | - Embolia pulmonar aguda- IC izquierda aguda- Ventilación mecánica con presión positiva- Escenarios de hipoxia aguda (p. ej., síndrome de dificultad respiratoria aguda del adulto)- Acidosis | - IT e IP agudas (p. ej., endocarditis infecciosa, trauma…)- Alto gasto agudo (p. ej., tirotoxicosis)- Fluidoterapia excesiva o transfusión masiva | - IAM con afección de VD- Miocarditis aguda- Síndrome poscardiotomía- Posimplante de asistencia ventricular izquierda- Cardiotoxicidad- Sepsis |
| Causas crónicas | - Estenosis del tracto de salida del VD (p. ej., tetralogía de Fallot no reparada)- VD sistémicos en transposición de grandes vasos reparados mediante técnica de switch auricular o en formas congénitamente corregidas no intervenidas- Estenosis pulmonar (valvular, infundibular, supravalvular o de ramas arteriales periféricas)- Pericarditis constrictiva- HP crónica | - IT crónica- IP crónica (p. ej., tetralogía de Fallot reparada con IP residual)- Shunts izquierda-derecha intracardiacos (p. ej., comunicación interauricular)- Fístulas arteriovenosas- Drenaje venoso pulmonar anómalo | - Cardiopatía isquémica crónica- Cardiotoxicidad- Miocardiopatías:• Dilatada• Hipertrófica• Restrictiva• Miocardiopatía arritmogénica del VD• Amiloidosis• Inflamatoria/granulomatosa (sarcoidosis)• Por otros depósitos (p. ej., Danon, Fabry, Pompe)- Anomalía de Ebstein |
HP: hipertensión pulmonar; IAM: infarto agudo de miocardio; IC: insuficiencia cardiaca; IP: insuficiencia pulmonar; IT: insuficiencia tricuspídea; VD: ventrículo derecho.
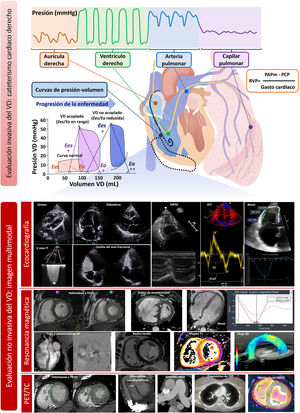
Figura central. Fisiopatología, diagnóstico y tratamiento de la disfunción ventricular derecha. AD: aurícula derecha; HAP: hipertensión arterial pulmonar; HTPTEC: hipertensión pulmonar tromboembólica crónica; IAM: infarto agudo de miocardio; IP: insuficiencia pulmonar; IT: insuficiencia tricuspídea; MAVD: miocardiopatía arritmogénica del ventrículo derecho; TEP: tromboembolia pulmonar; TSVD: tracto de salida del ventrículo derecho; VD: ventrículo derecho. Cardiorresonancia magnética de sobrecarga de volumen cortesía de la Dra. Amparo Esteban, Hospital Universitario La Moraleja.
El VD no está diseñado para tolerar aumentos agudos de poscarga, y su repercusión en la reducción del volumen sistólico es muy superior a la del VI11. Por ello, ante un aumento súbito de poscarga, por ejemplo en la embolia pulmonar, inicialmente el gasto cardiaco puede mantenerse mediante un aumento compensatorio de la frecuencia cardiaca y contractilidad, pero si persiste genera rápidamente dilatación ventricular, regurgitación tricuspídea por dilatación del anillo y disfunción sistólica, con la característica hipocinesia y acinesia de la pared libre basal y media, y la hipercontractilidad apical relativa (signo de McConnell). En formas graves, como consecuencia de la interdependencia ventricular, se reduce la precarga del VI, lo que provoca el colapso circulatorio. Ante la sobrecarga crónica de presión, el VD se adapta inicialmente mediante hipertrofia concéntrica progresiva, que permite preservar los volúmenes y función contráctil (adaptación homeométrica), pero, con el paso del tiempo, este mecanismo se agota y el VD experimenta un remodelado maladaptativo caracterizado por hipertrofia excéntrica, dilatación, aplanamiento telesistólico del septo interventricular y disincronía intra- e interventricular (adaptación heterométrica), lo que conduce al desacoplamiento progresivo con la arteria pulmonar (AP) y posterior IC derecha12. La respuesta adaptativa inicial es posible gracias a la capacidad de los cardiomiocitos de percibir y responder con cambios conformacionales al aumento de carga (mecanotransducción)13, y señales neurohormonales y paracrinas de fibroblastos adyacentes, que inducen una mayor expresión de genes fetales, como la cadena pesada de la miosina β, caracterizada por un menor requerimiento energético, pero menor capacidad contráctil que la α14. En esta adaptación del VD, el componente pulsátil o impedancia de la AP tiene un papel fundamental e independiente al componente resistivo (resistencia vascular pulmonar [RVP])15. Este hecho, en ocasiones ignorado en la clínica, se conoce a partir de estudios clásicos preclínicos en los que se observó cómo la rigidez de la AP (y, por tanto, el componente pulsátil de la poscarga) era mayor determinante de hipertrofia del VD que la presión arterial pulmonar (PAP)16.
A nivel histológico se genera hipertrofia y disposición desorganizada de los cardiomiocitos, hipertrofia de la media de las arterias coronarias, infiltrados linfocitarios y depósitos de tejido conectivo. En estadios avanzados, se produce isquemia por desequilibrio entre los mayores requerimientos de oxígeno y la alteración de la perfusión coronaria consecuencia de la mayor tensión parietal, práctica limitación a la diástole por el aumento de la presión del VD, remodelado vascular y rarefacción capilar concomitante. La activación neurohormonal, la inflamación y la isquemia conducen a mayor fibrosis miocárdica, la cual contribuye al desacoplamiento VD-AP17. No obstante, la extensión de la fibrosis en el VD es menor comparada con el VI sometido a sobrecarga de presión y más focal, con predominio en los puntos de inserción donde el estrés mecánico es mayor18, lo que puede explicar la frecuente recuperación funcional del VD tras una tromboendarterectomía o un trasplante pulmonar19. En todo este proceso se constatan a nivel experimental20 y clínico21 cambios metabólicos relevantes, particularmente la sustitución de la oxidación de ácidos grasos por glucólisis anaerobia como fuente de adenosintrifosfato, que pueden condicionar la respuesta adaptativa del VD más allá de la gravedad de la sobrecarga de presión.
Ventrículo derecho con sobrecarga de volumenLa sobrecarga de volumen mantenida conduce, a nivel estructural, a la dilatación progresiva de la AD y del VD, con aplanamiento y desplazamiento septal hacia la izquierda en diástole, y aumento de la masa miocárdica con espesores parietales conservados. La contractilidad puede preservarse durante largos periodos de tiempo (adaptación heterométrica)22, pero en fases avanzadas claudica (y la mayoría de las veces de forma irreversible), lo que conduce a congestión venosa periférica y visceral, sobre todo hepática y renal, claves en la patogenia de los síndromes cardiorrenal y cardiohepático, manifestaciones finales de la afección grave del VD por cualquier causa. A nivel molecular, la sobrecarga de volumen comparte vías con la sobrecarga de presión, como la reactivación de genes fetales, la activación de las vías proinflamatorias y profibróticas, y el cambio metabólico hacia la glucólisis23. En los últimos años, esta entidad ha cobrado relevancia dado el auge de las intervenciones percutáneas dirigidas a tratar la insuficiencia tricuspídea grave, cuyas indicaciones (de intervención y dispositivo) están condicionadas por el grado de disfunción del VD (tabla 2)24–30. La insuficiencia pulmonar en la tetralogía de Fallot corregida es otra causa relevante de sobrecarga de volumen del VD y supone la primera indicación de reintervención en el seguimiento26. La cirugía ha demostrado una mortalidad posoperatoria baja y buenos resultados a largo plazo, siempre y cuando se realice antes de que el fracaso del VD sea irreversible, y el riesgo de arritmias ventriculares y muerte súbita sea alto31. Por último, los defectos septales son causa relativamente frecuente de sobrecarga de volumen, cuya indicación de cierre mediante cirugía o dispositivo percutáneo está igualmente determinada por la función biventricular y RVP (tabla 2).
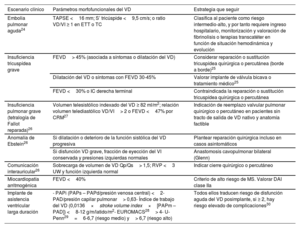
Parámetros morfofuncionales del ventrículo derecho con impacto en decisiones terapéuticas y estratificación de riesgo
| Escenario clínico | Parámetros morfofuncionales del VD | Estrategia que seguir |
|---|---|---|
| Embolia pulmonar aguda24 | TAPSE <16 mm; S’ tricúspide <9,5 cm/s; o ratio VD/VI ≥ 1 en ETT o TC | Clasifica al paciente como riesgo intermedio-alto, y por tanto requiere ingreso hospitalario, monitorización y valoración de fibrinolisis o terapias transcatéter en función de situación hemodinámica y evolución |
| Insuficiencia tricuspídea grave | FEVD> 45% (asociada a síntomas o dilatación del VD) | Considerar reparación o sustitución tricuspídea quirúrgica o percutánea (borde a borde)25 |
| Dilatación del VD o síntomas con FEVD 30-45% | Valorar implante de válvula bicava o tratamiento médico25 | |
| FEVD <30% o IC derecha terminal | Contraindicada la reparación o sustitución tricuspídea quirúrgica o percutánea | |
| Insuficiencia pulmonar grave (tetralogía de Fallot reparada)26 | Volumen telesistólico indexado del VD ≥ 82 ml/m2; relación volumen telediastólico VD/VI> 2 o FEVD <47% por CRM27 | Indicación de reemplazo valvular pulmonar quirúrgico o percutáneo en pacientes sin tracto de salida de VD nativo y anatomía factible |
| Anomalía de Ebstein26 | Si dilatación o deterioro de la función sistólica del VD progresiva | Plantear reparación quirúrgica incluso en casos asintomáticos |
| Si disfunción VD grave, fracción de eyección del VI conservada y presiones izquierdas normales | Anastomosis cavopulmonar bilateral (Glenn) | |
| Comunicación interauricular26 | Sobrecarga de volumen de VD Qp/Qs> 1,5; RVP <3 UW y función izquierda normal | Indicar cierre quirúrgico o percutáneo |
| Miocardiopatía arritmogénica | FEVD <40% | Criterio de alto riesgo de MS. Valorar DAI clase IIa |
| Implante de asistencia ventricular larga duración | - PAPi (PAPs – PAPd/presión venosa central) <2- PAD/presión capilar pulmonar> 0,63- Índice de trabajo del VD (0,0136×stroke volume index×[PAPm – PAD]) <8-12 g/m/latido/m2- EUROMACS28> 4- U-Penn29=6-6,7 (riesgo medio) y> 6,7 (riesgo alto) | Todos ellos traducen riesgo de disfunción aguda del VD posimplante, si ≥ 2, hay riesgo elevado de complicaciones30 |
CRM: cardiorresonancia magnética; DAI: desfibrilador automático implantable; ETT: ecocardiograma transtorácico; FEVD: fracción de eyección del ventrículo derecho; PAD: presión arterial derecha; PAPd: presión arterial pulmonar diastólica; PAPi: índice de pulsatilidad de la arteria pulmonar; PAPm: presión arterial pulmonar media; PAPs: presión arterial pulmonar sistólica; RVP: resistencia vascular pulmonar; MS: muerte súbita; TAPSE: excursión sistólica del plano del anillo tricuspídeo; TC: tomografía computarizada; UW: unidades Wood; VD: ventrículo derecho; VI: ventrículo izquierdo.
La afección miocardiopática hace referencia a la afección muscular intrínseca del VD, que genera alteración de su contractilidad o relajación. Entre las causas agudas (tabla 1), destacan el infarto de miocardio, la miocarditis y el síndrome poscardiotomía. En el escenario crónico, el paradigma clásico es la miocardiopatía arritmogénica del VD, en la que se produce sustitución fibroadiposa, preferentemente en los segmentos basales del VD en etapas precoces y apicales en formas más avanzadas32. La causa fundamental son mutaciones de genes que codifican para proteínas desmosómicas encargadas de la unión entre miocardicitos (placofilina-2 es la más frecuente). Sin embargo, las bases moleculares que conducen a la pérdida de cardiomiocitos, fibrosis, adipogénesis, inflamación y riesgo arrítmico no están clarificadas. En este sentido, el desarrollo de modelos experimentales ha contribuido a identificar vías de señalización, como la de la WNT, la proteína asociada a Hippo-Yes, el receptor activado por el proliferador de peroxisomas γ y ácidos microrribonucleicos33. Asimismo, la afección del VD también es frecuente y asocia peor pronóstico6,34 en las demás miocardiopatías, siendo su prevalencia del 30% en la miocardiopatía dilatada6, del 5% en la miocardiopatía hipertrófica35, del 60% en la amiloidosis cardiaca34 y aproximadamente del 15-20% en la sarcoidosis36. Finalmente, dentro del mecanismo miocardiopático, destaca la anomalía de Ebstein, donde el desplazamiento apical de la válvula tricúspide y la atrialización del VD resultan en un VD funcionalmente hipoplásico y, con el tiempo, disfuncional, lo cual se agrava en presencia de insuficiencia tricuspídea y otras anomalías frecuentemente asociadas (defectos septales y atresia o estenosis pulmonar).
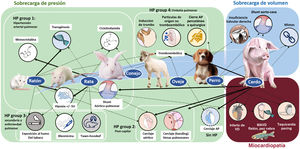
MODELOS EXPERIMENTALES DE DISFUNCIÓN DEL VENTRÍCULO DERECHOEl uso de modelos experimentales animales permite el estudio a nivel molecular de los mecanismos fisiopatológicos y, en el caso de animal grande, su caracterización mediante técnicas diagnósticas y terapéuticas similares a las utilizadas en la práctica clínica37. Las especies más frecuentes son los roedores (ratón y rata, principalmente) por su bajo coste, alta tasa de fertilidad y accesibilidad a su edición genética en el caso del ratón. Los modelos de animal grande, en especial el cerdo, aportan un enfoque más traslacional38–41, pero con un mayor coste de mantenimiento.
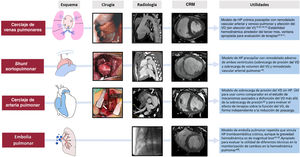
La figura 3 muestra los principales modelos animales clasificados según la generación de sobrecarga de presión (asociada o no a HP), sobrecarga de volumen y afección miocardiopática del VD, y sus ventajas e inconvenientes se detallan en la tabla 3. Respecto a los primeros, los más utilizados en roedores son los de hipoxia aislada o en combinación con el antagonista del receptor del factor de crecimiento endotelial Sugen, el modelo de toxicidad pulmonar por monocrotalina pirrólica y los modelos transgénicos. En nuestra experiencia, los modelos de sobrecarga de presión en cerdo son muy útiles para la validación de métodos diagnósticos y evaluación de terapias, dada su similitud anatómica y fisiológica con el humano. La figura 418,20,38–45 muestra los esquemas, caracterización mediante imagen avanzada y principales aportaciones de estos modelos que pueden generarse mediante una comunicación aortopulmonar40, cerclaje de las venas pulmonares18,38,39,41–44, estenosis de la AP20 o embolización con microesferas44,45. Estos y otros modelos han contribuido a identificar diversas rutas moleculares relacionadas con la disfunción del VD en la HP, que incluyen daño tisular (estrés oxidativo, fibrosis y apoptosis), activación de procesos maladaptativos (inflamación y fibrosis) y, a nivel celular, hipertrofia, switch metabólico y disfunción mitocondrial46. Asimismo, en los últimos años los modelos animales han servido para evaluar diferentes dianas terapéuticas en enfermedades como la HAP32,39,41 o la miocardiopatía arritmogénica del VD33.
Modelos animales experimentales de disfunción del ventrículo derecho. AP: arteria pulmonar; HP: hipertensión pulmonar; MAVD: miocardiopatía arritmogénica del ventrículo derecho; SU: Sugen; VD: ventrículo derecho. El grosor de las flechas indica la mayor utilización de esos modelos.
Modelos experimentales de disfunción del ventrículo derecho
| Modelo | Animal | Ventajas | Inconvenientes | |
|---|---|---|---|---|
| Sobrecarga de presión | ||||
| Sobrecarga de presión con HP | Monocrotalina | Rata | Simplicidad, bajo coste | Toxicidad miocárdica y sistémica, poco traslacional |
| Hipoxia | Ratón, rata | Simplicidad, bajo coste | Efecto hemodinámico de magnitud leve, reversibilidad en normoxia | |
| Hipoxia+Sugen | Rata | Simplicidad, bajo coste, mayor gravedad hemodinámica y efecto sobre VD que hipoxia aislada | Toxicidad miocárdica del Sugen e interferencia de la vía del factor de crecimiento endotelial en la fisiopatología | |
| Fawn-hooded (HP espontánea asociada a cromosomopatía) | Rata | Características similares a la HAP humana | Baja disponibilidad, poco traslacional | |
| Transgénicos (BMPR-2 KO; deficiencia de LRP1, PPARγ, TGFb1) | Ratón | Útiles para estudios mecanísticos asociados a la pérdida o ganancia de función en los diferentes genes | Baja disponibilidad, limitados a una alteración genética concreta y animales pequeños | |
| Embolia pulmonar (HP aguda) o repetida (HP crónica) por inducción de trombo/partículas de origen no tromboembólico | Rata, conejo, oveja, cerdo | Simplicidad, modelo agudo y crónico | En el caso del modelo crónico, gravedad hemodinámica de magnitud leve, sin remodelado significativo del VD | |
| Cierre agudo de rama pulmonar (quirúrgica/balón) | Rata, conejo, oveja, perro, cerdo | Elevación controlada de poscarga | No reproduce fisiopatología humana | |
| Cerclaje de venas pulmonares | Cerdo | Genera HP poscapilar crónica con remodelado vascular arterial y venoso, y del VD. Magnitud hemodinámica estable, útil para evaluación de terapias, sin la interferencia potencial de las mismas sobre el VI | Necesidad de cirugía, variantes anatómicas del tamaño y número de venas pulmonares, alto precio. La ausencia de enfermedad del VI limita su traslacionalidad (similitud mayor con estenosis de venas pulmonares o estenosis mitral) | |
| Shunt aortopulmonar | Cerdo | Reproduce HP precapilar con remodelado vascular y biventricular. Magnitud hemodinámica estable, útil para evaluación de terapias | Complejidad de la cirugía, precio elevado, ausencia de afección derecha aislada (coexistencia con sobrecarga de volumen y remodelado izquierdo) | |
| Sobrecarga de presión sin HP | Estenosis (banding) de la AP | Ratón, rata, conejo, oveja, perro, cerdo | Permite el estudio de la hipertrofia adaptativa del VD | Cierta variabilidad dependiendo del grado de constricción inicial provocado por el banding y el ritmo de crecimiento animal, necesidad de cirugía |
| Sobrecarga de volumen | ||||
| Insuficiencia valvular derecha (tricuspídea o pulmonar) | Oveja, cerdo | Útil para el estudio fisiopatológico de la sobrecarga de volumen aislada (aguda y crónica), posibilidad de procedimientos percutáneos (menos invasivos) | Precio elevado, periodo de tiempo largo hasta desarrollo de remodelado VD | |
| Shunt aorta-cava | Rata, ratón, perro, cerdo | Reproduce fisiopatología humana (cardiopatías congénitas) | Necesidad de cirugía, modelo mixto (posible HP por sobrecirculación pulmonar), periodo de tiempo largo hasta desarrollo de remodelado VD | |
| Miocardiopatía | ||||
| Infarto de VD (ligadura quirúrgica, cierre o implante de coil en la arteria coronaria derecha) | Ratón, perro, cerdo | Reproduce la fisiopatología del infarto con arteria coronaria derecha responsable en pacientes | Necesidad de cirugía o procedimiento percutáneo, alta mortalidad (por arritmias ventriculares), variabilidad del tamaño del infarto (dependiendo de la distribución coronaria) y afección izquierda concomitante | |
| MAVD (modelos transgénicos, principalmente por mutaciones desmosómicas) | Ratón, pez cebra | Útiles para estudios mecanísticos asociados a la pérdida o ganancia de función en los diferentes genes | Baja disponibilidad, limitados a una alteración genética concreta y hasta ahora centrados en el ratón | |
| Taquicardiopatía por estimulación auricular o ventricular rápida | Perro, cerdo | Relativamente sencillo | Puede provocar disfunción biventricular, pocos estudios centrados en el VD, reversibilidad al parar la estimulación | |
AP: arteria pulmonar; HP: hipertensión pulmonar; HAP: hipertensión arterial pulmonar; MAVD: miocardiopatía arritmogénica del ventrículo derecho; PPARγ: receptor de peroxisoma-proliferador-activado gamma; TGFb1: factor de crecimiento transformador beta 1; VD: ventrículo derecho; VI: ventrículo izquierdo.
La disfunción del VD típicamente cursa con síntomas inespecíficos, como fatiga, distensión abdominal o anorexia3. En la exploración física, puede apreciarse ingurgitación yugular, derrame pleural, ascitis, edema de extremidades inferiores, hepatomegalia o reflujo hepatoyugular (figura 2). Los péptidos natriuréticos y la troponina pueden ser útiles en la identificación y monitorización de la disfunción del VD, aunque se elevan también (y en mayor medida) ante disfunción del VI y no es posible diferenciar el nivel de daño en ambos47. Las alteraciones analíticas del perfil hepático y renal son relevantes en el contexto de congestión o bajo gasto. En la radiografía de tórax, puede apreciarse cardiomegalia a expensas del borde cardiaco derecho. En el electrocardiograma, es frecuente la desviación del eje a la derecha (> 90̊), onda P pulmonale y ondas R en V1 y S en V5-V6 prominentes, así como presencia de fibrilación auricular. En la embolia pulmonar aguda, se suele observar taquicardia sinusal, inversión de onda T de V1 a V3, patrón S1Q3T3 o bloqueo de rama derecha.
La ergoespirometría constituye una herramienta útil para evaluar la capacidad funcional de los pacientes con IC derecha, y su uso se ha extendido particularmente en la estratificación pronóstica de la HAP (donde un VO2 pico <11ml/min/kg [< 35% del predicho] y un VE/VCO2 en el umbral anaeróbico> 44 se asocian a una mortalidad anual> 20%3), en la decisión de reparación de la insuficiencia pulmonar en la tetralogía de Fallot intervenida31 o en la miocardiopatía arritmogénica del VD, en la cual un VE/VO2> 34 se ha asociado a mayor riesgo de IC y menor supervivencia libre de trasplante cardiaco48.
Evaluación multimodal por imagenEcocardiografíaLa ecocardiografía continúa siendo la técnica más usada para la evaluación inicial morfofuncional del VD (figura 5). Las dimensiones deben incluir los diámetros basal, medio y longitudinal, el grosor de la pared libre, el índice de esfericidad del VI y el cociente del diámetro basal VD/VI. Puede estimarse la probabilidad de HP a partir de la velocidad máxima del flujo de regurgitación tricúspidea, y las dimensiones de la AD, VD, AP y vena cava inferior. Los principales parámetros de función del VD se describen en la tabla 449–51, con sus valores de normalidad, ventajas e inconvenientes. La excursión sistólica del plano del anillo tricuspídeo (TAPSE) y el pico de velocidad sistólica por Doppler tisular en el anillo lateral tricuspídeo (S’) son sencillos de adquirir y menos dependientes de la ventana acústica, si bien presentan limitaciones en condiciones en las que la contractilidad del VD pasa a ser preferentemente transversal, como en la HP52 o tras cirugía cardiaca7. El cambio de área fraccional del VD presenta mejor correlación con la fracción de eyección del ventrículo derecho (FEVD) por cardiorresonancia magnética (CRM) o tomografía computarizada49,53, pero requiere una buena delimitación del endocardio. El análisis de la deformación (strain) longitudinal mediante speckle-tracking permite identificar la disfunción subclínica54 y ha demostrado valor pronóstico en HP, insuficiencia tricuspídea e IC55. La ratio TAPSE/presión arterial pulmonar sistólica se ha consolidado como una medida no invasiva del acoplamiento VD-AP56 con valor pronóstico en la IC y la HP3. Para el análisis de la función diastólica se utilizan los índices E/A y E/e’ por Doppler pulsado y tisular, el valor pico del strain rate en diástole precoz y el strain de la AD49. La ecocardiografía tridimensional es especialmente útil en cardiopatías congénitas con morfologías singulares del VD, pero su principal limitación es la dependencia de la ventana acústica. Por último, la ecocardiografía de estrés permite evaluar la reserva contráctil del VD antes de una cirugía o un intervencionismo valvular percutáneo, analizando cambios en parámetros como la TAPSE o S’.
Principales métodos de evaluación del ventrículo derecho. AP: arteria pulmonar; DTI: Doppler tisular; Ea: elastancia arterial efectiva; Ees: elastancia telesistólica; FDG: fluorodesoxiglucosa; FEVD: fracción de eyección de ventrículo derecho; IT: insuficiencia tricuspídea; PAPm: presión arterial pulmonar media; PCP: presión capilar pulmonar; PET: tomografía por emisión de positrones; PIA: punto de inserción anterior; PIP: punto de inserción posterior; RVP: resistencia vascular pulmonar; SIV: septo interventricular; TAPSE: excursión sistólica del plano del anillo tricuspídeo; TC: tomografía computarizada; TEP: tromboembolia pulmonar; VD: ventrículo derecho; VI: ventrículo izquierdo; Vmáx: volumen espiratorio máximo.
Parámetros más comunes de ecocardiografía y resonancia magnética cardiovascular en la evaluación funcional del ventrículo derecho
| Valores de referencia49 | Usos y ventajas | Limitaciones | |
|---|---|---|---|
| Ecocardiografía | |||
| TAPSE (modo M) | Normal: 24±35 mmAnormal: <17 mm | - Evalúa la contractilidad longitudinal- Fácil y rápido, a pie de cama- Menos dependiente de la ventana acústica- Valor pronóstico | - No considera función radial, e ignora SIV y TSVD- Carga-dependiente- No útil tras cirugía o trasplante cardiacos |
| TAPSE/PAPs | 55-64 años: 0,89±0,2365-74 años: 0,84±0,2275-84 años: 0,77±0,21≥ 85 años: 0,70±0,22(mm/mmHg) | - Evalúa acoplamiento VD/AP de forma no invasiva- Valor pronóstico | - No valorable en ausencia de IT, o si la IT es masiva o torrencial- Puntos de corte pronósticos variables según el escenario clínico- Poca evidencia sobre valores de normalidad en sujetos sanos jóvenes (< 55 años) |
| S’ (Doppler tisular) | - Normal: 14,1±2,3 cm/s- Anormal: <9,5 cm/s | - Evalúa la contractilidad longitudinal- Rápido y reproducible- Valor pronóstico | - Limitaciones similares a la TAPSE |
| Cambio de área fraccional | - Normal: 49±7%- Anormal: <35% | - Evalúa la contractilidad longitudinal y radial- Buena correlación con FEVD por CRM | - Requiere buena calidad de imagen enfocada en VD e ignora TSVD- Carga-dependiente- Menor reproducibilidad |
| Índice del rendimiento miocárdico (Doppler tisular)(TCAE – TE)/TE | - Normal: 0,38±0,08- Anormal:> 0,54 | - Evalúa la función sistólica y diastólica del VD- Menos dependiente de ventana acústica, reproducible y rápido | - Poco fiable si la presión AD es muy elevada |
| dP/dt | - Normal: ≤ 400 mmHg/s | - Fácil y disponible | - No aplicable si IT ausente, o si es masiva o torrencial; carga-dependiente |
| Strain pared libre VD(por speckle-tracking) | - Normal: -29±4,5%- Anormal:>−20% | - Evalúa la deformación longitudinal de la pared libre- Menor dependencia de condiciones de carga y de ángulo de adquisición- Valor pronóstico | - Dependiente de la calidad de imagen y requiere posprocesado- Ignora el TSVD- Valores dependientes del fabricante (importante en el seguimiento) |
| FEVD por 3D | - Normal: 58±6,5%- Anormal: <45% | - Libre de asunciones geométricas- Alta correlación con CRM- Valor pronóstico | - Dependiente de la calidad de imagen y requiere posprocesado- Menos disponible y requiere entrenamiento |
| CRM | |||
| FEVD | Varón <60 años: 64±7%; LIN: <50%Varón ≥ 60 años: 69±7%; LIN: <55%Mujer <60 años: 64±6%; LIN: <52%Mujer ≥ 60 años: 70±6%; LIN: <58% | - Libre de asunciones geométricas- Muy útil en anatomías complejas- Valor pronóstico | - Su adquisición convencional requiere apneas y mayor duración, por lo que se limita a pacientes clínicamente estables- Menor disponibilidad y mayor coste- Adquisición subóptima en presencia de arritmias- Uso limitado si dispositivos incompatibles, claustrofobia, insuficiencia renal avanzada o alergia a gadolinio- Requiere entrenamiento |
| Cateterismo derecho | |||
| Índice cardiaco | 4,1±1,3 l/min/m2 | - Parámetro clave a la hora de indicar dispositivos avanzados de soporte mecánico o trasplante | - La medición por termodilución presenta limitaciones en presencia de insuficiencia tricuspídea significativa o shunts- El método de Fick requiere asunciones físicas que pueden provocar variabilidad significativa |
| Presión auricular derecha | 5,5±2,0 mmHg | - Estimador de la precarga del VD- Aporta información sobre el estado de volemia del paciente y por tanto guía su tratamiento- Una elevación desproporcionada es marcador pronóstico- Medición de la onda V: clave en la planificación de terapias tricuspídeas percutáneas | - Variabilidad importante en función del estado hemodinámico y de volemia del paciente |
| PAD/PCP | 0,56±0,07 | - Medida de la desproporción en la elevación de la presión auricular derecha con respecto a las presiones en cavidades izquierdas, clave para toma de decisiones (trasplante; asistencia ventricular).- Un valor >0,63 es factor de riesgo de fracaso del VD posimplante de asistencia ventricular | - Limitado en el caso de disfunción de ambos ventrículos, ya que las presiones de llenado izquierda y derecha estarán elevadas y por tanto el índice puede simular normalidad |
| Índice de pulsatilidad de la arteria pulmonar (PAPi) (PAPs−PAPd)/PAD | 5,5±4,4 | - Validado en diversos estudios en el contexto de insuficiencia cardiaca avanzada y como predictor de fracaso derecho tras implante de asistencia ventricular izquierda de destino- Un valor <1,6 es factor de riesgo de fracaso del VD posimplante de asistencia ventricular | - Es un parámetro variable en función de la distensibilidad arterial pulmonar, PAD e incluso volumen-latido, por lo que es difícilmente comparable entre individuos |
| Índice de trabajo del VD (RVWSI)(IC/FC) x (PAPm−PAD) x 0,00136 | 4-12 g/m/latido/m2 | - Un valor <4 es factor de riesgo de fracaso del VD posimplante de asistencia ventricular | - El cálculo de este parámetro es dependiente de la precarga y múltiples parámetros, por lo que está sujeto a mayor variabilidad y error |
AD: aurícula derecha; AP: arteria pulmonar; CRM: cardiorresonancia magnética; FC: frecuencia cardiaca; FEVD: fracción de eyección del ventrículo derecho; IC: insuficiencia cardiaca; IT: insuficiencia tricuspídea; LIN: límite inferior de la normalidad; PAD: presión arterial derecha; PAPd: presión arterial pulmonar diastólica; PAPi: índice de pulsatilidad de la arteria pulmonar; PAPm: presión arterial pulmonar media; PAPs: presión arterial pulmonar sistólica; PCP: presión capilar pulmonar; RVWSI: right ventricular stroke work index; SIV: septo interventricular; TAPSE: excursión sistólica del plano del anillo tricuspídeo; TCAE: tiempo de cierre y apertura tricuspídeo; TE: tiempo de eyección; TSVD: tracto de salida del ventrículo derecho; VD: ventrículo derecho.
La CRM se considera el patrón oro para la evaluación no invasiva de la anatomía, función y caracterización tisular del VD. De todos los parámetros (tabla 4)50,57, el más utilizado en la clínica es la FEVD. Un valor de FEVD ≤ 40% en pacientes con infarto agudo de miocardio es predictor de mortalidad, independientemente de la edad, extensión del infarto y fracción de eyección del VI58. Un valor <45% se asocia con más eventos cardiovasculares y menor tiempo libre de trasplante en pacientes con miocardiopatía dilatada5, y con mayor hospitalización por IC y muerte tras reparación tricuspídea transcatéter59. Asimismo, la FEVD es predictora de eventos arrítmicos y muerte en la miocardiopatía arritmogénica del ventrículo derecho60, y de eventos cardiovasculares mayores en la miocarditis aguda61. La deformación (strain) longitudinal global y segmentaria del VD puede evaluarse mediante técnicas de feature tracking (la más disponible), tagging o codificación por deformación rápida (fastSENC)62. En la difícil toma de decisión sobre el momento óptimo para la reparación de la insuficiencia pulmonar en la tetralogía de Fallot corregida, un volumen telesistólico indexado del VD de 82 ml/m2 confiere una probabilidad alta de remodelado inverso tras la intervención27. Otros puntos de corte relevantes en la toma de decisiones clínicas se incluyen en la tabla 2. Las secuencias de contraste de fase permiten cuantificar de forma precisa el cociente entre el flujo pulmonar y el sistémico (Qp/Qs) en pacientes con cortocircuitos congénitos, caracterizar el flujo de la AP y la distensibilidad de su pared, y podrían servir para estimar y monitorizar la RVP43,44. La ratio entre el volumen latido y el volumen telesistólico supone otro método no invasivo para estimar el acoplamiento VD-AP63. En cuanto a la caracterización tisular, el realce tardío de gadolinio en los puntos de inserción del VD y el septo es frecuente, y se asocia con la gravedad hemodinámica en pacientes con HP, pero no ha demostrado valor pronóstico independiente64. En cambio, la cuantificación del T1 nativo y el volumen extracelular, parámetros subrogados de fibrosis miocárdica difusa, permiten detectar la afección temprana del VD18, y han demostrado valor pronóstico independiente65. Nuevas secuencias ultrarrápidas, como la Enhanced SENSE by Static Outer volume Substraction (ESSOS), reducen de forma drástica los tiempos de adquisición sin perjudicar la calidad66, lo que permitirá expandir la evaluación del VD por CRM.
Tomografía computarizadaSu mayor utilidad clínica reside en el diagnóstico de causas relevantes de disfunción aguda y crónica del VD, como la embolia pulmonar aguda o la HP tromboembólica crónica. Sin embargo, en estos casos el estudio habitualmente no es sincronizado, con lo que la información aportada del VD es limitada. En pacientes seleccionados en los que la CRM esté contraindicada y la información provista por la ecocardiografía sea insuficiente, como puede ocurrir en portadores de asistencias ventriculares53, se puede plantear una tomografía computarizada sincronizada con adquisición retrospectiva, que permite evaluar volúmenes, masa y FEVD, aunque con mayor exposición a radiación ionizante.
Tomografía de emisión de positronesSi bien su uso se encuentra todavía en el ámbito de la investigación, ofrece la posibilidad de evaluar el metabolismo miocárdico del VD. En pacientes con HAP, se ha observado que una captación de 18F-fluorodesoxiglucosa más intensa se asocia a mayor sobrecarga de presión, disfunción y peor curso clínico, y es modificable con tratamiento vasodilatador21. También en pacientes con sobrecarga de volumen por una comunicación interauricular23 se observa aumento de captación septal.
Evaluación hemodinámica del ventrículo derechoLas curvas de presión-volumen (figura 5) constituyen el patrón oro para evaluar la función del VD, pero debido a su relativa complejidad (requiere avanzar un catéter de conductabilidad hasta el VD), han quedado relegadas al ámbito de la investigación. El hecho de conocer su interpretación, no obstante, es interesante. Considerando que el eje de abscisas marca el volumen y el de ordenadas la presión, la anchura de la curva representa el volumen sistólico del VD, y su área, el trabajo sistólico (stroke work). La elastancia telesistólica (Ees) es el parámetro de referencia para evaluar la contractilidad del VD, al ser independiente de la pre- y poscarga, y se obtiene de la pendiente de la recta que conecta los puntos telesistólicos de cada curva. A su vez, la elastancia arterial efectiva (Ea) es el parámetro más fidedigno de poscarga del VD, ya que tiene en cuenta sus componentes resistivo, pulsátil y pasivo, y se obtiene como la pendiente de la línea que une los puntos telesistólico y telediastólico de la curva. La razón Ees/Ea representa el acoplamiento VD-AP y su valor normal es de 1. Valores de Ees/Ea inferiores a 0,6-0,8 se han relacionado con un mal pronóstico ante sobrecarga de presión o volumen67,68.
A partir del cateterismo cardiaco derecho se obtienen varios parámetros de función del VD que son de ayuda para la toma de decisiones (tabla 2) y que tienen factor pronóstico. Los más importantes son la presión de la AD, la razón entre la presión de la AD y la presión capilar pulmonar, el índice de trabajo del VD ([índice cardiaco/frecuencia cardiaca]*[PAPm−presión AD]*0,00136) y el índice de pulsatilidad de la AP (PAPi), que se obtiene con la fórmula ([PAP sistólica−PAP diastólica]/presión AD). Los valores de normalidad obtenidos a partir de sujetos sanos o grupos control de diferentes estudios constan en la tabla 451. PAPi ha adquirido una importancia creciente en los últimos años, fundamentalmente en pacientes con shock cardiogénico, IC69, y antes del implante de una asistencia ventricular izquierda30.
TRATAMIENTO DE LA DISFUNCIÓN DEL VENTRÍCULO DERECHOEl tratamiento de la disfunción del VD se basa fundamentalmente en tratar la causa y optimizar la precarga, poscarga y contractilidad (figura 2).
Tratamiento de la disfunción aguda del ventrículo derechoEl tratamiento de la disfunción aguda del VD ha de dirigirse al soporte hemodinámico y al abordaje del desencadenante. Para lo primero, es clave la optimización de la volemia, conociendo que la administración excesiva de volumen puede sobredistender el VD y aumentar su tensión parietal, lo que provoca disminución de la contractilidad, y agravamiento de la insuficiencia tricuspídea y de la interdependencia ventricular, que dificulta el llenado del VI, con la consiguiente reducción del gasto cardiaco. Por ello, aunque inicialmente sea necesaria la administración de volumen, es recomendable evaluar de forma exhaustiva y repetida el estado de volemia clínicamente o con medición de la presión venosa central70. Ante signos de congestión o presión venosa central elevada se debe iniciar tratamiento diurético, cuya monitorización y ajuste deben hacerse con la misma cautela.
El tratamiento vasoconstrictor e inótropo está indicado ante inestabilidad hemodinámica. Como vasoconstrictor destaca la noradrenalina, ya que aumenta la presión arterial sistémica y la perfusión coronaria sin afectar a la RVP, y como inótropos, la dobutamina, el levosimendán y la milrinona. El levosimendán favorece el acoplamiento ventriculoarterial, al aumentar la contractilidad del VD y disminuir la poscarga por vasodilatación arterial pulmonar1. En algunos casos, para reducir aún más la poscarga, pueden utilizarse agentes vasodilatadores pulmonares selectivos, como el óxido nítrico o las prostaciclinas1. Si persiste la inestabilidad hemodinámica refractaria a tratamiento médico, es fundamental plantear en el momento idóneo la necesidad de soporte mecánico circulatorio. La elección del dispositivo dependerá de la estimación de la duración del soporte. Son dispositivos de corta duración el oxigenador extracorpóreo de membrana, el Impella RP (Abiomed, Estados Unidos) y el PROTEK Duo (TandemLife, Estados Unidos). Si se estima una duración del soporte mayor a 10-15 días, se debe optar por dispositivos de implante quirúrgico, como Levitronix CentriMag (Abbott Medical, Estados Unidos). En pacientes asistidos en los que no se prevé recuperación, se ha de valorar la candidatura a trasplante cardiaco o cardiopulmonar1.
Por supuesto, además de estas medidas generales, es fundamental tratar el origen subyacente. La embolia pulmonar es una de las causas más frecuentes de disfunción aguda del VD y, en los pacientes de alto riesgo, definidos por inestabilidad hemodinámica causada por la IC derecha, está indicado el tratamiento de reperfusión con fibrinolisis sistémica o local transcatéter, o trombectomía quirúrgica o percutánea24,71. En el infarto del VD, debe revascularizarse lo antes posible la arteria responsable, pero, incluso en fase subaguda, puede ofrecer beneficio, dada la viabilidad miocárdica más prolongada del VD70.
Tratamiento de la disfunción crónica del ventrículo derechoEl tratamiento de la IC derecha crónica requiere igualmente un adecuado abordaje diurético para evitar la congestión, y sus consecuencias a nivel renal y hepático, y en el sentido contrario, evitar la depleción excesiva que conduzca a bajo gasto. En casos de resistencia diurética, se recomienda la combinación de las distintas familias (diuréticos de asa, tiazidas, antagonistas del receptor mineralocorticoide, acetazolamida, inhibidores del cotransportador de sodio-glucosa tipo 2 o incluso vaptanes) para lograr el bloqueo secuencial de la nefrona y, en formas más avanzadas, valorar hemodiálisis o diálisis peritoneal72. En el síndrome cardiohepático, el paciente puede exhibir un fenotipo de vasoplejia y gasto hiperdinámico, de difícil abordaje y mal pronóstico73.
En realidad, no disponemos de tratamientos específicos para tratar la disfunción del VD. En presencia de HP crónica, el tratamiento de la sobrecarga de presión depende del grupo etiológico3. En la HP del grupo 1, se utilizan vasodilatadores pulmonares específicos que actúan sobre las vías de la endotelina 1, prostaciclina y óxido nítrico. En cambio, en la HP de los grupos 2 y 3, se prioriza el tratamiento de la cardiopatía o neumopatía subyacente. Por último, en pacientes del grupo 4, la anticoagulación y el tratamiento médico (riociguat), quirúrgico o percutáneo se decide en función de la anatomía y características del paciente.
En la disfunción del VD por sobrecarga de volumen, presente en la insuficiencia tricúspidea, insuficiencia pulmonar (frecuente tras reparación de la tetralogía de Fallot) o shunts intracardiacos, la indicación de intervención y el procedimiento (percutáneo o quirúrgico) debe individualizarse según las características del paciente (p. ej., fragilidad), la anatomía de la válvula, y el defecto y la función del VD (tabla 2).
CONCLUSIONES Y FUTUROEl VD es una estructura única desde el punto de vista embrionario, anatómico y funcional. Aunque el interés hacia él ha crecido de forma exponencial en los últimos años, todavía existen retos importantes, como entender mejor los mecanismos subyacentes a la transición del remodelado adaptativo a la disfunción del VD; diagnosticar y tratar precozmente su afección, e identificar nuevas dianas terapéuticas o procedimientos que demuestren mejoría pronóstica. Estas premisas enfatizan la importancia de la investigación traslacional en el estudio del VD, abriendo la puerta a un campo de investigación amplio, joven y ávido de dar respuestas.
FINANCIACIÓNEste manuscrito ha sido financiado parcialmente por el Instituto de Salud Carlos III con financiación de la Unión Europea a través de los proyectos PI20/00742 y PI23/01341. El Centro Nacional de Investigaciones Cardiovasculares Carlos III cuenta con el apoyo del Instituto de Salud Carlos III, el Ministerio de Ciencia e Innovación y la Fundación Pro CNIC (AEI/10.13039/501100011033).
DECLARACIÓN SOBRE EL USO DE INTELIGENCIA ARTIFICIALNo se ha empleado inteligencia artificial.
CONTRIBUCIÓN DE LOS AUTORESTodos los autores contribuyeron en el diseño del trabajo y la decisión acerca de los contenidos científicos. C. Real y C.N. Pérez-García elaboraron la primera versión del manuscrito; ambos autores han contribuido de forma equitativa a este manuscrito. C. Galán-Arriola elaboró las figuras del trabajo, y contribuyó en la redacción y revisión del apartado de modelos de experimentación animal. I. García-Lunar contribuyó en la redacción del trabajo y su revisión, específicamente en la sección de imagen cardiaca. A. García-Álvarez elaboró el índice de contenidos y realizó una revisión profunda del documento completo.
CONFLICTO DE INTERESESNinguno.