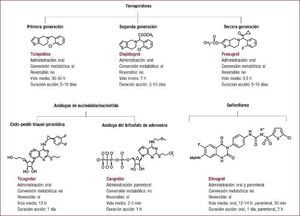
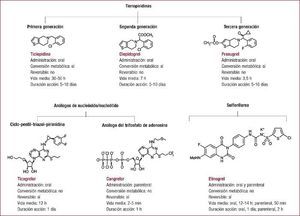
La doble antiagregación plaquetaria con ácido acetilsalicílico y un inhibidor del receptor P2Y12 actualmente es de elección para pacientes con síndrome coronario agudo o sometidos a intervencionismo coronario percutáneo. Pese a que la recomendación general es mantenerla durante 12 meses tras un síndrome coronario agudo y en los pacientes tratados con un stent liberador de fármaco, está en discusión cuál es la duración óptima en diversos escenarios clínicos. El objetivo del presente artículo es aportar una visión general del estado actual de conocimiento sobre las pautas de duración de la doble terapia antiagregante en el síndrome coronario agudo discutiendo las evidencias aportadas por estudios realizados en pacientes con síndrome coronario agudo o en el contexto de intervencionismo con implante de stent.
Palabras clave
La utilidad clínica de la doble antiagregación plaquetaria (DAP) se ha demostrado en distintos ámbitos clínicos. En 1994, se demostró que la DAP con ácido acetilsalicílico (AAS) y ticlopidina permitía evitar la anticoagulación que entonces se utilizaba sistemáticamente en el implante de stents coronarios Palmaz-Schatz y se asociaba a una alta incidencia de complicaciones hemorrágicas1. Desde entonces, la DAP ha sido un tratamiento habitual para pacientes con enfermedad coronaria. Las ventajas que el clopidogrel supuso frente a la ticlopidina, dosis única diaria y ausencia de riesgo de neutropenia, hicieron que su uso se extendiera a los pacientes tratados con stent coronario pese a no estar aprobado su uso con tal indicación. Sin embargo, el éxito de la DAP llevó a utilizarla en la angioplastia primaria y el síndrome coronario agudo sin elevación del ST (SCASEST) e incluso a probarla en enfermedad vascular crónica o prevención primaria cardiovascular2,3. Sin embargo, la DAP aumenta el riesgo hemorrágico frente a la antiagregación única. Este riesgo depende tanto de la dosis de antiagregantes como de su duración. Por lo tanto, el equilibrio entre beneficio clínico y riesgo hemorrágico es un aspecto clave en el debate sobre la duración óptima de la DAP para pacientes con enfermedad coronaria, que sigue abierto en cardiología. En este artículo se discuten las evidencias en favor de la utilización sistemática (no guiada por necesidades clínicas, como eventos isquémicos o hemorrágicos) de distintas pautas de duración de DAP en estos pacientes.
Duración de la doble terapia antiagregante: argumentos basados en estudios de tratamiento de síndromes coronarios agudosLa DAP prolongada con AAS y un inhibidor del receptor P2Y12 es un estándar en el tratamiento de los pacientes con síndrome coronario agudo (SCA) con y sin elevación del segmento ST, y así se indica en las recomendaciones de las guías de práctica clínica4, 5, 6. Las evidencias para su utilización provienen de ensayos clínicos que han probado la eficacia y la seguridad del tratamiento a largo plazo con inhibidores orales del receptor P2Y12, en concreto clopidogrel, prasugrel y ticagrelor, añadidos al tratamiento crónico con AAS en los SCA.
Duración de la doble antiagregación en el SCASESTTres grandes ensayos clínicos han demostrado la utilidad de la DAP en el ámbito de los SCASEST. El estudio CURE evaluó la eficacia y la seguridad de la administración de clopidogrel (dosis de carga de 300 mg, seguida de mantenimiento a 75 mg/día) añadido a AAS en 12.562 pacientes con SCASEST. El tratamiento con clopidogrel durante 9–12 meses redujo un 20% (el 11,4 frente al 9,3%) la incidencia del objetivo combinado de eficacia (muerte cardiovascular, infarto de miocardio [IM] no mortal o accidente cerebrovascular [ACV] no mortal) de manera concordante en todos los subgrupos, principalmente a expensas de la reducción de IM no mortal sin efecto en la mortalidad, y aumentó la incidencia de hemorragia mayor (el 3,7 frente al 2,7%)2. El beneficio del clopidogrel fue mayor en los pacientes sometidos a intervencionismo coronario percutáneo (ICP), con una reducción absoluta de riesgo del 1,9% (reducción relativa del riesgo [RRR], 30%)7. El beneficio de clopidogrel se mantuvo en el tiempo, con una reducción del objetivo principal del 1,1% (el 5,4 frente al 4,3%; RRR, 21%) en los primeros 30 días y del 1,1% (el 6,3 frente al 5,2%; RRR, 18%) entre los 30 días y los 12 meses8. En los pacientes sometidos a ICP, la reducción relativa en la incidencia de muerte e IM en los primeros 30 días fue del 40%, mientras que entre los 30 días y el final del seguimiento hubo una reducción adicional del 38%7. El uso de clopidogrel produjo un aumento relativo de la incidencia de hemorragias mayores del 31% en los primeros 30 días (el 2,01 frente al 1,54%) y del 48% entre los días 31 y 365 (el 1,75 frente al 1,18%) según la definición CURE8.
El estudio TRITON-TIMI 389 evaluó la eficacia y la seguridad de remplazar el clopidogrel por prasugrel, un profármaco oral cuyo metabolito activo actúa de manera más potente, rápida y constante que el de clopidogrel10. El tratamiento con prasugrel (dosis de carga de 60 mg y dosis de mantenimiento de 10 mg/día) durante 6–15 meses se demostró superior a clopidogrel en prevenir el evento combinado de eficacia (muerte cardiovascular, IM no mortal o ACV no mortal) en 13.608 pacientes con SCA de riesgo moderado-alto en los que se había realizado angiografía, iban a ser tratados con ICP y no habían recibido previamente clopidogrel. El prasugrel redujo la incidencia del objetivo principal el 2,2% (el 9,9 frente al 12,1%; RRR, 19%) a expensas de reducir el IM no mortral, y mostró también un gran beneficio en prevención de la trombosis del stent. Estos beneficios fueron particularmente notables en los pacientes diabéticos11. El tratamiento con prasugrel aumentó el 0,6% (el 2,4 frente al 1,8%) la incidencia de hemorragias mayores TIMI no relacionadas con cirugía coronaria y el 0,3% las mortales (el 0,4 frente al 0,1%)9. La reducción absoluta del evento combinado principal con prasugrel fue del 1,7% (el 5,7 frente al 7,4%) a los 30 días y del 0,8% (el 4,5 frente al 5,3%) entre los 30 días y el final del estudio9. La incidencia de hemorragia mayor fue numéricamente superior a los 30 días (el 1,03 frente al 0,87%) y entre el día 31 y el final del estudio (el 1,42 frente al 0,97%)13. En pacientes con SCASEST tratados médicamente, por el contrario, la DAP con AAS + prasugrel (entre 6 y 30 meses) no se demostró superior a AAS + clopidogrel12.
La DAP con ticagrelor, un antiagregante con propiedades farmacodinámicas similares a las del prasugrel, con unión reversible al receptor P2Y12 y duración de acción más corta (dosis de carga de 180 mg, seguida de mantenimiento con 90 mg/12 h) durante un máximo de 12 (mediana, 9) meses se demostró superior a la DAP con clopidogrel en 18.624 pacientes con SCA de riesgo moderado o alto. La incidencia del objetivo combinado de eficacia (muerte cardiovascular, IM o ACV no mortal) a los 12 meses fue el 1,9% menor con ticagrelor (el 9,8 frente al 11,7%; RRR, 16%) a expensas de la reducción en IM no mortal y de la mortalidad cardiovascular, con una menor incidencia de trombosis del stent14. El beneficio fue independiente de la estrategia terapéutica: ICP15, revascularización coronaria quirúrgica16 o tratamiento médico17. El ticagrelor aumentó el 0,7% las hemorragias mayores no relacionadas con la revascularización quirúrgica (el 4,5 frente al 3,8%), con otros efectos secundarios como disnea y bradicardia14.
A diferencia del prasugrel, cuyo máximo beneficio se observa en las primeras semanas, los beneficios clínicos del ticagrelor aumentan progresivamente. En el estudio PLATO se observó una reducción absoluta del 0,6% en el objetivo principal (el 5,4 frente al 4,8%) a los 30 días y el 1,3% (el 6,6 frente al 5,3%) desde el día 31 hasta el fin del estudio14, con un incremento absoluto de hemorragia mayor TIMI no relacionada con cirugía coronaria en los primeros 30 días (el 2,45 frente al 2,00%), pero no entre los días 31 y 365 (el 1,59 frente al 2,29%)18.
Duración de la doble antiagregación en el síndrome coronario agudo con elevación del segmento STDos estudios han evaluado la eficacia y la seguridad de la DAP con AAS + clopidogrel frente a AAS en pacientes con infarto agudo de miocardio con elevación del segmento ST (IAMCEST): el CLARITY-TIMI 28, realizado en pacientes menores de 75 años tratados con fibrinolisis, con dosis de carga de clopidogrel de 300 mg19, y el COMMIT, realizado en 45.852 pacientes con infarto agudo de miocardio en China, sin dosis de carga de clopidogrel20. Ambos estudios demostraron la eficacia y la seguridad de la DAP durante 28–30 días. No hay ensayos clínicos que comparen DAP con clopidogrel frente a AAS en pacientes tratados con angioplastia primaria.
El análisis de los 3.534 pacientes con IAMCEST del estudio TRITON-TIMI 38 tratados con angioplastia primaria o tardía mostró que el beneficio observado con prasugrel era superior al observado en el estudio PLATO en reducir el objetivo principal, con una diferencia absoluta del 3% (el 6,5 frente al 9,5%; RRR, 31%) a los 30 días, mientras que el beneficio tardío se atenuaba ligeramente, dejando un beneficio absoluto a los 15 meses del 2,4% (el 10,0 frente al 12,4%; RRR, 21%), sin diferencias en la incidencia de sangrados mayores21.
El subestudio de los 7.544 pacientes del estudio PLATO que sufrieron IAMCEST mostró una incidencia menor del objetivo principal en los pacientes tratados con AAS + ticagrelor, del 1,4% (el 9,4 frente al 10,8%; RRR, 13%), sin incrementar el riesgo hemorrágico. Al contrario que lo observado con prasugrel, no se observan prácticamente diferencias entre ambas opciones en los primeros 30 días, y las curvas divergen progresivamente a partir de las primeras semanas hasta alcanzar el máximo beneficio al final del seguimiento22.
Según esos estudios, la evidencia disponible indica que el tratamiento con DAP durante varios meses, aproximadamente 12 según el diseño de los ensayos clínicos (entre 6 y 15), se asocia a un beneficio clínico incremental sobre la DAP durante 30 días en la prevención de eventos isquémicos a expensas de un aumento en el riesgo de hemorragias mayores. Esto es así para el tratamiento con AAS + clopidogrel o ticagrelor en los pacientes con SCASEST manejados con cualquier estrategia terapéutica inicial y para el tratamiento con AAS + prasugrel en pacientes con SCASEST sometidos a una estrategia invasiva y revascularizados con stent. Dadas las diferencias en los diseños de los distintos ensayos clínicos, no se puede realizar comparaciones directas entre los tres inhibidores de la P2Y12. Sin embargo, el análisis de los resultados en el tiempo indican que, mientras que en la DAP con prasugrel el índice beneficio/riesgo es más favorable en los primeros 30 días del tratamiento, lo contrario parece suceder con ticagrelor, al tiempo que este índice se mantiene relativamente estable con clopidogrel (Figura 1). Además de estas evidencias, estudios observacionales señalan que la interrupción precoz de la DAP aumenta el riesgo de recurrencia de eventos coronarios23.
Figura 1. Cambios absolutos en la incidencia del objetivo compuesto de eficacia (muerte cardiovascular o infarto de miocardio o accidente cerebrovascular) y de seguridad (hemorragia mayor) en los tres ensayos clínicos sobre doble antiagregación plaquetaria para pacientes con síndromes coronarios agudos.
En el IAMCEST las evidencias disponibles indican mejores resultados para la DAP con AAS + prasugrel o ticagrelor en los pacientes sometidos a angioplastia primaria (o ICP tardía con prasugrel). Pese a su uso generalizado, no existen evidencias directas del papel de la DAP con AAS + clopidogrel y, por lo tanto, de su duración en estos pacientes. Por el contrario, los estudios disponibles solo confirman la eficacia de la DAP durante 1 mes en pacientes tratados con fibrinolisis o sin reperfusión. Se desconoce si acortar o alargar la DAP en estos pacientes es superior o equivalente a la duración de 12 meses recomendada por las guías de práctica clínica, por lo que son necesarios estudios diseñados específicamente para responder a esta pregunta.
Duración de la doble terapia antiagregante: argumentos basados en estudios de tratamiento tras implante de stent coronarioEn el ICP electivo, donde únicamente se acepta la combinación de AAS y clopidogrel, se recomienda la DAP durante 6 meses tras implante de stents liberadores de fármacos (SLF) de nueva generación y durante 1 mes en el caso de stents metálicos4. Asimismo, las guías de práctica clínica mencionan que ciertas subpoblaciones de pacientes (alto riesgo de eventos trombóticos o tratados con SLF de primera generación) podrían beneficiarse de una duración mayor, recordando que el riesgo de complicación hemorrágica aumenta cuanto mayor sea la duración de la DAP4. Esta aclaración lleva implícito un importante mensaje a la hora de decidir la estrategia de tratamiento antitrombótico: no todos los pacientes son iguales (diferencias en el riesgo de padecer un evento isquémico o hemorrágico y complejidad de la anatomía coronaria) ni todos los SLF son iguales.
El marcado beneficio obtenido con los SLF en comparación con los stents metálicos convencionales en cuanto a las tasas de reestenosis ha llevado a la generalización de su uso24. Pese a ello, la duración óptima de la DAP tras su implantación no se conoce con exactitud. De hecho, a pesar de que en los primeros trabajos realizados con SLF de primera generación la duración de la DAP era de 3 meses para los stents de sirolimus25 y 6 meses para los de paclitaxel26, la práctica habitual es mantenerla 12 meses. Dicha recomendación no se basó inicialmente en ningún estudio aleatorizado específicamente diseñado para evaluar esta estrategia, sino en un consenso basado en los resultados del estudio CREDO, que mostró una reducción del 27% de la incidencia de eventos isquémicos con 1 año de DAP comparado con 1 mes de tratamiento tras un ICP electivo27, y estudios observacionales que indicaban menor riesgo de muerte e IM con una DAP larga28. Estos hallazgos, sumados a observaciones iniciales que alertaban de un aumento del riesgo de trombosis tardía y muy tardía del stent en los pacientes a los que se implantaba un stent liberador de sirolimus o paclitaxel29, particularmente tras interrumpir la DAP30,31, llevaron a la recomendación general de mantener la DAP durante 12 meses tras implantar un SLF.
Los estudios observacionales que han evaluado de manera específica la duración de la DAP en pacientes que recibían SLF han establecido de forma consistente que la interrupción precoz se asocia con trombosis del stent cuando esta se produce en los primeros 6 meses, mientras que prolongarla más de 6 o 12 meses no se asocia con una reducción de la trombosis del stent32. Estos datos indican que el beneficio de prolongar la DAP estaría más relacionado con la prevención de eventos debidos a progresión de la arteriosclerosis que con una reducción en la incidencia de trombosis del stent, lo que indica la importancia de conocer el riesgo de eventos isquémicos y la extensión de la afección coronaria de un determinado paciente33.
Diversos estudios aleatorizados han intentado esclarecer en los últimos años cuál es la duración óptima de la DAP para pacientes tratados con SLF (Tabla 1)34, 35, 36, 37, 38, 39. Estos ensayos han recibido críticas en cuanto a diseño y metodología: a) inclusión de pacientes de bajo riesgo, lo que limitaría la extrapolación de los resultados al total de pacientes que reciben SLF34,35,37, 38, 39; b) pequeño tamaño muestral, lo que ocasiona problemas de potencia estadística si se evalúan diferentes stents36, 37, 38, 39 y condiciona unos márgenes excesivamente grandes para análisis de no inferioridad37, y c) importante cross-over entre grupos de tratamiento, lo que disminuye la validez de los análisis de la población por intención de tratar37,38. A pesar de estas limitaciones, estos estudios han aportado resultados consistentes que permiten elaborar unas consideraciones generales: a) para los pacientes de bajo riesgo isquémico, la prolongación de la DAP más allá de 12 meses aumenta el riesgo de eventos hemorrágicos sin conseguir una reducción evidente de los eventos isquémicos36,39; b) las pautas de tratamiento cortas (de 3 a 6 meses de DAP, especialmente la de 6) son aparentemente seguras para pacientes de bajo riesgo a los que se implanta un dispositivo de nueva generación, fundamentalmente stents liberadores de everolimus o zotarolimus34, 35, 36, 37, que son los que presentan menores tasas de trombosis del stent24; c) las pautas cortas probablemente sean insuficientes para los pacientes que reciben un SLF de primera generación, por el riesgo aumentado de trombosis del stent con estos dispositivos36,37, y d) perfiles de pacientes de más alto riesgo, como los pacientes diabéticos, podrían beneficiarse de una DAP más prolongada tras implantar un SLF37, aunque este aspecto debe estudiarse en más profundidad.
Tabla 1. Estudios aleatorizados finalizados que han evaluado diferentes pautas de duración de la doble terapia antiagregante en pacientes sometidos a ICP con implante de stent liberador de fármaco
| Estudio | Stent | Supuesto | Duración DAP | Objetivo principal | Resultados * |
| RESET 34 (n = 2.117) | ZES | Pacientes con angina o IM sometidos a ICP electiva | 3 meses (ZES) frente a 12 meses (ZES, SES, EES) | Muerte cardiovascular, IM, TS, revascularización de vaso diana o sangrado a 1 año | No inferioridad (p < 0,001) de la estrategia de 3 meses: el 4,7 frente al 4,7% (p = 0,84) |
| OPTIMIZE 35 (n = 3.119) | ZES | Pacientes con cardiopatía isquémica estable o SCA de bajo riesgo | 3 meses frente a 12 meses | Muerte, IM, ictus o sangrado mayor a 1 año | No inferioridad (p = 0,002) de la estrategia de 3 meses: el 6,0 frente al 5,8%; HR = 1,12 (IC95%, 0,87–1,45) |
| PRODIGY 36 (n = 2.013) | SM, ZES, PES, EES | Pacientes con cardiopatía isquémica estable, SCASEST o IAMCEST | 6 meses frente a 24 meses | Muerte, IM o ACV a 2 años | Sin diferencias en eficacia: el 10,0 frente al 10,1%; HR = 0,98 (IC95%, 0,74–1,29); p = 0,91. Aumento de sangrados en la estrategia de 24 meses |
| EXCELLENT 37 (n = 1.443) | EES, SES | Pacientes con cardiopatía isquémica estable o SCASEST de bajo riesgo (sin IM en las últimas 72 h) | 6 meses frente a 12 meses | Muerte cardiaca, IM, revascularización de vaso diana guiada por isquemia a 1 año | No inferioridad (p < 0,001) de la estrategia de 6 meses: el 4,8 frente al 4,3%; HR = 1,14 (IC95%, 0,70–1,8) |
| DES-LATE 38 (n = 5.045) | Cualquier SLF | Pacientes libres de eventos 12 meses tras implante de SLF | 12 meses frente a 36 meses | Muerte cardiovascular, IM o ictus a los 2 años de la aleatorización | Sin diferencias entre grupos: el 2,4 frente al 2,6%; HR = 0,94 (IC95%, 0,66–1,35); p = 0,75 |
| ARCTIC interruption 39 (n = 1.259) * | Cualquier SLF | Pacientes libres de eventos 12 meses tras implante de SLF | 12 meses frente a 30 meses | Muerte, IM, ictus, TS o revascularización urgente a los 18 meses de la aleatorización | Sin diferencias en eficacia: el 4,3 frente al 3,8%; HR = 1,17 (IC95%, 0,68–2,03); p = 0,57. Aumento de sangrados en la estrategia de 30 meses |
ACV: accidente cerebrovascular; DAP: doble antiagregación plaquetaria; EES: stent liberador de everolimus; IAMCEST: infarto agudo de miocardio con elevación persistente del segmento ST; IM: infarto de miocardio; SCASEST: síndrome coronario agudo sin elevación persistente del segmento ST; SES: stent liberador de sirolimus; SLF: stent liberador de fármaco; SM: stent metálico; TS: trombosis del stent; ZES: stent liberador de zotarolimus.
* Resultados preliminares presentados en el Congreso TCT 2013, San Francisco.
Actualmente se sigue necesitando estudios prospectivos aleatorizados con diseño y potencia estadística adecuados para definir con mayor precisión la duración óptima de la DAP en pacientes que reciben un SLF y qué subgrupos de pacientes podrían beneficiarse de pautas de tratamiento cortas o largas (Figura 2), aunque ya hay varios estudios en marcha (Tabla 2). En concreto, serán relevantes los resultados del ensayo DAPT (NCT00977938) por su gran tamaño muestral, ya que aleatorizará a más de 23.000 pacientes con SLF y cerca de 3.000 con stent convencional a recibir DAP durante 12 o 30 meses (estratificando según la complejidad clínica y angiográfica). Otro aspecto que evaluar sería la pauta óptima de DAP con prasugrel y ticagrelor40. De hecho, se ha llegado a plantear si la monoterapia con uno de estos antagonistas de P2Y12 más potentes sería más eficaz que la DAP con AAS y clopidogrel. Este concepto se está evaluando en el ensayo GLOBAL LEADERS (NCT 01813435), que incluirá aproximadamente a 16.000 pacientes (estables o con SCA, incluido el IAMCEST) a los que se implante un stent liberador de biolimus con polímero biodegradable, a los que se aleatorizará a una estrategia de estudio de 1 mes con AAS y ticagrelor, seguido de 23 meses con ticagrelor en monoterapia, comparada con una estrategia de referencia de 12 meses de DAP (AAS más ticagrelor para pacientes con SCA y AAS más clopidogrel para pacientes con angina estable), seguido de 12 meses de monoterapia con AAS.
Figura 2. Pautas de duración de la doble terapia antiagregante evaluadas en ensayos clínicos finalizados y en marcha.
Tabla 2. Estudios aleatorizados en marcha que evalúan diferentes pautas de duración de la doble terapia antiagregante en pacientes sometidos a intervencionismo coronario
| Estudio | Población | n | Duración DAP | Objetivo principal |
| DAPT (NCT00977938) | Pacientes sin eventos durante 12 meses de DAP tras implante de stent (SM o SLF) | 23.210 | 12 frente a 30 meses | Muerte, IM e ictus a los 18 meses de la aleatorización |
| ISAR-SAFE (NCT00661206) | Pacientes sin eventos durante 6 meses de DAP tras implante de SLF | 6.000 | 6 frente a 12 meses | Muerte, IM, ictus, trombosis del stent y sangrado mayor a los 9 meses de la aleatorización |
| OPTIDUAL (NCT00822536) | Pacientes sin eventos durante 12 meses de DAP tras implante de SLF | 1.966 | 12 frente a 48 meses | Muerte, IM, ictus y sangrado mayor a los 36 meses de la aleatorización |
| ITALIC (NCT00780156) | Pacientes a los que se implanta EES | 1.235 | 6 frente a 12 meses | Muerte, IM, ictus y revascularización urgente a los 12 meses de la aleatorización |
| ITALIC PLUS (NCT01476020) | Pacientes a los que se implanta EES | 1.240 | 6 frente a 24 meses | Muerte, IM, ictus, angioplastia por reestenosis y sangrado mayor a los 12 meses de la aleatorización |
| OPERA (NCT01325935) | Pacientes a los que se implanta ZES | 2.400 | 3 frente a 12 meses | Muerte, IM, ictus y sangrado mayor a los 12 meses de la aleatorización |
| SCORE (NCT00781573) | Pacientes libres de eventos durante 12 meses con DAP tras implante de SLF | 280 | 12 frente a 24 meses | Muerte e IM a los 12 meses de la aleatorización |
| GLOBAL LEADERS (NCT01813435) | Pacientes a los que se implanta BES | 16.000 | 12 meses de DAP + 12 meses de AAS frente a 1 mes de DAP (AAS+ticagrelor) + 23 meses de ticagrelor | Muerte e IM a los 24 meses de la aleatorización |
AAS: ácido acetilsalicílico; BES: stent liberador de biolimus; DAP: doble antiagregación plaquetaria; EES: stent liberador de everolimus; IM: infarto de miocardio; SLF: stent liberador de fármaco; SM: stent metálico; ZES: stent liberador de zotarolimus.
Un comentario aparte merece la antiagregación para pacientes tratados con un dispositivo completamente bioabsorbible, cuyo uso se está incrementando rápidamente. Estos dispositivos son prometedores en cuanto a que se produce una reabsorción progresiva del polímero que lo forma en aproximadamente 3 años, con lo que en teoría se evitarían a partir de ese instante las complicaciones tardías que se continúa observando con los SLF metálicos, además de restaurarse las propiedades vasomotoras y la anatomía original del vaso41. Sin embargo, también han surgido críticas que argumentan que, en comparación con los SLF, tienen struts más gruesos que podrían comprometer más fácilmente ramas laterales, empeorar la navegabilidad y aumentar el riesgo de fractura41. En lo que respecta al contenido de este artículo, se ha señalado que podrían tener un potencial trombogénico superior al de los SLF, incluso al año de implantarlos42. Pese a estos hallazgos, actualmente no existe evidencia firme para recomendar una terapia antiagregante más potente o más larga para los pacientes a los que se implantan dispositivos bioabsorbibles, pero sí deben alertarnos para estar atentos al seguimiento clínico y los resultados de futuros estudios con estos dispositivos.
ConclusionesAunque no existe evidencia suficiente para determinar la duración óptima, los estudios disponibles indican que, en ausencia de contraindicaciones o de criterios clínicos para prolongarlo, el tratamiento sistemático con DAP + AAS + un inhibidor del receptor P2Y12 durante 12 meses es una opción razonable para la mayoría de los pacientes con SCA. Para los pacientes con IAMCEST no tratados con ICP, la evidencia disponible solo permite recomendar una pauta de AAS + clopidogrel durante 1 mes.
Para los pacientes sometidos a ICP electiva en los que por un motivo concreto (p. ej., alto riesgo hemorrágico) se considere la opción de pautas de DAP más cortas, se puede tomar en consideración el tipo de stent empleado. Dado que una pauta de DAP más corta (entre 3 y 6 meses, preferiblemente6) se ha demostrado segura para pacientes con cardiopatía isquémica estable a los que se implanta SLF de nueva generación de manera electiva (fundamentalmente stents liberadores de everolimus o zotarolimus), puede ser razonable esta estrategia para pacientes con SCA de bajo riesgo que no presentan una anatomía coronaria compleja tratados con estos dispositivos. Por otro lado, se podría considerar una DAP larga (> 12 meses) para los pacientes con alto riesgo de recurrencia de eventos isquémicos o anatomía coronaria de riesgo (único vaso permeable, tronco común, etc.) que tengan, además, riesgo hemorrágico bajo. Los ensayos clínicos en marcha aportarán más información para individualizar la duración óptima de la DAP para cada paciente.
Conflicto de interesesH. Bueno: becas de investigación de AstraZeneca y pagos por ponencias/asesoría de AstraZeneca, Bayer, BMS, Daiichi-Sankyo, Eli-Lilly, Menarini, Novartis, Pfizer, Sanofi y Servier.
J.L. Ferreiro: honorarios por ponencias de Astra Zeneca, Eli Lilly Co. y Daiichi Sankyo, Inc., y honorarios por consultoría de AstraZeneca, Daiichi Sankyo, Inc., y Ferrer.
Autor para correspondencia: Servicio de Cardiología, Hospital General, Universitario Gregorio Marañón, Madrid, España. hecbueno@jet.es