La prevalencia de la insuficiencia mitral en los países occidentales, en particular la de origen degenerativo, presenta un aumento progresivo a pesar de una importante reducción de las reumopatías. El deterioro ventricular secundario, potencialmente irreversible cuando este se diagnostica clínicamente, precisa de un seguimiento ecocardiográfico cuidadoso para establecer un diagnóstico subclínico. Por ello, la ecocardiografía se ha convertido en una herramienta determinante en el manejo de los pacientes con insuficiencia mitral. Además de evaluar parámetros geométricos ventriculares, en manos expertas, permite la documentación sistemática de la afección hallada en cada uno de los segmentos, lo que, conjuntamente con el tipo de disfunción valvular, debe proporcionar una idea precisa de la complejidad de reparar dicha válvula. Esto es cada vez más relevante a medida que aumenta el número de pacientes asintomáticos referidos a cirugía mitral. En consecuencia, el estudio ecocardiográfico previo a la remisión del paciente es crucial para lograr una reparación mitral efectiva, y debe condicionar a cardiólogos, expertos en imagen cardiaca y cirujanos a la hora de referir al paciente a los especialistas con la habilidad necesaria para afrontar cada una de las lesiones encontradas.
Palabras clave
La prevalencia de la insuficiencia mitral (IM) en los países occidentales presenta un aumento progresivo1 a pesar de una importante reducción de las reumopatías2. La IM crónica orgánica (particularmente la de origen degenerativo) es la enfermedad valvular más común, con una frecuencia de IM moderada o grave del 1,7% de la población general, el 6,4% de los individuos entre 65 y 74 años y el 9,3% de los pacientes de más de 75 años de edad3.
El desarrollo de la cirugía mitral reparadora a manos de Alain Carpentier cambió radicalmente el pronóstico y el manejo clínico de los pacientes con IM4. Desde entonces, las ecocardiografías bidimensional, con Doppler y tridimensional han cobrado mucha más relevancia en cuanto al conocimiento de la anatomía funcional de una estructura dinámica como la válvula mitral (VM). Actualmente, la evaluación ecocardiografía exhaustiva debe ser el punto de partida para establecer un plan de tratamiento para todos los pacientes con IM. Además, esta técnica debe facilitar datos precisos acerca del tipo y la extensión de las lesiones valvulares, el mecanismo de la insuficiencia, la etiología, la gravedad y, por último, punto principal que nos ocupa en este capítulo, la probabilidad de reparación5.
ANATOMÍA QUIRÚGICA DE LA VÁLVULA MITRALLa VM humana es un complejo mecanismo tridimensional formado por elementos independientes que conforman una estructura anatómica dinámica6. Su funcionamiento conlleva una interacción perfectamente coordinada entre las valvas o velos, el anillo mitral, el aparato subvalvular (cuerdas tendinosas y músculos papilares) y el ventrículo izquierdo.
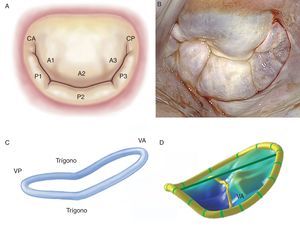
Las valvas y comisurasLa VM tiene dos valvas denominadas anterior y posterior, de superficie y grosor similares (∼1 mm), separadas por sus respectivas comisuras y ancladas en sus bases al tejido fibromuscular del anillo y en sus bordes libres al aparato subvalvular mediante las cuerdas tendinosas. Conseguir una línea de coaptación óptima implica una adaptación perfecta entre las superficies libres de las valvas y el orificio mitral nativo. La valva anterior tiene forma trapezoidal, se extiende verticalmente y se encuentra anclada a un tercio de la circunferencia anular. Es importante enfatizar la continuidad de la valva anterior con el tracto de salida del ventrículo izquierdo gracias a su íntima relación con la cortina aortomitral. La valva posterior descansa transversalmente al orificio mitral y, conjuntamente con las comisuras, está fijada a dos tercios de la circunferencia anular. La valva posterior presenta estrecha relación con la base mural del ventrículo izquierdo, punto de mayor estrés sistólico. Además, las valvas mitrales tienen dos zonas bien diferenciadas desde su base a su borde libre: la zona auricular o membranosa (lisa y traslúcida) y la zona de coaptación (rugosa, nodular y mucho más gruesa debido a la fusión de múltiples cuerdas tendinosas). Desde un punto de vista histopatológico, se pueden diferenciar tres capas: la capa fibrosa (continuación de las cuerdas tendinosas), la capa esponjosa (fibras de colágeno organizadas, proteoglucanos, elastina y otras células conectivas) y la capa fibroelástica que recubre la mayoría de la superficie de las valvas (elastina y colágeno). Además, y como referencia quirúrgica, la VM se puede subdividir en ocho segmentos anatómicos, considerando las comisuras como segmentos individualizados (Figura 1)7. A diferencia de la valva anterior, la valva posterior presenta dos indentaciones en su borde libre que permiten su total apertura en fase diastólica o de llenado ventricular y que a su vez delimitan tres segmentos. De ellos, el segmento medio tiene una forma mucho más redundante y un grosor variable debido al impacto de mayores presiones sistólicas, lo que explicaría la mayor facilidad de este segmento para prolapsarse y sufrir lesiones8, 9.
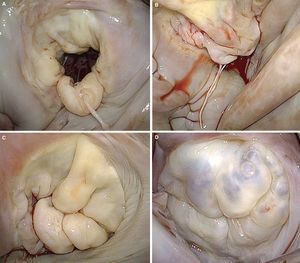
Figura 1. A: esquema de la clasificación de Carpentier (modificado de Carpentier et al 7 con permiso del autor). B: visión quirúrgica de una válvula mitral con signos degenerativos vista desde la aurícula izquierda. C: reconstrucción tridimensional del anillo mitral con forma en silla de montar; la porción más elevada corresponde a la porción anterior y la más baja, a los trígonos. D: reconstrucción tridimensional de las valvas mitrales junto con el anillo mitral, en el que se aprecia el prolapso del velo anterior. CA: comisura anterior; CP: comisura posterior; VA: velo anterior; VP: velo posterior.
Las comisuras son segmentos triangulares independientes que establecen continuidad entre ambas valvas. Para poder identificarlas, tomaremos como referencia el eje vertical de los músculos papilares y sus correspondientes cuerdas tendinosas, con lo que se obtiene una comisura anterior y una comisura posterior.
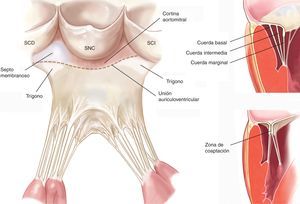
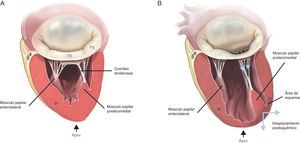
El anillo mitralLa unión anatómica entre la aurícula izquierda y el ventrículo izquierdo constituye la creación de una bisagra de tejido fibroso donde se inicia el movimiento de las valvas mitrales. Dicha estructura, denominada anillo mitral, es una parte integral del esqueleto fibroso del corazón humano. La zona del anillo donde se inserta la valva posterior está situada a 2 mm de la bisagra de tejido fibroso y está formada por una banda muy fina de tejido conectivo. Dado que este segmento del anillo no se encuentra vinculado a ninguna estructura de naturaleza rígida, es aquí donde se producen fenómenos de dilatación anular y calcificación en un mayor número de pacientes10. En cambio, la zona de inserción de la valva anterior es prácticamente la continuación de la cortina aortomitral reforzada en su base por dos estructuras rígidas, como son ambos trígonos fibrosos: el trígono fibroso derecho (unión del septo membranoso, el anillo mitral, el anillo tricuspídeo y la cúspide no coronaria del anillo aórtico) y el trígono fibroso izquierdo, contiguo a la cúspide coronaria izquierda del anillo aórtico y el borde izquierdo del anillo mitral. El anillo mitral normal es aproximadamente elíptico (en forma de D), con mayor excentricidad (menos circular) en fase sistólica que en diastólica11. Además, presenta una configuración tridimensional en silla de montar con dos puntos más bajos (trígonos) y un punto álgido representado por el punto medio de la valva anterior (Figura 1). El punto medio de la valva anterior es siempre superior al punto medio de la valva posterior. El área del anillo varía entre 5 y 11 cm2 (promedio, 7 cm2) y se modifica durante el ciclo cardiaco. Su tamaño se incrementa al final de la fase sistólica, continúa durante la relajación isovolumétrica y es máximo al final de la fase diastólica12. La disminución del tamaño anular empieza con la contracción auricular hasta ser máxima a mitad del ciclo sistólico, lo que propicia la óptima coaptación de ambos velos. Es importante matizar que los cambios de superficie anular se producen prácticamente a merced del anillo posterior, ya que la parte anterior del anillo es virtualmente inmóvil. Por último, el anillo mitral también presenta un movimiento oscilante o vertical, y se desplaza hacia la aurícula izquierda durante la diástole y hacia el ápex ventricular durante la sístole. Se calcula que la contracción anular normal es del 25%13.
Las cuerdas tendinosasLas cuerdas tendinosas son estructuras filamentosas de tejido conectivo fibroso que unen la superficie ventricular y el borde libre de las valvas con los músculos papilares y, por defecto, con la pared posterior del ventrículo izquierdo. Aproximadamente 25 cuerdas primarias se originan en los músculos papilares y se subdividen progresivamente para insertarse en las valvas. Se clasifican según su lugar de inserción entre el borde libre y la base de las valvas. Las cuerdas marginales se insertan en el borde libre de las valvas y su función es evitar el prolapso de estas. Las cuerdas intermedias o secundarias se insertan en la cara ventricular de las valvas y su función principal es aliviar el exceso de tensión en el tejido valvular. Las cuerdas basales o terciarias se encuentran únicamente en la valva posterior y conectan su base, así como el anillo mitral posterior, a los músculos papilares (Figura 2).
Figura 2. Esquema del aparato subvalvular mitral (panel izquierdo modificado de Carpentier et al 7 con permiso del autor). SCD: seno coronario derecho. SCI: seno coronario izquierdo. SNC: seno no coronario.
Los músculos papilaresExisten dos grupos organizados de músculos papilares denominados según su posición respecto a las comisuras mitrales. El músculo papilar anterolateral tiene un único cuerpo, es de mayor tamaño y está irrigado por la primera obtusa marginal, rama de la circunfleja, y por la primera diagonal, rama de la descendente anterior. El músculo papilar posteromedial tiene dos cuerpos, es de menor tamaño y está irrigado únicamente por la descendente posterior, rama de la coronaria derecha en el 90% de los casos y por la circunfleja en el 10% restante14. Por ello, el músculo posteromedial siempre es mucho más vulnerable a episodios isquémicos.
El ventrículo izquierdoLa continuidad de los músculos papilares con el ventrículo izquierdo otorga a este un papel determinante en el control del movimiento de los velos mitrales, particularmente en caso de enfermedad isquémica. La contractilidad de los miocitos compensaría, de acuerdo con la ley de Starling, el exceso de volumen en presencia de IM, especialmente en sus fases incipientes15. Pero dado que el ventrículo izquierdo sostiene de manera activa todo el aparato mitral, cualquier grado de dilatación patológica, sea o no de origen isquémico, conlleva IM funcional16.
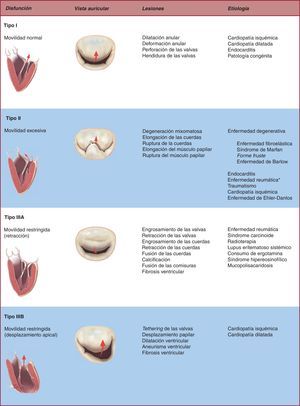
LA TRÍADA FISIOPATOLÓGICALa IM está caracterizada por la existencia de un flujo sanguíneo en sístole desde el ventrículo izquierdo a la aurícula izquierda17. Cualquier mínima lesión puede causar IM mediante la reducción o eliminación de la coaptación de los velos mitrales en fase sistólica. Por ello, el estudio (localización y magnitud) y posteriormente la descripción exacta de las lesiones mitrales son esenciales para evaluar la reparabilidad de la válvula y proceder con el plan terapéutico apropiado e individualizado para cada paciente18. Carpentier estableció la «tríada fisiopatológica» de la IM para abordar este particular grupo de pacientes de manera ordenada y sistemática19. Así, la tríada resalta la importancia de diferenciar entre la enfermedad por la cual se llega a la IM (etiología), las lesiones resultantes y, por último, cómo estas lesiones afectan a la movilidad de los velos, es decir, el tipo de disfunción que causan. Con el transcurso del tiempo, los especialistas cardiovasculares han ido adoptando esta tríada o clasificación, y hoy, aunque su uso todavía no está generalizado, propicia un perfecto entendimiento entre cirujanos y especialistas en imagen cardiaca.
Disfunción valvularEs de vital importancia identificar la etiología y las lesiones que resultan en la aparición de IM clínica, ya que las opciones terapéuticas y los resultados a largo plazo pueden variar sustancialmente en función del contexto clínico. Pero también es crucial describir la disfunción valvular secundaria a dichas lesiones o mecanismo de IM, particularmente cuando tratamos de establecer la probabilidad de reparación. La clasificación de las diferentes disfunciones mitrales se basa en la posición de los márgenes de los velos respecto al plano del anillo mitral: a) disfunción de tipo I: movilidad normal de las valvas con dilatación anular severa (flujo regurgitante central) o perforación de una de las valvas; b) disfunción de tipo II: movilidad excesiva de las valvas, generalmente secundaria a la elongación patológica de las cuerdas tendinosas o rotura de estas (en cuyo caso el flujo regurgitante se dirige al lado opuesto de la valva afectada), y c) disfunción de tipo III: movilidad restringida debido a la retracción del aparato subvalvular (IIIa) (frecuente en la enfermedad reumática o procesos inflamatorios) o desplazamiento del músculo papilar (remodelado isquémico o miocardiopatía dilatada) que causa el desplazamiento apical (tethering) de la valva (IIIb). El flujo regurgitante está dirigido al mismo lado de la valva afectada.
Etiologías y lesionesAunque las enfermedades reumáticas son todavía la causa más frecuente de IM en el mundo, han dejado de ser una causa común de IM en los países desarrollados. La enfermedad isquémica, que actualmente ocupa el 20% de casos de IM, en un futuro próximo podría perder protagonismo gracias al tratamiento cada vez más agresivo de las enfermedades coronarias. Sin embargo, la enfermedad degenerativa es a día de hoy la causa más frecuente de IM20.
La enfermedad degenerativa de la VM presenta un espectro de lesiones21 que van desde una simple rotura de cuerdas tendinosas con prolapso de un solo segmento en una válvula por lo demás totalmente normal al prolapso de múltiples segmentos en ambas valvas, acompañado de exceso de tejido y una marcada dilatación anular22, 23. Además, el espectro de lesiones encontradas en la enfermedad degenerativa da lugar a la diferenciación de dos entidades clínicas opuestas, la enfermedad fibroelástica (EFE) y la enfermedad de Barlow (EB). Todas las etiologías y lesiones implicadas en el desarrollo de la IM se encuentran representadas en la Figura 3.
Figura 3. Tríada fisiopatológica de la insuficiencia mitral. *El hallazgo de prolapso de las valvas en el contexto de enfermedad reumática únicamente se produce si coexiste una disfunción de tipo III o se identifica un seudoprolapso.
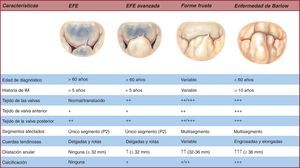
La EFE ocurre generalmente en pacientes mayores de 60 años de edad, con una historia relativamente corta de enfermedad valvular y con una IM holosistólica y grave24. El término «fibroelástica» describe una condición patológica asociada a un déficit de la proteína fibrilina25 que a menudo conduce a un progresivo debilitamiento26, elongación y rotura de las cuerdas tendinosas27, que usualmente involucra al segmento medio de la valva posterior28. La rotura de cuerdas es la lesión más frecuente de la EFE29. Los velos son delgados y traslúcidos, aunque en algunas ocasiones el segmento que prolapsa puede presentar características mixomatosas y distensión si la enfermedad ha estado presente largo tiempo30. El concepto clave para poder distinguir la EFE dentro del espectro reside en el análisis exhaustivo de los segmentos contiguos al prolapsado31. En dicha condición, los segmentos contiguos suelen ser totalmente normales, sin cambios en altura, tamaño o propiedades tisulares32. Finalmente, el tamaño del anillo33, definido por la superficie de la valva anterior, generalmente es < 32 mm (Figura 4).
Figura 4. Espectro de la enfermedad mitral degenerativa. EFE: enfermedad fibroelástica; IM: insuficiencia mitral.
En el extremo opuesto del espectro de la enfermedad degenerativa, tenemos la EB34. La EB se presenta eminentemente en pacientes jóvenes, generalmente menores de 60 años de edad cuando son remitidos a cirugía, y además presentan una larga historia de seguimiento cardiológico35, 36 debido a la aparición de un soplo cardiaco37. En este escenario, las valvas presentan una afección mucho más difusa y compleja, donde frecuentemente se halla prolapso y degeneración mixomatosa38, 39 de múltiples segmentos en una o ambas valvas (Figura 4, Figura 5). Las lesiones más comunes son el exceso de tejido y, por consiguiente, engrosamiento y distensión de los velos, así como elongación, engrosamiento y/o rotura de múltiples cuerdas tendinosas40. El tamaño anular en este tipo de pacientes41 es ≥ 36 mm. Por último, no es infrecuente encontrar varios grados de calcificación tanto anular como del aparato subvalvular, en particular en la cara posterior del anillo y en el músculo papilar anteromedial42.
Figura 5. Imágenes quirúrgicas de las lesiones más frecuentes de la enfermedad mitral degenerativa. A: prolapso posterior debido a la rotura de cuerdas tendinosas. B: prolapso anterior por elongación, adelgazamiento y rotura de las cuerdas tendinosas. C: prolapso anterior y posterior secundario a la elongación de cuerdas tendinosas y la degeneración mixomatosa de varios segmentos; véase las indentaciones patológicas de la valva posterior. D: enfermedad de Barlow con degeneración mixomatosa de ambas valvas.
La IM isquémica puede presentarse de manera aguda con rotura del músculo papilar43 (IM isquémica orgánica) o como consecuencia del remodelado del ventrículo izquierdo y el desplazamiento apical e inferior de los músculos papilares44 (IM isquémica funcional), los cuales tiran de las valvas mitrales y causan el tethering de estas y del punto de coaptación de los velos45 (Figura 6). La identificación ecocardiográfica de este tipo de lesiones es de suma importancia, ya que la supervivencia a largo plazo tras sufrir IM isquémica, incluso con lesiones isquémicas leves, se ve notablemente reducida46. Cuando la restricción en el movimiento de los velos se produce esencialmente en fase sistólica47, da lugar a un patrón restrictivo asimétrico, principalmente observado en pacientes con infartos posteriores y restricción de la valva posterior48. Por el contrario, en pacientes con cardiomiopatía dilatada o infartos anteriores y posteriores, ambas valvas presentan un déficit restrictivo que da lugar a un patrón simétrico49 (Figura 7).
Figura 6. Mecanismo de la insuficiencia mitral isquémica. A: válvula mitral normal. B: válvula mitral isquémica con restricción posterior pronunciada en P3 después de un episodio de isquemia ventricular. VI: ventrículo izquierdo.
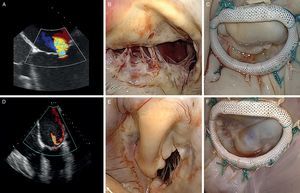
Figura 7. Evaluación ecocardiográfica e imágenes quirúrgicas de la insuficiencia mitral isquémica (A-C: patrón simétrico; D-F: patrón asimétrico). A: flujo regurgitante central. B: restricción simétrica. C: nótese la línea de coaptación simétrica tras la reparación. D: flujo regurgitante posterior. E: restricción asimétrica. F: véase la angulación de la línea de coaptación tras la reparación anular.
VALORACIÓN ECOCARDIOGRÁFICAEn manos expertas, el examen sistemático de la VM mediante ecocardiografía transtorácica (ETT) debería predecir de manera fiable su reparabilidad50. Sin embargo, cada vez son más los centros que optan por una ecocardiografía transesofágica (ETE), particularmente en casos complejos, antes de derivar a sus pacientes a una evaluación quirúrgica51. La representación ecocardiográfica de la VM debe aportar información generalizada52 (enfermedad anterior, posterior o bilateral) y segmentaria de las valvas (análisis individual de cada uno de los segmentos), identificar el exceso o la escasez de tejido en los velos (diferenciación etiológica)53, evaluar las dimensiones anulares, detallar el estado del aparato subvalvular y estimar la resistencia ventricular54. Para ello, el examen sistemático debe incluir cuatro proyecciones transesofágicas (cuatro cámaras, comisuras, dos cámaras y eje largo), así como una proyección gástrica (eje corto) (Figura 8).
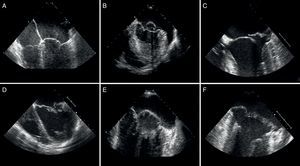
Figura 8. Diferenciación ecocardiográfica entre la enfermedad fibroelástica (A-C) y la enfermedad de Barlow (D-F). A-C: se puede observar la presencia de valvas finas no mixomatosas, un único segmento afectado y el prolapso generalmente debido a la rotura de cuerdas tendinosas. C-E: valvas engrosadas con marcada degeneración mixomatosa, prolapso de varios segmentos o ambas valvas afectadas y el desplazamiento auricular de la bisagra de tejido fibroso de la valva posterior.
Vista de cuatro cámarasSi utilizamos ETT, la clásica vista apical de cuatro cámaras nos permite analizar la valva anterior, especialmente A2 y A3, así como el segmento lateral de la valva posterior P1. En cambio, la ETE permite observar prácticamente todos los segmentos en función del grado de rotación del transductor. Con este a 0°, muestra los segmentos medios de ambas valvas (A2 y P2). Si la sonda rota unos 20°, corta la línea de coaptación oblicuamente y se obtiene información detallada de los segmentos más laterales, como A2, A1 y P1.
Vista de ambas comisurasEsta vista se puede obtener con un plano apical de dos cámaras en ETT o rotando la sonda transesofágica unos 60°, donde el plano de la imagen corta perpendicularmente el plano que delimita ambas comisuras, atravesando así ambas valvas para facilitar el análisis de P3 (a la izquierda de la imagen), A2 (en el centro de la imagen) y P1 (a la derecha de la imagen). En este plano, normalmente se puede apreciar los músculos papilares. Además, esta vista nos ayuda de manera importante a averiguar cuál es el segmento patológico, ya que, si el flujo regurgitante se inicia en el punto izquierdo de la línea de coaptación, podremos intuir que es secundario a lesiones en P3 o A3, mientras que, si el flujo regurgitante nace en un punto derecho de la línea de coaptación, los segmentos involucrados serán P1 o A1. La altura de P1 y P3 se puede calcular desde este plano, detalle importantísimo a la hora de predecir la complejidad de la reparación. Si la altura de estos segmentos es superior a 1,5 cm, se puede asumir una tendencia a que haya movimiento sistólico anterior tras la reparación; por ello, en dichas circunstancias, la complejidad de la reparación es mayor, ya que requiere la resección de parte de las valvas55.
Vista bicameralSi continuamos rotando el transductor hasta los 90°, obtenemos una vista bicameral. En este plano, P3 se aprecia a la izquierda de la imagen y todos los segmentos de la valva anterior se sitúan a la derecha de la imagen. Esta vista es crucial en el análisis de la valva anterior y la evaluación completa de la parte posteromedial de la línea de coaptación (A3 y P3), así como su correspondiente comisura.
Eje largo de vista paraesternal o vista sagitalEl eje largo del plano paraesternal si utilizamos ETT o la vista sagital con ETE si rotamos la sonda hasta los 120° cortan perpendicularmente la línea de coaptación, atravesando P2 (a la izquierda de la imagen) y A2 (a la derecha de la imagen). Esta vista es especialmente relevante, ya que el prolapso de P2 es el más frecuente, particularmente en pacientes con enfermedad degenerativa. Además, esta vista nos permite evaluar la superficie anular extrapolando el diámetro anular con la superficie de la valva anterior. Se considera que hay dilatación anular patológica cuando el cociente entre el anillo y la valva anterior es > 1,3 o el diámetro anular es > 35 mm. Además, el cirujano debe saber si hay calcificaciones importantes en el anillo o el aparato subvalvular, ya que la estrategia quirúrgica puede cambiar radicalmente ante segmentos calcificados o con una rigidez tisular extrema.
Eje corto de vista paraesternal o transgástricaEsta vista, aunque requiere manos experimentadas, se puede obtener mediante ETT (clásica vista paraesternal) o ETE (vista transgástrica a 0°). En fase diastólica, permitiría evaluar todos los segmentos y ambas comisuras. En fase sistólica, podemos intuir la localización del segmento patológico gracias al análisis de dirección del flujo regurgitante. Además, podemos obtener información acerca del aparato subvalvular y la distancia entre la cabeza del músculo papilar y el anillo mitral.
ECOCARDIOGRAFÍA TRIDIMENSIONALLos últimos avances tecnológicos en ecocardiografía tridimensional han permitido obtener imágenes en tiempo real de la VM y una caracterización mucho más detallada, lo que contribuye significativamente al conocimiento de su anatomía y su funcionamiento56. Esto es particularmente cierto en la evaluación geométrica del anillo mitral57. Se ha demostrado que el anillo mitral tiene forma de silla de montar58. Los puntos más elevados, es decir, más alejados del ápex cardiaco, corresponden a la región anterior más próxima a la raíz aórtica y la región posterior próxima a la pared posterior del ventrículo izquierdo59. De manera opuesta, los puntos más bajos corresponden a las comisuras mitrales. En pacientes sanos, la forma en silla de montar es más marcada en mesosístole, cuando el anillo adquiere la menor área. Al final de ambas fases, el anillo presenta una forma mucho más aplanada y extensa60. Todas estas variables cobran mayor interés clínico cuando analizamos la anatomía de pacientes con IM funcional. En este contexto, se puede observar una dilatación marcada del diámetro intercomisural y el diámetro anteroposterior, por lo que el anillo adopta forma circular y aplanada61. Si el infarto es de localización anterior, el aplanamiento del anillo es mayor que en infartos inferiores.
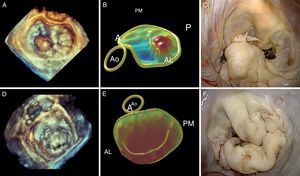
El análisis de las valvas mitrales (conjuntamente con el anillo) mediante ecocardiografía tridimensional aporta los datos más importantes para el cirujano. Actualmente, podemos trazar la disposición exacta de las valvas mitrales y medir su área con la aplicación de programas informáticos especiales. Debido a la forma en silla de montar del anillo, la ecocardiografía bidimensional puede sobrestimar la existencia de prolapso debido a una falsa apariencia de desplazamiento de las valvas hacia la aurícula izquierda. Durante la reconstrucción tridimensional, el segmento que prolapsa adquiere una forma convexa visto desde la aurícula, pero cóncava visto desde el ventrículo, y además presenta una correlación exacta con el examen anatómico que realiza el cirujano durante la cirugía (orientación superior de la valva anterior e inferior de la valva posterior), con una localización del prolapso superior al 96%62. La ecocardiografía tridimensional también es capaz de localizar todos los puntos quirúrgicos de interés: a) área del anillo y posiblemente talla del anillo que será implantado; b) superficie de las valvas; c) segmento prolapsado y volumen de prolapso; d) volumen del tenting (volumen entre el anillo y las valvas mitrales); e) distancia de tethering (distancia desde cualquier punto del anillo mitral a los músculos papilares), y f) distancia interpapilar63 (Figura 9).
Figura 9. Correlación de la ecocardiografía preoperatoria convencional y tridimensional con las imágenes quirúrgicas intraoperatorias. A: anterior; AL: anterolateral; Ao: aorta; P: posterior; PM: posteromedial.
CIRUGÍA MITRALEl estudio ecocardiográfico previo a la remisión del paciente es determinante para lograr una reparación mitral efectiva, y debe condicionar a pacientes, cardiólogos y cirujanos a la hora de elaborar la hoja de ruta óptima para cada paciente con IM64, 65. En este contexto, es cada vez más importante evaluar exhaustivamente la enfermedad mitral para poder referir al paciente al cirujano con la habilidad que requiere la reparación de cada una de las lesiones observadas66. La documentación sistemática de la afección hallada en cada segmento, conjuntamente con el tipo de disfunción valvular, debe proporcionar una idea precisa de la complejidad de reparar dicha válvula67.
Son varios los parámetros ecocardiográficos identificados en la literatura como posibles predictores de fracaso de la reparación de la VM68 (Tabla 1). Entre ellos se encuentran la presencia de flujo regurgitante central grave, la gran dilatación anular (≥ 50 mm), tres o más segmentos afectados, lesiones de la valva anterior o la intensa calcificación, entre otros69. Además, la escasez de tejido en las valvas también es un importante factor de riesgo tanto en el contexto de reumopatía como en pacientes con endocarditis infecciosa o enfermedad degenerativa con EFE avanzada70. Si se trata de enfermedad isquémica, el hallazgo en ETE de un diámetro anular diastólico ≥ 37 mm, área del tenting ≥ 1,6 cm2 y una IM grave puede conllevar el fracaso de la reparación mitral en un 50% de los pacientes durante el seguimiento clínico71. En cambio, cuando el estudio ecocardiográfico se realiza con un transductor transtorácico72, una distancia de coaptación > 1 cm, área sistólica de tenting > 2,5 cm2, angulación de la valva posterior > 45° (restricción de la valva posterior), flujo regurgitante central (indicio de gran restricción de ambas valvas), un flujo regurgitante con origen central o posteromedial y una importante hipertrofia ventricular (remodelación ventricular tras reparación) incrementan el riesgo de fracaso de la reparación73.
Tabla 1. Predictores ecocardiográficos de reparación mitral fallida
| IM orgánica | IM funcional |
| Jet central severo | Distancia de coaptación≥1 cm |
| Dilatación anular ≥ 50 mm | Área de tenting>2,5cm2 |
| Lesiones en tres o más segmentos | Ángulo posterolateral>45° |
| Lesiones de la valva anterior | Distancia interpapilar>20 mm |
| Calcificación severa | Acinesia ventricular |
| Escasez de tejido en las valvas | DTD>65mm o DTS>51 mm |
| Disfunción opuesta | Índice de esfericidad>0,7 |
DTD: diámetro telediastólico; DTS: diámetro telesistólico; IM: insuficiencia mitral.
La decisión de operar a un paciente con IM es el resultado de un proceso complejo que conlleva la evaluación de muchas variables74, 75, entre las que se encuentran la gravedad de la IM, el impacto de esta en la remodelación auricular y ventricular, la función ventricular, las presiones pulmonares, la probabilidad de reparación, las comorbilidades, el riesgo operatorio y el estado sintomático del paciente76, 77. Si analizamos cada uno de los parámetros individualmente, no sería desmesurado afirmar que cualquier variante en el tratamiento actual de la IM grave está totalmente supeditada al resultado del estudio ecocardiográfico. De hecho, cada vez se da menos importancia a los síntomas de los pacientes y más a los datos geométricos ventriculares78. En este sentido, existen corrientes de pensamiento en cuanto al momento exacto de la cirugía79. La primera, más clásica, y de amplio consenso, recomienda el seguimiento cuidadoso (evaluación ecocardiográfica cada 6 o 12 meses) del paciente hasta la aparición de síntomas o indicadores claros de disfunción ventricular como una fracción de eyección del ventrículo izquierdo < 60% o un diámetro telesistólico > 40 mm (> 45 mm en las guías europeas)80, 81, 82. Además, cuando la función ventricular es normal, se recomienda la cirugía si hay hipertensión pulmonar (> 50 mmHg) o fibrilación auricular83. Por el contrario, la segunda corriente84, mucho más actual, que recomienda la intervención quirúrgica en pacientes asintomáticos con una función sistólica conservada, genera mucha más polémica85. Así, se recomendaría la cirugía en pacientes asintomáticos siempre y cuando tengamos la certeza ecocardiográfica de la gravedad de la IM86, se pueda ofrecer una probabilidad de reparación > 95% y la mortalidad operatoria sea < 1%87. Todos estos requisitos presuponen la colaboración estrecha de un cardiólogo experto en cuantificación ecocardiográfica, un cirujano que realice alrededor de 50 reparaciones mitrales anuales88 y una unidad de cuidados intensivos experimentada89 (Tabla 2). Aunque la diversidad de opiniones y manejo es importante, creemos que el tratamiento individualizado de cada paciente no debe excluir ninguna de las vertientes si se las aplica con criterio (Figura 10). Además, este tratamiento individualizado debe suponer la elección de la técnica quirúrgica adecuada90, 91, 92, 93 para cada una de las lesiones encontradas.
Tabla 2. Patrón ecocardiográfico de derivación quirúrgica para optimizar la probabilidad de reparación mitral (estratificación aproximada por número de casos anuales realizados por un mismo cirujano)
| Etiología | Disfunción | Calcificación | Lesiones | Probabilidad de reparación | |
| < 50 casos/año | ≥ 50 casos/año | ||||
| Fibroelástica | II | No/anular | Prolapso posterior localizado (P2) | Factible | Factible |
| II | No/anular | Prolapso anterior | Probable | Factible | |
| Barlow | II | No/anular | Prolapso posterior localizado (P2) | Factible | Factible |
| II | No/anular | Prolapso tres o más segmentos | Probable | Factible | |
| II | Valvas | Prolapso tres o más segmentos | Improbable | Probable | |
| II | No/anular | Prolapso anterior | Improbable | Probable | |
| Endocarditis | I | No | Perforación | Probable | Factible |
| II | No | Prolapso | Probable | Factible | |
| II | No | Lesiones destructivas | Improbable | Probable | |
| Reumática | IIIA | Anular | Valva anterior maleable | Probable | Factible |
| IIIA | Valvas | Valva anterior calcificada (rígida) | Improbable | Improbable | |
| Isquémica (funcional) | I | No | Dilatación o deformación anular | Factible | Factible |
| IIIB | No | Tethering | Factible | Factible | |
| IIIB | No | Predictores de corrección fallida | Improbable | Probable | |
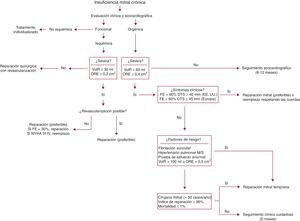
Figura 10. Algoritmo propuesto para el tratamiento de la insuficiencia mitral. DTS: diámetro telesistólico; EE.UU.: Estados Unidos; FE: fracción de eyección; M: moderada; NYHA: New York Heart Association; ORE: orificio regurgitante efectivo; S: severa; VolR: volumen regurgitante.
Cuando se trata de pacientes con IM isquémica, el riesgo de rotura de un músculo papilar o incluso ventricular es elevado y la cirugía debe ser inmediata. Sin embargo, el riesgo quirúrgico es mayor, y aunque se produzca mejoría sintomática tras la anuloplastia restrictiva94, no se ha comprobado el beneficio a largo plazo en la supervivencia. Además, la implantación de un anillo restrictivo (dos tallas por debajo del medidor) puede causar estenosis mitral postoperatoria y no corrige el problema de base, que es el desplazamiento de los músculos papilares95. Por ello se están llevando a cabo estudios quirúrgicos sobre la extensión de la valva posterior en P3 con tejido pericárdico, para aliviar la tensión de las valvas sin hacer anuloplastia restrictiva. Las corrientes actuales dictan que, cuando la IM isquémica es leve o moderada (orificio regurgitante efectivo [ORE] < 0,2 cm2), se debe considerar la corrección quirúrgica mediante anuloplastia, mientras que si el ORE > 0,2 cm2 (IM isquémica grave), el reemplazo valvular y la revascularización miocárdica pueden ser alternativas igual de factibles que la reparación mitral.
CONCLUSIONESSin duda alguna, los estudios de imagen son cada vez más importantes en el manejo de pacientes con IM, particularmente ante la tendencia a operar precozmente a los pacientes con IM grave asintomática. Es posible el seguimiento preciso de los cambios en geometría y volumen ventricular, lo cual permite establecer la indicación quirúrgica de pacientes con tendencia a la disfunción ventricular antes de un declive de la fracción de eyección. La ecocardiografía tridimensional proporciona una «vista quirúrgica» perfecta de la VM, lo que facilita identificar preoperatoriamente lesiones complejas que requieran remitir al paciente a centros especializados. El entrenamiento incesante de las futuras generaciones de especialistas se adivina crucial a la hora de evitar reemplazos innecesarios. La evaluación multidisciplinaria del paciente con IM debe convertirse en una práctica habitual para elegir la estrategia terapéutica adecuada.
FINANCIACIÓNProyecto financiado por The Mount Sinai Medical Center, Nueva York, Estados Unidos.
CONFLICTO DE INTERESESNinguno.
Autor para correspondencia: The Mount Sinai Medical Center, 1190 Fifth Avenue GP2W, Nueva York, NY 10029, Estados Unidos. javier.castillo@mountsinai.org