Los programas de atención a pacientes de insuficiencia cardiaca reducen ingresos hospitalarios. Algunos estudios reducen mortalidad. Se desconocen los determinantes del éxito. El objetivo es actualizar el conocimiento sobre la reducción de mortalidad y reingresos de estos programas, describir sus componentes e identificar factores condicionantes de resultados.
MétodosRevisión sistemática de la bibliografía (1990-2014) (PubMed, EMBASE, CINAHL, Cochrane Library) y búsqueda manual en revistas relevantes. Tres revisores independientes seleccionaron los estudios. La calidad metodológica fue evaluada a ciegas por una investigadora externa (escala Jadad). Los resultados se combinaron mediante modelos de efectos aleatorios. La heterogeneidad se evaluó con el estadístico I2, y se determinaron sus factores explicativos mediante análisis de metarregresión.
ResultadosSe identificaron 3.914 estudios. Se seleccionaron 66 ensayos clínicos controlados y aleatorizados (18 países, 13.535 pacientes), y se observaron riesgos relativos de muerte de 0,88 (intervalo de confianza del 95% [IC95%], 0,81-0,96; p < 0,002; I2, 6,1%), reingresos por todas las causas de 0,92 (IC95%, 0,86-0,98; p < 0,011; I2, 58,7%) y reingresos por insuficiencia cardiaca de 0,80 (IC95% 0,71-0,90; p < 0,0001; I2, 52,7%). Factores asociados al éxito: programas posteriores a 2001, no realizados en Estados Unidos, mayor uso basal de inhibidores de la enzima de conversión de la angiotensina/antagonistas del receptor de la angiotensina II, mayor número de profesionales y componentes de la intervención, especialización del cardiólogo y la enfermera, educación protocolizada y evaluada, automonitorización de signos y síntomas, reconocimiento de descompensación, pauta flexible de diuréticos, aviso y atención precoz, intervención psicosocial, coordinación de profesionales y duración del programa.
ConclusionesSe confirma la reducción de mortalidad y reingresos con los programas de insuficiencia cardiaca, cuyo éxito se asoció con diferentes variables de estructura e intervención.
Palabras clave
La prevalencia de la insuficiencia cardiaca (IC) está en ascenso y es > 10% de los mayores de 70 años1–3.
Es la primera causa de ingreso hospitalario de mayores de 65 años1. Produce un gran impacto en el sistema sanitario y supone aproximadamente el 2,5% del gasto sanitario total1, generado mayoritariamente por los ingresos. Sin embargo, el coste atribuible a los cuidados informales, habitualmente prestados por mujeres en España, es la partida más importante del coste total de los cuidados (59,1-69,8%)4. Afecta de modo considerable a la calidad de vida de pacientes y cuidadores4,5.
Los pacientes de IC son complejos y de edad avanzada. Presentan mucha comorbilidad y reingresos, lo que condiciona el tratamiento clínico y el pronóstico1,2.
Gran parte de los ingresos hospitalarios se consideran evitables1,2. Existen numerosos metanálisis6–23 y una metarrevisión24 que muestran que los programas específicos de atención a pacientes de IC reducen significativamente las readmisiones, por lo que están recomendados en las guías europeas de práctica clínica (I-A)2.
No obstante, estos metanálisis revisan un número limitado de estudios, que además son heterogéneos en cuanto a la población estudiada, sus características y cuidados habituales, la zona geográfica y los sistemas de salud. A menudo no describen con precisión intervenciones sumamente complejas. Por este motivo, es difícil valorar las características y el contexto clínico en que se muestran efectivas para poder guiar la organización de los diferentes sistemas de salud a la hora de establecer prioridades. Algunos metanálisis han estudiado determinadas características esenciales para el éxito14,16 con un número de estudios limitado. La necesidad de profundizar en todos estos elementos ha sido señalada en numerosos metanálisis11,14–16,19–24 y artículos recientes25–27.
Los objetivos de esta revisión sistemática son: a) actualizar el conocimiento sobre la efectividad de los programas de atención a pacientes de IC, que no utilicen sistemas de telemonitorización a distancia, describiendo con precisión el tipo de pacientes, la organización y el contenido de la intervención y sus resultados en reducción de mortalidad y reingresos, y b) identificar los factores determinantes de su éxito.
MÉTODOSDiseñoLa información detallada del diseño se puede encontrar en el ).
Se realizó una revisión sistemática y metanálisis de ensayos controlados aleatorizados (ECA) de programas de atención a pacientes de IC con intervenciones multifactoriales, que evalúan ingresos hospitalarios y/o mortalidad y no utilizan métodos de telemonitorización a distancia aparte del teléfono.
Se utilizó metodología basada en CONSORT (Consolidated Standards of Reporting Trials)1 y la AHA (American Heart Association) Taxonomy2 para evaluar las características sociodemográficas y clínicas de la población sobre la que intervienen, los aspectos organizativos relativos a equipo de profesionales, intensidad, método de provisión de cuidados y tipo de seguimiento, y los contenidos precisos de las intervenciones y los cuidados habituales.
Este metanálisis siguió las recomendaciones de la declaración PRISMA (Preferred Reporting Items for Systematic reviews and Meta-Analysis)3.
Se realizó una búsqueda en bases de datos electrónicas entre enero de 1990 y diciembre de 2014 en PubMed, EMBASE, CINAHL y Cochrane Library. Asimismo, se revisaron manualmente las principales revistas relacionadas con el tema objeto de interés y la bibliografía de las revisiones sistemáticas y metanálisis recuperados. Las bases de datos consultadas y la estrategia de búsqueda utilizada se detallan en el .
Se incluyeron ECA publicados en inglés, español, francés o alemán que ofreciesen resultados de mortalidad y/o readmisiones por cualquier causa o por IC.
Se excluyeron los estudios de telemedicina/teleasistencia, ya que han sido objeto de estudios específicos, añadirían heterogeneidad y, dados la alta prevalencia y el alto grado de comorbilidad clínica y psicosocial de los pacientes de IC, no parece posible ofrecer este tipo de asistencia con carácter general. Sin embargo, se incluyen los estudios con intervención solo telefónica, accesible habitualmente a casi todo tipo de pacientes.
También se excluyeron los estudios de medicamentos (excepto para dosificación y optimización de terapia), los que evaluaban múltiples enfermedades o no eran multifactoriales (p. ej., que se centraran solo en ejercicio o en una técnica). No obstante, se incluyeron los tres estudios de carácter multifactorial cuya intervención comprendía rehabilitación cardiaca de pacientes de IC.
Selección de estudios y extracción de datosTres revisores (M.J. Oyanguren Artola, J. Torcal Laguna y P.M. Latorre García) analizaron independientemente las fuentes de información disponibles. Al menos dos de los autores analizaron por separado los estudios a texto completo mediante formularios de selección preestablecidos. Los desacuerdos se resolvieron mediante discusión y, si el desacuerdo persistía, participaba el tercer autor.
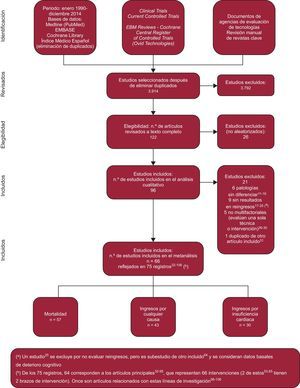
La selección de artículos (figura 1) resultó en un total de 96 publicaciones de ECA, de los que 21 cumplían algún criterio de exclusión () y 75 correspondían a 66 ensayos aleatorizados, reflejados en 64 artículos () sobre dos estudios con dos brazos de intervención y 11 artículos relacionados ().
Una investigadora externa y al menos dos miembros del equipo evaluaron a ciegas la calidad metodológica de los estudios incluidos tras su selección según los criterios de Jadad4. Todos los estudios seleccionados alcanzan una puntuación en la escala de Jadad > 3; 29 (43,9%) estudios alcanzan los 5 puntos; 23 (34,85%), 4 puntos y 14 (21,21%), 3 puntos. La escala de Jadad se describe en el .
Análisis estadísticoEn el caso de las variables que expresan proporciones, se empleó el procedimiento de Stata Metaprop5, que permite el cálculo combinado de la proporción y sus intervalos de confianza exactos basados en la prueba binomial.
Para combinar los resultados, se empleó un modelo de efectos aleatorios (DerSimonian y Laird), que tiene en cuenta la variabilidad entre estudios y en cada estudio6, y también se calculó su intervalo de confianza del 95% (IC95%). Para ello, a partir de los datos tabulados de los estudios individuales seleccionados, se calcularon los riesgos relativos (RR) y la diferencia de riesgos y sus IC95% de mortalidad, ingresos por cualquier causa e ingresos por IC. Se calculó asimismo el número de pacientes que es necesario tratar (NNT)7. Se utilizó el procedimiento metannt (STATA versión 11).
Para estimar y cuantificar la heterogeneidad entre los diferentes estudios, se emplearon el estadístico Q de Cochran y el estadístico I2, donde los valores del 25, el 50 y el 75% corresponderían a grados bajo, moderado y alto de heterogeneidad respectivamente8. La posible existencia de sesgo de publicación9 se evaluó visualmente mediante un gráfico de embudo, que enfrenta el efecto de los estudios (RR) con sus errores estándar10 ().
En caso de que algún estudio presentase más de dos brazos de tratamiento, se lo consideró como si fueran dos estudios de dos brazos separados y se dividieron los valores del grupo control por la mitad para evitar la doble ponderación del grupo de control7.
Se realizó un análisis de metarregresión para examinar el grado en que los diferentes componentes de las intervenciones y las características de los estudios pueden explicar la heterogeneidad del efecto del tratamiento entre los estudios.
Se utilizó el procedimiento metareg aplicado en STATA (versión 11). Se llevaron a cabo dos metarregresiones univariables que consideran cada factor por separado y metarregresiones multivariables que consideran todos los factores simultáneamente, y dieron resultados similares sobre las asociaciones entre los efectos del tratamiento y las características de los estudios.
RESULTADOSDescripción de los programasLa descripción de los estudios en cuanto a periodo de realización, país, carácter multicéntrico, tamaño muestral, lugar de reclutamiento y criterios de inclusión y exclusión de los estudios se recoge en la tabla 1 ().
Características de los estudios de programas de insuficiencia cardiaca*
| n (%) | |
|---|---|
| Estudios incluidos | 66 |
| Periodo analizado 1993-2013 | |
| Posterior a 2002 | 52 (78,8) |
| Pacientes | 13.535 |
| Carácter multicéntrico | 25 (37,9) |
| Área | |
| Europa | 29 (43,9) |
| Estados Unidos | 23 (34,8) |
| Canadá | 4 (6,1) |
| Sudamérica | 2 (3) |
| Asia | 3 (4,5) |
| Australia-Nueva Zelanda | 5 (7,6) |
| Lugar de captación de pacientes | |
| En una hospitalización | 50 (75,75) |
| En consulta | 9 (13,63) |
| En ambos | 7 (10,6) |
| Criterios de inclusión | |
| Ingreso por IC | 36 (54,54) |
| IC sintomática | 24 (36,36) |
| NYHA I | 2 (3) |
| NYHA II | 15 (22,7) |
| NYHA III | 20 (30,3) |
| NYHA IV | 17 (25,8) |
| FEVI ≤ 55% límite superior | 22 (33,33) |
| Límite inferior de edad ≥ 65 años | 10 (15,2) |
| Criterios de exclusión | |
| Enfermedad mental | 43 (65,15) |
| Terminal | 41 (62,12) |
| Vivir en residencia | 34 (51,51) |
| Enfermedad no cardiaca con posible influencia en resultados | 26 (39,39) |
| Rechazo de paciente o médico | 19 (28,78) |
| Vivir fuera del área | 23 (34,84) |
| Intervención quirúrgica o trasplante | 17 (25,75) |
| Problemas de comunicación/cumplimiento | 19 (28,78) |
| Controlado en otro programa | 16 (24,24) |
| Enfermedad renal grave o diálisis | 13 (19,69) |
| Infarto de miocardio o angina inestable | 17 (25,8) |
| Carecer de teléfono | 11 (16,66) |
FEVI: fracción de eyección del ventrículo izquierdo; IC: insuficiencia cardiaca; NYHA: New York Heart Association; %: porcentaje de estudios que presentan la característica estudiada, se ha calculado: N*100/66 (total de ECA incluidos en el metanálisis).
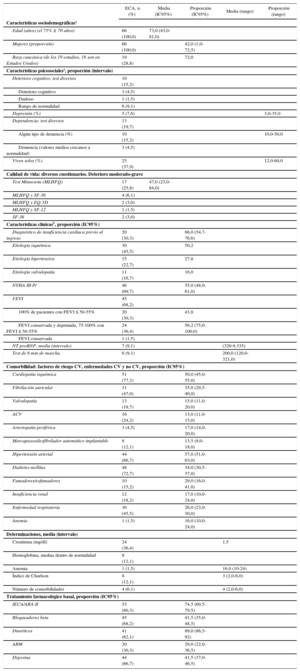
Asimismo se evaluaron las características sociodemográficas, psicosociales y clínicas de los pacientes a los que se dirigen (tabla 2) (). Eran predominantemente pacientes mayores y sexo masculino, clase funcional de la New York Heart Association (NYHA) avanzada, fracción de eyección del ventrículo izquierdo (FEVI) deprimida y gran comorbilidad cardiovascular y no cardiovascular.
Datos agrupados de las características de los pacientes en los programas de insuficiencia cardiaca ()
| ECA, n (%) | Media (IC95%) | Proporción (IC95%) | Media (rango) | Proporción (rango) | |
|---|---|---|---|---|---|
| Características sociodemográficasa | |||||
| Edad (años) (el 75% ≥ 70 años) | 66 (100,0) | 73,0 (43,0-81,0) | |||
| Mujeres (proporción) | 66 (100,0) | 42,0 (1,0-72,5) | |||
| Raza caucásica (de los 19 estudios, 16 son en Estados Unidos) | 19 (28,8) | 72,0 | |||
| Características psicosocialesa, proporción (intervalo) | |||||
| Deterioro cognitivo: test diversos | 10 (15,2) | ||||
| Deterioro cognitivo | 3 (4,5) | ||||
| Dudoso | 1 (1,5) | ||||
| Rango de normalidad | 6 (9,1) | ||||
| Depresión (%) | 5 (7,6) | 3,0-35,0 | |||
| Dependencia: test diversos | 13 (19,7) | ||||
| Algún tipo de demencia (%) | 10 (15,2) | 10,0-50,0 | |||
| Demencia (valores medios cercanos a normalidad) | 3 (4,5) | ||||
| Viven solos (%) | 25 (37,9) | 12,0-60,0 | |||
| Calidad de vida: diversos cuestionarios. Deterioro moderado-grave | |||||
| Test Minnesota (MLHFQ) | 17 (25,8) | 47,0 (23,0-64,0) | |||
| MLHFQ y SF-36 | 4 (6,1) | ||||
| MLHFQ y EQ-5D | 2 (3,0) | ||||
| MLHFQ y SF-12 | 1 (1,5) | ||||
| SF-36 | 2 (3,0) | ||||
| Características clínicasb, proporción (IC95%) | |||||
| Diagnóstico de insuficiencia cardiaca previo al ingreso | 20 (30,3) | 66,0 (54,7-76,6) | |||
| Etiología isquémica | 30 (45,5) | 50,2 | |||
| Etiología hipertensiva | 15 (22,7) | 27,8 | |||
| Etiología valvulopatía | 11 (16,7) | 16,0 | |||
| NYHA III-IV | 46 (69,7) | 55,0 (48,0-61,0) | |||
| FEVI | 45 (68,2) | ||||
| 100% de pacientes con FEVI ≤ 50-55% | 20 (30,3) | 43,8 | |||
| FEVI conservada y deprimida, 75-100% con FEVI ≤ 50-55% | 24 (36,4) | 56,2 (75,0-100,0) | |||
| FEVI conservada | 1 (1,5) | ||||
| NT-proBNP, media (intervalo) | 7 (9,1) | (320-9.335) | |||
| Test de 6 min de marcha | 6 (9,1) | 200,0 (120,0-321,0) | |||
| Comorbilidad: factores de riesgo CV, enfermedades CV y no CV, proporción (IC95%) | |||||
| Cardiopatía isquémica | 51 (77,3) | 50,0 (45,0-55,0) | |||
| Fibrilación auricular | 31 (47,0) | 35,0 (29,5-40,0) | |||
| Valvulopatía | 13 (19,7) | 15,0 (11,0-20,0) | |||
| ACV | 16 (24,2) | 13,0 (11,0-15,0) | |||
| Arteriopatía periférica | 3 (4,5) | 17,0 (14,0-20,0) | |||
| Marcapasos/desfibrilador automático implantable | 8 (12,1) | 13,5 (9,0-18,0) | |||
| Hipertensión arterial | 44 (66,7) | 57,0 (51,0-63,0) | |||
| Diabetes mellitus | 48 (72,7) | 34,0 (30,5-37,0) | |||
| Fumadores/exfumadores | 10 (15,2) | 29,0 (16,0-41,0) | |||
| Insuficiencia renal | 12 (18,2) | 17,0 (10,0-24,0) | |||
| Enfermedad respiratoria | 30 (45,5) | 26,0 (23,0-30,0) | |||
| Anemia | 1 (1,5) | 16,0 (10,0-24,0) | |||
| Determinaciones, media (intervalo) | |||||
| Creatinina (mg/dl) | 24 (36,4) | 1,5 | |||
| Hemoglobina, medias dentro de normalidad | 8 (12,1) | ||||
| Anemia | 1 (1,5) | 16,0 (10-24) | |||
| Índice de Charlson | 8 (12,1) | 3 (2,0-6,0) | |||
| Número de comorbilidades | 4 (6,1) | 4 (2,0-6,0) | |||
| Tratamiento farmacológico basal, proporción (IC95%) | |||||
| IECA/ARA-II | 53 (80,3) | 74,5 (69,5-79,5) | |||
| Bloqueadores beta | 45 (68,2) | 41,5 (35,0-48,5) | |||
| Diuréticos | 41 (62,1) | 89,0 (86,5-92) | |||
| ARM | 20 (30,3) | 29,0 (22,0-36,5) | |||
| Digoxina | 44 (66,7) | 41,5 (37,0-46,5) | |||
ACV: accidente cerebrovascular; ARA-II: antagonistas del receptor de la angiotensina II; ARM: antagonistas del receptor mineralocorticoideo; CV: cardiovascular; ECA: ensayos controlados aleatorizados; FEVI: fracción de eyección del ventrículo izquierdo; IECA: inhibidores de la enzima de conversión de la angiotensina; NYHA: clase funcional de la New York Heart Association; SF-12: Short Form 12 Health Survey; SF-36: Short Form 36 Health Survey.
Para el porcentaje de estudios que presentan la característica estudiada, se ha calculado: n × 100 / 66 (total de ECA incluidos en el metanálisis). Proporción: cálculo combinado de la proporción; IC95% (intervalos de confianza al 95% de la proporción, exactos basados en la prueba binomial). Media: cálculo combinado de la media de variables numéricas e IC95% (Intervalo de confianza al 95% de la estimación o Rango (valor mínimo- valor máximo) según proceda.
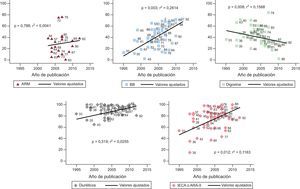
Se aprecia que con el tiempo aumenta la utilización de inhibidores de la enzima de conversión de la angiotensina (IECA)/antagonistas del receptor de la angiotensina II (ARA-II) (p < 0,012) y bloqueadores beta (p < 0,003) y se reduce la de digoxina (p < 0,008), con gran variabilidad observada en el porcentaje de utilización entre los diferentes estudios (figura 2).
Porcentaje de utilización de fármacos (BB, IECA/ARA-II, ARM, diuréticos y digoxina) en los diferentes estudios en función del año de publicación. Datos referidos por las publicaciones al inicio del estudio. La recta representa el valor promedio estimado a partir de un modelo de regresión para cada uno de los fármacos. Los números identifican estudios individuales. ARA-II: antagonistas del receptor de la angiotensina II; ARM: antagonistas del receptor mineralocorticoideo; BB: bloqueadores beta; IECA: inhibidores de la enzima de conversión de la angiotensina.
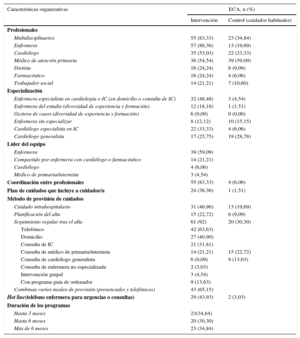
La organización de la intervención se refleja en la tabla 3, y las definiciones empleadas se muestran en el . Se analizó a los profesionales dedicados a los programas y su grado de especialización, el método de provisión de cuidados y la intensidad de los programas. El 83% de los programas eran multidisciplinarios, indicaban modos de coordinación entre ellos y tratamiento de los pacientes de modo acordado/protocolizado. Sin embargo, solo el 34,8% de los cuidados habituales contaba con dos o más miembros, y solamente el 6% informaba de sistemas de coordinación o planificación. La enfermera participaba en el 86% de los programas; el cardiólogo, en el 53% y el médico de atención primaria, en el 54%. En el 48% de los programas, las enfermeras estaban especializadas en cardiología o IC, trabajaban en consulta de IC o en el domicilio en igual proporción, y el cardiólogo era especialista en IC en el 33% (la definición de funciones se recoge en el ). La duración de los programas se distribuía proporcionalmente en < 3 meses, 3-6 meses y > 6 meses.
Características organizativas, datos agrupados de organización de programas de insuficiencia cardiaca
| Características organizativas | ECA, n (%) | |
|---|---|---|
| Intervención | Control (cuidados habituales) | |
| Profesionales | ||
| Multidisciplinarios | 55 (83,33) | 23 (34,84) |
| Enfermera | 57 (86,36) | 13 (19,69) |
| Cardiólogo | 35 (53,03) | 22 (33,33) |
| Médico de atención primaria | 36 (54,54) | 39 (59,09) |
| Dietista | 16 (24,24) | 6 (9,09) |
| Farmacéutico | 16 (24,24) | 4 (6,06) |
| Trabajador social | 14 (21,21) | 7 (10,60) |
| Especialización | ||
| Enfermera especialista en cardiología o IC (en domicilio o consulta de IC) | 32 (48,48) | 3 (4,54) |
| Enfermera del estudio (diversidad de experiencia y formación) | 12 (18,18) | 1 (1,51) |
| Gestora de casos (diversidad de experiencia y formación) | 6 (9,09) | 0 (0,00) |
| Enfermera sin especializar | 8 (12,12) | 10 (15,15) |
| Cardiólogo especialista en IC | 22 (33,33) | 4 (6,06) |
| Cardiólogo generalista | 17 (25,75) | 19 (28,78) |
| Líder del equipo | ||
| Enfermera | 39 (59,09) | |
| Compartido por enfermera con cardiólogo o farmacéutico | 14 (21,21) | |
| Cardiólogo | 4 (6,06) | |
| Médico de primaria/internista | 3 (4,54) | |
| Coordinación entre profesionales | 55 (83,33) | 4 (6,06) |
| Plan de cuidados que incluye a cuidador/a | 24 (36,36) | 1 (1,51) |
| Método de provisión de cuidados | ||
| Cuidado intrahospitalario | 31 (46,96) | 13 (19,69) |
| Planificación del alta | 15 (22,72) | 6 (9,09) |
| Seguimiento regular tras el alta | 61 (92) | 20 (30,30) |
| Telefónico | 42 (63,63) | |
| Domicilio | 27 (40,90) | |
| Consulta de IC | 21 (31,81) | |
| Consulta de médico de primaria/internista | 14 (21,21) | 15 (22,72) |
| Consulta de cardiólogo generalista | 6 (9,09) | 9 (13,63) |
| Consulta de enfermera no especializada | 2 (3,03) | |
| Intervención grupal | 3 (4,54) | |
| Con programa guía de ordenador | 9 (13,63) | |
| Combinan varios modos de provisión (presenciales y telefónicos) | 43 (65,15) | |
| Hot line(teléfono enfermera para urgencias o consultas) | 29 (43,93) | 2 (3,03) |
| Duración de los programas | ||
| Hasta 3 meses | 23(34,84) | |
| Hasta 6 meses | 20 (30,30) | |
| Más de 6 meses | 23 (34,84) | |
ECA: ensayos controlados aleatorizados; IC: insuficiencia cardiaca.
Se muestra número (porcentaje) de los estudios que presentan la característica estudiada: n × 100 / 66 (total de ECA incluidos en el metanálisis). Datos de los estudios originales en la .
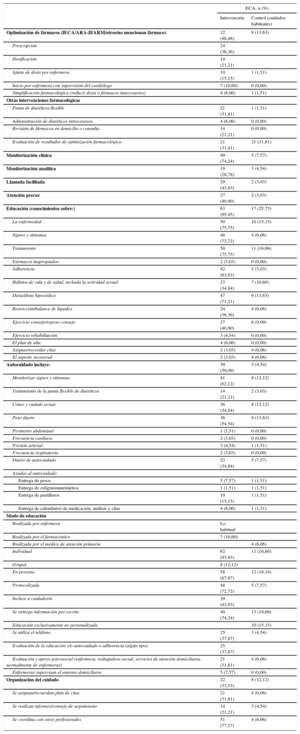
El contenido de la intervención durante el periodo hospitalario era similar en ambos grupos, salvo en 10 estudios, en los que había una evaluación suplementaria que puede incluir tratamiento farmacológico, dieta, ejercicio o aspectos psicosociales y las necesidades tras el alta. De esta evaluación se derivaba frecuentemente un plan de cuidados integrales del paciente al alta y el plan de citas y contactos, que se trasmitía a otros profesionales sanitarios extrahospitalarios y trabajadores sociales. La enfermera, y ocasionalmente el farmacéutico, comenzaban la educación de paciente y familia durante su estancia en el hospital. Se analizaron la optimización farmacológica y monitorización clínica tras el alta, contenidos y modo de educación en el autocuidado, aspectos psicosociales y de coordinación de estos programas reflejándose en la tabla 4 (, ).
Características de la intervención. Datos agrupados de contenidos principales de intervención de programas de insuficiencia cardiaca
| ECA, n (%) | ||
|---|---|---|
| Intervención | Control (cuidados habituales) | |
| Optimización de fármacos (IECA/ARA-II/ARM/otros/no mencionan fármaco) | 32 (48,48) | 9 (13,63) |
| Prescripción | 24 (36,36) | |
| Dosificación | 14 (21,21) | |
| Ajuste de dosis por enfermera | 10 (15,15) | 1 (1,51) |
| Inicio por enfermera con supervisión del cardiólogo | 7 (10,60) | 0 (0,00) |
| Simplificación farmacológica (reducir dosis o fármacos innecesarios) | 4 (6,06) | 1 (1,51) |
| Otras intervenciones farmacológicas | ||
| Pauta de diuréticos flexible | 21 (31,81) | 1 (1,51) |
| Administración de diuréticos intravenosos | 4 (6,06) | 0 (0,00) |
| Revisión de fármacos en domicilio o consulta | 14 (21,21) | 0 (0,00) |
| Evaluación de resultados de optimización farmacológica | 21 (31,81) | 21 (31,81) |
| Monitorización clínica | 49 (74,24) | 5 (7,57) |
| Monitorización analítica | 19 (28,78) | 3 (4,54) |
| Llamada facilitada | 29 (43,93) | 2 (3,03) |
| Atención precoz | 27 (40,90) | 2 (3,03) |
| Educación (conocimientos sobre:) | 63 (95,45) | 17 (25,75) |
| La enfermedad | 50 (75,75) | 10 (15,15) |
| Signos y síntomas | 48 (72,72) | 4 (6,06) |
| Tratamiento | 50 (75,75) | 11 (16,66) |
| Fármacos inapropiados | 2 (3,03) | 0 (0,00) |
| Adherencia | 42 (63,63) | 2 (3,03) |
| Hábitos de vida y de salud, incluida la actividad sexual | 23 (34,84) | 7 (10,60) |
| Dieta/dieta hiposódica | 47 (71,21) | 9 (13,63) |
| Restricción/balance de líquidos | 24 (36,36) | 4 (6,06) |
| Ejercicio consejo/reposo consejo | 27 (40,90) | 6 (9,09) |
| Ejercicio rehabilitación | 3 (4,54) | 0 (0,00) |
| El plan de alta | 4 (6,06) | 0 (0,00) |
| Asignar/recordar citas | 2 (3,03) | 4 (6,06) |
| El soporte sicosocial | 2 (3,03) | 4 (6,06) |
| Autocuidado incluye: | 39 (59,09) | 3 (4,54) |
| Monitorizar signos y síntomas | 41 (62,12) | 8 (12,12) |
| Tratamiento de la pauta flexible de diuréticos | 14 (21,21) | 2 (3,03) |
| Cómo y cuándo avisar | 36 (54,54) | 8 (12,12) |
| Peso diario | 36 (54,54) | 9 (13,63) |
| Perímetro abdominal | 1 (1,51) | 0 (0,00) |
| Frecuencia cardiaca | 2 (3,03) | 0 (0,00) |
| Presión arterial | 3 (4,54) | 1 (1,51) |
| Frecuencia respiratoria | 2 (3,03) | 0 (0,00) |
| Diario de autocuidado | 23 (34,84) | 5 (7,57) |
| Ayudas al autocuidado | ||
| Entrega de pesos | 5 (7,57) | 1 (1,51) |
| Entrega de esfigmomanómetros | 1 (1,51) | 1 (1,51) |
| Entrega de pastilleros | 10 (15,15) | 1 (1,51) |
| Entrega de calendarios de medicación, análisis y citas | 4 (6,06) | 1 (1,51) |
| Modo de educación | ||
| Realizada por enfermera | Lo habitual | |
| Realizada por el farmacéutico | 7 (10,60) | |
| Realizada por el médico de atención primaria | 4 (6,06) | |
| Individual | 62 (93,93) | 11 (16,66) |
| Grupal | 8 (12,12) | |
| En persona | 58 (87,87) | 12 (18,18) |
| Protocolizada | 48 (72,72) | 5 (7,57) |
| Incluye a cuidador/a | 29 (43,93) | |
| Se entrega información por escrito | 49 (74,24) | 13 (19,69) |
| Educación exclusivamente no personalizada | 10 (15,15) | |
| Se utiliza el teléfono | 25 (37,87) | 3 (4,54) |
| Evaluación de la educación y/o autocuidado o adherencia (algún tipo) | 25 (37,87) | |
| Evaluación y apoyo psicosocial (enfermera, trabajadora social, servicios de atención domiciliaria, normalmente de enfermeras) | 21 (31,81) | 4 (6,06) |
| Enfermeras supervisan el entorno domiciliario | 5 (7,57) | 0 (0,00) |
| Organización del cuidado | 22 (33,33) | 8 (12,12) |
| Se asignan/recuerdan plan de citas | 21 (31,81) | 4 (6,06) |
| Se realizan informes/consejo de seguimiento | 14 (21,21) | 3 (4,54) |
| Se coordina con otros profesionales | 51 (77,27) | 4 (6,06) |
ARA-II: antagonistas del receptor de la angiotensina II; ARM: antagonistas del receptor mineralocorticoideo; ECA: ensayos controlados aleatorizados; IECA: inhibidores de la enzima de conversión de la angiotensina.
Se muestra número (porcentaje) de los estudios que presentan la característica estudiada: n × 100 / 66 (total de ECA incluidos en el metanálisis). Datos de los estudios originales en la .
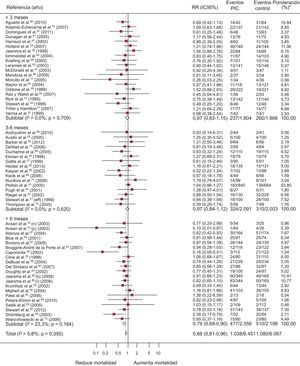
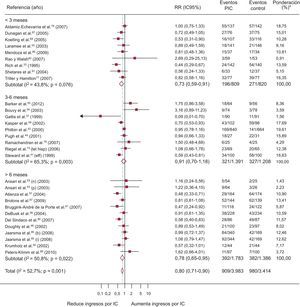
Un total de 57 ECA evalúan la mortalidad; de ellos, 4 presentan un resultado significativamente positivo (figura 3). El 13,7% (IC95%, 11,4-15,9%; I2, 89%) de los pacientes del grupo de intervención fallecen, frente al 16,7% (IC95%, 14,3-19,2%; I2, 87,4%) de los controles, con una diferencia de riesgo de muerte del –2,1% (IC95%, –3,4 a –1,0%; p < 0,0004; I2, 16,6%), atribuible a los programas, y RR = 0,88 (IC95%, 0,81-0,96; p < 0,002; I2, 6,1%) o dicho de otro modo, una reducción relativa de la mortalidad de un 12% asociada a los programas, con NNT = 20 (IC95%, 14-36) para programas de más de 6 meses (). La heterogeneidad es de grado bajo.
Forest plot que muestra los resultados de un metanálisis mediante un modelo de efectos aleatorios (DerSimonian y Laird) sobre los efectos de los programas de atención a los pacientes de insuficiencia cardiaca en la mortalidad estratificado por duración de la intervención. IC95%: intervalo de confianza del 95%; PIC: programas de insuficiencia cardiaca; RR: riesgo relativo. *Peso del estudio-modelo de efectos aleatorios.
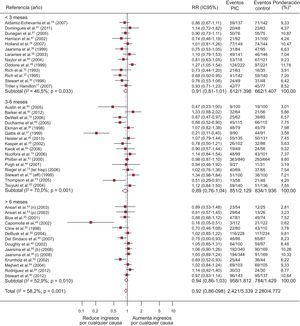
Un total de 43 ECA evalúan ingresos por cualquier causa, de los que 9 obtuvieron un resultado significativamente positivo (figura 4). El 44,5% (IC95%, 37,9-51,1%; I2, 96,7%) de los pacientes del grupo de intervención ingresa al menos una vez, frente al 49,5% (IC95%, 45,1-51,3%; I2, 89,9%) de los controles, con una diferencia de riesgo de ingreso del –4,8% atribuible a los programas (IC95%, –8 a –1,5%; p < 0,004; I2, 63,5%) y RR = 0,92 (IC95%, 0,86-0,98; p < 0,011; I2, 58,7%) es decir, una reducción relativa de ingresos por todas las causas de un 8% asociada a los programas, con NNT = 29 en estudios de más de 6 meses. La heterogeneidad es de grado moderado.
Forest plot que muestra los resultados de un metanálisis mediante un modelo de efectos aleatorios (DerSimonian y Laird) sobre los efectos de los programas de atención a los pacientes de insuficiencia cardiaca en los ingresos por cualquier causa estratificado por duración de la intervención. IC95%: intervalo de confianza del 95%; PIC: programas de insuficiencia cardiaca; RR: riesgo relativo. *Peso del estudio-modelo de efectos aleatorios.
Un total de 30 ECA recogen ingresos por IC, de los que 8 obtienen un resultado significativamente positivo (figura 5). El 23,5% (IC95%, 18,9-28,1%; I2, 93,7%) de los pacientes del grupo de intervención ingresa al menos una vez, frente al 30% (IC95%, 24-35,9%; I2, 95,10%) de los controles, con una diferencia de riesgo de ingresos del –5,6% (IC95%, –9 a –2,2%; p < 0,001; I2, 67,8%) atribuible a los programas y RR = 0,80 (IC95%, 0,71-0,90; p < 0,0001; I2, 52,7%), lo que supone una reducción relativa de ingresos por IC del 20% asociada a los programas, con NNT = 11 (IC95%, 8-20) en estudios de menos de 3 meses y NNT = 17 (IC95%, 12-35) en los de más de 6 meses. La heterogeneidad es de grado moderado.
Forest plot que muestra los resultados de un metanálisis mediante un modelo de efectos aleatorios (DerSimonian y Laird) sobre los efectos de los programas de atención a los pacientes de insuficiencia cardiaca en los ingresos por insuficiencia cardiaca estratificado por duración de la intervención. IC: insuficiencia cardiaca; IC95%: intervalo de confianza del 95%; PIC: programas de insuficiencia cardiaca; RR: riesgo relativo. *Peso del estudio-modelo de efectos aleatorios.
El análisis del efecto de los programas según el lugar de intervención se refleja en la tabla 5 e indica que los programas son efectivos tanto en consulta como en domicilio o su combinación.
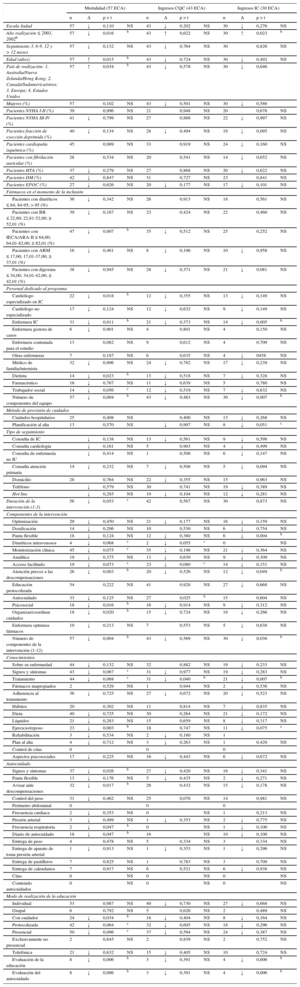
Factores relacionados con el éxito de los programas de insuficiencia cardiaca. Resultados del análisis de metarregresióna
| Mortalidad (57 ECA) | Ingresos CQC (43 ECA) | Ingresos IC (30 ECA) | ||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| n | Δ | p > t | n | Δ | p > t | n | Δ | p > t | ||||
| Escala Jadad | 57 | ↓ | 0,110 | NS | 43 | ↓ | 0,202 | NS | 30 | ↓ | 0,276 | NS |
| Año realización ≤ 2001, 2002b | 57 | ↓ | 0,016 | b | 43 | ↑ | 0,622 | NS | 30 | ↑ | 0,023 | b |
| Seguimiento 3, 6-9, 12 y > 12 meses | 57 | ↓ | 0,132 | NS | 43 | ↓ | 0,764 | NS | 30 | 0,826 | NS | |
| Edad (años) | 57 | ↑ | 0,015 | b | 43 | ↓ | 0,724 | NS | 30 | ↓ | 0,492 | NS |
| País de realización: 1, Australia/Nueva Zelanda/Hong Kong; 2, Canadá/Sudamérica/otros; 3, Europa; 4, Estados Unidos | 57 | ↑ | 0,034 | b | 43 | ↓ | 0,578 | NS | 30 | ↓ | 0,646 | |
| Mujeres (%) | 57 | 0,102 | NS | 43 | ↓ | 0,501 | NS | 30 | ↓ | 0,586 | ||
| Pacientes NYHA I-II (%) | 39 | 0,996 | NS | 21 | 0,948 | NS | 20 | 0,678 | NS | |||
| Pacientes NYHA III-IV (%) | 41 | ↓ | 0,799 | NS | 27 | 0,868 | NS | 22 | ↓ | 0,997 | NS | |
| Pacientes fracción de eyección deprimida (%) | 40 | ↓ | 0,134 | NS | 28 | ↓ | 0,494 | NS | 19 | ↓ | 0,095 | NS |
| Pacientes cardiopatía isquémica (%) | 45 | 0,989 | NS | 33 | 0,919 | NS | 24 | ↓ | 0,160 | NS | ||
| Pacientes con fibrilación auricular (%) | 28 | 0,534 | NS | 20 | 0,541 | NS | 14 | ↓ | 0,652 | NS | ||
| Pacientes HTA (%) | 37 | ↓ | 0,279 | NS | 27 | 0,868 | NS | 20 | ↓ | 0,622 | NS | |
| Pacientes DM (%) | 42 | ↓ | 0,847 | NS | 31 | 0,727 | NS | 23 | 0,841 | NS | ||
| Pacientes EPOC (%) | 27 | ↓ | 0,626 | NS | 20 | ↓ | 0,177 | NS | 17 | ↓ | 0,101 | NS |
| Fármacos en el momento de la inclusión | ||||||||||||
| Pacientes con diuréticos ≤ 84; 84-95; > 95 (%) | 36 | ↓ | 0,342 | NS | 26 | 0,913 | NS | 18 | 0,561 | NS | ||
| Pacientes con BB ≤ 22,80; 22,81-52,00; ≥ 52,01 (%) | 39 | ↓ | 0,167 | NS | 23 | 0,424 | NS | 22 | 0,460 | NS | ||
| Pacientes con IECA/ARA-II ≤ 64,00; 64,01-82,00; ≥ 82,01 (%) | 47 | ↓ | 0,007 | b | 35 | ↓ | 0,512 | NS | 25 | 0,252 | NS | |
| Pacientes con ARM ≤ 17,00; 17,01-37,00; ≥ 37,01 (%) | 16 | ↓ | 0,461 | NS | 8 | ↓ | 0,196 | NS | 10 | ↓ | 0,958 | NS |
| Pacientes con digoxina ≤ 34,00; 34,01-42,00; ≥ 42,01 (%) | 38 | ↓ | 0,945 | NS | 28 | ↓ | 0,371 | NS | 21 | ↓ | 0,081 | NS |
| Personal dedicado al programa | ||||||||||||
| Cardiólogo especializado en IC | 22 | ↓ | 0,018 | b | 12 | ↓ | 0,355 | NS | 13 | ↓ | 0,149 | NS |
| Cardiólogo no especializado | 17 | ↓ | 0,124 | NS | 12 | ↓ | 0,632 | NS | 9 | ↓ | 0,149 | NS |
| Enfermera IC | 31 | ↓ | 0,011 | b | 21 | ↓ | 0,373 | NS | 14 | ↓ | 0,005 | b |
| Enfermera gestora de casos | 6 | ↓ | 0,901 | NS | 4 | 0,801 | NS | 4 | 0,150 | NS | ||
| Enfermera contratada para el estudio | 13 | 0,082 | NS | 9 | 0,612 | NS | 4 | 0,709 | NS | |||
| Otras enfermeras | 7 | 0,187 | NS | 6 | 0,635 | NS | 4 | ↓ | 0458 | NS | ||
| Médico de familia/internista | 32 | ↓ | 0,906 | NS | 24 | ↓ | 0,782 | NS | 17 | ↓ | 0,239 | NS |
| Dietista | 14 | ↓ | 0,023 | b | 13 | ↓ | 0,518 | NS | 7 | ↓ | 0,328 | NS |
| Farmacéutico | 16 | ↓ | 0,767 | NS | 11 | ↓ | 0,639 | NS | 5 | 0,780 | NS | |
| Trabajador social | 14 | ↓ | 0,056 | c | 12 | ↓ | 0,519 | NS | 7 | ↓ | 0,632 | NS |
| Número de componentes del equipo | 57 | ↓ | 0,004 | b | 43 | ↓ | 0,483 | NS | 30 | ↓ | 0,007 | b |
| Método de provisión de cuidados | ||||||||||||
| Cuidados hospitalarios | 25 | 0,408 | NS | 0,400 | NS | 13 | ↓ | 0,268 | NS | |||
| Planificación al alta | 13 | 0,570 | NS | ↓ | 0,997 | NS | 8 | ↓ | 0,051 | c | ||
| Tipo de seguimiento | ||||||||||||
| Consulta de IC | ↓ | 0,138 | NS | 13 | ↓ | 0,561 | NS | 9 | ↓ | 0,598 | NS | |
| Consulta cardiología | ↓ | 0,161 | NS | 5 | 0,903 | NS | 4 | ↓ | 0,499 | NS | ||
| Consulta de enfermería no IC | ↓ | 0,414 | NS | 1 | 0,508 | NS | 6 | ↓ | 0,147 | NS | ||
| Consulta atención primaria | 14 | ↓ | 0,232 | NS | 7 | ↓ | 0,508 | NS | 5 | ↓ | 0,094 | NS |
| Domicilio | 28 | 0,764 | NS | 22 | ↓ | 0,355 | NS | 15 | 0,963 | NS | ||
| Teléfono | ↓ | 0,579 | NS | 30 | 0,741 | NS | 19 | ↓ | 0,389 | NS | ||
| Hot line | ↓ | 0,285 | NS | 19 | ↓ | 0,104 | NS | 12 | ↓ | 0,281 | NS | |
| Duración de la intervención (1-3) | 56 | ↓ | 0,053 | c | 42 | 0,567 | NS | 30 | 0,873 | NS | ||
| Componentes de la intervención | ||||||||||||
| Optimización | 29 | ↓ | 0,450 | NS | 21 | ↓ | 0,177 | NS | 16 | ↓ | 0,159 | NS |
| Dosificación | 14 | ↓ | 0,206 | NS | 10 | 0,530 | NS | 6 | ↓ | 0,754 | NS | |
| Pauta flexible | 18 | ↓ | 0,124 | NS | 12 | ↓ | 0,380 | NS | 6 | ↓ | 0,004 | b |
| Diuréticos intravenosos | 4 | ↓ | 0,068 | c | 2 | ↓ | 0,055 | c | 0 | NS | ||
| Monitorización clínica | 45 | ↓ | 0,075 | c | 35 | ↓ | 0,198 | NS | 21 | ↓ | 0,364 | NS |
| Analítica | 19 | ↓ | 0,375 | NS | 13 | ↓ | 0,639 | NS | 9 | ↓ | 0,309 | NS |
| Acceso facilitado | 19 | ↓ | 0,073 | c | 23 | ↓ | 0,080 | c | 14 | ↓ | 0,151 | NS |
| Atención precoz a las descompensaciones | 26 | ↓ | 0,003 | b | 20 | ↓ | 0,526 | NS | 12 | ↓ | 0,049 | b |
| Educación protocolizada | 54 | 0,222 | NS | 41 | 0,928 | NS | 27 | ↓ | 0,668 | NS | ||
| Autocuidado | 33 | ↓ | 0,125 | NS | 27 | 0,025 | b | 15 | 0,604 | NS | ||
| Psicosocial | 18 | ↓ | 0,016 | b | 16 | ↓ | 0,914 | NS | 9 | ↓ | 0,312 | NS |
| Organizar/coordinar cuidados | 18 | ↓ | 0,020 | b | 15 | ↓ | 0,724 | NS | 19 | ↓ | 0,266 | NS |
| Enfermera optimiza fármacos | 10 | ↓ | 0,213 | NS | 7 | 0,553 | NS | 5 | ↓ | 0,638 | NS | |
| Número de componentes de la intervención (1-12) | 57 | ↓ | 0,004 | b | 43 | ↓ | 0,569 | NS | 30 | ↓ | 0,036 | b |
| Conocimientos | ||||||||||||
| Sobre su enfermedad | 44 | ↓ | 0,132 | NS | 32 | 0,882 | NS | 19 | ↓ | 0,233 | NS | |
| Signos y síntomas | 43 | ↓ | 0,067 | c | 31 | ↓ | 0,977 | NS | 19 | ↓ | 0,283 | NS |
| Tratamiento | 44 | ↓ | 0,068 | c | 31 | ↓ | 0,040 | b | 21 | ↓ | 0,007 | b |
| Fármacos inapropiados | 2 | 0,529 | NS | 1 | 0,944 | NS | 2 | ↓ | 0,536 | NS | ||
| Adherencia al tratamiento | 36 | ↓ | 0,725 | NS | 27 | ↓ | 0,672 | NS | 20 | ↓ | 0,523 | NS |
| Hábitos | 20 | 0,302 | NS | 11 | 0,814 | NS | 7 | ↓ | 0,835 | NS | ||
| Dieta | 40 | ↓ | 0,725 | NS | 30 | 0,264 | NS | 21 | ↓ | 0,172 | NS | |
| Líquidos | 21 | ↓ | 0,283 | NS | 15 | 0,659 | NS | 8 | ↓ | 0,317 | NS | |
| Ejercicio/reposo | 23 | ↓ | 0,003 | b | 18 | 0,747 | NS | 11 | ↓ | 0,075 | c | |
| Rehabilitación | 3 | ↓ | 0,534 | NS | 2 | ↓ | 0,180 | NS | 1 | |||
| Plan al alta | 4 | ↓ | 0,712 | NS | 3 | ↓ | 0,263 | NS | 1 | 0,429 | NS | |
| Control de citas | 0 | 0 | 0 | |||||||||
| Aspectos psicosociales | 17 | ↓ | 0,225 | NS | 16 | ↓ | 0,443 | NS | 6 | ↓ | 0,672 | NS |
| Autocuidado | ||||||||||||
| Signos y síntomas | 37 | ↓ | 0,026 | b | 27 | ↓ | 0,420 | NS | 16 | ↓ | 0,341 | NS |
| Pauta flexible | 13 | ↓ | 0,176 | NS | 5 | ↓ | 0,435 | NS | 2 | ↓ | 0,271 | NS |
| Avisar ante descompensaciones | 32 | ↓ | 0,017 | b | 26 | 0,432 | NS | 15 | ↓ | 0,178 | NS | |
| Control del peso | 31 | ↓ | 0,462 | NS | 25 | 0,076 | NS | 14 | 0,981 | NS | ||
| Perímetro abdominal | 0 | 0 | 0 | |||||||||
| Frecuencia cardiaca | 2 | ↓ | 0,353 | NS | 0 | NS | 1 | 0,213 | NS | |||
| Presión arterial | 3 | ↓ | 0,489 | NS | 1 | ↓ | 0,353 | NS | 2 | ↓ | 0,775 | NS |
| Frecuencia respiratoria | 2 | ↓ | 0,047 | b | 0 | NS | 1 | ↓ | 0,100 | NS | ||
| Diario de autocuidado | 18 | ↓ | 0,047 | b | 16 | NS | 10 | ↓ | 0,100 | NS | ||
| Entrega de peso | 4 | 0,478 | NS | 5 | 0,334 | NS | 3 | 0,334 | NS | |||
| Entrega de aparato de toma presión arterial | 1 | ↓ | 0,913 | NS | 1 | ↓ | 0,353 | NS | 1 | ↓ | 0,296 | NS |
| Entrega de pastilleros | 7 | 0,825 | NS | 1 | 0,783 | NS | 3 | 0,709 | NS | |||
| Entrega de calendarios | 7 | 0,917 | NS | 6 | 0,521 | NS | 6 | ↓ | 0,938 | NS | ||
| Citas | 0 | NS | 0 | NS | 0 | NS | ||||||
| Contenido autocuidados | 0 | NS | 0 | NS | 0 | NS | ||||||
| Modo de realización de la educación | ||||||||||||
| Individual | 53 | 0,987 | NS | 40 | ↓ | 0,730 | NS | 27 | ↓ | 0,668 | NS | |
| Grupal | 6 | 0,792 | NS | 5 | 0,626 | NS | 2 | 0,489 | NS | |||
| Con cuidador | 24 | ↓ | 0,034 | b | 18 | ↓ | 0,404 | NS | 8 | ↓ | 0,164 | NS |
| Protocolizada | 42 | ↓ | 0,064 | c | 32 | ↓ | 0,605 | NS | 18 | ↓ | 0,296 | NS |
| Presencial | 50 | ↓ | 0,096 | c | 37 | ↓ | 0,594 | NS | 24 | ↓ | 0,387 | NS |
| Exclusivamente no presencial | 2 | 0,645 | NS | 2 | 0,839 | NS | 2 | 0,752 | NS | |||
| Telefónica | 21 | ↓ | 0,632 | NS | 15 | ↓ | 0,405 | NS | 10 | 0,724 | NS | |
| Evaluación de la educación | 8 | ↓ | 0,006 | b | 3 | ↓ | 0,391 | NS | 4 | ↓ | 0,006 | b |
| Evaluación del autocuidado | 8 | ↓ | 0,006 | b | 3 | ↓ | 0,391 | NS | 4 | ↓ | 0,006 | b |
↓: reducción de riesgo relativo entre los ECA que refieren el factor y los que no; ARA-II: antagonistas del receptor de la angiotensina II; ARM: antagonistas del receptor mineralocorticoideo; BB: bloqueadores beta; CQC: cualquier causa; DM: diabetes mellitus; ECA: ensayos controlados aleatorizados; EPOC: enfermedad pulmonar obstructiva crónica; FE: fracción de eyección; HTA: hipertensión arterial; IC: insuficiencia cardiaca; IECA: inhibidores de la enzima de conversión de la angiotensina; NS: no significativo; NYHA: New York Heart Association.
En el caso de los fármacos, la variable se ha recogido en porcentaje de pacientes que los utilizaban; para el análisis se han considerado los terciles de la distribución.
Las características principales de los programas de IC que se asocian de manera significativa a reducción de mortalidad y/o reducción de ingresos por todas las causas o por IC (tabla 5) () son las siguientes: el año de realización, 2002 o posterior; país distinto de Estados Unidos; mayor uso basal de IECA/ARA-II, y la relación inversa entre edad del paciente y mortalidad.
En cuanto a las características organizativas, se asocian a reducción de mortalidad o reducción de ingresos por todas las causas o por IC: el número de componentes del equipo multidisciplinario, el cardiólogo y la enfermera especializados en IC y la duración > 6 meses, aunque la intervención corta < 3 meses es significativa.
Finalmente, en cuanto a los contenidos de la intervención, se asocian a reducción de mortalidad y/o reducción de ingresos por todas las causas o por IC: el número de componentes evaluados en este metanálisis, y entre ellos la pauta flexible de diuréticos, la atención precoz a descompensaciones, los aspectos psicosociales, la organización y coordinación de la asistencia, la monitorización por el paciente de signos y síntomas y aviso precoz ante descompensaciones, el uso del diario de autocuidado, el conocimiento del tratamiento, el ejercicio, los aspectos psicosociales y la coordinación de la asistencia, así como la propia evaluación de la educación y el autocuidado e incluir a cuidadores.
También reducen el riesgo, sin alcanzar significación estadística: la optimización farmacológica, la dosificación, la administración de diuréticos intravenosos y la monitorización clínica y analítica.
DISCUSIÓNEste estudio de 66 ECA realizados en 18 países que incluyeron a 13.553 pacientes es el más extenso publicado hasta el presente. Los anteriores metanálisis publicados en 2004-2012 (en total, 19) con los que se compara evaluaron entre 6 y 35 ECA. En nuestro estudio se han incluido 16 ensayos no incluidos en metanálisis previos, publicados entre 2005 y 2013 ().
El metanálisis confirma la reducción de ingresos por todas las causas y por IC y demuestra la reducción en mortalidad de los programas de IC.
Nuestros resultados concuerdan en cuanto a reducción de mortalidad con 6 metanálisis previos6,11,13,14,17,21, mientras que otros 69,10,15,18,19,23 encontraron tendencias favorables no significativas y otro8, resultado neutro, si bien los ensayos incluidos en este último son anteriores a 2001. Un metanálisis7 demostró reducción en el combinado de mortalidad y readmisiones, otros 312,16,20 no analizaron mortalidad agrupada y encontraron una reducción significativa en 3, 4 y 1 estudio respectivamente, y finalmente uno22 no evaluó resultados de mortalidad. Por su parte, la metarrevisión de Savard et al.24 no combinó los metanálisis, pero halló reducciones significativas en 6 de 13 metanálisis y tendencias favorables no significativas en el resto.
La reducción encontrada de reingresos por todas las causas concuerda con 13 metanálisis6–9,11–15,18,21–23, otro10 (que solo incluyó 6 ensayos de 1998 a 2003) demostró tendencia no significativa a la reducción y otro más20, debido a la heterogeneidad, solo encontró diferencias significativas en 2 de 8 estudios en la reducción de ingresos. No proporcionaron datos agrupados 4 metanálisis12,16,19,20, uno de ellos16 observa reducción del combinado de readmisiones y mortalidad en 8 programas y, finalmente, un metanálisis17 no midió reingresos por todas las causas. En la metarrevisión de Savard et al.24, 10 de los 13 metanálisis considerados redujeron reingresos por todas las causas.
Nuestros resultados de reingresos por IC coinciden con los 9 metanálisis que los evaluaron6,7,11,13,15,17,22 y con los ensayos colaborativos de farmacéuticos de Koshman et al18. Los programas de gestión de casos de Taylor et al.19 presentan tendencia a la reducción. Los ensayos dirigidos por farmacéutico de Koshman et al.18 no resultaron en reducción de ingresos. En la metarrevisión de Savard et al.24, los 9 metanálisis que los midieron redujeron significativamente reingresos de IC.
En cuanto a los determinantes de reducción de ingresos y/o mortalidad de los programas, nuestro metanálisis señala que el año de realización 2002 o posterior mejora resultados de morbimortalidad, al igual que en el metanálisis de Göhler et al14. Los resultados mejorados en programas de 2002 y después se asocian a mayor uso basal de IECA y bloqueadores beta, y el mayor uso basal de IECA es un significativo factor determinante de resultados, algo señalado previamente por Phillips et al.10 y Göhler et al.14, y el mayor uso de bloqueadores beta es un determinante de resultados, pero no significativo. También mejoran resultados los programas no realizados en Estados Unidos. Los programas en Estados Unidos se asocian a una atención predominante en domicilio, y a que haya menos clínicas o unidades de IC, menor proporción de cardiólogos y enfermeras especialistas en IC, mayor frecuencia de gestoras de casos y menor porcentaje de optimización de fármacos, así como a dificultades añadidas de coordinación del sistema de salud de Estados Unidos debido a su carácter privado.
La mayoría de las características de los pacientes no se asocian de manera significativa con resultados, como es lógico al ser ECA y con comparables grupos de intervención y cuidados habituales, lo que se ha señalado previamente en cuanto a NYHA y FEVI16, etiología isquémica o diabetes mellitus14. Por el contrario, Göhler et al.14 asociaron menor NYHA a mayor reducción de mortalidad. Identificamos, al igual que esos autores, la relación inversa entre edad y mortalidad14, y por ello discrepamos del análisis de Yu et al.16, que refirieron que no influyen los factores demográficos.
Como han mencionado anteriores metanálisis, el equipo de profesionales es la característica organizativa primordial para una reducción significativa de morbimortalidad: el número de componentes6,13,14 y la especialización del equipo multidisciplinario y cardiólogo y enfermera especializados en IC6,10,11,13,14,16. Nuestro estudio añade también al dietista y, rozando la significación, la trabajadora social. El cardiólogo no especializado y el farmacéutico reducen el riesgo de modo no significativo. Nuestro metanálisis coincide con la observación de Yu et al.16 en que puede ser beneficiosa la incorporación del médico de atención primaria al equipo especializado de cardiólogo y enfermera, y al igual que en el nuestro, Whellan et al.12 plantearon que es cuestionable su influencia si no participa con este equipo.
Los programas con seguimiento en domicilio y consulta de IC reducen los ingresos de IC significativamente, no así la atención telefónica exclusiva.
Nuestro estudio consolida con los previos la duración > 6 meses como factor de reducción significativo14,17,21, aunque la intervención corta < 3 meses es también significativa (es un periodo de más ingresos, por lo que se puede influir en mayor medida). Difiere de Roccaforte et al.11, que establecieron asociación con estudios de 3-6 meses. Concluimos, al igual que Holland et al.13, que la calidad de los estudios no influye en los resultados, al contrario de Roccaforte et al.11, que manifiestan que, a más calidad, mayor reducción de mortalidad.
En cuanto a la intervención, coincidimos con otros metanálisis10,16,21 en señalar que el número de componentes de la intervención evaluados en el nuestro reduce reingresos o mortalidad de manera significativa.
Los elementos de la intervención que reducen el riesgo de mortalidad y/o reingresos de manera significativa en nuestro metanálisis han sido señalados en previos estudios: la pauta de diuréticos flexible16, la atención precoz a descompensaciones6,12,16, los aspectos psicosociales y la organización y coordinación de la asistencia16.
También los demás elementos de la intervención evaluados en este metanálisis reducen el riesgo de morbimortalidad en mayor o menor grado, aunque de modo no significativo: la monitorización clínica y analítica, el acceso facilitado, la administración de diuréticos intravenosos y la optimización y el ajuste posológico de fármacos16.
Aunque la educación y el autocuidado se reflejan como elementos positivos de la intervención en numerosos metanálisis6,15–17,23, el nuestro demuestra que, pese a reducir el riesgo de morbimortalidad, lo hacen de manera no significativa con carácter general. Sin embargo, algunos componentes de educación y autocuidado son esenciales para la reducción de riesgo de manera significativa: la monitorización por el paciente de signos y síntomas y aviso precoz, el diario de autocuidado, el conocimiento del tratamiento, del ejercicio, los aspectos psicosociales y la coordinación de la asistencia, así como la propia evaluación de la educación y el autocuidado e incluir al cuidador. La educación en persona y protocolizada es casi significativa. Otros elementos de la educación y autocuidado reducen el riesgo, pero de manera no significativa: el conocimiento de la dieta e ingesta de líquidos, los fármacos inapropiados, la importancia de la adherencia, del plan de alta, el control de peso, uso de pastilleros, etc.
Las implicaciones clínicas que se derivan de este estudio son: a) deben implementarse con carácter universal programas específicos para pacientes de IC, al menos para los que hayan tenido un ingreso hospitalario, ya que existe suficiente evidencia para poner en marcha programas exitosos, que asimismo pueden ser coste-efectivos por su reducción de ingresos hospitalarios y un alivio de la carga social de los cuidadores informales; b) estos programas pueden implementarse tanto en unidades de IC hospitalarias, clínicas de IC comunitarias y en domicilio; c) su diseño debe incluir al menos los factores que este metanálisis demuestra que reducen de manera estadísticamente significativa ingresos y mortalidad y aquellos que reducen el riesgo, que se converten en criterios de calidad para la gestión, y d) antes de generalizarlos, se debe contextualizar, adaptar y probar estos programas en cada sistema de salud, estudiando su eficiencia y la forma de implementación, y se debe revaluarlos permanentemente con indicadores de calidad.
Son necesarios nuevos estudios primarios de calidad para profundizar en los factores clave del éxito de los programas, sus características de intervención y organización, describiendo de un modo preciso las peculiaridades de los pacientes, el sistema de salud y el contexto social y geográfico en que se aplican. Se debe estudiar su aplicación en subgrupos de FEVI conservada, mujeres, pacientes con problemas mentales o comorbilidades importantes y el modo y el contenido de la participación del médico de primaria en los equipos de cardiólogo y enfermera de IC. Se deben estudiar con el mismo grado de precisión mencionado los programas que incluyen telemonitorización a distancia y contrastar su coste-efectividad con los programas que no la incluyen.
LimitacionesSe requiere interpretar la intervención, ya que los estudios describen pobremente las intervenciones implementadas, los contenidos, la organización y las características de los pacientes y de los cuidados habituales. La mayoría tampoco evalúa resultados directos de sus intervenciones (p. ej., grado de optimización farmacológica alcanzado, conocimiento adquirido por paciente y familia, grado de adherencia y resultado de la atención precoz a las descompensaciones). Se describe escasamente la intervención educativa de los programas de IC y es casi nula en el caso de los controles.
La definición de FEVI deprimida en algunos estudios no es la actualmente en uso. La definición de ingreso es imprecisa en numerosos estudios en cuanto a si incluyen o no ingresos planificados, visitas a urgencias y duración mínima.
El hecho de que los programas sean multifactoriales en cuanto a contenidos, intensidad, tipo de organización y pacientes y que además haya diferencias geográficas y de sistemas de salud hace difícil sacar conclusiones definitivas de las características que pueden garantizar el éxito de los programas de atención a pacientes de IC en cualquier sistema de salud.
CONCLUSIONESEl presente metanálisis corrobora en diciembre de 2014 la reducción de ingresos por todas las causas y por IC de la mayoría de los metanálisis previos, pero incluyendo un número de ECA mucho mayor (66) y más actual, además de incluir los ECA de nuestro entorno. Consolida asimismo la reducción de mortalidad de algunos de estos metanálisis e identifica los factores determinantes de resultados en reingresos y mortalidad.
CONFLICTO DE INTERESESNinguno.
- –
Los programas dirigidos a pacientes de IC, evaluados en conjunto, reducen ingresos.
- –
Algunos programas no obtienen estos resultados, pero no se conoce bien la razón.
- –
Algunos programas además reducen mortalidad, pero otros no, y no hay resultados generales concluyentes.
- –
La necesidad de realizar programas específicos para la atención del paciente de IC es incuestionable, pero se debe precisar los determinantes del éxito, en cuanto a características de los pacientes, contenidos de la intervención, organización y contexto social, geográfico y del sistema de salud en el que se realizan.
- –
Ratifica en diciembre de 2014 la reducción de ingresos por IC y por cualquier causa y confirma la reducción de la mortalidad con los programas multifactoriales que no incluyen telemonitorización.
- –
Identifica factores determinantes de reingresos y mortalidad de manera estadísticamente significativa: los equipos multidisciplinarios con enfermeras y cardiólogos especializados; la monitorización de signos y síntomas por el paciente, el aviso precoz y el conocimiento del tratamiento; la educación en autocuidado protocolizada y evaluada; la pauta de diuréticos flexible; la atención precoz a las descompensaciones; la intervención psicosocial; la coordinación de profesionales hospitalarios y extrahospitalarios, el seguimiento tras el alta en consulta y domicilio y la duración mayor de 6 meses.
- –
Señala reducción del riesgo sin alcanzar significación estadística: la optimización farmacológica, el ajuste posológico, la administración de diuréticos intravenosos y la monitorización clínica y analítica.
Agradecemos al Dr. Manuel Anguita, del Departamento de Cardiología del Hospital Reina Sofía de Córdoba, su revisión inicial del metanálisis.