Varios estudios han relacionado la presencia de fibrilación auricular (FA) con una tasa de filtrado glomerular estimada (TFGe) reducida. Nuestro objetivo es comparar la evolución de la TFGe en pacientes con FA tras ablación de venas pulmonares (VP) en función del éxito de la técnica, así como estudiar la relación entre TFGe y varios biomarcadores.
MétodosCohorte prospectiva de pacientes con FA remitidos a nuestro centro para ablación de VP con seguimiento de 1 año. La TFGe se obtuvo mediante la fórmula de la Chronic Kidney Disease Epidemiology Collaboration en el momento basal y a los 3 y 12 meses. Se midieron biomarcadores (péptido natriurético cerebral, corina y galectina-3) antes de la ablación y a los 12 meses.
ResultadosSe estudió a 124 pacientes (edad, 55±10 años; el 69,4% varones); 75 presentaban FA paroxística (60,5%). La media de la TFGe basal fue de 90,8 [77,8-100,0] ml/min/1,73 m2. La TFGe se incrementó al final del seguimiento, con diferencia estadísticamente significativa entre los pacientes que habían sufrido recurrencia a los 12 meses y los que no (–1,1 [–6,0 a 8,8] frente a 7,1 [–0,6 a 14,2] ml/min/1,73 m2; p=0,017). La mejora de la TFGe a los 12 meses fue inversamente proporcional a la TFGe basal. Las cifras de péptido natriurético cerebral y corina mejoraron a los 12 meses, mientras que los de galectina-3 empeoraron, sin relación con la TFGe.
ConclusionesEn los pacientes con FA tratados con ablación de VP, se observó una mejora general de la TFGe, más marcada en el subgrupo que no tuvo recurrencias, aunque sin diferencias significativas en el análisis multivariante.
Palabras clave
Las funciones renal y cardiaca están íntimamente relacionadas, pues la interacción entre riñones y corazón es bidireccional y depende de complejos mecanismos neurohumorales, ampliamente conocidos en campos como el de la insuficiencia cardiaca1. Full English text available from: www.revespcardiol. Sin embargo, la relación entre la función renal y las arritmias como la fibrilación auricular (FA) está menos establecida. Varios estudios han encontrado asociación significativa entre la prevalencia de FA y una tasa de filtrado glomerular estimada (TFGe) reducida2,3. Además, la progresión de la disfunción renal es un potente marcador de aparición de FA en pacientes con hipertensión arterial4 y de recurrencia de FA tras cardioversión eléctrica5,6 y ablación con catéter7,8.
Hasta la fecha, un único estudio prospectivo ha analizado la relación entre la ablación de la FA y la evolución de la función renal. En los pacientes sin recurrencias arrítmicas, la TFGe aumentaba y en los pacientes con recurrencias, la TFGe disminuía al año de seguimiento9. Un estudio retrospectivo encontró también mejora de la TFGe a lo largo del seguimiento, especialmente entre los pacientes que se mantenían en ritmo sinusal10. Otro estudio retrospectivo encontró que los pacientes con recurrencias arrítmicas tras la ablación de FA presentaban una TFGe peor, tanto basal como al año de seguimiento, que los pacientes sin recurrencias11.
El objetivo de nuestro estudio es profundizar en el conocimiento de la relación entre la función renal y la FA, evaluando los cambios producidos en la TFGe al año de seguimiento tras la ablación de las venas pulmonares (VP) en población europea y con la fórmula actualmente recomendada por la Chronic Kidney Disease Epidemiology Collaboration (CKD-EPI) en la guía KDIGO12, ya que el único estudio prospectivo realizado evaluó a población japonesa con una fórmula específica para dicha población9 y, por tanto, no aplicable a otros grupos poblacionales. Además, como objetivo secundario se incluyó el análisis de biomarcadores (péptido natriurético cerebral [BNP], corina y galectina-3) como posibles predictores de la evolución de la función renal y recurrencias tras ablación de las VP.
MÉTODOSDiseño y población de estudioCohorte prospectiva de pacientes con FA paroxística y persistente remitidos a nuestro centro consecutivamente y según la práctica clínica habitual, para realizar un procedimiento de ablación de VP durante el periodo de junio de 2015 a febrero de 2017. El seguimiento de los pacientes se realizó durante 12 meses. Todos los pacientes firmaron el consentimiento informado para el estudio, que previamente había aprobado el comité local de ética de investigación.
Los criterios de exclusión fueron: a) pacientes que rechazaron firmar el consentimiento informado; b) imposibilidad para realizar los seguimientos clínicos o la recogida de muestras biológicas; c) antecedente personal de insuficiencia renal grave (TFGe <30 ml/min/1,73 m2); d) pacientes en hemodiálisis; e) infarto agudo de miocardio o intervención coronaria percutánea en los 6 meses previos a la ablación, y f) ablación de FA en los 6 meses previos a la realización del estudio.
Marcadores relacionados con la función renal y la fibrilación auricularEn el estudio se incluyeron determinaciones de BNP, corina y galectina-3 basal y al año de seguimiento. Las muestras de sangre para analizar la corina y la galectina-3 se centrifugaron y se congelaron tras la extracción a –80°C hasta su análisis.
Ablación con catéterEl procedimiento de ablación se realizó conforme a lo descrito en el .
SeguimientoTras la ablación, los pacientes continuaron con el tratamiento antiarrítmico y la anticoagulación oral durante los primeros 3 meses, considerados como el periodo ventana. En la revisión de los 3 meses se realizó un Holter de 4-7 días y una analítica de sangre y orina. A los 12 meses se realizó otra revisión con Holter-electrocardiograma de 24 h y analítica de orina y sangre con biomarcadores. Se consideró recurrencia cualquier arritmia auricular (FA, aleteo o taquicardia auricular) de duración ≥ 30 s fuera del periodo ventana. Se indicó a los pacientes que acudieran a su centro de salud o urgencias en caso de palpitaciones para intentar documentar posibles recurrencias, ya que no se disponía de registrador de eventos.
Evaluación de la función renalLa TFGe se obtuvo según la guía KDIGO de 2012, que recomienda estimarla mediante la fórmula CKD-EPI12. La TFGe se midió en el momento basal y 3 y 12 meses tras la ablación. Se consideró mejora de la TFGe cualquier incremento en el seguimiento frente al valor basal. En los pacientes a los que se administró contraste yodado durante el procedimiento para la realización de la angiografía rotacional, se realizó una analítica de control a las 24 h para descartar nefropatía por contraste, definida como aumento absoluto de la creatinina sérica ≥ 0,5 mg/dl o relativo ≥ 25% en dichas 24 h tras la exposición al contraste13.
Análisis estadísticoLas variables numéricas se describen como media±desviación estándar o mediana [intervalo intercuartílico] en el caso de la variables no normales. Las variables categóricas se describen como frecuencias absolutas y relativas. Para comparar las posibles diferencias en las variables cualitativas entre los grupos según el tipo de FA y grupos de TFGe, se utilizó el test de la χ2 de Pearson o el test exacto de Fisher cuando no se cumplían las condiciones de aplicabilidad. Para las variables numéricas se utilizó el test de la t de Student y ANOVA para muestras independientes o Mann-Whitney y Kruskal-Wallis en los casos no paramétricos. La normalidad de las variables se estudió con el test de Shapiro-Wilk. Se utilizó el modelo lineal general de medidas repetidas para comparar la evolución de los distintos parámetros en el seguimiento, considerando el tiempo como factor individual y el grupo de comparación (los distintos factores de riesgo cardiovascular, tratamientos, etc.) como factor interindividual. Para la comparación de los parámetros cualitativos en los distintos momentos, se empleó el test de McNemar. Se realizó un modelo de regresión lineal de efectos mixtos para analizar las variables que influyen en la variación de la TFGe, se ajustó por el tiempo, recurrencia y el resto de posibles variables confusoras, y se consideró a los pacientes como efecto aleatorio del modelo. En primer lugar, se ajustó el modelo nulo, al considerar únicamente la variabilidad del paciente (modelo I); en segundo lugar, se ajustó por la variable tiempo (modelo II) y en tercer lugar, por las demás covariables (modelo III). Para todos los contrastes se consideró significativo un valor de p <0,05. Los datos se analizaron con el software SPSS 19.0 (SPSS Inc.; Chicago, Illinois, Estados Unidos).
RESULTADOSCaracterísticas basalesSe incluyó a 124 pacientes de un total de 174 a los que se realizó ablación de VP durante el periodo de inclusión del estudio. Los motivos de la exclusión de los pacientes fueron: 1 por insuficiencia renal grave (2%; TFGe, 23 ml/min); 5 (10%) por una ablación menos de 6 meses antes; 6 (12%) estaban participando en otro estudio no compatible con el nuestro; 26 (52%) por rechazo del paciente o imposibilidad de seguimiento, y 12 (24%) por imposibilidad en la recogida de biomarcadores.
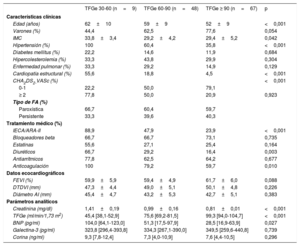
La media de edad fue 55±10 (intervalo, 22-75) años y 86 eran varones (69,4%). Se trató con ablación de VP con radiofrecuencia a 98 pacientes (79%) y con crioablación a 26 (21%). Tenían FA paroxística 75 pacientes (60,5%) y FA persistente 49 (39,5%). En 96 pacientes (77,4%) fue el primer procedimiento de ablación y a 28 (22,6%) se les había realizado una ablación anteriormente. La TFGe basal fue de 90,8 [73,8-90,8] ml/min/1,73 m2 y la creatinina basal, 0,88 [0,78-1,03] mg/dl. Los pacientes se dividieron en 3 grupos según su TFGe basal: grupo 1 (67 pacientes, 54%) con TFGe normal (≥ 90ml/min/1,73 m2); grupo 2 (48 pacientes, 38,7%) con TFGe ligeramente reducida (60-89 ml/min/1,73 m2), y grupo 3 (9 pacientes, 7,3%) con TFGe moderadamente reducida (30-59 ml/min/1,73 m2). Los 9 pacientes con TFGe <60ml/min/1,73 m2 no tenían registrado en su historia el antecedente de insuficiencia renal, todos ellos eran hipertensos, 2 de ellos además eran diabéticos y 1 tenía lupus eritematoso sistémico como posibles causas del deterioro de la función renal. No hubo ningún paciente con TFGe <30 ml/min/1,73 m2 puesto que era un criterio de exclusión. No hubo ningún caso de nefropatía por contraste en las 24 h tras la ablación.
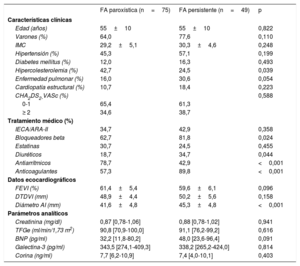
Las características clínicas, ecocardiográficas y analíticas agrupadas según el tipo de FA y según el grupo de TFGe basal se muestran en la tabla 1 y en la tabla 2. Los pacientes con FA persistente estaban tratados más frecuentemente con diuréticos, bloqueadores beta y anticoagulantes que aquellos con FA paroxística; además presentaron un diámetro mayor de aurícula izquierda, mientras que los pacientes con FA paroxística tuvieron con mayor frecuencia hipercolesterolemia y un mayor uso de fármacos antiarrítmicos. No hubo diferencias entre ambos grupos en la TFGe basal, la creatinina basal ni los biomarcadores. Respecto a los pacientes agrupados por TFGe basal, aquellos con peor TFGe (grupos 2 y 3) tenían más edad, mayor índice de masa corporal, mayor proporción de hipertensión arterial y cardiopatía estructural, mayor uso de inhibidores de la enzima de conversión de la angiotensina/antagonistas del receptor de la angiotensina II, diuréticos y anticoagulantes, y mayor concentración de BNP basal.
Características basales agrupadas por tipo de fibrilación auricular
| FA paroxística (n=75) | FA persistente (n=49) | p | |
|---|---|---|---|
| Características clínicas | |||
| Edad (años) | 55±10 | 55±10 | 0,822 |
| Varones (%) | 64,0 | 77,6 | 0,110 |
| IMC | 29,2±5,1 | 30,3±4,6 | 0,248 |
| Hipertensión (%) | 45,3 | 57,1 | 0,199 |
| Diabetes mellitus (%) | 12,0 | 16,3 | 0,493 |
| Hipercolesterolemia (%) | 42,7 | 24,5 | 0,039 |
| Enfermedad pulmonar (%) | 16,0 | 30,6 | 0,054 |
| Cardiopatía estructural (%) | 10,7 | 18,4 | 0,223 |
| CHA2DS2-VASc (%) | 0,588 | ||
| 0-1 | 65,4 | 61,3 | |
| ≥ 2 | 34,6 | 38,7 | |
| Tratamiento médico (%) | |||
| IECA/ARA-II | 34,7 | 42,9 | 0,358 |
| Bloqueadores beta | 62,7 | 81,8 | 0,024 |
| Estatinas | 30,7 | 24,5 | 0,455 |
| Diuréticos | 18,7 | 34,7 | 0,044 |
| Antiarrítmicos | 78,7 | 42,9 | <0,001 |
| Anticoagulantes | 57,3 | 89,8 | <0,001 |
| Datos ecocardiográficos | |||
| FEVI (%) | 61,4±5,4 | 59,6±6,1 | 0,096 |
| DTDVI (mm) | 48,9±4,4 | 50,2±5,6 | 0,158 |
| Diámetro AI (mm) | 41,6±4,8 | 45,3±4,8 | <0,001 |
| Parámetros analíticos | |||
| Creatinina (mg/dl) | 0,87 [0,78-1,06] | 0,88 [0,78-1,02] | 0,941 |
| TFGe (ml/min/1,73 m2) | 90,8 [70,9-100,0] | 91,1 [76,2-99,2] | 0,616 |
| BNP (pg/ml) | 32,2 [11,8-80,2] | 48,0 [23,6-96,4] | 0,091 |
| Galectina-3 (pg/ml) | 343,5 [274,1-409,3] | 338,2 [265,2-424,0] | 0,814 |
| Corina (ng/ml) | 7,7 [6,2-10,9] | 7,4 [4,0-10,1] | 0,403 |
AI: aurícula izquierda; ARA-II: antagonistas del receptor de la angiotensina II; BNP: péptido natriurético cerebral; DTDVI: diámetro telediastólico del ventrículo izquierdo; FA: fibrilación auricular; FEVI: fracción de eyección del ventrículo izquierdo; IECA: inhibidor de la enzima de conversión de la angiotensina; IMC: índice de masa corporal; TFGe: tasa de filtrado glomerular estimada.
Los valores se expresan como media±desviación estándar en el caso de variables normales, y como mediana [intervalo intercuartílico] en el caso de variables no normales.
Características basales agrupadas según grupo de tasa de filtrado glomerular estimada
| TFGe 30-60 (n=9) | TFGe 60-90 (n=48) | TFGe ≥ 90 (n=67) | p | |
|---|---|---|---|---|
| Características clínicas | ||||
| Edad (años) | 62±10 | 59±9 | 52±9 | <0,001 |
| Varones (%) | 44,4 | 62,5 | 77,6 | 0,054 |
| IMC | 33,8±3,4 | 29,2±4,2 | 29,4±5,2 | 0,042 |
| Hipertensión (%) | 100 | 60,4 | 35,8 | <0,001 |
| Diabetes mellitus (%) | 22,2 | 14,6 | 11,9 | 0,684 |
| Hipercolesterolemia (%) | 33,3 | 43,8 | 29,9 | 0,304 |
| Enfermedad pulmonar (%) | 33,3 | 29,2 | 14,9 | 0,129 |
| Cardiopatía estructural (%) | 55,6 | 18,8 | 4,5 | <0,001 |
| CHA2DS2-VASc (%) | <0,001 | |||
| 0-1 | 22,2 | 50,0 | 79,1 | |
| ≥ 2 | 77,8 | 50,0 | 20,9 | 0,923 |
| Tipo de FA (%) | ||||
| Paroxística | 66,7 | 60,4 | 59,7 | |
| Persistente | 33,3 | 39,6 | 40,3 | |
| Tratamiento médico (%) | ||||
| IECA/ARA-II | 88,9 | 47,9 | 23,9 | <0,001 |
| Bloqueadores beta | 66,7 | 66,7 | 73,1 | 0,735 |
| Estatinas | 55,6 | 27,1 | 25,4 | 0,164 |
| Diuréticos | 66,7 | 29,2 | 16,4 | 0,003 |
| Antiarrítmicos | 77,8 | 62,5 | 64,2 | 0,677 |
| Anticoagulación | 100 | 79,2 | 59,7 | 0,010 |
| Datos ecocardiográficos | ||||
| FEVI (%) | 59,9±5,9 | 59,4±4,9 | 61,7±6,0 | 0,088 |
| DTDVI (mm) | 47,3±4,4 | 49,0±5,1 | 50,1±4,8 | 0,226 |
| Diámetro AI (mm) | 45,4±4,7 | 43,2±5,3 | 42,7±5,1 | 0,383 |
| Parámetros analíticos | ||||
| Creatinina (mg/dl) | 1,41±0,19 | 0,99±0,16 | 0,81±0,01 | <0,001 |
| TFGe (ml/min/1,73 m2) | 45,4 [38,1-52,9] | 75,6 [69,2-81,5] | 99,3 [94,0-104,7] | <0,001 |
| BNP (pg/ml) | 104,0 [64,1-123,0] | 51,3 [17,5-97,9] | 28,5 [16,9-63,9] | 0,027 |
| Galectina-3 (pg/ml) | 323,8 [296,4-393,8] | 334,3 [267,1-390,0] | 349,5 [259,6-440,8] | 0,739 |
| Corina (ng/ml) | 9,3 [7,8-12,4] | 7,3 [4,0-10,9] | 7,6 [4,4-10,5] | 0,296 |
AI: aurícula izquierda; ARA-II: antagonista del receptor de la angiotensina II; BNP: péptido natriurético cerebral; DTDVI: diámetro telediastólico del ventrículo izquierdo; FA: fibrilación auricular; FEVI: fracción de eyección del ventrículo izquierdo; IECA: inhibidor de la enzima de conversión de la angiotensina; IMC: índice de masa corporal; TFGe: tasa de filtrado glomerular estimada.
Los valores se expresan como media±desviación estándar en el caso de variables normales, y como mediana [intervalo intercuartílico] en el caso de variables no normales.
En todos los pacientes se realizó aislamiento circunferencial de VP y el objetivo del aislamiento de todas las venas abordadas se consiguió en 121 pacientes (97,6%). A 9 pacientes (7%) se les realizó un segundo procedimiento de ablación durante el año de seguimiento, que se llevó a cabo con radiofrecuencia en todos los casos: estos casos se contabilizaron como recurrencias. A los 12 meses, 84 pacientes (67,7%) estaban libres de recurrencias, de los que 57 tenían FA paroxística (76%) y 27, FA persistente (55%) (p=0,013). De los 40 pacientes con recurrencia, en 28 fue como FA paroxística (22,6%), en 8 como FA persistente (6,5%) y en 4 como aleteo atípico (3,2%). Las recurrencias se documentaron en 16 pacientes (12,9%) en el electrocardiograma realizado durante la asistencia a urgencias, en 20 (16,1%) con electrocardiograma o Holter realizados para la revisión en consulta y en 4 (3,3%) de ambas maneras. De los 84 pacientes sin recurrencia a los 12 meses, 11 (13%) estaban tomando fármacos antiarrítmicos al final del seguimiento frente a 25 (62,5%) de los pacientes con recurrencias (p <0,0001). No se encontró relación entre los biomarcadores y las recurrencias; en el estudio multivariante la única variable asociada con las recurrencias fue la presencia de FA persistente (odds ratio=2,3; intervalo de confianza del 95% [IC95%], 0,9-5,7).
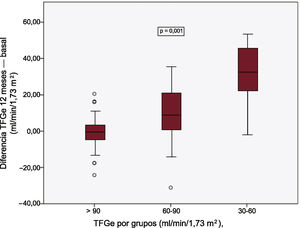
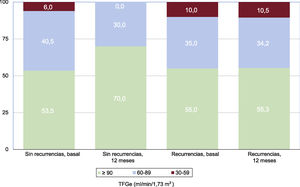
Cambios en el filtrado glomerularAl año de seguimiento y en el total de pacientes, la TFGe se incrementó de 90,8 [77,8-100,0] a 95,6 [84,8-103,3] ml/min/1,73 m2 (p <0,0001) y la creatinina se redujo de 0,88 [0,78-1,03] a 0,82 [0,76-0,92] mg/dl (p <0,0001). No hubo diferencias en la mejora de la TFGe en función de que se produjeran recurrencias o no durante el periodo ventana (p=0,095). Hubo diferencias entre la TFGe basal, a los 3 y a los 12 meses. Estas diferencias se debieron al tiempo, pero no al grupo, aunque sí a la interacción entre tiempo y grupo (tabla 3). La TFGe se incrementó de media al final del seguimiento en 2,9 [–2,7 a 11,8] ml/min/1,73 m2, con diferencia estadísticamente significativa entre los pacientes que presentaron recurrencia a los 12 meses y los que no (–1,1 [–6,0 a 8,8] frente a 7,1 [–0,6 a 14,2] ml/min/1,73 m2; p=0,017). La mejora de la TFGe a los 12 meses fue inversamente proporcional a la TFGe basal, de manera que los pacientes con TFGe de 30-59ml/min/1,73 m2 fueron los que mayor incremento de la TFGe presentaron (grupo 1, –0,2 [–4,3 a 3,8] ml/min/1,73 m2; grupo 2, 9,1 [0,9 a 21,5] ml/min/1,73 m2; grupo 3, 32,9 [19,4 a 47,6] ml/min/1,73 m2; p=0,001) (figura 1). En los pacientes que no tuvieron recurrencias a los 12 meses, basalmente había un 5% de ellos en el grupo 3 de TFGe y un 41,2% en el grupo 2, mientras que a los 12 meses había 0 y un 30% respectivamente (p <0,0001), frente a los pacientes que sí tuvieron recurrencias, en los que se mantuvo el mismo porcentaje de pacientes en cada grupo a los 12 meses (p=0,006) (figura 2). Las características clínicas, ecocardiográficas y analíticas fueron similares entre los pacientes en que hubo mejora de la TFGe al final del seguimiento y los que no obtuvieron mejoría, aunque hubo una tendencia a un mayor número de diabéticos, una mejor fracción de eyección del ventrículo izquierdo, un mayor uso de anticoagulantes y un menor uso de inhibidores de la enzima de conversión de la angiotensina/antagonistas del receptor de la angiotensina II en el grupo sin mejora de la TFGe. La única variable relacionada con la mejora de la TFGe fue la presencia o ausencia de recurrencias (tabla 4).
Modelo lineal general de medidas repetidas que analiza la TFGe basal y a los 3 y los 12 meses en función de que hubiera recurrencias o no
| Recurrencias, no | Recurrencias, sí | p | |||||||
|---|---|---|---|---|---|---|---|---|---|
| Basal | 3 meses | 12 meses | Basal | 3 meses | 12 meses | Grupo | Tiempo | Grupo x tiempo | |
| TFGe | 88,2±15,4 | 90,2±13,9 | 93,9±12,6 | 86,6±20,4 | 92,7±16,7 | 87,6±19,9 | 0,556 | 0,026 | 0,006 |
TFGe: tasa de filtrado glomerular estimada.
Los valores se expresan como media±desviación estándar.
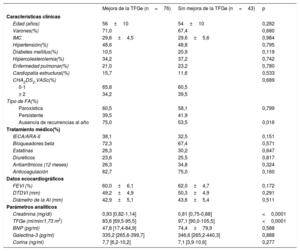
Características basales agrupadas según mejorara o no la TFGe al año de seguimiento
| Mejora de la TFGe (n=76) | Sin mejora de la TFGe (n=43) | p | |
|---|---|---|---|
| Características clínicas | |||
| Edad (años) | 56±10 | 54±10 | 0,282 |
| Varones(%) | 71,0 | 67,4 | 0,680 |
| IMC | 29,6±4,5 | 29,6±5,6 | 0,984 |
| Hipertensión(%) | 48,6 | 48,8 | 0,795 |
| Diabetes mellitus(%) | 10,5 | 20,9 | 0,119 |
| Hipercolesterolemia(%) | 34,2 | 37,2 | 0,742 |
| Enfermedad pulmonar(%) | 21,0 | 23,2 | 0,780 |
| Cardiopatía estructural(%) | 15,7 | 11,6 | 0,533 |
| CHA2DS2-VASc(%) | 0,689 | ||
| 0-1 | 65,8 | 60,5 | |
| ≥ 2 | 34,2 | 39,5 | |
| Tipo de FA(%) | |||
| Paroxística | 60,5 | 58,1 | 0,799 |
| Persistente | 39,5 | 41,9 | |
| Ausencia de recurrencias al año | 75,0 | 53,5 | 0,016 |
| Tratamiento médico(%) | |||
| IECA/ARA-II | 38,1 | 32,5 | 0,151 |
| Bloqueadores beta | 72,3 | 67,4 | 0,571 |
| Estatinas | 26,3 | 30,2 | 0,647 |
| Diuréticos | 23,6 | 25,5 | 0,817 |
| Antiarrítmicos (12 meses) | 26,3 | 34,8 | 0,324 |
| Anticoagulación | 62,7 | 75,0 | 0,160 |
| Datos ecocardiográficos | |||
| FEVI (%) | 60,0±6,1 | 62,0±4,7 | 0,172 |
| DTDVI (mm) | 49,2±4,9 | 50,3±4,9 | 0,291 |
| Diámetro de la AI (mm) | 42,9±5,1 | 43,6±5,4 | 0,511 |
| Parámetros analíticos | |||
| Creatinina (mg/dl) | 0,93 [0,82-1,14] | 0,81 [0,75-0,88] | <0,0001 |
| TFGe (ml/min/1,73 m2) | 83,6 [69,5-95,5] | 97,1 [90,0-105,5] | <0,0001 |
| BNP (pg/ml) | 47,8 [17,4-84,9] | 74,4±79,9 | 0,588 |
| Galectina-3 (pg/ml) | 335,2 [265,6-399,7] | 346,6 [265,2-440,3] | 0,888 |
| Corina (ng/ml) | 7,7 [6,2-10,2] | 7,1 [3,9-10,6] | 0,277 |
AI: aurícula izquierda; ARA-II: antagonista del receptor de la angiotensina II; BNP: péptido natriurético cerebral; DTDVI: diámetro telediastólico del ventrículo izquierdo; FA: fibrilación auricular; FEVI: fracción de eyección del ventrículo izquierdo; IECA: inhibidor de la enzima de conversión de la angiotensina; IMC: índice de masa corporal; TFGe: tasa de filtrado glomerular estimada.
Los valores se expresan como media±desviación estándar en el caso de variables normales y como mediana [intervalo intercuartílico] en el caso de variables no normales.
Los pacientes sin recurrencias a los 12 meses presentaron una TFGe basal similar a la de los pacientes que sí las tuvieron (90,8 [75,7-100,0] frente a 90,9 [69,8-100,3] ml/min/1,73 m2; p=0,708). Tampoco hubo diferencias significativas en las recurrencias según el grupo de TFGe basal (grupo 1 el 32,8%, frente a grupo 2 el 29,2%, frente a grupo 3 el 44,4%; p=0,660).
Evolución biomarcadoresEl BNP se redujo de 47,8 [17,5-85,7] a 32,6 [13,1-69,4] pg/ml al año de seguimiento (p=0,013), aunque al año no hubo diferencias significativas entre los pacientes con y sin recurrencias (p=0,465). Tampoco se encontró relación entre el BNP y ninguna de las otras variables estudiadas. Los valores de corina se incrementaron de 7,63 [4,72-10,64] a 10,60 [9,00-12,23] ng/ml a los 12 meses (p <0,001), sin diferencias según hubiera recurrencias o no (p=0,461). Los valores de corina a los 12 meses fueron mayores en el grupo de FA persistente que en el grupo de FA paroxística (p=0,011); no hubo diferencias en el resto de variables estudiadas. Los valores de galectina-3 pasaron de los 343,5 [266,4-411,7] pg/ml en situación basal a 371,7 [310,8-470,5] pg/ml a los 12 meses (p=0,025), sin que se encontrara asociación con ninguna de las variables estudiadas.
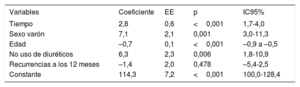
Variables asociadas con mejoría de la función renalEl modelo multivariante de efectos mixtos mostró un aumento significativo de la TFGe debido al tiempo, con un aumento en promedio de 2,8 (IC95%, 1,7-4,0) ml/min/1,73 m2 más en el seguimiento. Los pacientes con recurrencia tuvieron menor TFGe (–1,4; IC95%, –5,4 a 2,5 ml/min/1,73 m2), aunque sin diferencia estadísticamente significativa. El sexo varón se relacionó de forma directa con un aumento de la TFGe de 7,1 (IC95%, 3,0-11,3) ml/min/1,73 m2; los pacientes que no tomaban diuréticos mejoraron 6,3 (IC95%, 1,8-10,9) ml/min/1,73 m2, mientras que la edad se relacionó de manera inversa, con un empeoramiento de –0,71 (IC95%, –0,9 a –0,5) ml/min/1,73 m2 por cada año (tabla 5). Ninguno de los biomarcadores estudiados se asoció con la mejora de la TFGe.
Modelo de efectos mixtos para el análisis de las variables que influyen en la evolución de la TFGe
| Variables | Coeficiente | EE | p | IC95% |
|---|---|---|---|---|
| Tiempo | 2,8 | 0,6 | <0,001 | 1,7-4,0 |
| Sexo varón | 7,1 | 2,1 | 0,001 | 3,0-11,3 |
| Edad | –0,7 | 0,1 | <0,001 | –0,9 a –0,5 |
| No uso de diuréticos | 6,3 | 2,3 | 0,006 | 1,8-10,9 |
| Recurrencias a los 12 meses | –1,4 | 2,0 | 0,478 | –5,4-2,5 |
| Constante | 114,3 | 7,2 | <0,001 | 100,0-128,4 |
EE: error estándar; IC95%: intervalo de confianza del 95%; TFGe: tasa de filtrado glomerular estimada.
En nuestro estudio se observa en los pacientes tratados mediante ablación de VP una mejoría de la función renal medida mediante la TFGe. De estos pacientes, aquellos sin recurrencias fuera del periodo ventana tuvieron mejor TFGe que los que sí las tuvieron, aunque dicha diferencia no fue estadísticamente significativa en el modelo multivariante. Este resultado es similar al encontrado en estudios previos9,10. En el trabajo llevado a cabo por Kornej et al.11, no se observó una mejora de la TFGe tras la ablación, pero sí se encontró que los pacientes con recurrencias tenían una mayor probabilidad de que tuvieran peor TFGe al final del seguimiento. Estos hallazgos refuerzan la teoría de que la función renal está influida por la presencia de FA.
Al igual que en los trabajos de Takahashi et al.9 y Navaravong et al.10, en nuestro estudio se observó que la mejora de la TFGe al año de seguimiento es inversamente proporcional a la TFGe basal del paciente, con un mayor incremento en los pacientes que partían del cuartil de TFGe más bajo. Esta asociación es importante, ya que en la práctica clínica habitual es más relevante mejorar la TFGe de los pacientes que parten de una TFGe deteriorada que mejorarlo en aquellos otros que presenten una TFGe normal. Según la guía de prevención cardiovascular14, tener una enfermedad renal crónica moderada (TFGe, 30-59 ml/min/1,73 m2) o grave (TFGe <30 ml/min/1,73 m2) supone estar incluido en una categoría de riesgo cardiovascular alto o muy alto respectivamente. Por lo tanto, a los pacientes que en nuestro estudio pasaron de una TFGe basal de 30-59 ml/min/1,73 m2 a una TFGe> 60 ml/min/1,73 m2, se les modificó esta categoría de riesgo cardiovascular alto.
Ni en nuestro trabajo ni en los de Takahashi et al.9 y Navaravong et al.10 se incluyó a pacientes con TFGe <30 ml/min/1,73 m2, y en el de Kornej et al.11 tan solo se incluyó a 6 pacientes de este grupo (el 0,5% de la población estudiada), por lo que sería interesante realizar estudios dirigidos específicamente a esta población. Sin embargo, hay que tener en cuenta que, aunque nuestro estudio y el de Navaravong et al.10 no encontraron relación entre una peor función renal basal y una mayor tasa de recurrencias, otros autores sí han descrito esta relación8,11,15-17.
En el análisis multivariante se encontró que los pacientes varones tenían mejor TFGe y los de más edad, peor TFGe, en posible relación con que ambas variables están incluidas en el cálculo de la fórmula CKD-EPI, de tal forma que sería difícil estimar si la relación encontrada seguiría siendo tal si no estuvieran incluidas en dicha fórmula. Los pacientes en tratamiento con diuréticos presentaron peor TFGe, probablemente porque son pacientes con peor grado funcional, hipertensión arterial de más difícil control o por el propio efecto del diurético en la función renal.
El objetivo principal para indicar a un paciente una ablación de FA es la mejoría de los síntomas y, por lo tanto, de la calidad de vida; otros objetivos potenciales son la supresión de fármacos antiarrítmicos en caso de ablación exitosa o la mejoría de la función ventricular de los pacientes con taquicardiomiopatía. A la luz de nuestros datos, la mejoría de la función renal se podría considerar otro posible beneficio de la ablación, aunque son necesarios estudios más amplios para confirmar dicha mejoría.
La concentración de la fracción aminoterminal del propéptido natriurético cerebral (NT-proBNP) está elevada de manera significativa en los pacientes con FA paroxística y persistente, en comparación con los pacientes en ritmo sinusal18. No obstante, son pocos los estudios que han analizado prospectivamente la asociación entre los valores de NT-proBNP y la incidencia de insuficiencia renal. En un trabajo de 125 pacientes con insuficiencia cardiaca seguidos durante 18 meses, el riesgo de sufrir insuficiencia renal era significativamente mayor en los pacientes con NT-proBNP elevado (cociente de tasas de incidencia=3,6; IC95%, 1,9-7,0)19. En el estudio MESA, las cifras de NT-proBNP se asociaron de manera significativa con el riesgo de fibrilación auricular (hazard ratio=2,2; IC95%, 1,9-2,5)20. En nuestro estudio, el BNP se redujo al año de seguimiento en el total de la muestra, aunque no se encontró asociación con la TFGe ni con la presencia de recurrencias. Este dato es relevante, pues una posible explicación fisiopatológica para la mejoría de la función renal observada tras la ablación sería una mejoría del gasto cardiaco y, por lo tanto, de la presión de perfusión renal, derivadas del mantenimiento efectivo del ritmo sinusal. Este hecho precisaría de estudios dirigidos para poder ser confirmado.
La corina es una proteína transmembrana que transforma el propéptido natriurético auricular y el pro-BNP en sus formas activas y tiene un papel importante en la regulación del balance hidrosalino, la presión arterial y la función cardiaca21. Las cifras bajas de corina se han asociado con peor clase funcional de la New York Heart Association, mayores concentraciones de NT-proBNP y una disminución de la fracción de eyección del ventrículo izquierdo y la TFGe; además se ha descrito que los valores bajos de corina sérica son un factor pronóstico independiente de eventos cardiovasculares mayores en pacientes con insuficiencia cardiaca22. También se ha encontrado que las concentraciones de corina en los pacientes con FA paroxística son menores que en quienes tienen FA persistente23. En nuestro estudio se produjo un incremento de las cifras de corina en el seguimiento, lo cual podría estar relacionado con una mejoría de la función cardiaca tras la ablación. Por otro lado, la galectina-3 es una proteína profibrótica asociada con fibrosis hepática, renal, pulmonar y también cardiaca. La fibrosis y el remodelado eléctrico en la aurícula izquierda podrían ser la consecuencia final de una cascada de señales intracelulares (en la que la galectina-3 podría tener un papel esencial) que contribuirían a la estabilización y perpetuación de la arritmia24. Existen estudios que correlacionan la existencia de FA con valores elevados de galectina-325. A su vez la inhibición de la galectina-3 podría constituir una diana terapéutica en el futuro para prevenir el remodelado cardiaco asociado con fibrosis miocárdica26. A diferencia del estudio de Takemoto et al.27, en nuestro estudio no se ha demostrado que los valores de galectina-3 puedan predecir las recurrencias tras ablación de FA. La falta de asociación entre la evolución de los biomarcadores y la mejora de la TFGe, así como con las recurrencias, podría deberse a que en nuestro estudio no se conoce la carga arrítmica.
Los pacientes incluidos en nuestro estudio eran los derivados para ablación de VP según práctica clínica habitual y, por lo tanto, lo resultados serían extrapolables a la mayor parte de dicha población. Aunque se excluyó a los pacientes con TFGe <30 ml/min/1,73 m2, estos raramente son enviados para ablación de VP, como demuestra el hecho de que en nuestro estudio solo se excluyera a 1 paciente por esta razón. No obstante, en el futuro sería bueno que se llevaran a cabo estudios multicéntricos, con mayor tamaño muestral, y que no excluyeran a pacientes con ningún grado de afección renal. También sería deseable realizar estudios que incluyeran la cuantificación de la carga arrítmica, pues la falta de diferencia estadísticamente significativa entre los pacientes con y sin recurrencias fuera del periodo ventana podría deberse a que, aunque los pacientes tengan recurrencias, podrían tener una carga arrítmica significativamente menor que antes de la ablación. Este hecho explicaría que estos pacientes también mejoren su TFGe aunque en menor cuantía.
LimitacionesA pesar de que se han estudiado la mayoría de los factores que podrían estar relacionados con la función renal, podría haber otros factores de confusión que explicasen los cambios en la TFGe. La detección de recurrencias en nuestro estudio podría mejorarse con el uso de registradores de eventos y además sería deseable cuantificar la carga de FA. El aumento de la TFGe en el total de los pacientes sin recurrencias es discreto y habría que ver su importancia en la práctica clínica habitual.
CONCLUSIONESEn la cohorte de pacientes con FA y sin insuficiencia renal grave basal, tratados mediante ablación de VP, se observó una mejora general de la TFGe al año de seguimiento. Los pacientes sin recurrencias fuera del periodo ventana tuvieron una mejor TFGe que los que sí las tuvieron, aunque dicha diferencia no fue estadísticamente significativa en el modelo multivariante. Se observó una reducción del BNP y una elevación de corina, ambos parámetros indicadores de buena función cardiaca, aunque no se ha conseguido demostrar su asociación con la mejora de la TFGe observada.
FINANCIACIÓNEl presente trabajo ha sido financiado parcialmente mediante una colaboración con Bayer para la compra de reactivos de biomarcadores cardiacos. Bayer no ha tenido ningún tipo de participación en el estudio.
CONFLICTO DE INTERESESM. Álvarez-López ha recibido honorarios personales de Johnson & Johnson.
- –
Varios estudios han encontrado relación entre la presencia de FA y una TFGe reducida.
- –
La relación causal entre la FA y el deterioro de la función renal no ha sido bien establecida.
- –
Existen escasos datos que comparen la evolución de la función renal en pacientes tratados con ablación de FA en función de que haya recurrencias arrítmicas o no.
- –
La ablación de VP se asocia con una mejora de la TFGe al año de seguimiento.
- –
Se observa una mayor mejora de la TFGe en los pacientes que parten de una TFGe basal más baja.
- –
Podría considerarse la estrategia de control del ritmo de FA como factor que tener en cuenta para evitar el deterioro de la función renal de pacientes con antecedentes de FA.
A Manuela Expósito por su participación en el análisis estadístico y a Laura Jáimez y María Molina por su inestimable colaboración.